Остапчук М.В., Рибак А.І. Системи технологій (за видами діяльності)
Подождите немного. Документ загружается.


маси приховати за величиною коефіцієнта масовіддачі. Розрахунок
коефіцієнтів масовіддачі ґрунтується на теоріях масопередачі.
Термодифузія. Розглянуті вище основні закони дифузії одержані за умови дії
лише однієї рушійної сили — градієнта концентрацій розглядаємого
компонента системи. В реальних умовах масопередачі є звичайно і градієнти
інших інтенсивних параметрів: температури, тиску, концентрації решти
компонентів системи. Встановлено, що швидкість дифузії даного компонента
більшою чи меншою мірою залежить також від усіх зазначених градієнтів.
Так, наприклад, для молекулярного перенесення в бінарній суміші можна
записати
n
P
Pn
T
Tn
C
Dq
б
T
k
k
, (4.35)
де
k
T
— термодифузійний коефіцієнт;
k
б
— бародифузійний коефіцієнт.
У цьому рівнянні перша складова величина характеризує концентраційну
дифузію, друга — термодифузію (ефект Cope), третя —
181
бародифузію. Звичайно бародифузією нехтують. Що ж до термо-дифузії, то
вона у ряді випадків відіграє помітну роль (наприклад, у процесах сушіння
матеріалів). Коефіцієнт термодифузії додатний для більш важких
компонентів і від'ємний — для легших. Отже, важкі компоненти
переміщуються в бік зниження температури.
Дія термодифузії являється переважно в газах і до деякої міри в рідинах.
Проектуючи апарати, треба прагнути, щоб напрями термодифузії і
концентраційної дифузії збігалися.
4.6.3. Сушіння
Загальні відомості
У багатьох видах речовин міститься багато води. Під час технологічної
обробки нерідко відбувається зволоження напівпродуктів виробництва. Але в
готових продуктах повинна бути точно нормована кількість вологи. Вологу з
матеріалів можна вилучати різними способами: механічним, фізико-хімічним
і тепловим.
При механічному способі вологу віджимають на пресах або в центрифугах. У
цьому випадку вилучається лише частина вологи з матеріалу.
Фізико-хімічний спосіб ґрунтується на застосуванні різних водовідбірних
засобів і застосовується переважно в лабораторній практиці. Зневоджуючи
засобами є сірчана кислота, хлористий кальцій та ін.
При тепловому способі вологу з матеріалу вилучають випаровуванням,
випарюванням і конденсацією. Цей спосіб широко застосовується у тому
випадку, коли треба максимально вилучити вологу.
Вилучення вологи з матеріалів, при якому використовують теплову енергію
для її випаровування та відведення пари називають сушінням. Якщо
виходити з цього означення, сушіння принципово не відрізняється від
випарювання, але по суті воно є одночасно і дифузійним процесом, оскільки
волога з матеріалу в навколишнє середовище переходить при поверхневому
випаровуванні, а також у процесі її дифузії з внутрішніх шарів до поверхні
матеріалу. Розрізняють природне і штучне сушіння. Природне відбувається
на відкритому повітрі без штучного нагрівання і без відведення сушильного
агента (повітря). Прикладом природного сушіння може бути сушіння
кухонної солі у відкритих морських джерелах, сушіння фруктів в країнах з
теплими і жаркими кліматами. Цей спосіб відрізняється значною три-
182
валістю сушіння, причому процес цей не регулюється і одержуваний
кінцевий матеріал ще досить вологий.
У промисловості майже всюди застосовують штучне сушіння, тобто сушіння
нагрітим сушильним агентом (димові гази, повітря, водяна пара та ін.), який
після поглинання ним вологи з матеріалу відводять за допомогою
спеціальних витяжних пристроїв (вентиляторів). Для більшості виробництв
сушіння є кінцевою стадією технологічної обробки, тому цей процес
застосовують майже в усіх виробництвах.
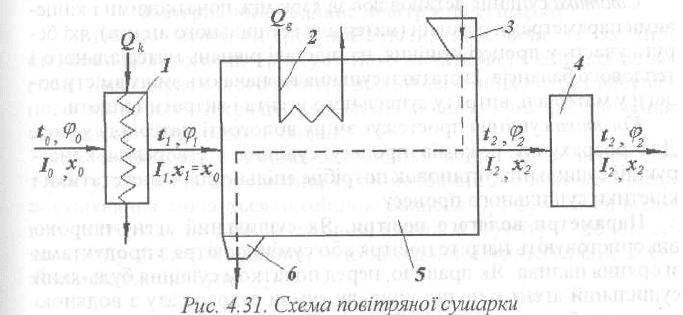
Принцип дії повітряної сушарки, вологий матеріал надходить у сушильну
камеру повітряної сушарки, схему якої наведено на рис. 4.31 через
завантажувальний бункер 3 і за допомогою транспортних пристроїв
переміщується вздовж сушильної камери 5. Висушений матеріал видаляють
через бункер б. Вентилятором 4 у калорифер 1 засмоктують холодне повітря,
де воно підігрівається до певної температури, а потім проходить вздовж
сушарки. Контактуючи з висушуваним матеріалом, повітря поглинає з нього
вологу і виходить з камери висушування. На рисунку зображено основну
схему сушильного процесу, що характеризується одноразовим
використанням сушильного агента. У промисловості використовують різні
варіанти сушіння і відповідно різні апарати для штучного сушіння. У деяких
випадках встановлюють додатковий калорифер 2, змонтований в самій
сушильній камері. Така схема дає можливість значно знизити температуру
сушіння, що дуже важливо для матеріалів, які треба сушити в точно заданих
параметрах середовища. Як і в інших процесах, розрізняють дві сторони
процесу сушіння — його статику і кінетику.

183
Статика сушіння встановлює зв'язок між початковими і кінцевими
параметрами речовин (матеріалу і сушильного агента), які беруть участь у
процесі сушіння, на підставі рівнянь матеріального і теплового балансів. Із
статики сушіння визначають зміну вмісту вологи у матеріалі, витрату
сушильного агента і витрати теплоти.
Кінетика сушіння простежує зміну вологості матеріалу у часі. Для
розрахунку режимів процесу сушіння і створення конструкцій сушильних
установок потрібне спільне вивчення статики і кінетики сушильного процесу.
Параметри вологого повітря. Як сушильний агент широко використовують
нагріте повітря або суміш повітря з продуктами згоряння палива. Як правило,
перед початком сушіння будь-який сушильний агент є не що інше, як суміш
сухого газу з водяною парою, тобто вологий газ. Виходячи з цього вологим
повітрям називають бінарну суміш сухого повітря з водяною парою. Вологе
повітря (газ) характеризується вісьмома параметрами в т. ч. тиском,
вологістю і ентальпією (тепловмістом).
Тиск. За законом Дальтона, тиск суміші ідеальних газів, що займають певний
об'єм, дорівнює сумі парціальних тисків в усіх компонентах суміші.
Відповідно до цього барометричний тиск вологого повітря дорівнюватиме
рр
П.ВП
p
(4.36)
Де
рр
П.ВП
,
— парціальний тиск сухого повітря і водяної пари.
Стан вологого повітря визначають за 1-х діаграмою і він характеризується на
діаграмі перетином чотирьох ліній: сталих температури t, вологовмісту х,
відносної вологості
та ентальпії I. Для визначення стану повітря достатньо
знати будь-які два параметри.
За допомогою діаграми вологи повітря (1-х — діаграма) яку наведено в
додатку 1, можна визначити точку роси
t
p
(границю охолодженого повітря)
і температуру мокрого термометра
t
m
(границю охолодження вологих тіл).
Точка роси для повітря даного стану визначається ізотермою, що проходить
через точку перетину ліній заданого вологовмісту з лінією відносної
вологості
1
. Границю охолодження вологих тіл або температуру мокрого
термометра знаходимо, як ізотерму, що проходить через точку перетину
ліній сталої ентальпії повітря даного стану з лінією
1
. Лінії
const
t
M
будуть геометричним місцем точок з незмінною температурою мокрого
термометра. Ці лінії на деяких діаграмах також нанесені і йдуть трохи
пологіше, ніж лінії І = const.
184
Матеріальний баланс повітряної сушарки
Звичайно сушарки розраховують, виходячи із заданої кількості вологого
матеріалу та його початкової і кінцевої вологості. Для витрат сухого повітря
при визначенних витрат висушеного матеріалу, витрати видаляємої вологи і
на висушування складають матеріальний баланс:

а) за абсолютно сухою речовиною: якщо немає втрат матеріалу, кількість
абсолютної сухої речовини в ньому до і після висушування лишається
незмінною; якщо ж
G
1
і
G
2
— маси вологого матеріалу до і після
сушіння, кг/год, a
W
1
і
W
2
— вологості матеріалу до і після сушіння, %
до загальної маси, то баланс за сухою речовиною буде
,
)()(
WGWG
100
100
100
100
2211
(4.37)
звідки маси вологого матеріалу
,
W
W
GG
1
2
21
100
100
(4.38)
або маси висушеного матеріалу
,
W
W
GG
2
1
12
100
100
(4.39)
б) за вологою в матеріалі; кількість вологи W, яку вилучають під час
висушування, дорівнює різниці мас вологого і висушеного матеріалу
GG
W
21
, (4.40)
Підставивши в останнє рівняння попереднє дістанемо
W
W
GG
W
2
1
21
100
100
або
W
WW
G
W
WW
G
W
1
11
2
2
21
1
100100
Матеріальний баланс за масою в сушаці можна подати і так
)(LW
xx
12
185
Звідки визначають витрати повітря на 1 кг вологи
ddxx
W
W
L
l
1212
1000
або простіше
,
кг
кг
,l
ddxx
1222
10001
(4.41)
Рівняння енергетичного балансу дозволяють визначити затрати енергії на
вилучення вологи із висушуємого матеріалу. На поверхні вологого матеріалу
під час випаровування вологи утворюється пограничний пароповітряний
шар, який перебуватиме у стані рівноваги з вологим матеріалом. Різниця

парціальних тисків водяної пари над поверхнею матеріалу
p
M
і в навко-
лишньому середовищі
p
c
, є рушійною силою процесу переходу вологи з
поверхневої плівки в навколишнє середовище
рр
сн
p
Кількість пари, що продифундувала, визначиться за законом випаровування з
вільної поверхні
,Fd)(
pp
cH
k
B
dW
(4.42)
F— поверхня випаровування;
— тривалість процесу.
Порядок аналітичного розрахунку сушарки такий:
1. Визначають стан повітря перед калорифером. Для цього за відомою його
початковою температурою
t
0
в таблицях для насиченої водяної пари
знаходять його тиск при насиченні
р
н
. Розраховують вологовміст х при
відомій відносності повітря
0
. Знаходять ентальпію водяної пари
i
0
, а
потім — ентальпію повітря
I
0
.
2. Визначають стан повітря після калорифера, тобто перед сушильною
камерою. Для цього треба вибрати температуру
t
1
і відносну вологість
1
.
Ці параметри вибирають, виходячи з умов технології сушіння конкретного
матеріалу.
3. Визначають стан повітря після сушильної камери, вибравши температуру,
відпрацьованого повіттря
t
2
і відносну вологість
2
4. Обчислюють поправку на реальну сушарку.
5. Одержані значення
xtti
,,,,
2212
i
xx
10
підставляють у
відповідні рівняння. У результаті обчислень має бути тотожність. Якщо її
немає, треба вибрати нові значення для
t
2
і
2
, знову виз-
186
начити параметри для повітря, що виходить з сушарки, а весь розрахунок
повторити до одержання тотожності.
6. Розраховують питомі витрати сухого повітря, витрати теплоти в
калорифері і додаткові витрати теплоти в сушильній камері.
З усього описаного випливає, що аналітичний розрахунок повітряної
сушарки громіздкий, незручний, потребує кількох повторних обчислень.
Аналітичний розрахунок не багато в чому поступається перед графічним
методом, а похибки, що мають місце в результаті графічного розрахунку не
виходять за межі звичайниих технічних розрахунків.
Розрахунок повітряної сушарки за 1-х діаграмою. Розрахувати повіряну
сушарку — це означає визначити питомі і загальні втрати теплоти і повітря
на висушування, а також значення інших парамерів, необхідних для

розрахунку калорифера, сушильної камери й витяжного пристрою
(вентилятора). Побудова процесу сушіння в 1-х діаграмі дає можливість
встановити характер обміну теплотою і вологою, а також визначити проміжні
і кінцеві параметри повітря.
Теоретична сушарка. Процес, що відбувається в теоретичній сушарці, на
діаграмі (див. додаток 6) зображають так. За відомою початковою
температурою повітря
t
0
і його відносною вологістю
0
знаходять на
діаграмі точку А, для якої, в свою чергу, знаходять вологовміст
x
0
та
ентальпію
0
. Оскількии повітря в калорифері нагрівають при незмінному
вологовмісті, перетин лінії
xx
10
= const із заданою ізотермою
t
1
дає
точку В, що характеризує стан повітря на вході в сушарку, для цієї точки
знаходять ентальпію І.
Оскільки в теоретичній сушарці теплообмін відбувається при сталій ентальпії
повітря, то спускаючись з точки В лінії сталої ентальпії
II
21
= const до
перетину кривої заданої температури повітря на виході з сушарки з
ізотермою
t
2
або з лінією, знаходять точку С кінцевого стану повітря. Для
цієї точки на діаграмі знаходять значення вологовмісту
x
2
і ентальпії
II
21
Знаючи параметри повітря на вході і виході, легко обчислити:
питомі витрати сухого повітря на випарювання 1 кг вологи — за рівнянням
4.41, а питомі витрати теплоти в калорифері — за рівнянням:
)(lgg
II
02
і цього рівняння випливає, що в теоретичній сушарці тепло витрачається на:
випаровування
i
2
кДж/кг вологи;
187
втрату з відпрацьованим повітрям
))(x,(
tt
02
9311000
вологи.
Причому втрати теплати будуть тим меншими, чим нижча температура
відпрацьованого повітря
t
2
і вища температура свіжого повітря, що
надходить у калорифер, а також чим менші питомі витрати сухого повітря.
4.6.4 Кристалізація
Кристалізацією називають процес вилучення речовини з розчину, розплаву
або пари у вигляді кристалів. У промисловості переважно мають справу з
кристалізацією з розчинів.
Кристалічна будова твердої фази найстійкіша, оскільки структурні елементи
(атоми, іони або молекули), утворюючи кристалічні решітки,

розташовуються найбільш компактно і мають мінімум вільної енергії. Тому
аморфні речовини поступово кристалізуються (наприклад, кристалізація
сахарози в карамелі та інших кондитерських масах під час тривалого
зберігання). Зовні кристали являють собою багатогранники різної форми, з
певною симетрією. Саме властивість симетрії і покладено в основу
класифікації кристалів.
У випадку масової кристалізації (за умов промислового виробництва)
кристали однієї й тієї самої речовини відрізняються між собою розмірами і
зовнішнім виглядом (габітусом). Проте кути між відповідними гранями у всіх
кристалів цієї речовини лишаються однаковими. Ця властивість, пов'язана з
особливостями внутрішньої будови, називається законом сталості кутів
(закон Гюї). Деякі речовини мають кілька кристалічних форм, стійких у
певних інтервалах тиску і температури (явище поліморфізму). Перехід з
однієї кристалічної форми в іншу супроводжується тепловим ефектом у
зв'язку з перебудовою кристалічних решіток. Багато речовин кристалізується
з включенням у кристалічні решітки молекул води, утворюючи так звані
кристалогідрати.
Кристалографія, спираючись на симетрію, зводить усю різноманітність форм
кристалів до 230 груп, які, в свою чергу, об'єднуються в 7 кристалічних
систем (сингоній): триклинну, моноклин-ну, ромбічну, тригональну,
тетрагональну, гексагональну і кубічну. Наприклад, кристали поширеної —
сахарози — відносять до моноклинної сингонії. Вони характеризуються
трьома кристалографічними осями з нерівними відрізками, причому дві
осі розташовані під прямими кутами, а третя — похило (
103
°)
188
У промисловості за допомогою кристалізації одержують речовини (сіль,
цукор, глюкозу, лактозу) у чистому і зручному для використання вигляді.
Щоб дістати надчисті речовини, вдаються до багаторазової перекристалізації
(наприклад, при виробництві цукру). Крім чистоти, важливою
характеристикою є розмір .кристалів та їх однорідність. Звичайно прагнуть
одержати крупнокри-сталічний однорідний продукт, що добре фільтрується і
сушиться.
У процесі виготовлення карамелі вживають усіх заходів, щоб запобігти
кристалізації (зцукрюванню) — додають крохмальну патоку, інвертний
цукор та інші антикристалізатори. Кристалізація — небажане явище і під час
зберігання багатьох кондитерських мас. А при виробництві кристалічного
ірису, навпаки, прагнуть прискорити процес кристалізації. У виробництві
мармеладу і пастили цей процес регулюють так, щоб утворилася тоненька
кристалічна кірочка, яка надає виробам товарного вигляду. Процес
кристалізації використовують також під час згущування виморожуванням
термонестійких рідких продуктів. При цьому зберігаються їх поживні
властивості.
Зворотний кристалізації процес переходу твердої фази в рідкий стан, коли
молекули твердої речовини розподіляються між молекулами розчинника,
називають розчиненням. Розчинення супроводжує процес кристалізації в
промислових умовах при коливаннях температури і концентрації. Поряд з
цим він має самостійне значення у більшості виробництв, де використовують
цукор, сіль та інші розчинні продукти.
Процеси кристалізації і розчинення не є суворо зворотними. Часто за
однакових значень рушійної сили (різниці концентрацій) розчинення
відбувається значно швидше, ніж кристалізація. Зазначимо, що процес
кристалізації набагато складніший. Кристалізація, як і будь-який фізико-
хімічний процес, характеризується статикою, кінетикою і динамікою.
Статика кристалізації визначає умови рівноваги між кристалами і розчином, з
якого вони утворювались, а також зв'язок між початковими і кінцевими
параметрами процесу.
Кінетика встановлює величину швидкості переходу речовини з однієї фази в
іншу при заданих умовах.
Динаміка кристалізації визначає характер зміни параметрів системи в часі
при зміні керованих параметрів (температури, концентрації).
На основі статики складають матеріальні і теплові баланси,
189
потрібні для розрахунку виходу кристалічного продукту, а також витрати
теплоти. Кінетичний розрахунок застосовують для вибору конструкції та
визначення розмірів кристалізатора. Динамічні характеристики
кристалізаторів потрібні для автоматичного керування і оптимізацїі процесу.
Фізичні основи процесу. Кристалізація відбувається в результаті обмеженої
розчинності речовин. Якщо в розчинник ввести достатню кількість кристалів
розчинної речовини, то процес розчинення через деякий час припиниться і
встановиться динамічна рівновага між розчином, що утворився, і твердою
фазою, яка не розчинилася. Такий розчин називають насиченим, а його
концентрацію — розчинністю. Розчин, концентрація якого менша від
рівноважної, називають ненасиченим, а більша—перенасиченим.
Як ненасичені, так і насичені розчини перебувають у сталому стані і можуть
зберігатись у незмінному вигляді необмежений час. При цьому в насиченому
розчині міститься стала максимально можлива за даних умов кількість
розчиненої речовини. На відміну від них, перенасичений розчин нестійкий.
Надлишкова (порівняно з рівноважною) кількість розчиненої речовини в ньо-
му може випасти в осад у вигляді кристалів, і розчин перетвориться на
насичений. Отже, процес кристалізації — це перехід несталого
перенасиченого розчину в сталий насичений.
Перевищення концентрації перенасиченого розчину С над
Розчинністю Co називають перенасиченням (П=С – Со), а їх відношення —
коефіцієнтом перенасичення а=С/Со
Розчинність Со що характеризує стан динамічної рівноваги
між кристалами і розчином, залежить від властивостей системи, температури
і наявності домішок.
4.6.5. Перегонка і ректифікація
За допомогою процесу перегонки багатокомпонентну рідку суміш
розподіляють на фракції, що містять компоненти суміші в концентрованому
вигляді. Ректифікацією називають процес багатократної перегонки, за
допомогою якого з рідкої суміші вилучають незначні кількості небажаних
домішок.
Переганяють і ректифікують суміші, що складаються з компонентів, які
відрізняються своєю леткістю. Під час випаровування рідкої суміші окремі
компоненти переходять у пароподібний стан інтенсивніше, завдяки чому їх
вміст у паровій фазі більший, ніж у рідкій.
190
Діаграми рівноваги. Якщо на горизонтальній осі х координат відкладати
вміст компонента А від 0 до 100% в бінарній рідкій суміші А + В, а на
вертикальній осі у — вміст цього компонента в паровій фазі, що утворюється
під час кипіння рідкої суміші різного складу, то одержаний графік і буде
діаграмою, або кривою рівноваги. За допомогою цієї кривої визначають вміст
компонента А (а отже, і компонента В) у рідкій і паровій фазах, що
перебувають у рівновазі. На осях координат кривих рівноваги відкладають
вміст легколеткого компонента, позначаючи його в рідкій фазі через х, а у
паровій — через у. Відношення х до у для будь-якої точки кривої рівноваги
називають коефіцієнтом випаровування А = у/х.
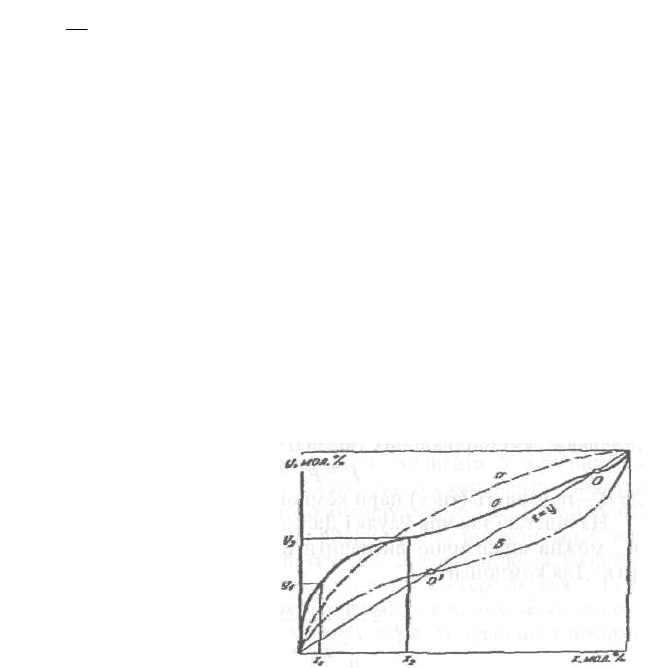
Графік характерних кривих рівноваги для різних бінарних сумішей подано на
рис. 4.32. Крива а відповідає суміші, в якій знаходиться легко-леткий
незалежно від складу суміші компоненті, вміст якого в фазах відкладено на
осях х і у.
Коефіцієнт випаровування його завжди більший від одиниці
)
x
y
k( 1
Крива б відповідає суміші, в якій компонент А до певної концентрації його в
суміші легколеткий (цю концентрацію позначають точкою О), а при вищій
концентрації—важколегкий (к < 1). Точку О, так само, як і відповідну їй
суміш називають азеотропними (для азеотропної суміші (к = 1). Криві
рівноваги широко використовують у розрахунках процесів перегонки бінар-
них сумішей. Розраховуючи процеси ректифікації, користуються величинами
коефіцієнтів А випаровування домішок — відношенням вмісту домішки у
паровій фазі до її вмісту в рідкій за умов рівноваги. При незначному вмісті
домішки її коефіцієнт випаровування залежить від вмісту двох інших
компонентів у рідкій суміші і не залежить від вмісту в суміші самої домішки.
Криві коефіцієнтів випаровування для характерних домішок, що супрово-
джують суміші етилового спирту з водою, подано на рис. 4.33.
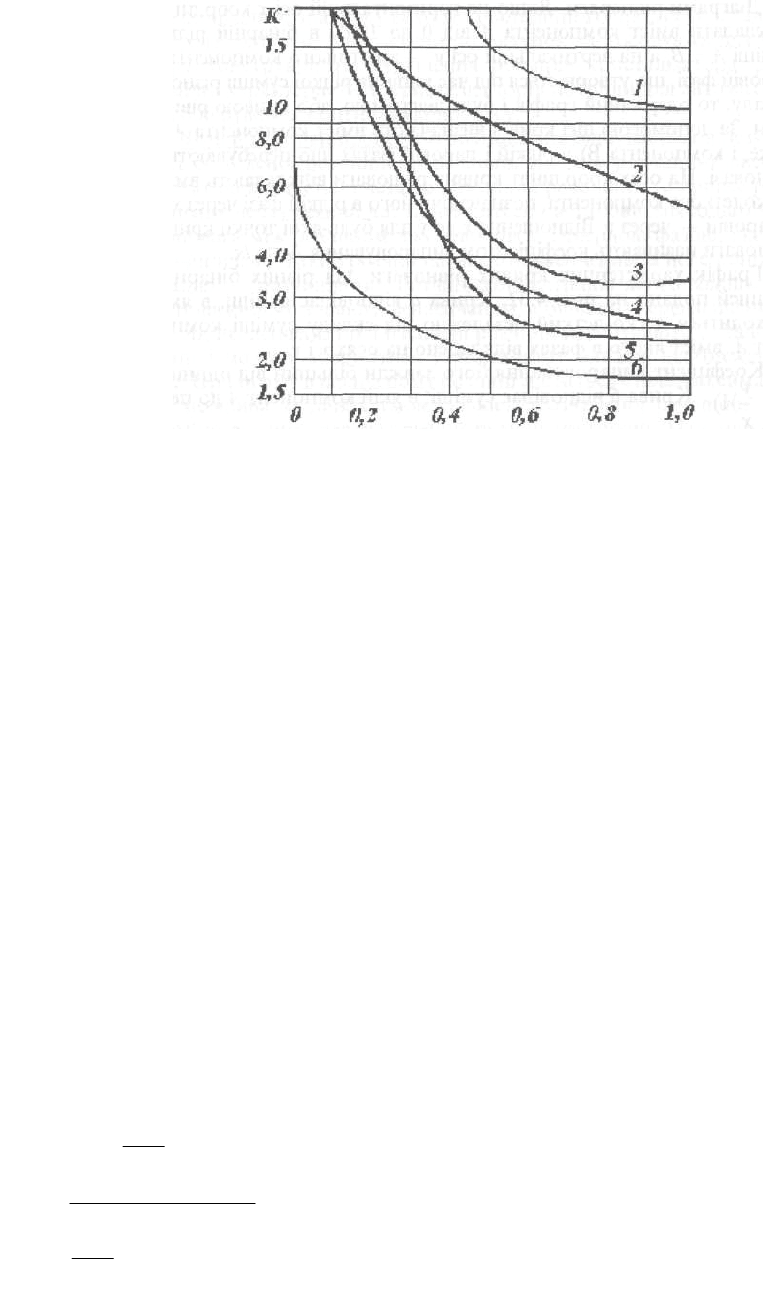
Рис. 4.32. Криві рівноваги різних бінарних сумішей
191
Рис. 4.33. Криві коефіцієнтів випаровування домішок етилового
спірту: 1 — діетиловий спирт; 2 — ацетальдегід; 3 — метилацетат;
4 — н.маслянип альдегід; 5 — етилацетат; 6 — метанол
Класифікація сумішей. У бінарних сумішах виділяють їх основні групи:
ідеальні, реальні, взаємно нерозчинних рідин і обмежено взаємно розчинних
рідин.
Ідеальні суміші підлягають законам Рауля і Дальтона. За законами Рауля,
парціальний тиск р компонента над сумішшю пропорційний його молярній
частці в ній х. Для компонента А
,
p
x
p
A
A
A
(4.43)
Де
P
A
—пружність (тиск) пари компонента А.
За законом Дальтона, загальний тиск пари над сумішшю
дорівнює сумі парціальних тисків її компонентів
pp
BA
p
, (4.44)
Де
р
в
—пружність (тиск) пари компонента В.
На підставі законів Рауля і Дальтона, знаючи склад рідкої фази, можна
аналітично визначити вміст компонентів у паровій
фазі. Для компонента
xx
P
P
x
P
P
AA
A
A
A
B
A
1
y
A
(4.45)
192
Характерну форму кривої рівноваги для ідеальної суміші було показано на
