Николаева Р.Б., Сайкова С.В., Казаченко А.С. Неорганическая химия. Практикум по химии элементов и их соединений (часть 4)
Подождите немного. Документ загружается.

81
Такую дополнительную пассивацию алюминиевых изделий иногда проводят
специально, чтобы повысить их коррозионную устойчивость (в частности, при этом
снижается способность Al растворяться в разбавленных кислотах).
С другой стороны, пассивирующее действие оксидной пленки можно устранить
амальгамированием, натирая поверхность алюминия ртутью
1
. И тогда металл реа-
гирует и с водой, и с
2
O воздуха при об.у. (На амальгамированной поверхности, по-
скольку атомы Al разбавлены атомами Hg, оксид алюминия формируется
не сплош-
ной
пленкой, а в виде отдельных нитей (образующих «щетину») и пассивации не
происходит.)
Отметим, что, проявляя большое сродство к кислороду, Al в виде порошка при
поджигании легко вытесняет (как и магний) углерод из
2
CO , а также большинство
металлов (Mn, Cr, V, W, Fe и др.) из их оксидов, связывая кислород. В частности,
взаимодействие компонентов термита (смесь 75% Al и 25%
32
OFe ) протекает очень
бурно (с разбрасыванием искр), ибо выделяется так много тепла
( 1676)OAl(H
32f
−=∆ кДж/моль), что температура реакционной зоны достигает
3000
0
С. Это используется, например, для сваривания рельсов железом, образующим-
ся по данной реакции.
Кислородные соединения р-элементов III группы
Оксиды и гидроксиды.
Оксиды и гидроксиды аналогов бора резко отлича-
ются по свойствам от соединений
самого бора.
Во-первых, борная кислота состоит из мономеров
33
BOH, связанных слабыми
ММС [24], как следствие, независимо от способа ее синтеза (гидратацией ли оксида,
осаждением ли из раствора и т.д.)
сразу формируется кристаллическая решетка
(в форме чешуек белого цвета, жирных на ощупь), поэтому активность борной ки-
слоты практически не зависит от времени хранения.
Напротив, при осаждении гидроксидов аналогов бора (из растворов солей
Э(III) действием щелочи), как и в случае других малорастворимых соединений с
ко-
валентными связями, за счет
направленности и высокой
прочности этих связей скорость
их формирования значительно
превышает скорость роста кри-
сталлов, поэтому образуются
аморфные
2
осадки с высокораз-
витой поверхностью и, как след-
ствие, достаточно активные. (В
частности, свежеполученный
3
)OH(Al сравнительно легко рас-
творяется в разбавленных кисло-
тах, а также (в силу своей амфо-
терности) и в щелочах.) Однако при стоянии эти гидроксиды
кристаллизуются и
их активность падает.
1
Амальгамировать можно, обрабатывая алюминий раствором соли ртути. При этом восстановленная алюминием
ртуть покрывает поверхность металла, образуя с ним амальгаму.
2
Если Al(OH)
3
получать пропусканием углекислого газа через раствор алюмината, то формируется кристалличе-
ская структура.
Рис. 20. Г
р
а
ф
ическая
ф
о
р
м
у
ла тет
р
або
р
ат-аниона
−
⎥
⎥
⎥
⎥
⎥
⎥
⎥
⎥
⎥
⎥
⎥
⎥
⎦
⎤
⎢
⎢
⎢
⎢
⎢
⎢
⎢
⎢
⎢
⎢
⎢
⎢
⎣
⎡
2
OH
OBO
OHBOBHO
OBO
OH

82
Во-вторых, при нагревании все гидроксиды р-элеменов III группы, даже TlOH
1
,
теряют воду, но в случае алюминия (и его аналогов в ст.ок. (+3)) этот процесс
не-
обратим
, т.к. получается продукт с очень прочной решеткой (т.пл.
32
OAl равна
2050
0
С). А борный ангидрид с гораздо менее стабильной структурой (т.пл.=450
0
С)
при об.у. поглощает даже влагу воздуха, снова образуя борную кислоту.
Подчеркнем, что
оксид бора (в отличие
33
BOH) - полимер, поэтому, рас-
плавляясь, легко переходит в стеклообразное (т.е. аморфное) состояние.
Соли. Являясь полимерами, и метабораты (подобно
32
OB, а также
2
SiO и
силикатам) тоже легко образуют стекла, например, при прокаливании буры с солями
многозарядных металлов. (Они могут иметь разный состав и часто окрашены в ха-
рактерные цвета:
322
)BO(CrNaBO ⋅ – зеленый;
222
)BO(CoNaBO2
⋅
– синий и т.д., что
используется в аналитической химии.)
На свойстве буры растворять оксиды металлов с образованием стеклообраз-
ных боратов основано также применение ее для получения эмалей.
Подчеркнем, что сама бура тоже является полимером, ее простейшая формула
точнее записывается как OH8])OH(OB[Na
24542
⋅
, т.е. ее анион – тетрамер, в котором
бор имеет
3
sp - и
2
sp -гибридизацию (рис. 20). Причем, за счет способности бора об-
разовывать боркислородные циклы и цепи, построенные из фрагментов и
3
BO , и
4
BO , наблюдается большое структурное разнообразие боратов.
Отметим, что если бор в солях выступает лишь в роли
анионообразователя,
то его аналоги чаще составляют
катионную часть солей, причем их ацетаты, нит-
раты, сульфаты и галиды растворимы в воде (кроме TlГ), но гидролизуются, и тем в
большей степени, чем меньше радиус катиона. (Поэтому сульфиды алюминия и гал-
лия в контакте с водой не существуют, а индий(III), напротив, осаждается сероводо-
родом из водных растворов.)
К тому же,
в случае аналогов бора сравнительно небольшой радиус ионов
+3
Э
и высокий заряд способствуют образованию не только достаточно прочных катион-
ных (аква-) комплексов, а также двойных солей, в частности, квасцов (см. выше), но
и анионных (например, галидных) КС.
О токсичности соединений B и Al
Соединения бора противопоказаны животным организмам, в том числе че-
ловеку, т.к. приводят к нарушению обмена веществ и заболеванию желудочно-
кишечного тракта. Поэтому в последние десятилетия использование борной кислоты
в медицине резко ограничено.
Алюминий в ряду
токсичности металлов (для человека) находится на по-
следнем месте. Однако при его избытке в организме может быть дегенерация нерв-
ных клеток (болезнь Альцгеймера), заболевания почек и печени; кроме того, алюми-
ний служит катализатором превращения нитратов в более вредные для организма
нитриты (см. выше).
Вследствие высокой химической активности, особенно токсичными являются
водородные
соединения бора и алюминия, а также все соединения их аналогов.
1
Гидроксид таллия(I) желтого цвета, при 100
0
С чернеет, переходя в Tl
2
O, который хорошо растворяется в воде,
снова образуя TlOH. Борная кислота дегидратируется выше 170
0
С, причем процесс идет через образование про-
межуточного продукта – полиметаборной кислоты (НВО
2
)
n
.

83
Лабораторная работа «БОР И АЛЮМИНИЙ»
ОПЫТ 1. ПОЛУЧЕНИЕ ОКСИДА БОРА И ЕГО СВОЙСТВА
Небольшое количество борной кислоты нагреть на жести (на плитке), а когда
масса начнет вспучиваться, подцепить часть ее стеклянной палочкой и потянуть. На-
блюдается ли стеклообразность полученного продукта? Проверить после охлаждения
оксида его отношение к влаге воздуха, к воде, а также к хлороводородной кислоте и
щелочи, добавляя по 3 капли реактива к
небольшому количеству оксида. Сделать
вывод о кислотно-основных его свойствах.
ОПЫТ
2. ПОЛУЧЕНИЕ И СВОЙСТВА БОРНОЙ КИСЛОТЫ
А. Получение. На предметном стекле к 1 капле насыщенного раствора буры
добавить 1 каплю концентрированной серной кислоты, на этом же стекле те же кап-
ли поместить рядом и соединить их каплей воды. Рассмотреть форму образующихся
кристаллов под микроскопом, сравнить их между собой, а также с формой кристал-
лов реактивной (товарной) борной кислоты. Сделать выводы.
Б. Качественная реакция. К 1 г борной кислоты (в пробирке) прилить 10 мл
этилового спирта и 1 мл концентрированной серной кислоты. Перемешивая содер-
жимое пробирки, нагреть его на водяной бане до полного растворения кристаллов.
Полученную жидкость вылить в фарфоровую чашку (под тягой) и поджечь. Что на-
блюдается и почему?
В. Кислотные свойства
1. Определение pH. Приготовить 12 мл насыщенного раствора борной кисло-
ты. Определить его значение pH, используя универсальную индикаторную бумагу и
pH-метр. Дать объяснения полученным результатам. Раствор сохранить для выпол-
нения пункта 2, а также опыта Г-1.
2. Реакция с магнием. Отобрать 2 мл борной кислоты, полученной по пункту 1,
и опустить в нее кусочек магниевой ленты. Что
наблюдается и почему?
Г. Вытеснение кислот
1. Угольная кислота. На небольшое количество сухого карбоната натрия по-
действовать 2 мл насыщенного раствора борной кислоты, приготовленного в опыте
В-1. Объяснить результат.
2. Хлороводородная кислота. Растертую смесь сухих борной кислоты и хлорида
натрия нагреть в тигле на плитке (под тягой). Что происходит и почему?
Можно ли объяснить явления, наблюдаемые в опытах
Г-1 и Г-2, используя
значения констант диссоциации кислот?
ОПЫТ
3. СВОЙСТВА БУРЫ
А. Гидролиз. Приготовить 20 мл насыщенного раствора буры и измерить его
значение pH (универсальной индикаторной бумагой и с помощью иономера). Объяс-
нить полученные данные.
Б. Сплавление с оксидом металла. Окисленную медную проволоку опус-
тить в сухую буру и затем поместить в пламя спиртовки на 1-2 минуты. Повторить
эту операцию несколько раз. Что наблюдается?
В. Осаждение катионов. В 4 пробирки поместить по 3-4 капли насыщенного
раствора буры и добавить (
отдельно в каждую прбирку!) по несколько капель рас-
творов солей Cr(III), Fe(III), Co(II), Cu(II). Отметить цвета выпавших осадков. Уста-
новить боратами или гидроксидами они являются (с помощью каких реакций?).

84
ОПЫТ 4. ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ С ПРОСТЫМИ ВЕЩЕСТВАМИ
А. Реакция с кислородом
1. Пластинку алюминия очистить наждачной бумагой. На свежую поверхность
металла нанести каплю нитрата ртути(I) или хлорида ртути(II). (Осторожно, эти рас-
творы ядовиты!) Наблюдать изменение внешнего вида пластинки под каплей. Поче-
му оно происходит? 3атем каплю стряхнуть в специальную банку, а пластинку, про-
мокнув фильтровальной бумагой, оставить на воздухе. Наблюдать окисление алюми
-
ния и происходящее при этом разогревание пластинки. Каков вид продукта?
2. Порошок алюминия микродозами всыпáть в пламя спиртовки. Что наблюда-
ется и почему?
Б. Реакция с бромом. (Опыт проводить в вытяжном шкафу!) Поместить в
пробирку, вставленную в стаканчик, маленький кусочек алюминия и прилить 6-
7 капель брома. Что начинает происходить через несколько минут? Дать объяснения.
ОПЫТ
5. ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
A. Реакция с водой. Гранулу алюминия очистить наждачной бумагой и опус-
тить в коническую (зачем?) пробирку с дистиллированной водой. Выделяется ли во-
дород? Осторожно, чтобы не раздавить пробирку, потереть поверхность алюминия
стеклянной палочкой. Происходит ли выделение газа? Почему? Нагреть пробирку,
отметить наблюдение.
Извлечь кусочек алюминия из пробирки, вытереть его досуха, положить на
фильтровальную бумагу
и смочить его поверхность одной каплей раствора соли рту-
ти(I) или (II). Через 2-3 мин стряхнуть каплю в специальную банку, алюминий осу-
шить фильтровальной бумагой и снова опустить в пробирку с водой. Что наблюдает-
ся?
Б. Реакция с хлоридом аммония. В пробирку с 1 мл насыщенного раствора
хлорида аммония опустить гранулу алюминия. Нагреть содержимое пробирки в пла-
мени спиртовки. Объяснить наблюдения.
В. Вытеснение меди(II). Налить в две пробирки по 1 мл 0,5М растворов: в
одну – хлорида меди(II), а во вторую – сульфата меди, и опустить по 1 грануле алю-
миния. Одинаков ли внешний эффект? Нагреть содержимое пробирок, отметить и
объяснить наблюдаемые явления.
Г. Восстановление перманганат-ионов. Небольшой кусочек алюминия об-
лить в пробирке 1М
42
SOH и затем добавить немного разбавленного раствора
4
KMnO . Что наблюдается при об.у. и при нагревании?
ОПЫТ
6. ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ С КИСЛОТАМИ
А. С серной кислотой. В две пробирки поместить по кусочку алюминия и до-
бавить в одну пробирку 1 мл 1М серной кислоты, а в другую – концентрированной.
Отметить внешние эффекты при комнатной температуре и при нагревании. Каков со-
став газообразных продуктов?
В. Пассивация алюминия, взаимодействие с соляной кислотой. Обра-
ботать в пробирке в течение 15 мин гранулу алюминия концентрированной азотной
кислотой (4,1
=ρ г/см
3
). Затем слить жидкость, промыть гранулу водой. Во вторую
пробирку поместить необработанную гранулу алюминия и затем в обе пробирки до-
бавить по 1 мл 1M хлороводородной кислоты. Сравнить интенсивность реакций и
объяснить полученные результаты.
85
ОПЫТ 7. ПОЛУЧЕНИЕ И СВОЙСТВА ГИДРОКСИДА АЛЮМИНИЯ
А. Получение. Амфотерные свойства
1. К 1 мл соли алюминия добавить 1 мл карбоната аммония. Отметить цвет
осадка и установить его состав. С этой целью сделать следующее:
а). К 1/3 осадка добавить при перемешивании избыток 1M щелочи (но не бо-
лее чем требуется для растворения осадка), а затем лопаточку сухой соли хлорида
аммония. Отметить наблюдаемые эффекты.
б). Оставшийся осадок
отфуговать, раствор слить, а осадок промыть 2 раза
дистиллированной водой (заливая по 4 мл воды, хорошо взмучивая осадок и затем
отделяя его фугованием). К промытому осадку добавить избыток 1M HCl и отметить
внешний эффект. Наблюдается ли выделение газа?
На основании полученных результатов сделать вывод о составе осадка.
2. Проверить, что произойдет при сливании равномолярных растворов
соли
алюминия и гидроксида натрия в соотношениях: 1:4 и 4:1. Почему?
Б. Получение алюминиевого лака. К 3-4 каплям раствора хлорида алюми-
ния (в пробирке) прибавлять по каплям аммиак до прекращения образования осадка.
Затем прилить 5-6 капель ализарина и нагреть содержимое пробирки до кипения.
Что наблюдается? Почему?
ОПЫТ
8. ИССЛЕДОВАНИЕ АЛЮМИНИЙСОДЕРЖАЩИХ СОЛЕЙ
А. Гидролиз соли алюминия. К раствору сульфата алюминия добавить на-
сыщенный раствор ацетата натрия. Можно ли обнаружить внешние признаки проте-
кания реакции? Разбавить и прокипятить раствор. Что происходит?
Б. Получение алюмокалиевых квасцов. Налить в пробирку по 0,5 мл на-
сыщенных растворов сульфатов алюминия и калия, хорошо перемешать стеклянной
палочкой. Что наблюдается через 2-3 мин? Перенести каплю полученного раствора
на предметное стекло и рассмотреть образование кристаллов под микроскопом.
(Сравнить с кристаллами исходных веществ.) Раствор сохранить для опыта В.
B. Применение алюмокалиевых квасцов.
Приготовить две узкие полоски
белой хлопчатобумажной ткани. Одну из них оставить не обработанной, а другую
опустить вначале в раствор квасцов, полученный в опыте Б, затем в раствор карбо-
ната натрия (выдерживая в каждом растворе примерно по 20 сек) и снять с нее из-
лишки жидкости (промокнув фильтровальной бумагой).
Затем обе полоски
ткани обработать раствором метилового оранжевого и вы-
сушить над плиткой. После чего выдержать их 4 мин в воде и сравнить окраску.
Д
ОПОЛНИТЕЛЬНЫЙ ОПЫТ. АЛЮМОТЕРМИЯ
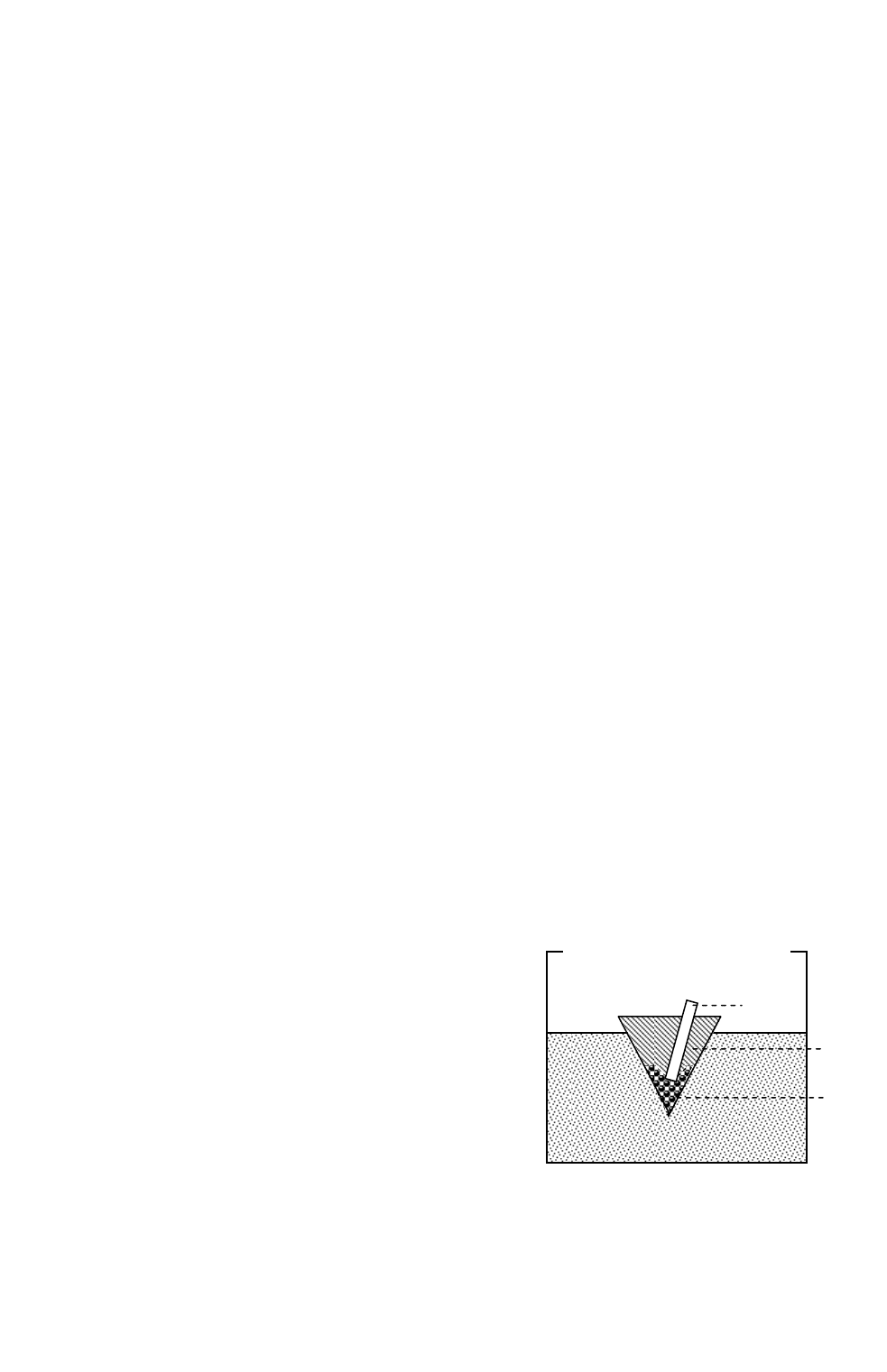
Собрать установку по схеме, приведенной
на рис. 21. Для этого в небольшой бумажный ку-
лек, высотой
6≈
см, насыпать хорошо переме-
шанные мелкодисперсные порошки алюминия
(0,6 г) и прокаленного оксида железа(III) (0,2 г)
– смесь(1). Сделать в ней углубление, вставить в
него магниевую или смоченную спиртом бумаж-
ную ленту (3) и засыпать
зажигательной сме-
сью (2)., как указано на рис. 21. (Она готовится
смешением порошка алюминия (0,8 г) и
мелко-
растертой соли нитрата калия (1,4 г), причем нитрат калия нужно растирать в ступ-
ке обязательно
отдельно от алюминия! Почему?) Кулек поместить в металличе-
Рис. 21. Установка для проведения алю-
мотермической реакции
3
2
1

86
ский сосуд с песком (под тягой!) и поджечь ленту (3) с помощью длинной лучины.
Объяснить наблюдения.
Вопросы по теме «БОР И АЛЮМИНИЙ»
1. Общая характеристика бора и алюминия. Формы нахождения в природе. (Кати-
онные или анионные формы предпочтительней для Al?). Получение простых
веществ. (Почему трудно синтезировать чистый бор?) Применение. Объяснить с
позиций ММО возможность существования молекул
2
B . При каких условиях и
почему они образуются в действительности?
2.
Составить логичный текст, используя следующие словосочетания: трудность
получения алюминия из его оксида, тугоплавкость (т.пл. 2050
0
С), значительная
разность электроотрицательностей, высокая твердость (9 по шкале Мооса), ма-
лая растворимость в воде, прочность связи OAl
−
, термодинамическая устойчи-
вость (4,1588)OAl(G
32
0
f
−=∆ кДж/моль), наличие
)dp( −
π
-перекрывания,
к.ч.(Al)=6, достаточно большой радиус, высокая металличность, сравнительно
низкая т.пл. Al (660
0
С).
3.
Как объяснить резкое изменение свойств при переходе от бора к алюминию? В
чем и почему проявляется сходство бора с диагонально расположенным крем-
нием? Почему кремний – полупроводник, а алюминий – металл с высокой элек-
тропроводностью? Почему к галлию она резко снижается?
4.
Взаимодействие бора и алюминия с простыми веществами, с водой, с кислота-
ми, со щелочами. Амальгамирование. Почему алюминий растворяется в водном
растворе хлорида аммония, но устойчив к концентрированной
3
HNO ? Взаимо-
действие с оксидами (с
2
CO ). Алюмотермия.
5.
Получение соединений бора и алюминия с водородом, их отношение к воде.
Использование их в качестве ракетного топлива. Особенность химических свя-
зей в боранах. Можно ли образование димера
62
HB объяснить действием меж-
молекулярных водородных связей? Почему связь
ЭHЭ
−
−
, присутствующая в
боранах, невозможна для углеводородов? В чем проявляется различие в струк-
туре и свойствах водородных соединений алюминия и бора? Как их объяснить?
6.
Гидридокомплексы. За счет чего
3
AlH может выступать как донор электронных
пар (при проявлении оснóвных свойств) и за счет чего, как акцептор (кислот-
ные свойства)? Примеры этих реакций.
7.
Гидроксиды бора и алюминия. Получение, кислотно-основные свойства. Струк-
тура. Одинаковые ли процессы будут наблюдаться при действии на водный рас-
твор хлорида алюминия избытка щелочи? избытка аммиака? Почему? Можно ли
с помощью кислоты получить основание из раствора соли? Почему кристаллы
33
BOH имеют форму чешуек? Если к насыщенному горячему раствору буры до-
бавить концентрированную HCl, то образуются прозрачные кристаллы
33
BOH.
Почему?
8.
Кислая ли борная кислота на вкус? (Что чувствительнее в данном случае: язык
или индикатор?) Какая характеристика применима к полиборным кислотам: по-
лимерные кислоты, конденсированные кислоты, изополикислоты, многоядерные
комплексы? Определить тип гибридизации орбиталей бора в ионах:
−3
32
)BO(,
−2
74
)OB(.
87
9. Одинаково ли состояние
−
OH -ионов в борной кислоте и в гидроксиде алюми-
ния? Почему? Как это сказывается на их свойствах? При замещении воды в ак-
вакомплексе трехзарядного иона до состава ])OH()OH(Э[
323
образуется осадок.
Как это объяснить? Почему амфотерные гидроксиды, как правило, малораство-
римы? Укажите, какие из группировок атомов могут входить в структуру гидро-
ксида алюминия:
OHAl
− , AlOAl
−
− , OAl = ,
H
OAl
H
.
Проанализировать возможность использования для описания алюмогеля сле-
дующих формул:
32
OAl ,
3
)OH(Al , )OH(AlO , OnHOAl
232
⋅
. Какие процессы идут
при постепенном прокаливании ортоборной кислоты и гидроксида алюминия?
10.
Оксиды бора и алюминия. Модификации. Получение. Применение. Физические
и химические свойства. Одинаково ли отношение к воде и кислотам образцов
оксида алюминия, синтезированных при разной температуре? В чем растворя-
ется кристаллический оксид алюминия? Почему глина пластична, а корунд
тверд, хотя основой и того, и другого является
32
OAl ?
11.
Как получить
342
)SO(Al из глины? Написать в ионной форме уравнения гидро-
лиза солей:
24
)SO(KAl , ])OH(Al[Na
4
, ]AlCl[K
4
. Какие ионы находятся в разбав-
ленном растворе буры? Зависит ли степень полимеризации анионов в боратах,
силикатах и т.п. от рН среды и концентрации маточного раствора? Как? Привес-
ти примеры борида, борана, бората.
12.
Галиды бора и алюминия. Почему хлорид бора дымит на воздухе? Гидролиз га-
лидов. Привести примеры, иллюстрирующие склонность атомов бора и алюми-
ния к комплексообразованию. Как и почему изменяется тип гибридизации атом-
ных орбиталей бора и прочность связи
FB
−
при переходе от
3
BF к
−
4
BF ? То же
ли наблюдается при переходе от
3
NH к
+
4
NH ? Почему? Каковы углы между свя-
зями в
33
NHBF ⋅ ? Можно ли получить безводный
3
AlCl термической дегидрата-
цией его кристаллогидрата? Почему
3
BF – мономер,
3
BH и
3
AlBr – димеры, а
3
AlH ,
3
AlCl и BN –полимеры? Какую пространственную конфигурацию имеет
молекула димера бромида алюминия? Какую структуру имеет
3
AlF ? Почему раз-
лична структура фторидов р-элементов V периода (
3
InF – координационная,
4
SnF – слоистая,
5
SbF – волокнистая, а
6
TeF – молекулярная)? Определить на-
правление протекания процесса:
)г()т()г(3
AlF3Al2AlF ↔+
,
если 21)AlF(G
0
f
−=∆ кДж/моль, а 2,585)AlF(G
3
0
f
−=∆ кДж/моль. Куда смещает
равновесие данной реакции повышение температуры?
13.
Нитриды бора и алюминия. Получение, свойства. Боразон, боразол. Чем объяс-
нить сходство в структуре и физических свойствах боразола и бензола? Какая
из приведенных формул более адекватна боразолу:

88
14.
Дописать реакции:
(1)
→
+
262
ClHB
(12)
⎯→⎯+
t
32
MgOB
(2)
→+
33
NHBF
(13) →
+
OH)CO(Al
2332
(3) →+ OHBF
23
(14)
→
+
OHAlCl
23
(4) →+ OHBCl
23
(15)
→
+
.)недост(NaFAlF
3
(5) →++ OHAuClB
23
→
+
)избыток(NaFAlF
3
(6) →
+
4104
KMnOHB
(16) →
+
OH)AlH(
2x3
(7) →+ Na]BF[K
4
(17)
⎯→⎯+
t
3232
CONaOAl
(8)
→++ HClKMnOAl
4
(18)
→
+
OHBOH
233
(9) →++ OHNaOHAl
2
(19)
Как получить
32
SAl
?
(10)
→+
+
OHS)NH(AlCl
2243
(20) →
+
.)конц(HNOAl
3
(11)
⎯⎯⎯⎯→⎯+
>t,OHбез
2
2
COAl
(21)
→
+
.)разб(HNOAl
3
ВОПРОСЫ К КОЛЛОКВИУМУ II
1. Общая характеристика р-элементов IV группы. Нахождение в природе. Получе-
ние и применение простых веществ, их структура и физические свойства. Усло-
вия образования алмаза, графита и других модификаций простых веществ угле-
рода.
2.
Химические свойства простых веществ р-элементов IV группы в реакциях с М,
неметаллами, водой, кислотами и щелочами. Различия в химической активности
алмаза и графита.
3.
Водородные соединения элементов IVА группы. Их устойчивость, способы полу-
чения, физические и химические свойства. Соединения с металлами. Получе-
ние, классификация, свойства. Карбид кремния. Перкарбиды.
4.
Оксиды и гидроксиды р-элементов IV группы в ст.ок. (+2). Получение и струк-
тура. Физические и кислотно-основные свойства. Особенности оксида уг-
лерода(II). Применение.
5.
Оксиды и гидроксиды элементов IVА группы в ст.ок. (+4). Структура, модифи-
кации. Физические и кислотно-основные свойства. Применение, получение.
Особенности структурообразования кремниевой кислоты. Золь, гель, ксерогель.
6.
Окислительно-восстановительные свойства оксидов и гидроксидов р-элементов
IV группы их применение. Свинцовый аккумулятор.
7.
Соли моно- и поликислот элементов IVА группы, их использование. Алюмосили-
каты, цеолиты. Глины. Цемент. Стекло. Зависимость свойств стекла от состава.
8.
Нитриды. Синильная и родановодородная кислоты и их соли. Получение, свой-
ства, применение. Сульфиды. Их растворимость, химический состав, получение,
применение.
9.
Галиды. Их устойчивость, получение, свойства. Фреоны. Фторокремниевая ки-
слота. Флюаты. Смешанные соединения углерода, фосген.

89
10. Общая характеристика р-элементов III группы. Нахождение в природе, получе-
ние. Модификации простых веществ, их структура, физические свойства и при-
менение.
11.
Характерные степени окисления р-элементов III группы. Взаимодействие их
простых веществ с М, неметаллами, водой, кислотами, щелочами, оксидами и
солями. Алюмотермия. Соединения с металлами. Свойства. Применение.
12.
Водородные соединения. Их структурные особенности. Получение, свойства,
применение. Гидридокомплексы.
13.
Кислородные соединения. Получение, модификации. Корунд. Свойства и приме-
нение. Гидроксиды.
Их применение. Получение, структура, физические и хими-
ческие свойства.
14.
Соли р-элементов III группы. Их растворимость. Бура. Структура буры, свойст-
ва, применение. Нитриды. Боразон. Боразол. Галиды. Их устойчивость, структу-
ра, получение, свойства, применение. Комплексы. Особенности фторидных КС.
15.
Общая характеристика s-элементов II группы. Нахождение в природе. Способы
получения простых веществ. Физические свойства. Применение. Энергия иони-
зации атомов и химическая активность s-металлов II группы. Взаимодействие с
водой, кислотами и щелочами.
16.
Пероксиды, гидриды, оксиды щелочноземельных металлов. Получение и свой-
ства. Применение. Гидроксиды. Получение и свойства, растворимость, приме-
нение.
17.
Растворимость солей ЩЗМ. Получение, свойства, применение. Аква-, амино- и
анионные комплексы. Многоядерные комплексы бериллия. Известняк, гипс. Же-
сткость воды, ее устранение. Иониты. Их использование для тонкой очистки во-
ды.
18.
Общая характеристика s-элементов I группы. Нахождение в природе. Получе-
ние, применение, физические и химические свойства щелочных металлов. Про-
дукты их взаимодействия с компонентами воздуха. Есть ли корреляция между
1
I , )M/M(E
00 +
и химической активностью М? Хранение. Почему s-металлы
II группы имеют более высокие температуры плавления и кипения, чем
I группы?
19.
Закономерности изменения тепловых эффектов образования соединений ще-
лочных металлов с водородом, кислородом, галогенами. Свойства гидридов.
Пероксиды. Надпероксиды. Получение, свойства, применение.
20.
Получение и физические свойства оксидов и гидроксидов ЩМ, химические
свойства. Действия щелочей на металлы и неметаллы.
21.
Соли ЩМ. Их получение. Растворимость, применение.
22.
Производство соды. Экологические проблемы этого производства. Возможные
пути их решения.
23.
Благородные газы. Положение в периодической системе. Нахождение в приро-
де. Получение, применение. Физические и химические свойства. Соединения
БЭ.

90
d-ЭЛЕМЕНТЫ
История открытия. Лабораторные способы получения.
Химические свойства простых веществ
История открытия d-элементов первых трех декад охватывает очень широ-
кий
период, начиная от древности (VIII тысячелетие до н.э.), и кончая сороковыми
годами XX века. Это объясняется тем, что возможность получения того или иного
d-металла (как и других простых веществ) сопряжена, как правило, с разной трудно-
стью
вскрытия их природных соединений, поэтому открытия часто оказываются
обусловлены появлением принципиально новых методов переработки сырья. И есте-
ственно, что d-металлы, встречающиеся на Земле в
самородном состоянии: медь,
золото, серебро, ртуть и железо (метеоритного происхождения), - были известны из-
древле.
Примерно в то же время научились получать медь и из природных соедине-
ний, используя
уголь в качестве восстановителя. (Латинское название «купрум» - от
названия о. Кипр, где медь таким способом выплавляли, а русское слово «медь»
произошло от греческого «маталлос», что означало «рудник».) С тех пор медь стали
широко применять для технических целей. Как результат
каменный век сменился
медным, а спустя 1000 лет – бронзовым, поскольку бронза
1
(сплав меди и олова)
превосходила медь по прочности и коррозионной устойчивости.
Железо (точнее сталь) удалось выплавить из руды много позже – лишь в
1500 г. до н.э., когда при получении металлов начали применять дутье, т.е. усилен-
ный ток воздуха. (Это интенсифицирует процесс сгорания угля, в результате чего
развивается более высокая
температура, необходимая для отшлаковывания силика-
тов (примесей руды).)
Бронзовое оружие против нового стального было бессильно, как следствие,
примерно с XII века до н.э. начинается
железный век. В латинском названии «фер-
рум» (крепость) как раз и отражена повышенная прочность железных изделий, это
же заключает в себе русское слово «железо», образованное от глагола «лез» - «ре-
зать».
Латинские название других металлов древности: «аргентум» (белый, свер-
кающий) и «аурум» (утренняя заря) подчеркивают красивый блеск металлов, как и
русское название «
серебро» - от «серп» (Луна) и «золото» - от «сол» (Солнце). А
латинское «гидраргирум» (жидкое серебро) отражает необычное для металла агре-
гатное состояние ртути. Русское название «
ртуть», возможно, произошло от слова
«руда» - «красный цвет» – окраска природного соединения киновари HgS.
Одним из результатов
алхимического периода химии явилось получение ме-
таллического
цинка (в XII веке в Индии), хотя латунь (сплав Cu и Zn, образующийся
при нагревании меди с цинкосодержащими минералами) была известна еще во
II веке до н.э. Название этому металлу, вероятно, дали за внешний вид: германское
«цинко» означает «бельмо на глазу».
Аналог цинка -
кадмий, открыт позже его – в 1817 г. Название он получил за
желтый цвет своего сульфида. (Кадмией с древних времен называли вещества, при-
дающие меди, выплавляемой из руды, золотистый цвет.)
1
Название «бронза» (первого сплава, полученного человечеством) произошло от города Брундизи, где его про-
давали.
