Николаева Р.Б., Сайкова С.В., Казаченко А.С. Неорганическая химия. Практикум по химии элементов и их соединений (часть 4)
Подождите немного. Документ загружается.


41
Гидразин и гидроксиламин, содержащие азот в промежуточных ст.ок. (в отли-
чие от
3
NH ), могут проявлять также достаточно сильные окислительные свойства
(табл. 1), причем не только в кислой среде, но и в щелочной:
33222
NH)OH(FeOHOHNH)OH(Fe
+
→++ (56,0))OH(Fe/)OH(Fe(E
23
0
−= В)
Проявляя и окислительные и восстановительные способности,
42
HN и OHNH
2
склонны к реакциям дисмутации, поэтому взрывоопасны. Чтобы снизить редокс-
активность, их переводят в соли. Например, сравните:
05,0)Cl]OHNH/[ON(E
32
0
−= В, а 05,1)OHNH/ON(E
22
0
−= В.
Однако даже аммиак в виде соли сохраняет достаточную восстановительную
активность, что используется, в частности, при пайке для очистки поверхности ме-
талла от оксида:
OHHClNCuClHNCuO
22
0
)т(4
+++→+ .
Основная особенность солей аммония – легкость их разложения, причем в за-
висимости от природы аниона процесс идет по-разному. Так, в случае соли летучей
кислоты, не являющейся окислителем, происходит возгонка:
HClNHClNH
3
C338
4
0
+⎯⎯⎯→⎯ ,
223
C405
4
IHNHINH
0
++⎯⎯⎯→⎯ .
(иодоводородная кислота в данных условиях неустойчива).
Если кислота нелетуча, то идет отщепление аммиака:
↑+⎯⎯⎯→⎯
344
C218
424
NHHSO)NH(SO)NH(
0
,
↑+⎯⎯→⎯
3424
C70
424
NHPOH)NH(HPO)NH(
0
.
(из приведенных примеров видно, что чем слабее кислота, тем ниже температура
разложения соли).
Если же соль содержит анион, проявляющий достаточно сильные окислитель-
ные свойства, то
3
N
−
восстанавливает его:
OHOCrNOCr)NH(
2322
t
7224
++⎯→⎯
(данный процесс протекает настолько бурно и красиво, что может использоваться в
качестве фейерверка);
OHNNONH
22
C70
24
0
+⎯⎯⎯→⎯
>
,
OHONNONH
22
C260170
34
0
+⎯⎯⎯⎯→⎯
−
.

42
Последние реакции проводят в лаборатории для получения
2
N и ON
2
соответ-
ственно. Причем,
ON
2
образуется с хорошим выходом, если брать нитрат аммония
чистый (особенно от хлорид-ионов), высушенный (при 105
0
С) и смешанный с сухим
песком. Иначе процесс идет с образованием других продуктов:
)NO;ON(NOOHNNONH
23222
C260170
34
0
++⎯⎯⎯⎯→⎯
−
.
При нагревании до более низких температур нитрат аммония разлагается на
3
NH и
3
HNO , а выше 270
0
C взрывается с образованием
2
N
,
2
O
и
OH
2
.
Нитраты металлов (М) тоже термически неустойчивы. Причем в зависимости
от активности М образуются разные продукты. Так, в случае нитратов благородных
элементов происходит восстановление металлов:
22
0
t
3
ONOAgAgNO ++⎯→⎯ .
Разложение солей более активных М (от Cu до Mn в ряду напряжений) идет с
образованием оксидов:
22
t
23
ONOCuO)NO(Cu ++⎯→⎯ ,
причем в случае марганца его степень окисления повышается:
22
t
23
NO2MnO)NO(Mn +⎯→⎯ .
Наиболее устойчивы соли ЩМ (вследствие минимального поляризующего дей-
ствия металла). Так, нитриты ЩМ даже кипят без разложения. Нитраты менее ста-
бильны – при нагревании выше 600
0
С переходят в нитриты с выделением O
2
(влия-
ние энтропийного фактора)
1
.
А поскольку отделяется кислород от анионов соли в
атомарном состоянии, то
нитраты используются как сильные окислители при
высокотемпературных про-
цессах [24]. В частности,
3
KNO применяют в качестве компонента пороха:
2222
C600.взрыв
3
NSOCOSKCSKNO
0
+++⎯⎯⎯⎯⎯→⎯++
>
.
Нитрат
натрия, вследствие своей гигроскопичности, для этой цели не годится
(порох должен быть сухим).
В водных растворах, напротив, нитраты стабильнее нитритов за счет большей
доли
π-перекрывания в связях ON
−
(влияние энтальпийного фактора), поэтому и
азотистая кислота в воде
2
менее устойчива к разложению, чем азотная, и, как ре-
зультат, является более сильным окислителем:
45,1)N/HNO(E
22
0
= В, а 25,1)N/NO(E
23
0
=
−
В.
1
Плавится нитрат натрия при температуре 300
0
С.
2
Достаточно концентрированные растворы HNO
2
имеют голубую окраску.

43
Техника безопасности при работе с соединениями азота
Вследствие своей химической активности азотсодержащие неорганические
вещества являются и
биологически активными (токсичными). Причем нитраты и
нитриты могут попадать в организм через пищеварительный тракт, а летучие веще-
ства (аммиак и оксиды азота) – через дыхательные пути.
Аммиак. Это бесцветный газ с едким запахом и жгучим вкусом. Смеси с воз-
духом, содержащие от 14 до 28% (об.)
3
NH взрывоопасны. Аммиак сильно раздража-
ет слизистую оболочку и может даже вызвать рефлекторную остановку дыхания.
Признаки отравления им бывают необычными. Например, не очень громкий звук вы-
зывает судороги.
ПДК аммиака в воздухе производственных помещений - 20 мг/м
3
(отметим, что
запах его ощущается уже при 0,5 мг/м
3
). Концентрацию 250 мг/м
3
с трудом выдер-
живает в течение часа даже очень здоровый человек. Еще более высокое содержа-
ние аммиака вызывает химические ожоги глаз, поражения дыхательных путей,
одышку и воспаление легких. Все это сопровождается сильным кашлем и жжением в
горле.
Первая помощь – свежий воздух, обильное промывание водой глаз, вдыхание
водяного пара, ингаляция 1%-ой
уксусной кислотой. Хроническое отравление ам-
миаком приводит к ослаблению слуха, расстройству пищеварения, катару верхних
дыхательных путей и т.п..
Оксиды азота. Все оксиды азота ядовиты, кроме т.н. «веселящего газа», т.е.
«
закиси азота, правильнее – оксида азота (I) [24], который обладает наркотическим
действием и токсичен лишь при концентрациях в воздухе >20%.
Оксид азота(II) – бесцветный газ при соприкосновении с воздухом перехо-
дит в
диоксид азота буро-красного цвета, который обладает характерным запахом.
Оба вещества действуют в основном на слизистую оболочку дыхательных путей (при
этом на ней образуются кислоты, а в крови появляются нитраты и нитриты). Кроме
того, NO соединяется с гемоглобином, затрудняя дыхание.
Отравление данными оксидами азота проявляется (в виде сухости во рту,
кашля, иногда тошноты
и рвоты, боли в груди, сильной одышки) лишь спустя не-
сколько часов после вдыхания газа. Отравление ими особо опасно для людей со
слабым сердцем.
ПДК NO и
2
NO
в воздухе производственных помещений - 5 мг/м
3
. Вдыхание в
течение часа воздуха, содержащего 500 мг/м
3
этих оксидов, может вызвать опасные
для жизни заболевания. При
хроническом отравлении наблюдается усиленное
сердцебиение, катар дыхательных путей, кровохаркание, разрушение зубов.
Первая помощь при
острых отравлениях – обильный прием молока, кисло-
родное дыхание, впрыскивание камфары, свежий воздух, полный покой, тепло. Сле-
дует вызвать врача.
44
Лабораторная работа «АЗОТ»
ОПЫТ 1. ПОЛУЧЕНИЕ И СВОЙСТВА АЗОТА
Собрать прибор по схеме (рис. 12). На-
сыпать в колбу (1) 1 г размельченного нитри-
та натрия, прилить по каплям концентриро-
ванный раствор хлорида аммония и (осторож-
но) нагреть колбу. Собрать выделяющийся газ
в две пробирки и проверить, поддерживает ли
он горение древесины, имеет ли запах.
ОПЫТ
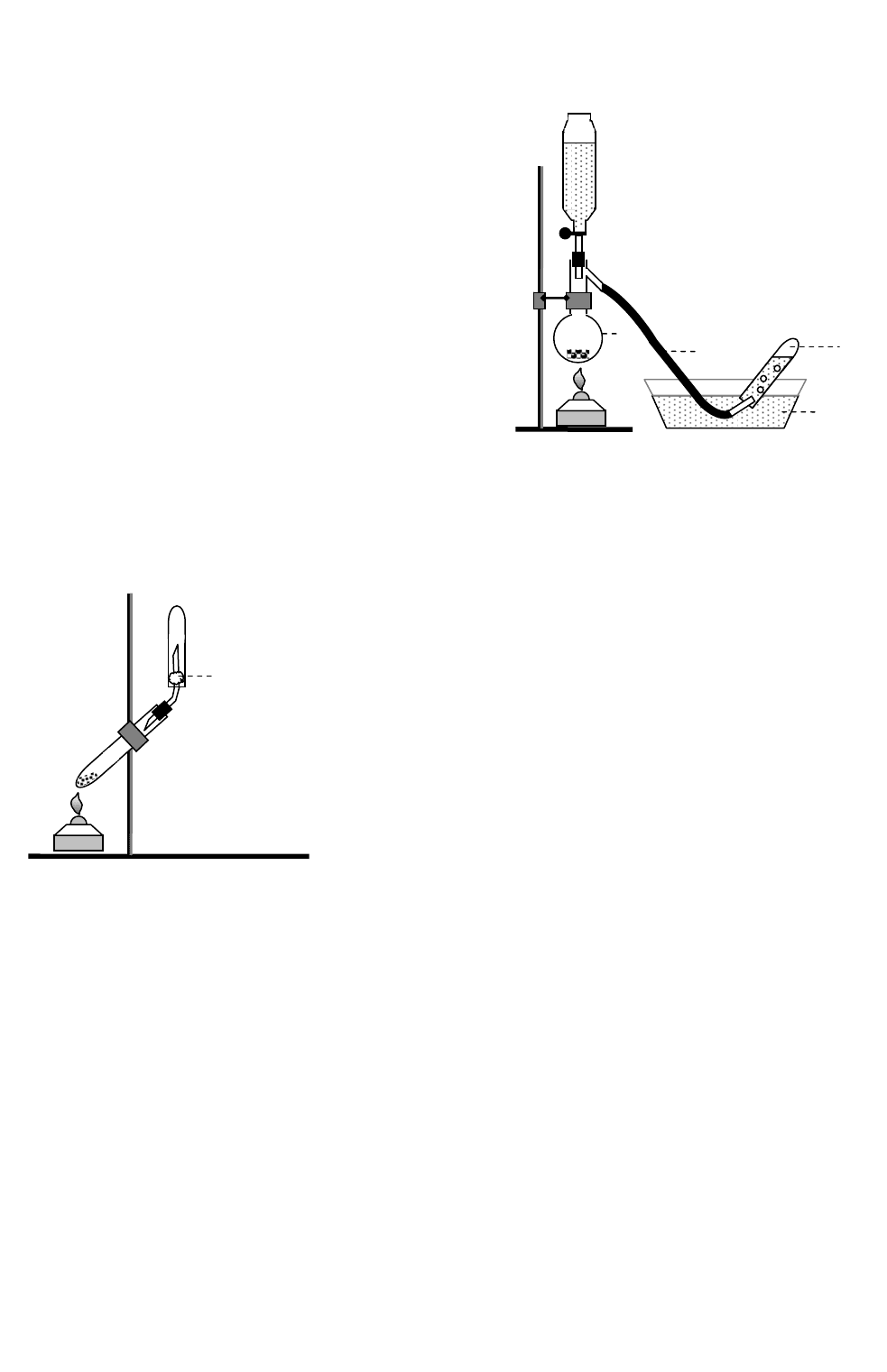
2. АММИАК И ЕГО СВОЙСТВА
А. Получение и идентификация.
Приготовить в ступке смесь из равных по объ-
ему частей хлорида аммония и гашенной из-
вести. Обладает ли смесь запахом? Перенести
смесь в пробирку и заткнуть ее пробкой с га-
зоотводной трубкой (рис. 13). Пробирку нагреть (под тягой) и поднести к концу га-
зоотводной трубки влажную розовую лакмусовую бумажку. Что наблюдается?
Сохра-
нить бумажку для демонстрации. Каков запах выделяющегося газа?
Б. Растворение. «Малиновый фонтан».
Приготовить стакан на 100 мл, заполненный на
2/3 объема разбавленным раствором фенолфталеина.
Собрать аммиак в пробирку объемом на 30-40 мл
(рис. 13). О заполнении пробирки газом судить по из-
менению окраски влажной розовой лакмусовой бу-
мажки, поднесенной к отверстию пробирки.
Не переворачивая пробирку, заткнуть ее проб-
кой с газоотводной трубкой, расположенной так, что-
бы ее оттянутый конец находился внутри пробирки,
и в присутствии группы погрузить другой конец труб-
ки в стакан с раствором фенолфталеина. Дождаться,
пока жидкость из стакана поднимется по трубке. Что
затем происходит? Почему? Раствор сохранить для
опыта Г.
В. Гидратация. Собрав аммиак в другую пробирку, проверить, действительно
ли в присутствии аммиака лед тает быстрее, чем в воздушной среде. Объяснить на-
блюдение.
Г. Сдвиг равновесия. Налить по 3 мл раствора, полученного в опыте А, в три
пробирки. Одну нагреть в пламени спиртовки до закипания раствора. (Изменяется ли
интенсивность окраски? Почему?) Во вторую пробирку добавить 0,5 мл 2М NaOH, а к
третьей прилить 0,5 мл 2М HCl.
О направлении смещения равновесия в двух последних случаях судить по из-
менению цвета
розовой лакмусовой бумажки, поднесенной к пробирке, или по ин-
тенсивности
запаха аммиака. Дать объяснения наблюдениям. Результаты сохранить
для демонстрации.
Д. Получение «дыма». На дно чашки Петри поместить 1 каплю концентри-
рованного аммиака и в присутствии группы накрыть другой чашкой Петри, на кото-
Рис. 12.
У
становка
д
ля пол
у
чения азота
1
4
2
3
Рис. 13. Установка для по-
лучения аммиака
вата

45
рой «висит» капля концентрированной HCl, так, чтобы капли были как можно даль-
ше друг от друга. Что происходит и почему?
Е. Окисление аммиака. К 0,5 мл концентрированного аммиака добавлять по
каплям при перемешивании 0,1М перманганат калия. Что наблюдается и почему?
Ж. Получение и разрушение комплекса. К 1 мл соли меди(II) добавлять
при перемешивании 6М аммиак до растворения выпадающего вначале осадка (ка-
кова его окраска?), не более. Затем раствор (отметить его цвет) разделить на три
пробирки; одну сохранить для сравнения, во вторую прилить 2 мл 2М серной кисло-
ты, а третью нагреть на водяной бане в течение 10 мин. Отметить наблюдаемые яв-
ления.
ОПЫТ
3. СВОЙСТВА СОЛЕЙ АММОНИЯ
А. Разложение. Растереть в ступке 0,5 г сульфата аммония и рассыпать при-
мерно поровну в две сухие пробирки. Одну нагреть в пламени спиртовки до рас-
плавления соли. Испытать выделяющийся газ с помощью влажной
розовой лакму-
совой бумажки. Что наблюдается и почему? Бумажку сохранить для демонстрации.
После охлаждения добавить в обе пробирки по 2 мл воды и по 1 мл лакмуса. Объяс-
нить наблюдение и сделать вывод. Результат опыта показать группе.
Б. Тепловой эффект растворения. В стакан на 100 мл с 10 мл воды, по-
ставленный на мокрый картон, всыпать 6 г нитрата аммония и перемешать палочкой
до растворения соли. Что наблюдается, если приподнять стакан? Почему?
В. Восстановительные свойства. Прокалить две медных проволоки в пла-
мени спиртовки до почернения, затем одну оставить для сравнения, а вторую на-
греть в стакане с насыщенным раствором
ClNH
4
. Что наблюдается? Повторить опыт,
используя сухую соль хлорида аммония. Каков результат? Объяснить наблюдения.
ОПЫТ
4. СВОЙСТВА СОЛЕЙ ГИДРОКСИЛАМИНА
А. Определение pH. Растворить лопаточку соли гидроксиламина в 1 мл во-
ды. Испытать раствор с помощью универсальной индикаторной бумаги (сохранить
его для опыта Б), дать объяснение и сделать вывод.
Б. Окислительные свойства. Растворить несколько кристалликов соли Мора
в 0,5 мл воды в чистой пробирке, добавить 6 капель 2М щелочи (что наблюдается и
почему?) и затем прилить раствор соли гидроксиламина, полученный в опыте А.
Объяснить наблюдения.
В. Восстановление.
1. Железо(III) В две чистые пробирки отобрать по 0,5 мл хлорида железа(III),
в одну из них добавить 3-4 кристаллика соли гидроксиламина и нагревать до изме-
нения цвета раствора от желтого до светло-зеленого. Затем прилить в обе пробирки
по 0,5 мл 2М щелочи. Сравнить внешние эффекты в обеих пробирках в момент при-
ливания и
через некоторое время и объяснить различия.
2. Медь(II). Получить аммиачный раствор меди (как описано в опыте 2Ж), от-
метить внешние эффекты, наблюдаемые при добавлении к нему кристаллов соли
гидроксиламина и при последующем встряхивании на воздухе.
ОПЫТ
5. ОКСИДЫ АЗОТА
А. Получение и свойства оксида азота(I). Нагреть в тигле на плитке соль
нитрата аммония, высушенную при 105
0
С и смешанную с сухим песком. Испытать,
горит ли интенсивнее лучинка над тиглем, чем просто на воздухе? Объяснить на-
блюдение.
46
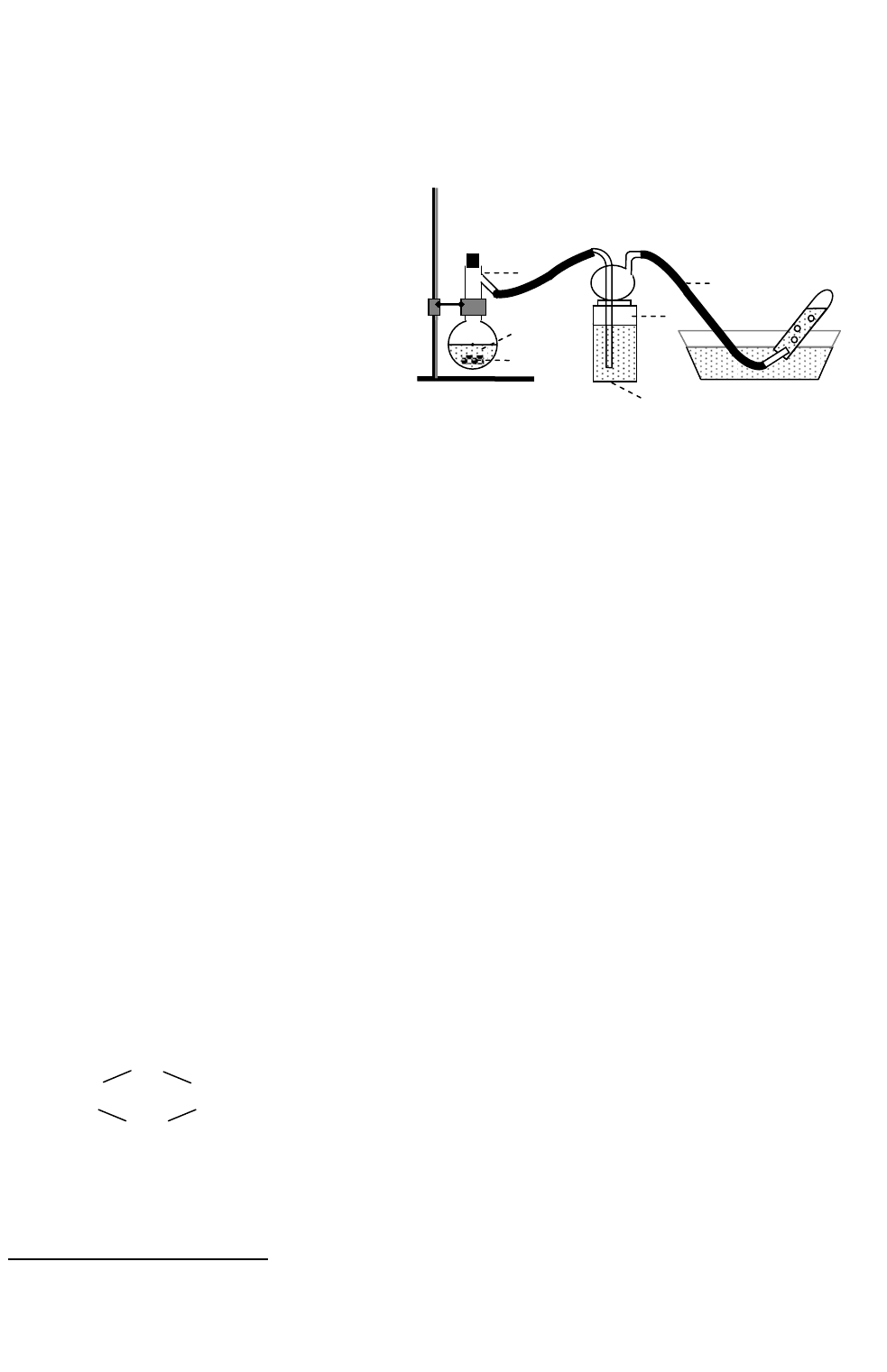
Б. Получение и свойства оксида азота(II). Cобрать прибор (по схеме на
рис. 14) под тягой. Поместить в колбу (1) 5 г медных стружек и добавить 30 мл 30%-
ной азотной кислоты. Если реакция идет слабо, подогреть (осторожно!) колбу (1).
Чем объяснить появление окраски газовой фазы в колбе? Какая реакция протекает в
промывалке (2)?
Собрать оксид азота (II) в две широкие пробирки и закрыть их
пробками. Га-
зоотводную трубку (3) опустить в
пробирку со свежеприготовленным
раствором сульфата железа(II). Что
наблюдается и почему? Результат по-
казать группе и в ее присутствии ис-
пытать, что происходит в пробирках с
собранным газом при внесении в одну
– горящей лучинки, в другую – за-
жженного фосфора. Как получить ос-
тальные оксиды азота?
ОПЫТ 6. СВОЙСТВА АЗОТИСТОЙ КИСЛОТЫ
(Опыт выполнять под тягой!)
А. Получение и разложение. К 8 каплям насыщенного раствора нитрита
натрия в пробирке добавить 8 капель 1М серной кислоты. Каков цвет раствора в
первый момент после добавления? Отметить и объяснить последующее изменение
его цвета. Какие газы выделяются? Почему?
Б. Редокс-свойства. В две пробирки налить по 1 мл нитрита натрия и по
0,5 мл 1М серной кислоты. Затем в одну пробирку добавить 1 каплю 0,1М перманга-
ната калия, а во вторую – 1 мл иодида калия. Отметить и объяснить наблюдаемые
внешние эффекты проведенных реакций.
ОПЫТ
7. СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
(Опыт выполнять под тягой!)
А. Разложение. Налить в 3 пробирки по 1 мл концентрированной азотной ки-
слоты. Первую пробирку закрепить в штативе вертикально и, нагрев кислоту, в при-
сутствии группы отметить изменение цвета раствора и газа над ним. Во вторую про-
бирку опустить кусочек лакмусовой бумаги, в третью – небольшую медную стружку.
Что наблюдается и почему?
Б. ОВР с металлами. Проверить с помощью реактива Hecслера
1
, с образо-
ванием какого продукта идет взаимодействие разбавленной азотной кислоты с цин-
ком, отобрав для анализа 3-4 капли раствора. (Под действием указанного реактива
ионы аммония образуют красно–бурый садок:
⎥
⎥
⎥
⎦
⎤
⎢
⎢
⎢
⎣
⎡
Hg
NHO
Hg
2
I.)
1
Реактив Несслера можно приготовить самим: действием избытка иодида калия на раствор соли ртути(II) полу-
чить комплекс K
2
[HgI
4
] и смешать его с равным объемом 2М щелочи.
Рис. 14. Установка для пол
у
чения оксида азота
(
II
)
NaOH
2
1
HNO
3
Cu
3

47
Внимание! Все отходы, содержащие ртуть, после окончания опыта
сливать в специальный сосуд (под тягой) — ни в коем случае не в ракови-
ну. Остатки реактива Несслера сдать препаратору!
ОПЫТ 8. ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА НИТРАТОВ
А. Качественная реакция на нитрат-ионы. К 8 каплям 0,5М нитрата калия
в тигле добавить равное количество концентрированной щелочи и лопаточку порош-
ка алюминия. Нагреть тигель на плитке. Определить запах выделяющегося газа,
внести в его пары разовую лакмусовую бумажку.
Б. Окисление органического вещества («огонь – художник»). На листе
фильтровальной бумаги нарисовать
насыщенным раствором нитрата натрия (с по-
мощью стеклянной палочки) линию так, чтобы она не пересекалась и не прерыва-
лась, и вывести ее в низ листа. После
полного высушивания поднести в присутст-
вии группы тлеющую лучинку к месту вывода линии. Что наблюдается и почему?
В. Испытание пороха. Растереть соль нитрата натрия и просушить в течение
15 мин на асбестированной сетке (на электроплитке). Смешать ее с меньшими (при-
мерно в 4 раза) и равными между собой по насыпному объему тонко растертыми су-
хими порошками серы и угля. Затем поджечь длинной лучинкой. Отметить и объяс-
нить наблюдаемый эффект.
Г. Разложение нитрата щелочного металла. Прокалить соль нитрата ка-
лия (или натрия) в тигле на электрической плите в течение 1 часа. Затем проверить,
появились ли при прокаливании нитрит-ионы. Как это сделать?
Д
ОПОЛНИТЕЛЬНЫЙ ОПЫТ. АНАЛИЗ АЗОТСОДЕРЖАЩИХ СОЛЕЙ
Получить у препаратора три соли и определить, какая из них является хлори-
дом аммония, нитратом натрия и нитритом натрия, используя иономер
или универ-
сальную индикаторную бумагу.
Вопросы к семинару по теме «АЗОТ»
1. Нахождение азота в природе. Способы получения и применение
2
N . Отличается
ли по составу газ, полученный пропусканием воздуха, очищенного от
2
CO , че-
рез трубку с раскаленными медными стружками, от полученного при разложе-
нии
24
NONH ?
2.
Электронная конфигурация молекулы
2
N с точки зрения ММО. Физические и
химические свойства азота.
3.
Возможные степени окисления N. Чем объясняется малая активность азота? По-
чему зажженный Mg горит в
2
N ? Почему этот процесс идет менее интенсивно,
чем горение Mg на воздухе? Какие химические процессы составляют основу но-
вых методов связывания азота при сравнительно невысокой температуре?
4.
Аммиак. Получение и применение. Его физические свойства; NH
3
– как раство-
ритель. Собственная ионизация в жидком аммиаке. Почему уксусная кислота в
нем диссоциирует нацело? Чем объяснить, что температура кипения воды вы-
ше, чем и у аммиака, и у фтороводорода?
5.
Химические свойства аммиака. Какие продукты в зависимости от условий обра-
зуются при его сжигании? Почему в отсутствии воды затруднена реакция NH
3
и
HC? Можно ли сушить аммиак с помощью
.)конц(SOH
42
?
52
OP?
2
CaCl ? CaO ?

48
6. Равновесие в водных растворах аммиака. Почему с точки зрения термодинамики
невозможно образование молекулы
OHNH
4
? Объяснить влияние добавления ки-
слоты и щелочи на растворимость
3
NH . Почему аммиак используют для выведе-
ния жирных пятен?
7.
Рассчитать, во сколько раз разбавили 1М раствор
3
NH (
6,11pH =
), если значе-
ние рН снизилось всего на 0,1.
8.
Какие вещества получаются при пропускании через раствор аммиака следую-
щих газов:
2
CO
, NO,
2
NO
,
2
SO
? Если
3
NH восстановитель, то почему он не вы-
тесняет водород из растворов кислот, как активные металлы, а наоборот при-
соединяет
+
H к себе?
9.
В каких случаях водный раствор аммиака не следует использовать для осажде-
ния малорастворимых гидроксидов металлов? Вычислить степень гидролиза
нитрата аммония в его 0,1М растворе.
10.
Как влияет на термическую устойчивость солей аммония природа аниона? Что
будет, если банку с карбонатом аммония достаточно долго держать открытой?
Почему эту соль можно использовать при выпечке теста? Почему при хранении
в лаборатории склянок с HCl и
3
HNO на их горлышках появляется белый налет,
а на склянках с
42
SOH – нет? Как разделить соли NaCl и ClNH
4
?
11.
Получение, структура и свойства гидразина, гидроксиламина и азидоводород-
ной кислоты. Их соли. Почему в ионе
−
3
N обе связи «азот-азот» имеют одинако-
вую длину (0,115 нм), а в молекуле
3
HN – разную: (0,113 нм и 0,124 нм)? Поче-
му валентный угол NNH
−− в
3
HN равен 110
0
?
12.
Проверить по справочникам, верна ли закономерность, данная в [14] в ряду:
22
OH ; OHNH
2
;
42
HN
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
→
⎯
активностьтельнаявосстановивозрастает
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
⎯
→
⎯
активностьнаяокислительяуменьшаетс
Почему не получены нитраты и хлораты гидразина? Почему при 8pH
≅ гидро-
ксиламин окисляет HI (продукты
2
I и
42
HN ), а при 9pH > восстанавливает
2
I
(продукты
2
N и
−
I)?
13.
Почему азиды свинца(II), ртути(II) и серебра(I) малорастворимы в отличие от
азидов щелочных металлов? Почему смесь
3
HN и HCl ведет себя (в какой реак-
ции?) подобно «царской водке»? Расположите в ряд увеличения рН водные рас-
творы одинаковой молярной концентрации следующих веществ:
OHNH
2
,
3
NH ,
42
HN ,
3
HN .
14.
Какое количество энергии освободится при взрыве 10 г
3
HN , если
8,293)HN(H
3
0
f
=∆ кДж/моль?
15.
Имея серу, кислород, азот и водород, получите сульфамид
222
)NH(SO .
16.
Почему
5
NF не получен, а
3
NF не является донором электронной пары, как
3
NH ?
17.
Оксиды азота. Структура, парамагнетизм, полярность молекул, получение, фи-
зические и химические свойства. Отношение к щелочам. Чем объясняется ус-
тойчивость оксидов при н.у.? Совпадают ли по абсолютному значению валент-
ность и степень окисления азота в соединениях:
ON
2
,
42
ON ,
52
ON,
3
HN ?

49
18. Изменится ли состав воздуха после нагревания до 3000
0
С и последующего рез-
кого охлаждения? При 2000 К для реакции:
)г()г(2)г(2
NO2ON
=
+
, значение
а
K
равно
4
103,2
−
⋅ . Вычислить равновесную концентрацию NO, если исходные по
2
N и
2
O равны 1 моль/л.
19.
Оценить термодинамическую возможность сгорания фосфора, железа и меди в
атмосфере NO. При каких условиях растворение
2
NO в воде может протекать с
образованием а)
3
HNO ; б)
3
HNO и
2
HNO ; в)
3
HNO и NO?
20.
К какому типу реакций следует отнести взаимодействие
3
AgNO и NOCl в жид-
ком диоксиде азота?
21.
Гидроксиды азота, получение, структура молекул, свойства. Устойчивость. По-
чему реакция:
3222
HNONHO →++ , не идет, причем во всем возможном тем-
пературном интервале, хотя 84,79)HNO(G
3
0
f
−=∆ кДж/моль? Как из разбавлен-
ной азотной кислоты получить концентрированную?
22.
В каких условиях
3
HNO диссоциирует на: а)
+
2
NO ,
−
3
NO и
OH
2
; б)
+
32
NOH и
−
3
NO ;
в)
+
H и
−
3
NO ? Как определить, какая из кислот: азотная, азотистая или азидо-
водородная, – находится в водном растворе?
23.
Приведите примеры, когда при сливании растворов слабых кислот образуется
сильная кислота. Объяснить, почему раствор приобретает голубую окраску в
результате реакции:
243
охлаждение
323
NONOAsOHOAsHNO ++⎯⎯⎯⎯→⎯+
.
24.
Чем объяснить, что азотная кислота слабее хлорноватой? Сравнить устойчи-
вость, силу, редокс-активность и возможность взаимного вытеснения из солей
кислот:
3
HNO ,
42
SOH и HCl. Почему при хранении концентрированной азотной
кислоты она желтеет? Реакции азотной кислоты с металлами. Почему «царская
водка» является более сильным окислителем, чем
3
HNO ?
25.
Почему азотная кислота окисляет серебро, хотя 80,0)Ag/Ag(E
0
=
+
В, а
78,0)NO/HNO(E
23
0
= В? Почему FeS растворим в HCl, а CuS нет, но оба раство-
ряются в
3
HNO ? Можно ли использовать азотную кислоту для получения серо-
водорода из сульфидов металлов?
26.
Соли. Применение. Кристаллические решетки каких из нитридов: NLi
3
,
23
NCa ,
NW
2
, NCl
3
, - имеют ионную структуру? Их отношение к воде. Какие виды сырья
требуются для синтеза
3
NaNO ,
424
SO)NH( ? Какое из этих удобрений дешевле?
27.
Составу соли отвечает массовое соотношение Э:H:N:O=12:5:14:48. Определить
формулу соли.
28.
За счет протекания какого процесса медь растворяется в расплаве
34
NONH ? В
чем причина разных (каких?) продуктов разложения нитратов натрия, сереб-
ра(I) и свинца(II)? Как по продуктам термического разложения определить со-
став смеси нитратов натрия и меди(II)? Почему нитроцеллюлоза является
без-
дымным
порохом?
29.
Техника безопасности при работе с оксидами и гидроксидами азота, с аммиа-
ком.
30.
Дописать реакции:

50
(1)
→+
23
CaOClNH (12)
⎯→⎯
t
7224
OCr)NH(
(2)
→++ HClSnClHN
242
(13)
⎯→⎯
t
424
HPO)NH(
(3)
→+ KIHN
3
(14)
⎯→⎯
t
23
)NO(Pb
(4)
+
→++
32
NHKOHZnKNO (15)
⎯→⎯
t
3
AgNO
(5)
→+ HClOHN
3
(16) →+
+
427222
SOHOCrKOHNH
(6) →++
4222
SOHPbONaNO (17) →+
+
OHNaNOClNH
224
(7)
→++⋅
42423
SOHKMnOOHNH (18) →
+
+
HClHNOAu
3
(8)
⎯→⎯
t
34
NONH
(19)
→
+
OHNONH
234
(9)
⎯→⎯
t
3
KNO
(20)
→
+
223
OHHN
(10)
⎯→⎯
t
4
INH
(21)
→
+
222
OHOHNH
(11)
⎯→⎯
t
4
ClNH
Фосфор и его аналоги
Наиболее активную модификацию P – белый фосфор – получают из красного,
выдерживая последний
без доступа воздуха при 280-340
0
С (длительным нагрева-
нием ниже 240
0
С в отсутствии кислорода можно осуществить обратный переход).
Белый фосфор представляет собой мягкую, как воск, прозрачную массу с ха-
рактерным запахом, т.пл.=44,1
0
С, т.кип.=240
0
С. В воде практически не растворим,
но хорошо растворяется в сероуглероде, хлористой сере, несколько хуже в бензоле,
эфире.
Вследствие своей активности белый фосфор поверхностно окисляется на воз-
духе даже при об.у. (хотя и медленно) с образованием продуктов РО,
2
PO
,
32
OP, в
которых Р находится в неустойчивом состоянии. С этим состоянием связаны элек-
тронные переходы, обеспечивающие свечение белого фосфора, хорошо видимое в
темноте.
Не только белый, но даже
красный фосфор реагирует с активными металла-
ми со
взрывом, образуя фосфиды, которые при действии воды дают водородные
соединения фосфора,
самовоспламеняющиеся на воздухе.
При поджигании красный фосфор сгорает, переходя при достаточном избытке
2
O
в высший оксид
52
OP, способный активно поглощать влагу воздуха. При этом, как
и при действии воды на оксид фосфора(V) образуются полиметакислоты, причем
циклического строения, ибо циклическим является исходный оксид [14]:
432104
)HPO(OHOP →+ .
При нагревании за счет разрыва циклов получаются молекулы цепочечного
вида:
3343
POnHPOH ⋅
1
, которые, постепенно деполимеризуясь (быстрее при кипяче-
нии в присутствии азотной кислоты), дают вначале дифосфорную кислоту
724
OPH и
затем монофосфорную (т.е. ортофосфорную) –
43
POH.
Обратные процессы можно осуществить тоже в присутствии азотной кислоты
(катализатор), но при более высокой температуре:
1
Дайте графическое изображение молекул кислот фосфора циклического и цепочечного вида.
