Лахтин Ю.М., Леонтьева В.П. Материаловедение
Подождите немного. Документ загружается.

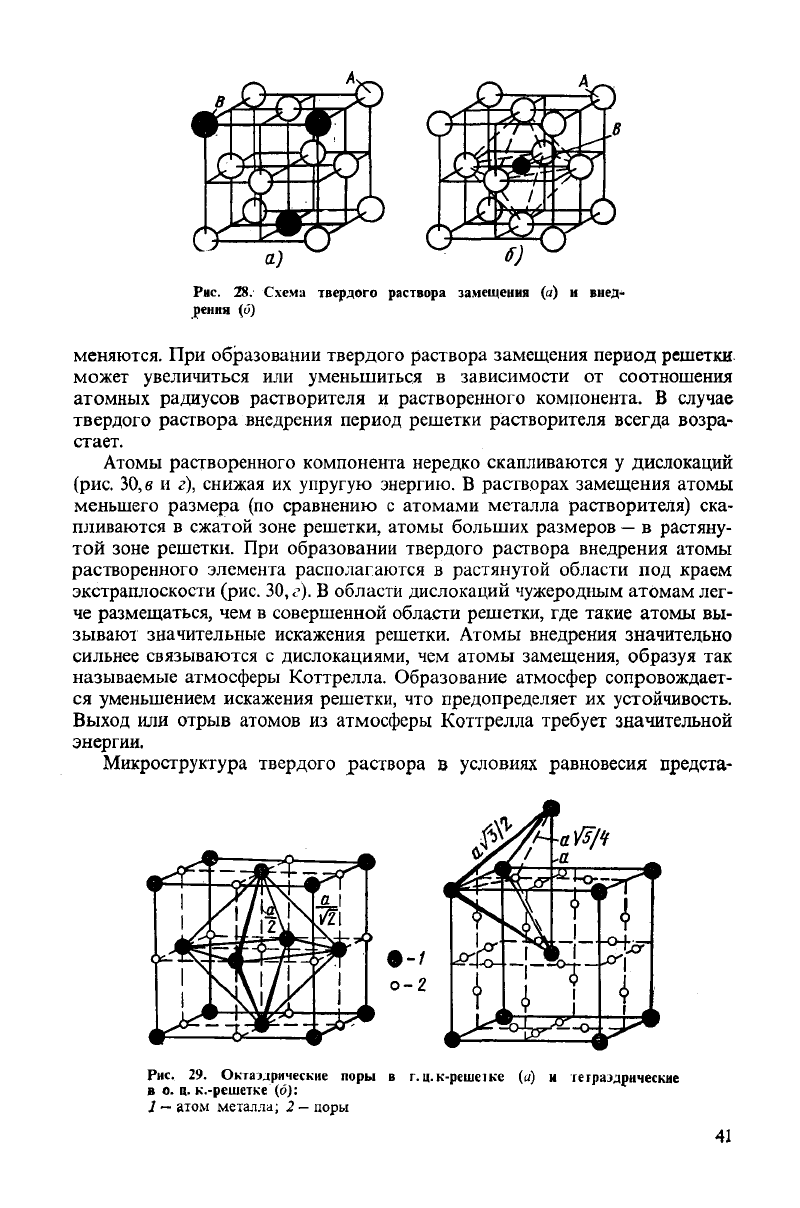
Рис.
28. Схема твердого раствора замещения (а) и внед-
рения (о)
меняются.
При
образовании твердого раствора замещения период решетки
может увеличиться
или
уменьшиться
в
зависимости
от
соотношения
атомных радиусов растворителя
и
растворенного компонента.
В
случае
твердого раствора внедрения период решетки растворителя
всегда
возра-
стает.
Атомы
растворенного компонента нередко скапливаются
у
дислокаций
(рис.
30, в
и г),
снижая
их
упругую
энергию.
В
растворах замещения атомы
меньшего размера
(по
сравнению
с
атомами металла растворителя)
ска-
пливаются
в
сжатой зоне решетки, атомы больших размеров —
в
растяну-
той зоне решетки.
При
образовании твердого раствора внедрения атомы
растворенного элемента располагаются
в
растянутой области
под
краем
экстраплоскости
(рис. 30, г).
В
области дислокаций чужеродным атомам
лег-
че размещаться,
чем в
совершенной области решетки,
где
такие атомы
вы-
зывают значительные искажения решетки.
Атомы
внедрения значительно
сильнее связываются
с
дислокациями,
чем
атомы замещения, образуя
так
называемые атмосферы Коттрелла. Образование атмосфер сопровождает-
ся
уменьшением искажения решетки,
что
предопределяет
их
устойчивость.
Выход
или
отрыв атомов
из
атмосферы Коттрелла
требует
значительной
энергии.
Микроструктура твердого раствора
в
условиях равновесия предста-
Рис.
29. Окгаэлрические поры в
в о. ц. к.-решетке (о):
1
— атом металла; 2 — поры
г.ц. к-решаке (ц) и те графические
41

а)
Рис.
30.
Искажения
кристаллической решетки при образовании твердого раствора
Замещения
(атомы В и D) и внедрения
(атом
С)
вляет однородные кристаллические зерна (рис. 31, а), мало отличающиеся
от структуры, чистого металла.
1
Все металлы
могут
в той или иной степени взаимно растворяться
друг.
В
друге
в твердом состоянии. Например, в алюминии может растворяться
до 5,5% Си, а в меди 39% Zn без изменения типа их кристаллической ре-
шетки.
В тех случаях, когда компоненты
могут
замещать
друг
друга
в кри-
сталлической решетке в любых количественных соотношениях, образуется
непрерывный
.ряд твердых растворов.
Твердые растворы замещения с неограниченной растворимостью
могут
образоваться при соблюдении условий, приведенных ниже.
1. Компоненты должны обладать одинаковыми по типу (изоморфны*
ми)
кристаллическими решетками. Только в этом
случае
при изменении
концентрации
твердого раствора
будет
возможен непрерывный переход от
кристаллической решетки одного компонента к решетке
другого
компо-
нента.
2. Различие в атомных размерах (AR) компонентов должно быть незна-
чительным и не превышать 8 — 15%.
3. Компоненты должны принадлежать к одной и той же группе Перио-
дической системы элементов или к смежным родственным группам и
в
связи с этим иметь близкое строение валентной оболочки электронов
в
атомах.
Например,
неограниченно растворяются в твердом состоянии следую-
щие
металлы с г. ц. к.-решеткой: Ag и Аи(AR = 0,2%), Ni и Си(Д7? = 2,7%),
Ni
и Rd(AR =
10,5%)
и др., а также металлы с о. д. к.-решеткой: Мо и
W (АЯ =
9,9%),
V-Ti(AK
= 2,0%). Такие металлы, как Na, Ca, К, Pb, Sr
и
др., имеющие большой атомный диаметр, в Fe
7
, Cu, Ag нерастворимы.
Однако
даже при соблюдении перечисленных условий непрерывный ряд
твердых растворов может не возникнуть. Твердые растворы внедрения
образуются только в тех случаях, когда диаметр атома растворенного эле-
мента невелик.
Твердые растворы этого типа получаются лишь при растворении в ме-
талле (например, в железе, молибдене, хроме и т. д.)
углерода
(атомный
1
В металловедении принято обозначать: чистые компоненты — большими буквами латин-
ского алфавита А, В, С, твердые растворы — малыми буквами греческого алфавита а, (?, у
и т. д., а упорядоченные твердые растворы теми же буквами со штрихом — «', р', у' и т.. д.
42

Г7;
Рис.
31. Типичные микроструктуры сплавов:
а — твердый раствор
(Cu-Ni);
б — твердый раствор меди в алюминии с выделением по
границам
зерен химического соединения (CuAl,); в — смесь
двух
твердых растворов в сплаве
Cu-Zn
(у. + Р), полученных в
результате
перетектического превращения; г - эвтектика
с. + (J с избыточными кристаллами а в сплаве РЬ - Sb; й - эвтектика а + р; е - эвтектика
а + Р с избыточными кристаллами р в сплаве Pb - Sb (x 250)
43
радиус 0,77 Л), азота (0,71 А), водорода (0,46 А), т. е. элементов с малым
атомным радиусом. Твердые растворы внедрения
могут
быть только огра-
ниченной
концентрации, поскольку число пор в решетке ограничено,
а атомы основного компонента сохраняются в
узлах
решетки. Роль этого
вида твердого раствора значительна в сталях и
чугунах.
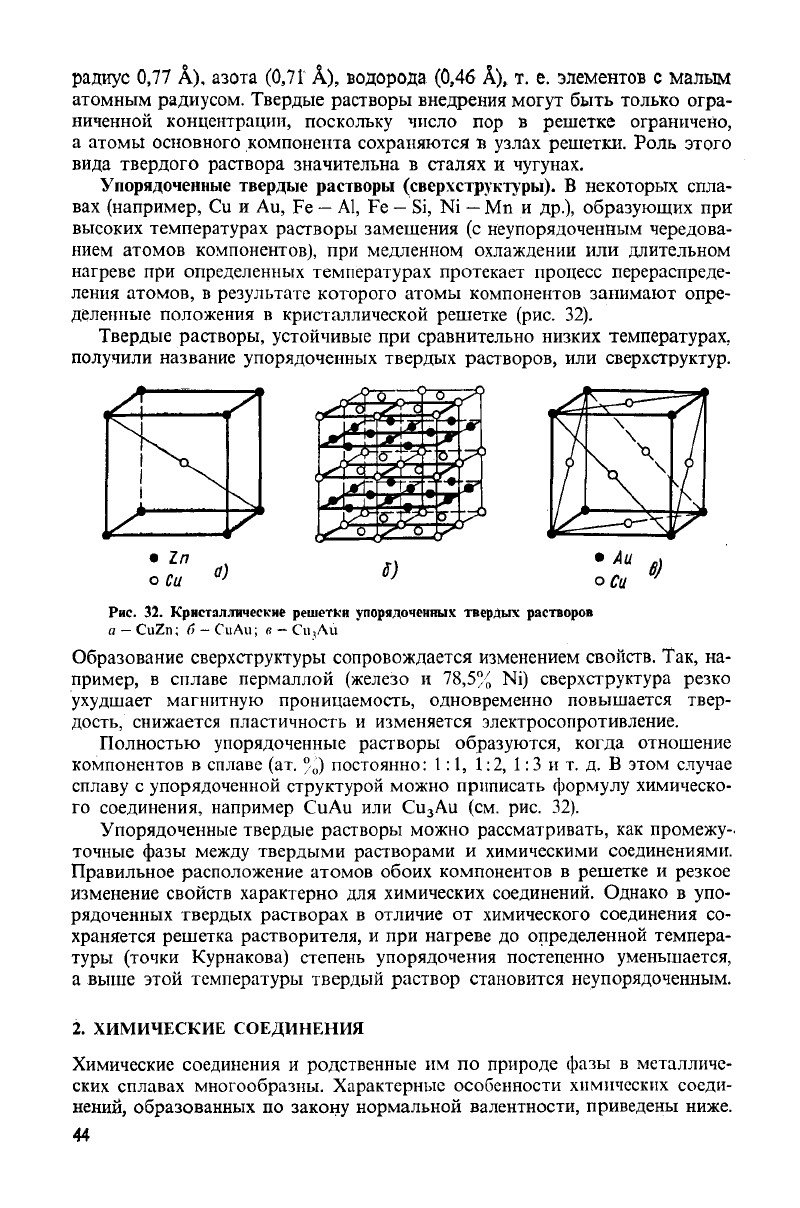
Упорядоченные твердые растворы (сверхструктуры). В некоторых спла-
вах (например, Си и Аи, Fe — Al, Fe — Si, Ni — Mn и др.), образующих при
высоких температурах растворы замещения (с неупорядоченным чередова-
нием
атомов компонентов), при медленном охлаждении или длительном
нагреве при определенных температурах протекает процесс перераспреде-
ления
атомов, в результате которого атомы компонентов занимают опре-
деленные положения в кристаллической решетке (рис. 32).
Твердые растворы, устойчивые при сравнительно низких температурах,
получили название упорядоченных твердых растворов, или сверхструктур.
ч)
5)
в)
Рис.
32.
Кристаллические решетки упорядоченных твердых растворов
а
— CuZn;
б
— CuAu;
в
— Си,Ли
Образование сверхструктуры сопровождается изменением свойств. Так, на-
пример,
в сплаве пермаллой (железо и 78,5% Ni) сверхструктура резко
ухудшает
магнитную проницаемость, одновременно повышается твер-
дость, снижается пластичность и изменяется электросопротивление.
Полностью
упорядоченные растворы образуются, когда отношение
компонентов
в сплаве (ат. %) постоянно: 1:1, 1:2, 1:3 и т. д. В этом
случае
сплаву с упорядоченной структурой можно приписать формулу химическо-
го соединения, например CuAu или Cu
3
Au (см. рис. 32).
Упорядоченные твердые растворы можно рассматривать, как промежу-
точные фазы
между
твердыми растворами и химическими соединениями.
Правильное
расположение атомов обоих компонентов в решетке и резкое
изменение
свойств характерно для химических соединений. Однако в упо-
рядоченных твердых растворах в отличие от химического соединения со-
храняется решетка растворителя, и при нагреве до определенной темпера-
туры (точки Курнакова) степень упорядочения постепенно уменьшается,
а выше этой температуры твердый раствор становится неупорядоченным.
2.
ХИМИЧЕСКИЕ
СОЕДИНЕНИЯ
Химические соединения и родственные им по природе фазы в металличе-
ских сплавах многообразны. Характерные особенности химических соеди-
нений,
образованных по закону нормальной валентности, приведены ниже.
44

1. Кристаллическая решетка отличается от решеток компоненте», обра-
зующих соединение. Атомы в решетке химического соединения распола-
гаются упорядоченно, т. е. атомы каждого компонента расположены
закономерно
и по определенным узлам решетки. Большинство химических
соединений
имеют сложную кристаллическую
структуру.
2. В соединении всегда сохраняется простое кратное соотношение ком-
понентов.
Это позволяет выразить их состав простой формулой А^
т
, где
А
и В — соответствующие элементы; п и т — простые числа.
3. Свойства соединения резко отличаются от свойств образующих его
компонентов.
4. Температура плавления (диссоциации) постоянная.
5. Образование химического соединения сопровождается значительным
тепловым эффектом.
В отличие от твердых растворов химические соединения обычно обра-
зуются
между
компонентами, имеющими большое различие в электрон-
ном
строении атомов и кристаллических решеток.
В качестве примера типичных химических соединений с нормальной ва-
лентностью можно указать на соединения магния с элементами
IV—VI
групп Периодической системы (см. табл. 1): Mg
2
Sn, Mg
2
Pb, Mg
2
P
2
,
Mg
3
Sb
2
, Mg^Bi
2
, MgS и др. Соединения одних металлов с другими носят
общее название интерметаллидов или интерметаллических соединений. Хи-
мическая
связь
между
атомами в интерметаллидах чаще металлическая.
Соединения
металла с неметаллом (нитриды, карбиды, гидриды и т. д.),
которые
могут
обладать металлической связью, нередко также называют
металлическими соединениями.
Большое
число химических соединений, образующихся в металлических
сплавах, отличается по некоторым особенностям от типичных химических
соединений,
так как не подчиняется законам валентности и не имеет по-
стоянного
состава.
Ниже
будут
рассмотрены наиболее важные химические соединения,
образующиеся в сплавах.
Фазы
внедрения. Переходные металлы (Fe, Mn, Сг, Мо и др.) образуют
с
углеродом, азотом, бором и водородом, т. е. с элементами, имеющими
малый атомный радиус, соединения: карбиды, нитриды, бориды и ги-
дриды. Они имеют общность строения и свойств и часто называются фа-
зами
внедрения.
Фазы
внедрения имеют формулу М
4
Х
(Fe
4
N,
Mn
4
N
и др.), М
2
Х (W
2
C,
Мо
2
С,
Fe
2
N,
Cr
2
N
и др.), MX(WC, TiC, VC, NbC, TiN, VN и др.).
Кристаллическая
структура фаз внедрения определяется соотношением
атомных радиусов неметалла (R
x
) и металла
(R
M
).-
Если R
x
/Ru < 59, то
атомы металла в этих фазах расположены по типу одной из простых кри-
сталлических решеток: кубической (KS, K12) или гексагональной (Г12),
в
которую внедряются атомы неметалла, занимая в ней определенные
поры.
Фазы
внедрения являются фазами переменного состава, а соответ-
ствующие им химические формулы обычно характеризуют максимальное
содержание в них неметалла. Фазы внедрения обладают высокой электро-
проводностью, уменьшающейся с повышением температуры. Карбиды,
45

относящиеся к фазам внедрения, имеют высокую температуру плавления.
Многие фазы внедрения обладают высокой твердостью.
Рассмотренные выше твердые растворы внедрения образуются при зна-
чительно меньшей концентрации второго компонента (С, N, Н) и имеют ре-
шетку металла растворителя, тогда как фазы внедрения получают кристал-
лическую решетку, отличную от решетки металла.
Если условие R
X
/R
SI
< 0,59 не выполняется, как это наблюдается для
карбида железа, марганца и хрома, то образуются соединения с более
сложными решетками, и такие соединения нельзя считать фазами внедре-
ния.
На базе фаз внедрения легко образуются твердые растворы вычита-
ния,
называемые иногда твердыми растворами с дефектной решеткой.
В твердых растворах вычитания часть узлов решетки, которые должны
быть заняты атомами одного из компонентов, оказываются свободными.
В избытке, по сравнению со стехиометрическим соотношением А„В,„
имеется другой компонент.
Растворы вычитания образуются, например, в карбидах VC, TiC, ZrC,
NbC
и др.
Электронные
соединения. Эти соединения чаще образуются
между
одно-
валентными (Си, Ag, Аи, L i, Na) металлами или металлами переходных
групп (Mn, Fe, Co и др.), с одной стороны, и простыми металлами с ва-
лентностью от 2 до 5 (Be, Mg, Zn, Cd, Al и др.) с другой стороны. Соедине-
ния
этого типа имеют определенное отношение числа валентных электро-
нов
к числу атомов, т. е. определенную электронную концентрацию. Так,
существуют
соединения, у которых это отношение в одних случаях равно
3
/г (1,48); в
других
21
/i3 (1,62), в третьих
7
/4(1,75). Каждому из указанных
соотношений соответствуют и определенные типы кристаллической
решетки.
Все соединения с электронной концентрацией, равной
3
/
2
(1,48), имеют
кубическую объемно-центрированную, сложную кубическую или гексаго-
нальную решетку и обозначаются как Р-соединения. К соединениям этого
типа относятся CuBe, CuZn, Cu
3
Al, Cu
5
Sn, CoAl, FeAl и др.
Соединения
с электронной концентрацией
21
/i3
(1,62)
имеют сложную
решетку и обозначаются у-фазой. К ним относятся соединения Cu
5
Zn
8
,
Cu
31
Sn
8
, Cu
9
Al
4
, Cu
31
Si
8
и др.
Соединения
с электронной концентрацией
7
Д
(1,75)
имеют плотноупако-
ванную гексагональную решетку и обозначаются s-фазой. К ним относятся
соединения CuZn
3
, CuCd
3
, Cu
3
Si, Cu
3
Sn, Au
3
Sn и др.
Электронные соединения подобно обычным химическим соединениям
имеют кристаллическую решетку, отличную от решетки образующих их
компонентов.
Но в отличие от химических соединений с нормальной ва-
лентностью электронные соединения образуют с компонентами, из ко-
торых они состоят, твердые растворы в широком интервале концентраций.
Фазы
Лавеса.
Эти фазы имеют формулу АВ
2
и образуются
между
ком-
понентами типа А я В при отношении атомных диаметров
DJ/DB
=
.=
1,2 (чаще 1,1 — 1,6). Фазы Лавеса имеют плотноупакованную кристалли-
ческую решетку гексагональную (MgZn
2
и MgNi
2
) или гранецентрирован-
ную кубическую (MgCu
2
). К фазам Лавеса относятся
AgBe
2
,
CaAl
2
, T iBe
2
,
TiCr
2
и др. (тип MgCu
2
) или BaMg
2
, MoBe
2
, TiMn
2
и др. (тип MgZn
2
).
Кроме
рассмотренных металлических соединений
существует
и ряд
46

других,
например фазы со структурой никельаресенида NiAs, а также фазы,
обозначаемые ст, X, 8, u, R, S, T, W и т. д., но о них
будет
сказано при рас-
смотрении конкретных сплавов.
3. ГЕТЕРОГЕННЫЕ СТРУКТУРЫ
При
кристаллизации многих сплавов (РЬ — Sb, Си - Bi, Zn — Sft, Pb — Bi,
Ni
— Cr, Fe — C, Al - Си и др.) образуются структуры, состоящие из
меха-
нической
смеси нескольких фаз. Фазы, образующие эту гетерогенную
структуру,
обнаруживаются микроанализом (см. рис. 31,6). Рентгенограм-
ма такого сплава показывает наличие кристаллических решеток соответ-
ствующего числа фаз, образующих его
структуру,
Ниже
будут
рассмо-
трены такие структуры.

Глава
IV ФОРМИРОВАНИЕ СТРУКТУРЫ СПЛАВОВ
ПРИ
КРИСТАЛЛИЗАЦИИ
1.
ДИАГРАММЫ
СОСТОЯНИЯ
Диаграммы состояния, или диаграммы фазового равновесия в удобной
графической
форме показывают фазовый состав сплава в зависимости от
температуры и концентрации. Диаграммы состояния строят для условий
равновесия
или условий, достаточно близких к ним.
Равновесное
состояние
соответствует
минимальному значению свобод-
ной
энергии. Это состояние может быть достигнуто только при очень
малых скоростях охлаждения или длительном нагреве. В связи с этим рас-
смотрение диаграмм состояния позволяет определить фазовые превраще-
ния
в условиях очень медленного охлаждения или нагрева. Истинное рав-
новесие в практических условиях достигается редко. В подавляющем числе
случаев
сплавы находятся в метастабильном состоянии, т. е. в таком со-
стоянии,
когда они
обладают
ограниченной устойчивостью и под влия-
нием
внешних факторов переходят в
другие
более устойчивые состояния,
так
как их свободная энергия больше минимальной. Для целей практики
важно,
что метастабильные состояния нередко сообщают сплавам высокие
механические или
другие
свойства. В этом
случае
материаловедение
должно установить природу метастабильных состояний, обеспечивающих
оптимальный
комплекс свойств, и разработать режимы термической или
какой-либо
другой
обработки, позволяющей получить эти неравновесные
состояния.
Исходным положением при решении этих задач является зна-
ние
диаграмм фазового равновесия.
Правило
фаз. Диаграммы фазового равновесия характеризуют оконча-
тельное или предельное состояние сплавов, т. е. полученное после того, как
все превращения в них произошли и полностью закончились. Это состояг
ние
сплава зависит от внешних условий (температуры, давления) и характе-
ризуется числом и концентрацией образовавшихся фаз. Закономерность из-
менения
числа фаз в гетерогенной системе определяется правилом фаз.
Правило
фаз устанавливает зависимость
между
числом степеней
свободы, числом компонентов и числом фаз и выражается уравнением
С=К + 2-Ф,
где С — число степеней свободы системы (или вариантность); К — число
компонентов,
образующих систему, т. е. минимальное число химических
элементов,
необходимых для образования любой фазы системы; 2 — число
внешних
факторов; Ф — число фаз, находящихся в равновесии.
Под
числом степеней свободы (вариантностью системы) понимают воз-
можность изменения температуры, давления и концентрации без измене-
ния
числа фаз, находящихся в равновесии.
При
изучении физико-химических равновесий за внешние факторы,
влияющие на состояние сплава, принимают
температуру
и давление. При-
48

Меняя
правило фаз к металлам, можно во многих
случаях
принять изме-
няющимся
только один внешний фактор —
температуру,
так как давление,
за исключением очень высокого, мало влияет на фазовое равновесие спла-
вов в твердом и жидком состояниях. Тогда уравнение примет следующий
вид: С = К + 1 — Ф. Так как число степеней свободы не может быть мень-
ше нуля и не может быть дробным числом, то К — Ф + 1^0, а Ф ^ К + 1,
т. е. число фаз в сплаве, находящемся в равновесном состоянии, не может
быть больше, чем число компонентов плюс единица. Следовательно,
в
двойной системе в равновесии может находиться не больше
трех
фаз,
в
тройной — не больше
четырех
и т. д.
Если в равновесии в системе с определенным числом компонентов на-
ходится максимальное число фаз, то число степеней свободы системы рав-
но
нулю (С = 0). Такое равновесие называют нонвариантным (безва-
риантным).
При нонвариантном равновесии, сплав из данного числа фаз
может существовать только в совершенно определенных условиях: при по-
стоянной
температуре и определенном составе
всех
находящихся в равно-
весии фаз. Это означает, что превращение начинается и заканчивается при
одной постоянной температуре.
В
случае
уменьшения числа фаз на одну против максимально возмож-
ного число степеней свободы возрастает на единицу (С = 1). Такую систему
называют моновариантной (одновариантной). Когда С = 2, система бива-
риантна (двухвариантна).
Равновесие в двухкомпонентных системах. Как уже было отмечено, ус-
ловием равновесия является минимум свободной энергии. Самопроизволь-
но
в системе протекают лишь те физические процессы, при которых сво-
бодная энергия уменьшается. Если сплав состоит из одной фазы, например
жидкого или твердого раствора а, то свободная энергия (Ё
ж
, F
a
) при по-
стоянной
температуре и давлении зависит от ее (т. е. фазы) природы и со-
става (рис. 33, а). Для случая, приведенного на рис. 33, а, устойчив а--
твердый раствор, так как его свободная энергия (F
a
) ниже, чем у жидкой
фазы
(^ж). Если система (сплав) состоит из
двух
и более фаз, то при по-
стоянной
температуре и давлении ее свободная энергия определяется по
правилу смешения (рис. 33,6).
Точка F
c
(рис. 33,6), характеризующая свободную энергию сплава со-
става С
с
, лежит на прямой, соединяющей точки, характеризующие свобод-
ную энергию а- и (3-фаз (F
a
и Fp) и делит эту прямую на отрезки, обратно
пропорциональные весовым количествам а- и р-фаз.
Если а- и Р-фазы, образующие данную систему,
могут
изменять свой
состав, то свободная энергия каждой фазы в зависимости от концентрации
может изменяться так, как это показано на рис. 33, в.
Состав фаз, находящихся в равновесии при данной температуре, отве-
чает
точками С, и Ср (рис. 33, в). Двухфазное состояние
соответствует
кон-
центрациям,
лежащим в пределах С
а
и Ср, где свободная энергия смеси
двух
фаз a-состава С
а
и Р-состава Ср, определяемая токами на прямой аб,
меньше свободной энергии отдельных фаз. Составы, имеющие концентра-
цию меньше, чем С
а
, в условиях равновесия
будут
состоять только из а-
фазы,
а сплавы с концентрацией более Ср из Р-фазы.
В двухкомпонентной системе при некоторых условиях, например нонва-
риантном равновесии (С = 0),
могут
одновременно сосуществовать три
49
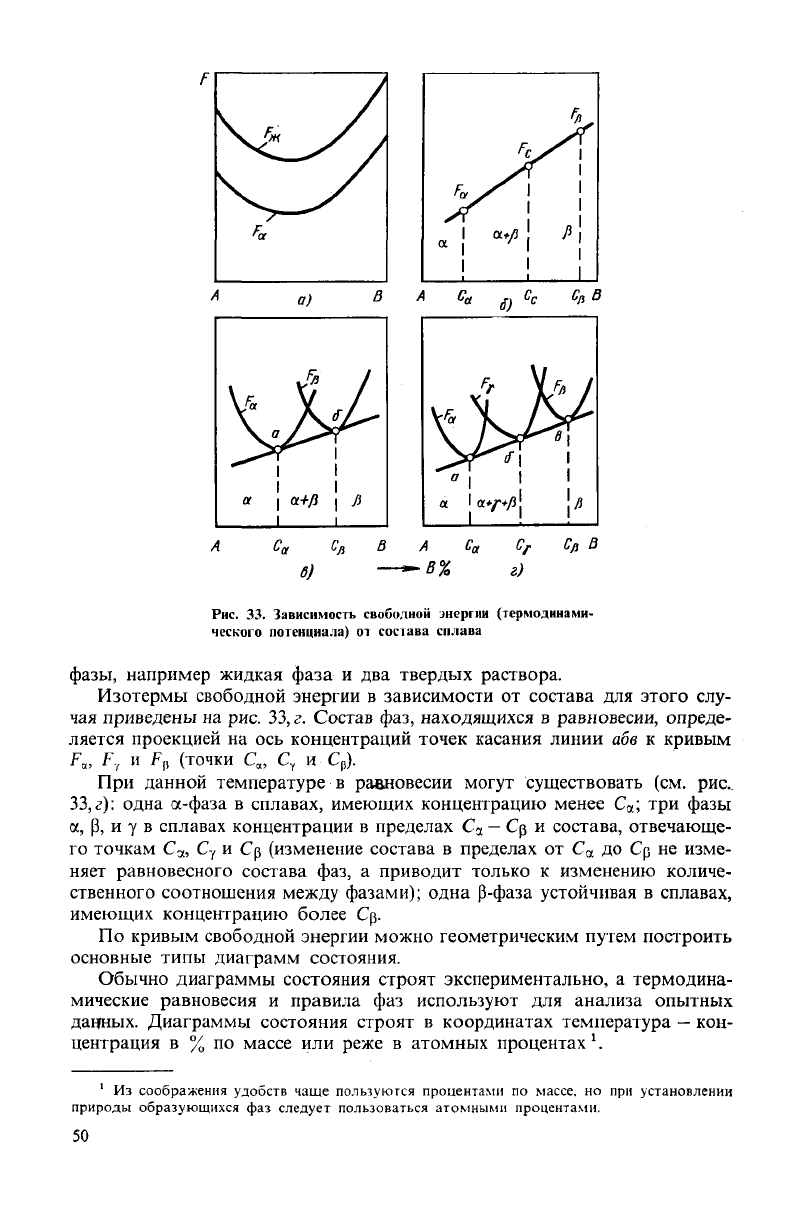
г)
Рис.
33.
Зависимость свободной
энергии (термодинами-
ческого потенциала) от состава сплава
фазы,
например жидкая фаза и два
твердых
раствора.
Изотермы свободной энергии в зависимости от состава для этого слу-
чая приведены на рис. 33, г. Состав фаз, находящихся в равновесии, опреде-
ляется проекцией на ось концентраций точек касания линии абв к кривым
F
a
, F, и F,, (точки С„ С, и C
t
).
При
данной температуре в равновесии
могут
существовать (см. рис..
33,г): одна а-фаза в сплавах, имеющих концентрацию менее С
а
; три фазы
а, р, и у в сплавах концентрации в пределах С
а
—
Ср и состава, отвечающе-
го точкам С
я
, Су и Ср (изменение состава в пределах от С
а
до Ср не изме-
няет равновесного состава фаз, а приводит только к изменению количе-
ственного соотношения
между
фазами); одна Р-фаза устойчивая в сплавах,
имеющих концентрацию более Ср.
По
кривым свободной энергии можно геометрическим
путем
построить
основные типы диаграмм состояния.
Обычно диаграммы состояния строят экспериментально, а термодина-
мические равновесия и правила фаз используют для анализа опытных
данных. Диаграммы состояния строят в координатах температура - кон-
центрация
в % по массе или реже в атомных процентах
1
.
1
Из соображения
удобств
чаще пользуются процентами по массе, но при установлении
природы образующихся фаз
следует
пользоваться атомными процентами.
50
