Лабораторный практикум по микробиологии
Подождите немного. Документ загружается.


ЗАНЯТИЕ № 1
ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНЫХ СРЕД И МЕТОДЫ ИХ СТЕРИЛИЗАЦИИ
ОСОБЕННОСТИ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Цель: Изучить правила работы в микробиологической лаборатории, особенности
культивирования микроорганизмов, способы приготовления питательных сред и методы их
стерилизации.
Задачи
1. Ознакомится с правилами поведения при выполнении микробиологического
практикума.
2. Изучить особенности культивирования микроорганизмов.
3. Изучить методы приготовления и разлива питательных сред.
4. Изучить методы стерилизации посуды и питательных сред.
5. Приготовить и разлить питательную среду МПА.
6. Получить накопительную культуру сенной и картофельной палочек.
Литература
1. Аникеев В.В., Лукомская К.А. Руководство к практическим занятиям по
микробиологии. М.:Просвещение, – 1983.
2. Гусев М.В. Микробиология: учебник для вузов / М.В. Гусев, Л.А. Минеева. –
Москва, 2004
3. Емцев В.Т. Микробиология: учебник для вузов / В.Т. Емцев, Е.Н. Мишустин. – М.:
Дрофа, 2005.
4. Лукомская К.А. Микробиология с основами вирусологии. М.:Просвещение, - 1983.
5. Основы микробиологии, вирусологии и иммунологии. / Под. Редакцией Воробьева
А.А. и Кривошеина Ю.С. - М.:Мастерство, 2001.
6. Пименова М.Н. Руководство к практическим занятиям по микробиологии. Москва,
1971.
7. Практикум по микробиологии. Под ред. Нетрусова А.И. – М.: Академия, - 2005.
8. Теппер Е.З. Практикум по микробиологии. – М.: Дрофа, 2004.
Материалы и оборудование. Стерильные чашки Петри, стерильные конические
колбы на 100-150 мл, агар питательный, пептон, сено, клубни картофеля, мел, плитка,
спиртовки, колбы, вата, марля, пипетки, весы, разновесы, термостат.
Основные понятия. Культивирование, культура, поверхностное культивирование,
глубинное культивирование, периодическое культивирование, непрерывное
культивирование, чистая культура, накопительная культура, посев, инкубация, пассирование,
элективные среды, накопительные среды, оптимальные среды, естественные среды,
синтетические среды, полусинтетические среды, агар, стерилизация, фламбирование,
тиндализация, пастеризация, автоклавирование, МПА.
Ход работы
Задание № 1. Изучить правила работы при выполнении микробиологического
практикума.
Задание № 2. Изучить классификацию питательных сред, особенности их
приготовления и разлива, методы стерилизации питательных сред и посуды.
Задание № 3. Приготовить и разлить питательную среду МПА в стерильные чашки
Петри.
Задание № 4. Получить накопительную культуру сенной палочки (Bacillus subtilis).
Сено мелко нарезают и помещают в колбу объемом 500 мл, заполняя ее на одну
четверть объема, добавляют щепотку мела и кипятят 15-20 мин, пока среда не приобретет
цвет настоя крепкого чая. Сенной отвар разливают в стерильные конические колбы на 100-
150 мл слоем 1,0-1,5 см, закрывают ватными пробками и помещают в термостат при
температуре 22-25 °С.
Через двое суток на поверхности среды развивается беловатая пленка Вас. subtilis,
которая при старении, на 3-4-е сутки, становится серовато-зеленоватой. Другие
микроорганизмы при этом вырастают редко и в небольших количествах.
1

Задание № 5. Получить накопительную культуру картофельной палочки (Вас. subtilis
var. mesentericus).
Промытые клубни картофеля, не очищая, нарезают кружочками. Поверхность их
натирают мелом для нейтрализации среды и помещают в стерильные чашки Петри на
двойной слой фильтровальной бумаги, смоченный дистиллированной водой. Чашки с кар-
тофельной средой выдерживают в автоклаве при 0,5 атм в течение 10 мин и ставят в
термостат с температурой 27-30°С на 3-4 суток.
На поверхности ломтиков картофеля образуется плотная морщинистая пленка
культуры картофельной палочки. Окраска пленки может быть разной: беловато-серой,
розоватой, желто-бурой, черной, что зависит от разновидностей культуры, получивших
преимущественное развитие.
Контрольные вопросы
1. Классификация питательных сред.
2. Методы стерилизация лабораторной посуды и питательных сред.
3. Методы приготовления отдельных питательных сред (МПБ, МПА, МПЖ, СА, КА и
др.) Разливка питательных сред.
4. Особенности культивирования микроорганизмов (поверхностное и глубинное,
периодическое и непрерывное). Накопительные и чистые культуры.
Вопросы для самостоятельного изучения
1. Способы приготовления нативных и фиксированных препаратов микроорганизмов.
2. Изучить основные этапы развития науки микробиологии, вклад русских и
зарубежных ученых в ее развитие. Заполнить таблицу № 1.
Таблица № 1. История развития микробиологии
Дата Ученый, название трудов Направление исследования
А. ван Левенгук, Л. Пастер, Р. Кох, Л.С.
Ценковский, И.И. Мечников, Н.Ф. Гамалея, Э.
Дженнер, М. Бейеринк, С.Н. Виноградский,
Д.И. Ивановский, Г.Н. Минх, В.Л. Омелянский,
А. Клюйвер, К.ван Ниль и др.
ЗАНЯТИЕ № 2
ПРИГОТОВЛЕНИЕ ЖИВЫХ И ФИКСИРОВАННЫХ ПРЕПАРАТОВ
МИКРООРГАНИЗМОВ И ЗНАКОМСТВО С ИХ МОРФОЛОГИЕЙ
Цель: Изучить методы и приемы приготовления микропрепаратов при исследовании
микроорганизмов и познакомится с их морфологией.
Задачи:
1. Изучить особенности морфологии бактериальных клеток.
2. Приготовить прижизненный и фиксированный микропрепараты микроорганизмов.
Материалы и оборудование. Предметные стекла, бактериологическая петля,
спиртовка, фильтровальная бумага, кристаллизатор с мостиком для препаратов, промывалка с
водой, водные растворы красителей – фуксина, метиленового синего, генцианвиолета (далее
– оборудование для приготовления микропрепаратов); иммерсионное масло, микроскоп;
мясная вода, дрожжи, культуры сенной и картофельной палочки.
Ход работы
Задание № 1. Провести прижизненное изучение бактериальных клеток следующими
методами, сделать рисунки:
Метод раздавленной капли. На предметное стекло микробиологической петлей
наносят каплю одной из жидкостей. Покровное стекло ставят на ребро у края капли и
постепенно опускают на нее.
Метод висячей капли. По центру покровного стекла наносят бактериологической
петлей небольшую каплю исследуемой жидкости и опрокидывают его над углублением
специального предметного стекла.
Препарат «отпечаток». Из агаризованной среды, на которой микроорганизмы растут
сплошным газоном или в виде отдельных колоний, вырезают небольшой кубик и переносят
2

его на предметное стекло так, что поверхность с микроорганизмами была обращена вверх.
Затем к газону или колонии прикладывают чистое покровное стекло, слегка надавливают на
него петлей или пинцетом и тотчас же снимают, стараясь не сдвинуть. Полученный препарат
помещают отпечатком вниз в каплю воды или метиленового синего (1:40) на предметное
стекло.
Задание № 2. Приготовить фиксированный препарат Вас. subtilis, Вас. subtilis var
mesentericus, St. lactis, S. cerevisiae, E.coli (рис. № 1, 2, 3, 4 приложения), сделать рисунки.
1. Нанесение. Предметное стекло обсушивают на пламени спиртовки. Бактерио-
логической петлей, простерилизованной на пламени горелки, по центру предметного стекла
наносят мазок исследуемого материала. Если культура микроорганизма выращена на плотной
питательной среде, предварительно на стекло наносят каплю воды, в нее бактериологической
петлей вносят небольшое количество материала и делают мазок.
2. Высушивание и фиксация. Препарат высушивают на воздухе, а далее фиксируют.
Обычные мазки микроорганизмов фиксируют термически, проводя стекло 2—3 раза через
пламя горелки мазком вверх. Фиксация мазка приводит к гибели микроорганизмов, плотному
прилипанию их к поверхности стекла и более легкой восприимчивости микробов к
красителю.
3. Окраска. Заливают поверхность раствором любого красителя на 2-3 мин
(метиленовая синь, генцианвиолет, фуксин). Различают простое и дифференциальное
окрашивание микроорганизмов. В первом случае прокрашивается вся клетка, так что
становятся хорошо видны ее форма и размеры. Дифференциальное окрашивание выявляет
только определенные структуры клетки и запасные вещества.
4. Промывка. Затем краситель с мазка смывают водой из промывалки, нижнюю
сторону препарата вытирают полоской фильтровальной бумаги, верхнюю осторожно
обсушивают и микроскопируют.
Контрольные вопросы и задания
1. Общая характеристика микроорганизмов. Отличительные признаки прокариот и
эукариот.
2. Форма и размеры бактериальных клеток. Морфологические типы бактерий.
3. Основы систематики микроорганизмов. Положение бактерий в системе организмов
и их изменчивость. Признаки бактерий, используемые при определении вида.
4. Краткая характеристика порядка Schizomycetales.
5. Краткая характеристика порядка Actinomycetales. Нокардии. Микобактерии.
6. Краткая характеристика порядка Myxobacteriales.
7. Грибы. Краткая характеристика зиго-, аско- и дейтеромицетов.
8. Заполнить таблицу № 2.
Таблица № 2. Отличительные признаки эукариот и прокариот
Характеристика Прокариоты Эукариоты
Цитологические признаки
Наименьший размер клетки — 0,05 мкм
Наличие оформленного ядра
Наличие автономных органелл (митохондрии,
хлоропласты)
Рибосомы расположены:
В цитоплазме
На ЭПС
Жгутики (если присутствуют): диаметр 0,01 —0,02
мкм, формула среза 8 + 1
диаметр около 0,2 мкм, формула среза 9 + 2
Молекулярно-биологические признаки
Число хромосом
Кольцевая хромосома
Линейные хромосомы
3
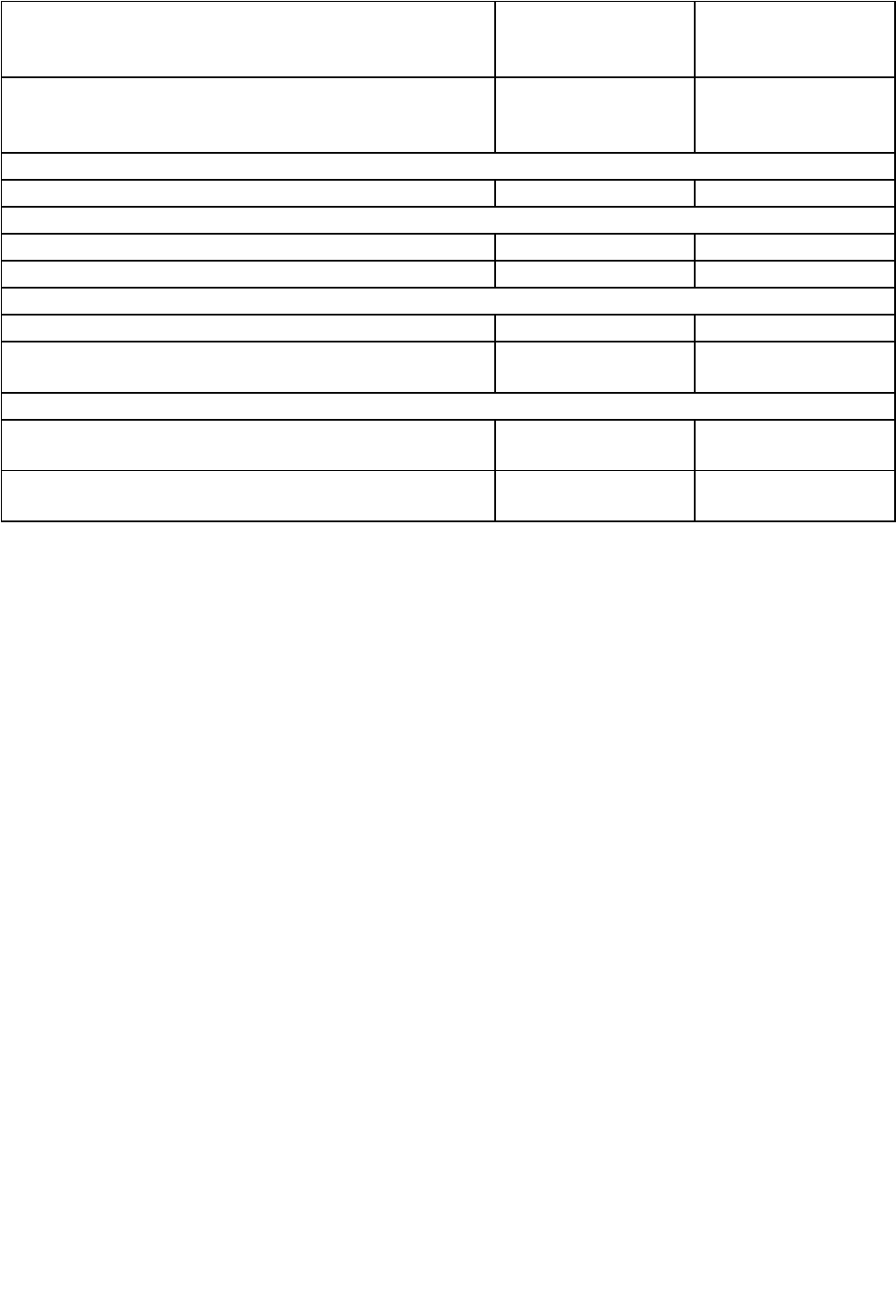
Константы седиментации рибосом:
70S
80S
Константы седиментации рибосомной РНК
5S 16S 23S
5S 5.85S 18S 28S
Признаки на основе хим. анализа
Присутствие пептидогликана
Питание
Эндоцитоз
Диффиузия или транспорт через мембрану
Размножение
Митоз, мейоз
Перенос генов и рекомбинация включают
гаметогенез и образование зигот
Метаболизм
Дыхание и фотосинтез сосредоточены на
плазмалемме
Хемолитотрофность, метаногенез, фиксация
молекулярного азота, аноксигенный фотосинтез
Вопросы для самостоятельного изучения
1. Краткая характеристика отельных групп бактерий (по определителю бактерий
Берджи).
2. Морфологическая характеристика и систематика водорослей.
3. Морфологическая характеристика и систематика простейших.
ЗАНЯТИЕ № 3
ОКРАСКА ВКЛЮЧЕНИЙ, КАПСУЛ И ЭНДОСПОР, ОКРАСКА ПО ГРАМУ
Цель: Изучить методы окраски спор, капсул и включений бактериальной клетки;
изучить ее цитологические свойства на примере окраски по Граму.
Задачи:
1. Обнаружить включения полифосфатов (волютин) в клетках дрожжей.
2. Обнаружить липидные гранулы в клетках дрожжей.
3. Обнаружить гликогеноподобные полисахариды в клетках дрожжей.
4. Обнаружить капсулы бактериальной клетки методом негативного
контрастирования (на примере Azotobacter).
5. Произвести дифференциальную окраску спор и цитоплазмы по методу Ожешки.
6. Произвести окраску бактерий по Граму.
Материалы и оборудование. Предметные стекла, бактериологическая петля,
спиртовка, фильтровальная бумага, кристаллизатор с мостиком для препаратов, промывалка с
водой, микроскоп. Водные растворы красителей – фуксина, метиленового синего,
генцианвиолета, карболовый фуксин Циля, судан III. Иммерсионное масло, серная кислота
1%, тушь, соляная кислота 0,5%, раствор Люголя. Культуры Вас.subtilis, Вас.mycoides,
S.cerevisiae, E.coli.
Основные понятия. Муреин, волютин, нуклеоид, гликоген, капсулы, клеточная
стенка, полисахариды, полифосфаты, метахроматические зерна, монотрихи, перетрихи,
лофотрихи, бациллярная форма, клостридиальная форма, плектридиальная форма, экзина,
интина, метахромозия.
Ход работы
Задание № 1. Обнаружить включения полифосфатов (волютин) в клетках дрожжей.
Волютин в клетках грибов и дрожжей локализован в вакуолях, у бактерий и актиномицетов в
цитоплазме. Является запасным фосор- и азотсодержащим веществом, производным
4

нуклеиновых кислоты. Характерное свойство – метахромозия, т. е. способность приобретать
иной цвет, чем окрашивающие его вещества.
Окраска волютина по методу Омелянского. На предметном стекле готовят тонкий
мазок из культуры микроорганизма, высушивают на воздухе, фиксируют на пламени,
окрашивают карболовым фуксином 30-40 с и промывают водой. Дифференцируют, погружая
его в склянку с 1%-ным раствором серной кислоты на 20-30 с и немедленно промывают
водой. Серная кислота обесцвечивает цитоплазму, а зерна волютина остаются окрашенными
фуксином. Препарат докрашивают метиленовым синим (1:40) 20-30 с, промывают водой,
высушивают на воздухе и микроскопируют. На препарате зерна волютина окрашены в
красный цвет, цитоплазма клетки – в голубой (рис. № 1, 2 приложения).
Задание № 2. Обнаружить липидные гранулы в клетках дрожжей. Резервные липиды у
дрожжей и мицелиальных грибов представлены нейтральным жирами; у бактерий эту
функцию выполняет оксимасляная кислота.
Окраска жировых включений. К капле водной взвеси микроорганизмов на
предметном стекле добавляют каплю раствора судана III, накрывают покровным стеклом и
микроскопируют, пользуясь объективом ВИ-40. Судан III растворяется в жировых
включениях бактериальной клетки, окрашивая их в оранжево-красный цвет. Цитоплазма
клетки остается бесцветной.
Задание № 3. Обнаружить гликогеноподобные полисахариды в клетках дрожжей.
Запасные вещества углеводной природы в клетках бактерий накапливаются в виде гранул.
Гранулеза – крахмалоподобное вещество, при взаимодействии с реактивом Люголя
окрашивающееся в синий цвет; гликоген – полисахарид окрашивающийся в таких же
условиях в красно-коричневый цвет. Гранулеза встречается только в клетках прокариот.
Окраска гликогена и гранулезы. К капле суспензии микроорганизма на предметном
стекле добавляют каплю слабого раствора Люголя, накрывают покровным стеклом и
микроскопируют, пользуясь объективом ВИ-40.
Задание № 4. Обнаружить капсулы бактериальной клетки методом негативного
контрастирования (у Azotobacter).
Выявление капсул на негативном прижизненном препарате. На хорошо
обезжиренное предметное стекло микробиологической петлей наносят большую каплю
черной туши и в нее вносят каплю исследуемой культуры микроорганизма, распределяют при
помощи предметного стекла и высушивают. Рассматривают с иммерсионной системой. На
темном фоне туши выявляются прозрачные зоны капсул вокруг резко очерченных клеток
(рис. № 8. приложения).
Задание № 5. Произвести дифференциальную окраску спор и цитоплазмы (у Вас.
mycoides).
Метод Ожешки. Высушенный препарат заливают 0,5% соляной кислотой и
подогревают 2 минуты до появления паров. Мазок промывают водой, накрывают
фильтровальной бумагой и заливают карболовым фуксином Циля. Окрашивают в течение 5
минут при нагревании до появления паров. Промывают водой и дифференцируют в 1%
серной кислоте 0,5-1 мин (время определяется опытным путем). Промывают водой и
докрашивают в течение 30 с метиленовым синим. Еще раз промывают, подсушивают и
микроскопируют. Споры окрашиваются в розовый цвет, цитоплазма – в синий (рис. № 2
приложения).
Задание № 6. Произвести окраску бактерий по Граму. Различие в химическом составе
клеточных стенок бактерий сказывается на их способности окрашиваться по Граму. По этому
признаку бактерии делятся на грамположительные и грамотрицательные (таб. № 3).
Оболочки грамположительных содержат больше полисахаридов, муреина и тейховых кислот;
оболочки грамотрицательных имеют многослойную структуру с высоким содержанием
липидов (липопротеидов и липосахаридов). Грамположительные микроорганизмы при
окрашивании образуют нерастворимое в спирте соединение иода с основным красителем, у
грамотрицательных это соединение растворяется в спирте.
Окраска по Граму. На предметное стекло наносят и далее одновременно
обрабатывают сразу три мазка: из культуры бактерий заведомо грамположительной, из
5

культуры бактерий заведомо грамотрицательной и между ними мазок из культуры
исследуемого микроорганизма. Используют молодые односуточные культуры.
Мазки высушивают на воздухе, фиксируют на пламени горелки и окрашивают 1%-
ным водным раствором генцианвиолета 1мин. Краситель смывают раствором Люголя и
заливают мазки этим же раствором на 1 мин. Препарат промывают водой и дифференцируют
в склянке с 95%-ным этанолом (0,5-1,0 мин). После дифференциации мазка препарат
немедленно тщательно промывают водой и докрашивают дополнительным красителем –
0,1%-ным водным раствором фуксина 2-3 мин. Препарат окончательно промывают водой,
высушивают на воздухе и микроскопируют с масляной иммерсией. На препарате
грамположительные бактерии окрашиваются в сиренево-фиолетовый цвет,
грамотрицательные – в розово-малиновый (рис. № 2 приложения).
Таблица № 3. Отношение бактерий к окраске по Граму
Грамположительные Грамотрицательные
Staphyloccocus aureus Escherichia coli
Streptococcus Proteus vulgaris
Bacillus subtilis Pseudomonas aeruginosa
Sacharomyces Shigella sp.
Контрольные вопросы и задания
1. Строение оболочки бактериальной клетки. Образование капсул.
2. Отношение бактерий к окраске по Граму. Отличительные особенности
грамположительных и грамотрицательных микроорганизмов.
3. Клеточная мембрана и внутриклеточные мембранные структуры.
4. Ядерный аппарат, состав, организация и репликация.
5. Рибосомы, газовые вакуоли и другие органеллы бактерий; их значение.
6. Включения бактериальной клетки (полисахариды, полифосфаты, липиды,
включения серы).
7. Способы размножения бактерий. Спорообразование у бактерий.
8. Жгутики. Движение бактерий. Таксис.
Вопросы для самостоятельного изучения
1. Наследственные факторы микроорганизмов.
2. Механизмы, вызывающие изменение генетической информации микроорганизмов.
ЗАНЯТИЕ № 4
КОЛИЧЕСТВЕННЫЙ УЧЕТ МИКРОФЛОРЫ ВОЗДУХА И ВОДЫ
ОПРЕДЕЛЕНИЕ МИКРОБНОГО ЧИСЛА
Цель: Провести количественный учет микроорганизмов воздуха и воды.
Задачи
1. Изучить методы количественного учета микрофлоры воздуха и воды.
2. Провести микробиологический анализ воздуха и санитарно-бактериологическое
исследование воды.
Материалы и оборудование. Чашки Петри со стерильным МПА, стерильные
пипетки на 1 мл, водяная баня, электроплитка, термометр, вода водопроводная, вода из
водоема, спиртовка, спички.
Основные понятия. Общее микробное число воды, общее микробное число воздуха,
коли-индекс, коли-титр, санитарно-показательные микроорганизмы, автохтонная
микрофлора, аллохтонная микрофлора, зоны сапробности.
Ход работы
Задание № 1. Заложить опыт по определению ОМЧ (общее микробное число) воздуха.
Для заражения чашки Петри открывают в исследуемом помещении или на улице на 5
мин. Крышку чашки Петри снимают и, не переворачивая, ставят рядом. На крышке чашки
Петри указывают вариант опыта, дату посева. Зараженные чашки Петри помещают в
термостат при температуре 25-28°С.
Через 2-3 суток подсчитывают число колоний микроорганизмов, развившихся на
агаровой пластинке чашки Петри. При этом учитывают следующее: по приблизительным
6

подсчетам (Омелянский) на площади в 100 см
2
в течение 5 минут оседает столько
микроорганизмов и спор, сколько их содержится в 10 л воздуха. Допускаем, что каждая
колония возникла из одной клетки или споры. Этот метод дает лишь приблизительные
данные, но относительное число микроорганизмов в воздухе разных помещений он позволяет
обнаруживать довольно точно. Заполняют таблицу № 4, делают выводы.
Например: в чашке Петри обнаружено 5 колоний, радиус чашки 2 см. Площадь
составляет S=πr
2
=3.14*4=12.5. Тогда в 10 л содержится
измовмикроорган40
5,12
100*5
Таблица № 4. Общее микробное число (ОМЧ) воздуха помещений.
Исследуемое
помещение
Время
экспозиции
Число КОЕ (колониеобразующих
едениц) бактерий
ОМЧ, к-во/м
3
На чашку
Петри
100 см
2
поверхности
агаровой пластинки
Аудитория
Коридор
Улица
Колонии микроорганизмов, выделенные из воздуха на пластинках МПА, могут быть
использованы для работы по идентификации вида. Наиболее часто из воздуха выделяются
колонии микрококков, сарцин, некоторых бацилл и бактерий.
Задание № 2. Заложить опыт по определению ОМЧ воды.
Для исследования в стерильные колбы берут водопроводную воду. Из колбы берут
стерильной пипеткой 1 мл воды и вносят в чашку Петри с расправленной средой (МПА)
(температура ее не должна быть выше 45°С). Чашку закрывают и, осторожно наклоняя,
перемешивают питательную среду, дают пластинке застыть, помещают в термостат. Через 3-
5 суток развившиеся в чашках Петри колонии подсчитывают и определяют количество
бактерий в 1 мл воды.
После подсчета колоний производится определение микробного числа воды –
количества микроорганизмов на 1 мл исследуемой воды, учитывая разведение, если оно
производилось.
Данные оформляют в виде таблицы № 5, делают выводы.
Таблица № 5. Общее микробное число (ОМЧ) питьевой воды
Источник
Количество микроорганизмов в
исследуемом объеме воды
ОМЧ, к-во/мл
Водопроводная вода
Контрольные вопросы
1. Особенности микрофлоры воздуха. Распространение микроорганизмов в воздухе.
2. Нормы санитарного состояния воздуха помещений.
3. Санитарно-микробиологическое исследование воздуха.
4. Микрофлора питьевой воды.
5. Микрофлора природных вод. Распределение микроорганизмов в воде.
6. Санитарные показатели питьевой воды. Общее микробное число воды. Коли-
индекс, коли-титр воды.
7. Загрязнение и самоочищение водоемов. Роль микроорганизмов в процессах
самоочищения водоемов.
8. Биологическая очистка питьевых и сточных вод.
9. Санитарно-бактериологическое исследование воды. Определение ОМЧ, коли-
индекса, коли-титра.
10. Санитарно-показательные микроорганизмы воздуха, воды, почвы.
11. Требования, предъявляемые к санитарно-показательным микроорганизмам.
12. Микрофлора пищевых продуктов (кисло-молочных, рыбы, мяса, колбасных
изделий, консервов).
13. Характеристика групп микроорганизмов, используемых при оценке безопасности
продовольственного сырья и пищевых продуктов.
7

14. Санитарно-бактериологические нормативы для различных пищевых продуктов.
15. Методы санитарно-бактериологического исследования пищевых продуктов.
16. Почва как среда обитания микроорганизмов.
17. Экологические факторы распространения микроорганизмов почвы.
18. Взаимоотношения между микроорганизмами почвы.
19. Участие микрофлоры почвы в процессах минерализации органических веществ и
образовании гумуса.
20. Санитарно-бактериологическое исследование почвы.
ЗАНЯТИЕ № 5
ПОЛУЧЕНИЕ ЧИСТОЙ КУЛЬТУРЫ МИКРООРГАНИЗМОВ
НЕФЕЛОМЕТРИЧЕСКИЙ МЕТОД КОЛИЧЕСТВЕННОГО УЧЕТА
МИКРООРГАНИЗМОВ
Цель: Провести выделение чистых культур микроорганизмов, освоить
нефелометрический метод учета количества микроорганизмов.
Задачи
1.Провести выделение чистой культуры методом «истощающего» штриха.
2.Провести количественную оценку микроорганизмов нефелометрическим методом
Материалы и оборудование. Чашки Петри со стерильным МПА, ФЭК, камера
Горяева, микроскопы, петли микробиологические, спиртовка, спички.
Основные понятия. Чистая культура, рост, размножение, бинарное деление,
почкование, клеточный цикл (мономорфный, диморфный, полиморфный), время генерации,
удельная скорость роста, выход биомассы, экономический коэффициент, стационарная фаза
роста, лаг-фаза, фаза экспоненциального размножения, стационарная фаза, фаза отмирания,
непроточная культура, проточная культура, синхронная культура.
Ход работы
Задание № 1. Получение чистой культуры микроорганизмов
Выделение чистых культур аэробов проводят, рассевая накопительную культуру на
поверхность твердой питательной среды. Посев проводят методом истощающего штриха.
После того, как колонии вырастут, поверяют чистоту выделенных колоний визуально и
микроскопированием. Через 3-6 суток выбирают и описывают изолированную колонию
микроорганизмов (используя рисунки приложения). Колонию описывают по следующей
схеме:
1. Величина колонии: точечные (D – меньше 1 мм), мелкие (D – 1-2 мм), средние
(D – 2-4 мм) и крупные (D – 4-6 мм и более).
2. Форма колонии – округлая, амебовидная, ризоидная.
3. Оптические свойства – прозрачная, матовая, флуоресцирующая,
полупрозрачная (просвечивает), непрозрачная, блестящая.
4. Цвет – отмечают цвет колонии и выделение пигмента в среду.
5. Поверхность – гладкая, шероховатая, складчатая, бугристая.
6. Профиль – плоский, выпуклый, кратерообразный, врастающий в агар и т.д.
7. Край колонии – ровный, волнистый, лопастной, ризоидный и др.
8. Структура колонии – однородная, мелко или крупнозернистая.
9. Консистенция – маслянистая, тестообразная, вязкая, пленчатая.
Задание № 2. Провести количественную оценку микроорганизмов
нефелометрическим методом.
а) Нефелометрический метод. Плотность клеток S. cerevisiae в жидкой среде
определяют нефелометрически (ФЭК), используя кювету с длиной оптического пути 0,5 см и
зеленый светофильтр (А = X 540 нм). Для получения достоверных результатов плотность
клеток должна быть в пределах 0,1-0,6. При концентрациях клеток выше 0,6 происходит
вторичное рассеяние света, что приводит к получению заниженных результатов. Поэтому
суспензии больших плотностей перед измерением светопропускания следует разводить водой
в 2, 4, 6, 8 и 10 раз. Результаты измерений оптической плотности каждой суспензии
(контролем служит вода) записывают в таблицу № 6.
8

б) Подсчет клеток в камере Горяева-Тома. Для перехода от показаний
фотоэлектроколориметра (ФЭК) к количеству клеток микроорганизмов в среде
подсчитывают их число, пользуясь счетной камерой Горяева-Тома и разведениями суспензии
дрожжей, которые использовали для определения их плотности нефелометрическим методом.
Клетки подсчитывают в больших квадратах сетки, пользуясь объективом 8*. Общее число
подсчитанных клеток должно быть не менее 600. Количество клеток в 1 мл соответствующей
суспензии рассчитывают по формуле М = 1000*a*n/h*S, где М – число клеток в 1 мл
суспензии; а – среднее число клеток в большом квадрате сетки; h – глубина камеры (1/10 мм);
S — площадь большого квадрата сетки (1/25 мм
2
); n – степень разведения суспензии; 1000
мм
3
– 1 мл. Полученные результаты, млн. клеток в 1 мл записывают в табл. № 6.
Таблица № 6. Количество клеток дрожжей в суспензиях, установленное с помощью
камеры Горяева, и соответствующие показания ФЭК
Показатель
Номер суспензии
1 2 3 4 5 6 И т.д.
Количество клеток, млн/мл (М)
Показания ФЭК
Построить калибровочную кривую на основании данных табл. № 6, откладывая на оси
абсцисс количество клеток дрожжей, а на оси ординат оптическую плотность соот-
ветствующей суспензии. Калибровочную кривую строят для быстрого определения ко-
личества клеток определенного вида микроорганизмов по показаниям ФЭК.
Контрольные вопросы и задания
1. Накопительные культуры и принцип элективности. Чистые культуры, методы
получения и значение.
2. Размножение микроорганизмов.
3. Клеточные циклы бактерий. Рост отдельных микроорганизмов и популяций.
Сбалансированный и несбалансированный рост.
4. Параметры роста культур: время генерации, удельная скорость роста, выход
биомассы, экономический коэффициент.
5. Кривые роста, особенности отдельных фаз. Рост микроорганизмов при
непрерывном культивировании. Синхронные культуры.
ЗАНЯТИЕ № 6
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПИЩЕВЫХ
ПРОДУКТОВ
Цель: Провести санитарно-бактериологическую оценку состояния продуктов питания.
Задачи
1. Определить общее микробное число некоторых пищевых продуктов.
2. Определить наличие БГКП (бактерии группы кишечной палочки).
Материалы и оборудование. Чашки Петри с МПА, чашки Петри со средой Эндо,
пипетки на 1 мл, ступки с пестиками, скальпели, пробирки с 9 мл стерильной воды, пробирки
со средой Кесслера, стерильные колбы с 100 мл воды, весы.
Основные понятия. Специфическая микрофлора пищевых продуктов,
неспецифическая микрофлора пищевых продуктов, БГКП, санитарно-показательные
микроорганизмы.
Ход работы
Задание № 1. Определить наличие БГКП и общую обсемененность продуктов
питания, выполняя последовательно следующие этапы:
1. Подготовка пищевых продуктов к исследованию.
Растирают в стерильной фарфоровой ступке 10 г навески (берут стерильно из разных
мест), постепенно добавляя 90 мл изотонического раствора хлорида натрия, и оставляют при
комнатной температуре на несколько минут. Затем стерильной пипеткой с широким носиком
отбивают взвесь для посевов и разведений (1 мл). Принимается, что 1 мл приготовленной
9
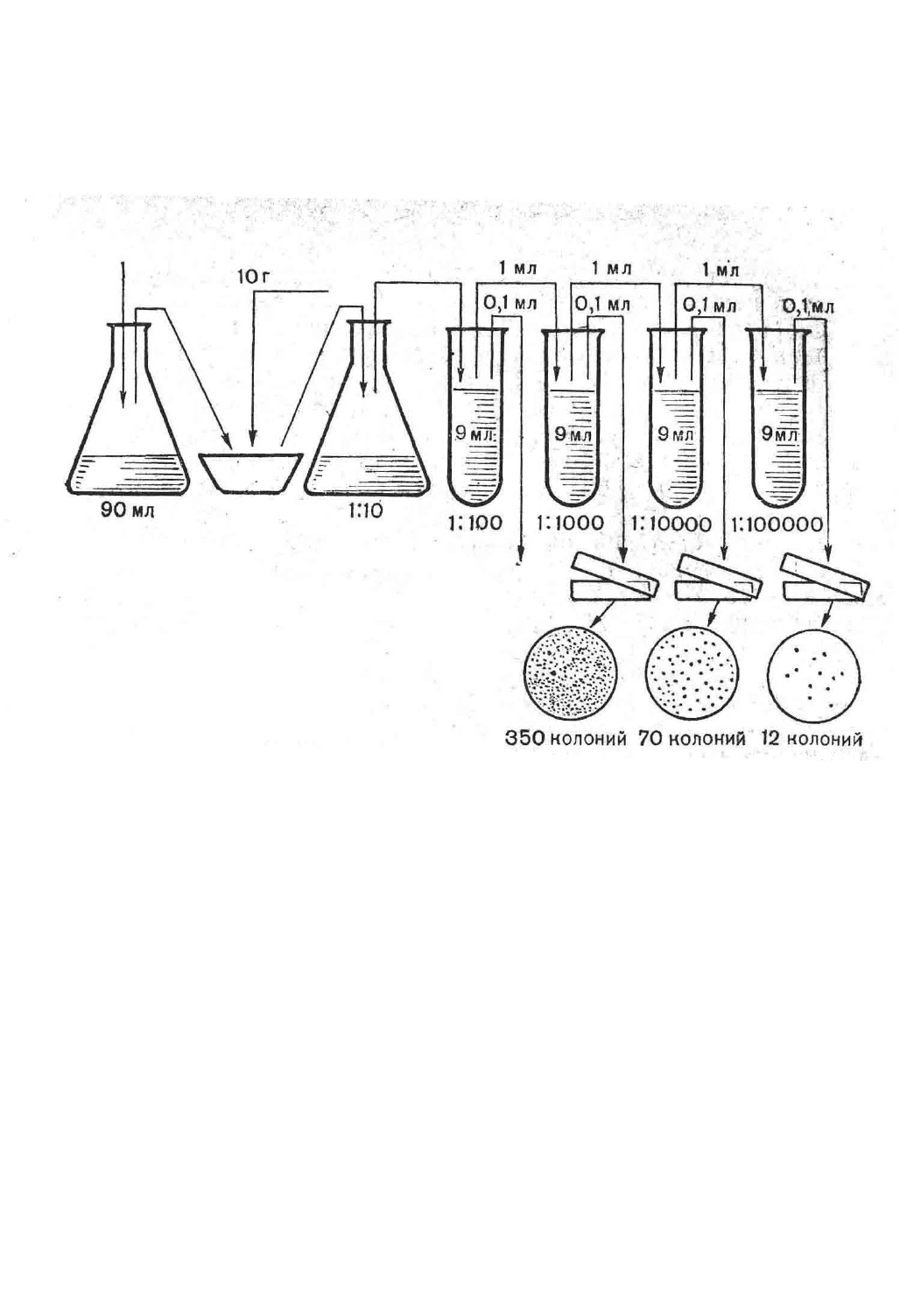
взвеси содержит 0,1 г исходного продукта (разведение 10
-1
). Продукты жидкой консистенции
засевают и разводят для посевов без предварительной подготовки.
2. Приготовление разведений пищевых продуктов для посева.
Для продуктов жидкой консистенции разведения готовят следующим образом:
отбирают стерильной пипеткой 1 мл продукта и вносят в пробирку, содержащую 9 мл
стерильного изотонического раствора хлорида натрия, перемешивают. Полученное
разведение (10
-2
) подвергают таким же образом дальнейшему разведению в необходимое
количество раз (кратное 10).
Рисунок № 1. Приготовление разведений и высева почвенной суспензии на твердые
питательные среды
3. Определение общей обсемененности.
Выбранные для посева разведения вносят по 1 мл в стерильные чашки Петри с
расплавленным при 45-50
0
МПА, после чего их перемешивают. Среде дают застыть, посевы
выращивают в течение суток при 37°С, после чего подсчитывают число выросших колоний
(КОЕ). Определяют общее количество бактерий в 1 мл или 1 г продукта.
4. Определение наличия БГКП.
Для посева используется то количество продукта, в котором в соответствии с
установленными нормами предусматривается отсутствие БГКП. Из выбранных разведений
исследуемых образцов продуктов берут по 1 мл и засевают в пробирки со средой Кесслера.
Засеянные пробирки инкубируют при 37°С 24 ч. При отсутствии признаков роста
(газообразования или изменения цвета среды) делают заключение о соответствии
исследуемого продукта нормативу. При наличии признаков роста производят высев на среду
Эндо. Посевы инкубируют 18-20 ч при 37°С. При просмотре посевов отмечают колонии,
подозрительные или типичные для БГКП (образуют красные, розовые, бледнорозовые
колонии с металлическим блеском или без него). Из них делают препараты живых и
фиксированных клеток, окрашивают по Граму, микроскопируют. Обнаружение
грамотрицательных, не образующих спор палочек с закругленными концами, свиде-
тельствует о возможном наличии БГКП.
Данные по общей обсемененности и наличию кишечной палочки вносят в таблицу.
Делают выводы о микрофлоре различных продуктов питания, используя санитарно-
микробиологические нормативы (СанПиН 2.3.2.560-96) (таб. № 7).
10
