Контрольная работа по общей химии. Вариант 63
Подождите немного. Документ загружается.

СИИЖТ, вариант 63
Контрольная работа 1: 5, 27, 45, 67, 92, 108, 133, 150, 171
Контрольная работа 2: 193, 203, 224, 252, 277, 283,303,332,343
1
Контрольная работа 1
5. При восстановлении 1,485 г оксида металла, выделилось 0,41 л оксида
углерода СО. Вычислить эквивалентную массу металла.
Решение:
1,485 г 0,41 л
1. MeO + C = CO + Me
Э
MeO
Э
СО
По закону эквивалентов:
1,485 г оксида - « - « - 0,41 л СО
Э
MeO
- « - « - 11,2 л СО
Отсюда:
Э
MeO
= 1,485 * 11,2 / 0,41 = 40,56 г/моль
2. Эквивалентная масса кислорода равна 8 г/моль
Отсюда, эквивалентная масса металла равна:
40,56 – 8 = 32,56 г/моль
Ответ: эквивалентная масса металла равна 32, 56 г/моль.
27. Какое состояние атома называется основным, и какое – возбужденным?
Чем ион отличается от нейтрального атома? Изобразите электронные
формулы и схемы атома серы в основном и возбужденном состояниях, а
также ионов S
+4
и S
-2
.
Решение:
Атом не излучает и не поглощает энергию при движении электронов
только по определенным (стационарным орбитам). Такое состояние атома
называется устойчивым.
При поглощении атомом энергии он переходит из нормального
(соновного) в возбужденное состояние. При этом электроны удаляются от
ядра, «перескакивая» на более дальние стационарные орбиты.
Размещение электронов по АО в пределах одного энергетического
подуровня определяется правилом Хунда (суммарный спин данного
2
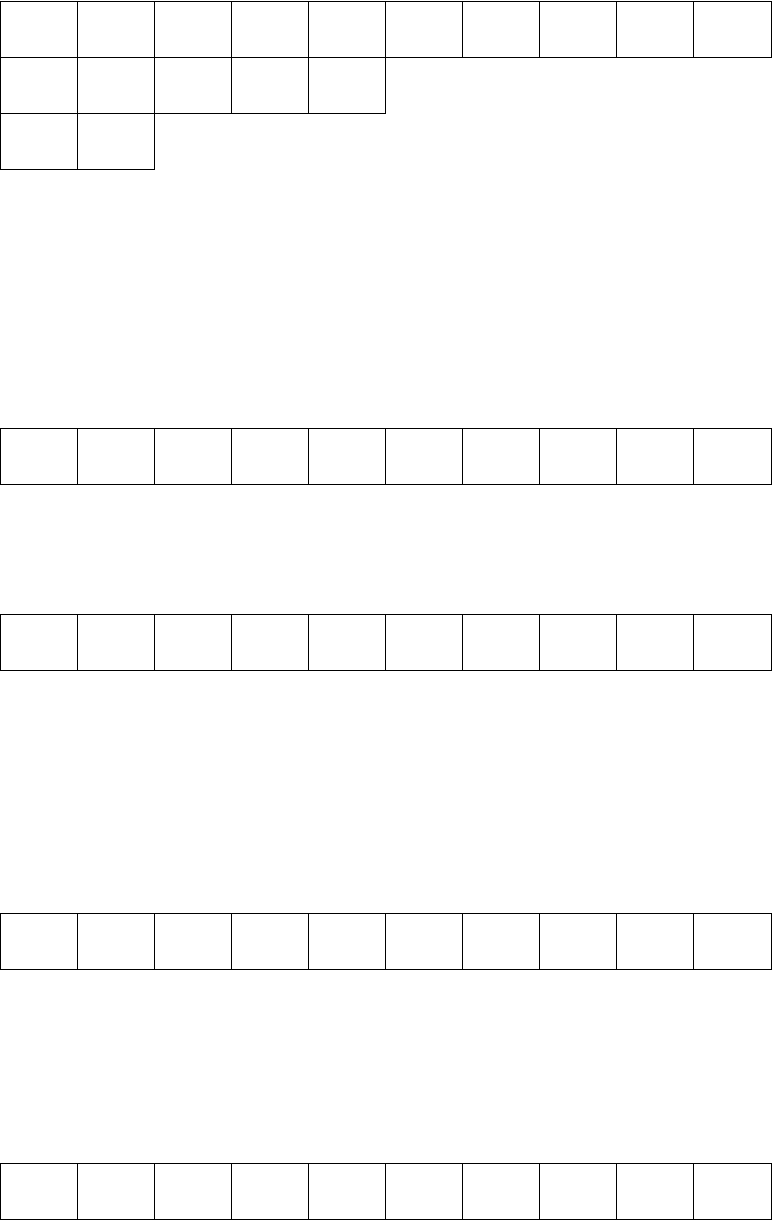
подуровня должен быть максимальным). При любом другом размещении
электронов атом будет находится в возбужденном состоянии.
16
S – 1s
2
2s
2
2p
6
3s
2
3p
4
p-элемент
s p d
n=3
↑↓ ↑↓ ↑ ↑
n=2
↑↓ ↑↓ ↑↓ ↑↓
n=1
↑↓
Основное состояние; В=2 (число неспаренных электронов)
При возбуждении: S + hν → S
*
16
S
*
s p d
n=3
↑↓ ↑ ↑ ↑ ↑
В=4
16
S
*
s p d
n=3
↑↓ ↑ ↑ ↑ ↑ ↑
В=6
Ион от нейтрального атома отличается числом электронов.
S
0
- 4 e → S
+4
S
+4
- 1s
2
2s
2
2p
6
3s
2
3p
0
s p d
n=3
↑↓
S
0
+ 2 e → S
-2
S
-2
- 1s
2
2s
2
2p
6
3s
2
3p
6
s p d
n=3
↑↓ ↑↓ ↑↓ ↑↓
3
45. Исходя из положения металла в периодической системе, определите,
какой из двух гидроксидов является более сильным основанием:
а)Mg(OH)
2
или Be(OH)
2
, б) Cd(OH)
2
или Sn(OH)
2
, в) Sr(OH)
2
или Mo(OH)
2
?
Решение:
С увеличением порядкового номера в группах сила оснований возрастает,
поэтому Mg(OH)
2
как основание сильнее Be(OH)
2
.
С увеличением порядкового номера в периодах сила оснований ослабевает, а
сила кислот возрастает, поэтому Cd(OH)
2
сильнее Sn(OH)
2
, а Sr(OH)
2
сильнее
Mo(OH)
2
.
67. Что представляет собой гибридизация атомных орбиталей? В каких
случаях она имеет место? Какие типы гибридизации АО вам известны? Есть
ли гибридизация АО и какого типа в молекулах: N
2
, BCl
3
, PCl
3
?
Решение:
В результате комбинации различных орбиталей (s,p,d и т.д.) возникают
новые атомные орбитали промежуточной формы, которые называются
гибридными. А перестройка различных орбиталей, позволяющая ей более
полно перекрываться с орбиталью соседнего атома, называется
гибридизацией. Гибридизация осуществляется при возбуждении атома,
например:
4
Be - 1s
2
2s
2
s p
n=2
↑↓
В возбужденном состоянии:
s p
n=2
↑ ↑
А результате: одна s + одна p- орбиталь → две sp- гибридные орбитали.
При гибридизации одной s- и двух p - орбиталей образуется три sp
2
-
гибридных орбитали.
4
В молекуле BCl
3
центральный атом В - 1s
2
2s
2
2p
1
в возбужденном состоянии:
s p
n=2
↑ ↑ ↑
Такой тип гибридизации объясняет расположение всех трех связей в
молекуле BCl
3
в одной плоскости.
Если со стороны атома в химических связях участвуют четыре атомные
орбитали одного слоя – s-, p
x
,p
y
,p
z
, то в результате их гибридизации
образуется четыре эквивалентные sp
3
– орбитали.
Изменить свою «форму» атомная орбиталь может лишь комбинируясь с
другими атомными орбиталями иной симметрии этого же атома.
Гибридизация осуществляется при возбуждении атома, т.е. требует затрат
энергии.
В молекуле атома азота:
Атом азота
7
N - 1s
2
2s
2
2p
3
s p
n=2
↑↓ ↑ ↑ ↑
Нет свободных орбиталей и возбуждения атома не происходит, поэтому в
участии образовании молекулы азота не участвуют гибридные орбитали,
участвуют просто три р- орбитали.
В молекуле PCl
5
центральный атом Р - 1s
2
2s
2
2p
6
3s
2
3p
3
в возбужденном
состоянии:
s p d
n=3
↑ ↑ ↑ ↑ ↑
В результате образуется пять sp
3
d – гибридных орбиталей.
В молекуле PCl
3
центральный атом Р находится в невозбужденном
состоянии:
5

s p d
n=3
↑↓ ↑ ↑ ↑
В связи участвуют три p- орбитали. Поэтому в молекуле PCl
3
гибридизации
АО не происходит.
92. Вычислите тепловой эффект реакции разложения карбида кальция СаС
2
(к) водой, в результате которой образуется гидроксид кальция Cа(OH)
2
(к) и
ацетилен С
2
Н
2
(г). Сколько теплоты выделится при разложении водой 100 г
карбида кальция?
Решение:
СаС
2
(к) +2 Н
2
О (ж) = Cа(OH)
2
(к) + С
2
Н
2
(г)
1.По следствию из закона Гесса:
∆ Н
0
р
= ∑ ∆ Н
0
прод
- ∑∆ Н
0
исход
∆ Н
0
р
= (∆ Н
0
Cа(OH)
2
+ ∆ Н
0
С
2
Н
2
) - (∆ Н
0
CаС
2
+ 2∆ Н
0
Н
2
О)=
(-986,2 + 226,75) – (- 62,7 + 2* (-285,84)) = - 125,07 кДж
2.
100 г
СаС
2
+ 2 Н
2
О = Cа(OH)
2
+ С
2
Н
2
+ 125,07 кДж
М= 64 г/моль
64 г СаС
2
- « - « - 125,07 кДж
100 г СаС
2
- « - « - х кДж
Х = 196,4 кДж
Ответ: 1) тепловой эффект реакции равен – 125,07 кДж; 2) при разложении
100 г карбида кальция выделяется 196,4 кДж тепла.
108. Реакция протекает по уравнению:
ZnO (к) + CO (г) = Zn (к) + CO
2 (г)
Вычислите ∆G этой реакции, используя табличные значения ∆ Н
0
298
и
∆ S
0
298
и сделайте вывод о возможности самопроизвольного протекания
реакции.
6
Решение:
1. По следствию из закона Гесса:
∆ Н
0
р
= ∑ ∆ Н
0
прод
- ∑∆ Н
0
исход
∆ Н
0
р
= (∆ Н
0
Zn
+ ∆ Н
0
CO
2
) - (∆ Н
0
ZnO
+ ∆ Н
0
CO) =
( 0 + (- 393,51)) – (- 349,0 + (-110,5)) = + 65,99 кДж
2. ∆ S
0
р
= ∑ S
0
прод
- ∑ S
0
исход
∆ S
0
р
= (41,59 + 213,6) - (43,5 + 197,4) = 14,29 Дж/ К
3. ∆G
298
= ∆ Н
0
298
- Т *∆ S
0
298
= 65,99 – 298*14,29/1000 = + 61,73 кДж
Ответ: ∆G
реакц
> 0 , следовательно, при стандартных условиях реакция
протекать не будет.
133. Константа равновесия реакции N
2 (г)
+ 3 H
2 (г)
↔ 2 NH
3 (г)
равна 0,1.
Равновесные концентрации водорода и аммиака равны 0,6 и 0,18 моль/л
соответственно. Вычислите равновесную и исходные концентрации азота.
Решение:
1. Константа равновесия определяется по уравнению:
К
р
= [NH
3
]
2
/[ N
2
]*[ H
2
]
3
= 0,1
Отсюда, равновесная концентрация азота:
[N
2
] = 0,18
2
/ 0,6
3
*0,1 = 1,5 моль/л
2. Из 1 моль азота образуется 2 моль аммиака, следовательно, на 0,18 моль/л
аммиака было затрачено ½ концентрации азота,т.е. 0,09 моль/л азота.
Исходная концентрация азота составит:
0,09 + 1,5 = 1,59 моль/л
150. Вычислите нормальность следующих растворов:
а) 60%-ного растворв уксусной кислоты (ρ =1,068 г/см
3
), б) 49%-ного
раствора Н
3
РО
4
(ρ =1,338 г/см
3
).
Решение:
7
1. Эквивалентная концентрация (или нормальность) С
н
- число моль
эквивалентов растворенного вещества, содержащегося в 1 л раствора.
Эквивалентную концентрацию определяют по формуле:
С
н
= m / Э* v
2. Массу растворенного вещества определим следующим образом:
в 100 г 60%-ного раствора СН
3
СООН содержится 60 г СН
3
СООН
а в 100 г 49%-ного раствора Н
3
РО
4
содержится 49 г Н
3
РО
4
безводной
3. С учетом плотностей растворов определяем содержание безводных кислот
в 1 литре раствора:
ρ = m/v → v = m/ ρ
а) 100 г : 1,068 г/ см
3
= 92,6 см
3
в 92,6 см
3
- 60 г СН
3
СООН
в 1000 см
3
- х г СН
3
СООН
х = 60*1000 /92,6 = 648 г/л
б) 100 г : 1,338 г/ см
3
= 74,74 см
3
в 74,74 см
3
- 49 г Н
3
РО
4
г
в 1000 см
3
- х г Н
3
РО
4
г
х = 49*1000 / 74,74 = 655,6 г/л
4. Определяем эквивалентные массы кислот:
а) Э
СН3СООН
= М
СН3СООН
/1 = 60 г/ моль-экв
б) Э
Н3РО4
= М
Н3РО4
/3 = 98/3 = 32,667 г/моль-экв
5. Нормальная концентрация растворов:
а) С
н
= 648 г/л : 60 г/моль-экв = 10,8 н.
б) С
н
= 655,6 г/л : 32,667 г/моль-экв = 20 н.
171. При растворении хлороформа массой 15 г в диэтиловом эфире массой
400 г температура кипения последнего повысилась на 0,635
0
С. Вычислить
молярную массу хлороформа. Эбуллиоскопическая константа эфира равна
2,02 град.
Решение:
8
1. К
эб
= ∆ Т
кип
/ m, где m –моляльная концентрация раствора.
2. Моляльность – число моль растворенного вещества содержащегося в 1
кг растворителя.
3. Число моль растворенного вещества определяется по формуле:
ν = m / M
Отсюда, моляльность раствора:
m = К
эб
/∆ Т
кип
= 2,02 : 0,635 = 3,11моль/кг
15 г хлороформа - на 400 г эфира
х г хлороформа - на 1000 г эфира
х = 15*1000/400 = 37,5 г/кг
М = ν * m = 37,5 *3,11=116,625 г/моль
Можно использовать формулу:
М= (1000* К
эб
*g ) /(g
0
*∆ Т
кип
) =(1000 *2,02*15) /(400 * 0,635) = 116,5
г/моль
Где g – масса растворенного вещества
g
0
- масса растворителя.
Контрольная работа №2.
193. Составьте молекулярные и ионно-молекулярные уравнения реакций:
а) Cr(OH)
3
+ KOH
б) NaNO
2
+ H
2
SO
4
в) Ba(OH)
2
+ H
2
SO
4
Решение:
а) Cr(OH)
3
+ 3 KOH = К
3
[Cr(OH)
6
]
Cr(OH)
3
+ 3 К
+
+ 3 ОН
-
= 3 К
+
+ Cr(OH)
6
3-
Cr(OH)
3
+ 3 ОН
-
= Cr(OH)
6
3-
б) 2 NaNO
2
+ H
2
SO
4
= 2НNO
2
+ Na
2
SO
4
2 Na
+
+ 2 NO
2
-
+ 2 H
+
+ SO
4
2-
= 2НNO
2
+ 2Na
+
+ SO
4
2-
2 NO
2
-
+ 2 H
+ -
= 2НNO
2
9
NO
2
-
+ H
+ -
= НNO
2
в) Ba(OH)
2
+ H
2
SO
4
= BaSO
4
+ Н
2
О
Ba
2+
+ 2 ОН
-
+ 2 H
+
+ SO
4
2-
= BaSO
4
+ Н
2
О
203. Какие из солей Fe
2
(SO
4
)
3
, (NH
4
)
2
S, NaCl, K
3
AsO
4
подвергаются
гидролизу? Составьте молекулярные и ионные уравнения гидролиза
соответствующих солей.
Решение:
Соли, образованные сильным основанием и сильной кислотой, не
подвергаются гидролизу. К ним относятся NaCl, K
3
AsO
4
.
Для остальных солей составим уравнения гидролиза:
А) Fe
2
(SO
4
)
3
+ 2 Н
2
О ↔ 2 (Fe ОН) SO
4
+ H
2
SO
4
2 Fe
3+
+ 3 SO
4
2-
+ 2 Н
2
О ↔ 2 Fe ОН
2+
+ 3 SO
4
2-
+ Н
+
Fe
3+
+ Н
2
О ↔ Fe ОН
2+
+ Н
+
- кислая реакция среды, рН < 7
Б) (NH
4
)
2
S – соль, образованная слабым основанием и слабой летучей
кислотой, поэтому она полностью подвергается гидролизу.
(NH
4
)
2
S + Н
2
О ↔ NH
4
ОН + Н
2
S
2 NH
4
+
+ S
2-
↔ NH
4
ОН ↑ + Н
2
S↑
224. Какие соединения и простые вещества могут проявлять как
окислительные, так и восстановительные свойства? Выберите такие
вещества из предложенного перечня:
Br
2
, KNO
3
, Na
2
SO
3
, NaNO
2
, Mg, H
2
O
2
Решение:
Соединения и простые вещества могут проявлять как окислительные, так и
восстановительные свойства, если они содержат элементы с промежуточной
степенью окисления. К таким относятся:
Br
2
0
, Na
2
S
+4
O
3
, NaN
+3
O
2
, H
2
O
2
-1
252. Рассчитайте электродный потенциал железного электрода, опущенного в
раствор соли FeCl
3
, 12,6 г которой содержится в 1 л раствора.
10
