Контрольная работа по материаловедению
Подождите немного. Документ загружается.

Контрольная работа по материаловедению №1
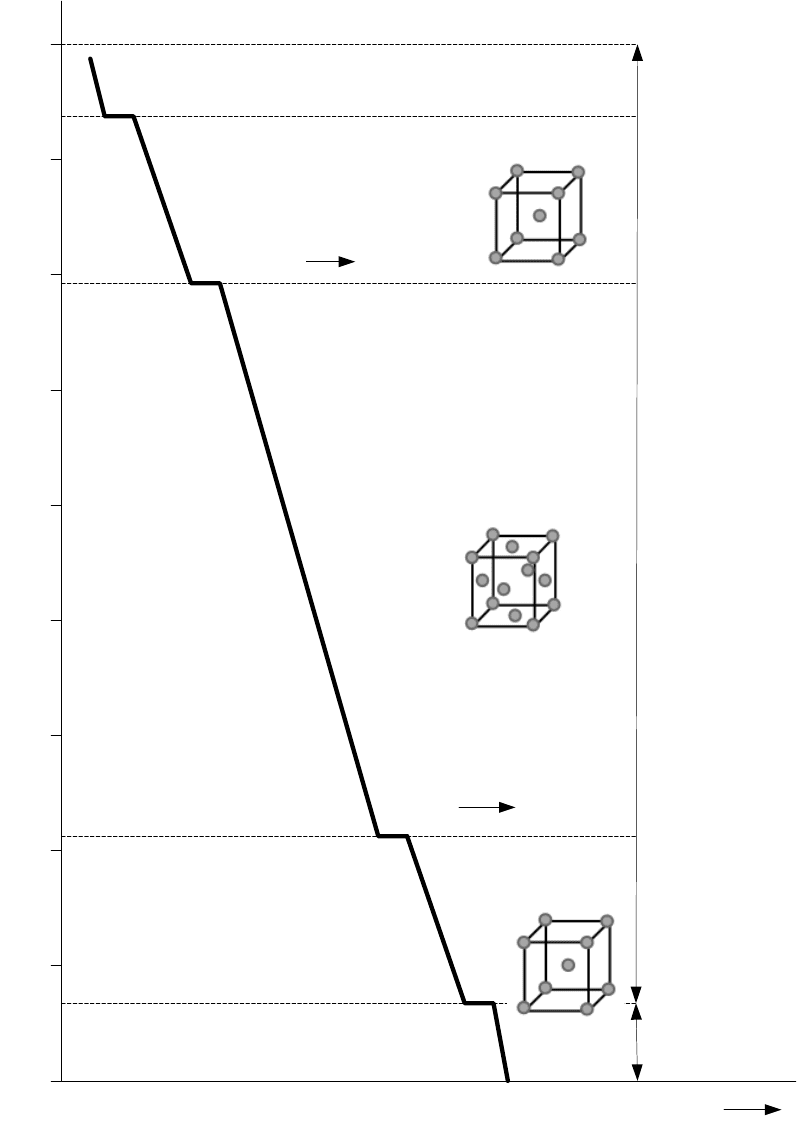
Вопрос 9. Построить кривую охлаждения для чистого железа и на этом
примере пояснить сущность аллотрофических (полиморфных) превращений
металлов и их использование
700
800
900
1000
1100
1200
1300
1400
1500
1600
Т, град С
Время, t
1539
1392
911
768
Жидкое железо
T затвердевания 1539 град.С
Fe
Fe
Fe
Fe
Fe
Точка Кюри
Fe
Fe
НемагнитноМагнитно
Рис.1 Кривая охлаждения чистого металла

Многие металлы при изменении температуры меняют тип
кристаллической решетки. К таким металлам относятся железо, кобальт,
титан, марганец, олово и некоторые другие, в частности редкоземельные
металлы. Способность металла менять тип кристаллической решетки с
изменением температуры называется аллотропией. Одновременно с
изменением типа кристаллической решетки меняются и свойства металла.
Этим явлением широко пользуются в технике для придания металлам
требуемых свойств.
Принято обозначать различные аллотропические формы одного и того
же металла буквами греческого алфавита — α, β, γ, δ и т. д. Причем форму,
существующую при самых низких температурах, обозначают буквой α,
следующую — β и т. д.
Аллотропическое превращение при нагревании происходит с
поглощением тепла, а при охлаждении — с его выделением. Как в процессе
нагревания, так и в процессе охлаждения аллотропическое превращение
происходит с некоторым запаздыванием. Это явление называется
гистерезисом. Оно характерно для аллотропических превращений.
Самый распространенный в технике металл — железо. Температура
плавления железа равна 1539°. Одной из самых важных особенностей железа
является его способность претерпевать превращения в твердом состоянии
(аллотропические превращения). Аллотропические превращения,
протекающие в чистом железе, показаны на кривой охлаждения железа
(рис.1). Из приведенной кривой видно, что железо проходит через ряд
аллотропических превращений и, следовательно, может находиться в
различных структурных состояниях.
До 1539° С происходит плавное остывание жидкого железа. На кривой
охлаждения при этой температуре появляется площадка; железо затвердевает
и выделяется скрытая теплота кристаллизации. Пока все железо не
затвердеет, температура не изменяется. В интервале 1539-1392°С
температура плавно снижается. Здесь железо имеет кристаллическую
решетку объемно-центрированного куба Feδ (δ — железо).
При 1392° С на кривой охлаждения появляется вторая площадка,
связанная с аллотропическим превращением δ-железа в γ-железо. Оно
сопровождается выделением тепла, поэтому на кривой охлаждения
появляется площадка; Feγ (γ-железо) имеет кристаллическую решетку
гранецентрированного куба. При аллотропическом превращении исчезают
старые зерна и появляются новые.
Следующая площадка на кривой охлаждения наблюдается при 911° С.
Она вызвана превращением γ-железа в α-железо. Кристаллическая решетка
из гранецентрированной кубической опять перестраивается в
объемноцентрированную, которая существовала ранее в интервале 1539-
1392° С. Далее структура Feα (α-железа) сохраняется до самых низких
температур.
Последняя площадка на кривой охлаждения при 769° С связана с
превращением особого рода. При этой температуре не происходит изменения
в кристаллической решетке, и не появляются новые зерна. Тепловой эффект
связан не с изменением строения кристаллической решетки, а с перестройкой
электронных оболочек атомов. Выше этой температуры железо парамагнитно
(немагнитно), ниже — ферромагнитно (магнитно).
Таким образом, основными аллотропическими формами железа
являются α-железо и γ-железо. На этих модификациях основано большинство
видов термической обработки стали [3].

Вопрос 10. Описать термодинамические основы фазовых превращений
в металлах.
Переходы вещества из одной фазы в другую при изменении состояния
системы называют фазовыми превращениями. Фаза — совокупность
телесных объектов с определенным химическим составом и
термодинамическими свойствами, отделенная от других фаз поверхностью
раздела.
При изменении - внешних условий (температуры, давления,
напряженности электрического поля и др.) вещество может переходить из
одной фазы в другую. Такой переход называют фазовым. К фазовым
переходам относятся испарение и конденсация, плавление и затвердевание и
др.
При фазовых переходах скачкообразно изменяется ряд физических
свойств вещества (плотность, концентрация компонентов и др.). В
зависимости от физических условий, главным образом от температуры и
давления, вещества могут существовать в твердом, жидком и газообразном
состояниях. Эти состояния вещества называют агрегатными.
Основная характеристика фазовых превращений — температура, при
которой фазы находятся в состоянии термодинамического равновесия —
точка фазового перехода.
Термодинамические причины фазовых превращений являются одним
из частных случаев общего закона природы: стремления любой системы к
состоянию с наименьшим запасом энергии.
Рассмотрим термодинамические основы процесса кристаллизации.
Кристаллизация – это процесс перехода металла из жидкого состояния
в твердое с образованием кристаллической структуры. Основной причиной и
движущей силой процесса кристаллизации является стремление вещества к
наиболее устойчивому в термодинамическом отношении состоянию.
Кристаллизация может происходить как при переходе из жидкого
состояния в твердое, так и в твердом состоянии при переходе из одной
аллотропической формы в другую.
Переход металла из жидкого или парообразного состояния в твердое с
образованием кристаллической структуры называется первичной
кристаллизацией. Она протекает вследствие перехода системы из
неустойчивого термодинамического состояния в устойчивое, т.е. из
состояния с большей энергией в состояние с меньшей энергией.
Одной из характеристик энергетического состояния системы является
свободная энергия. Свободной энергией называется часть полной энергии
вещества, которая обратимо изменяется при изменении температуры,
полиморфных превращениях, плавлении и т.д. С повышением температуры
величина свободной энергии уменьшается.
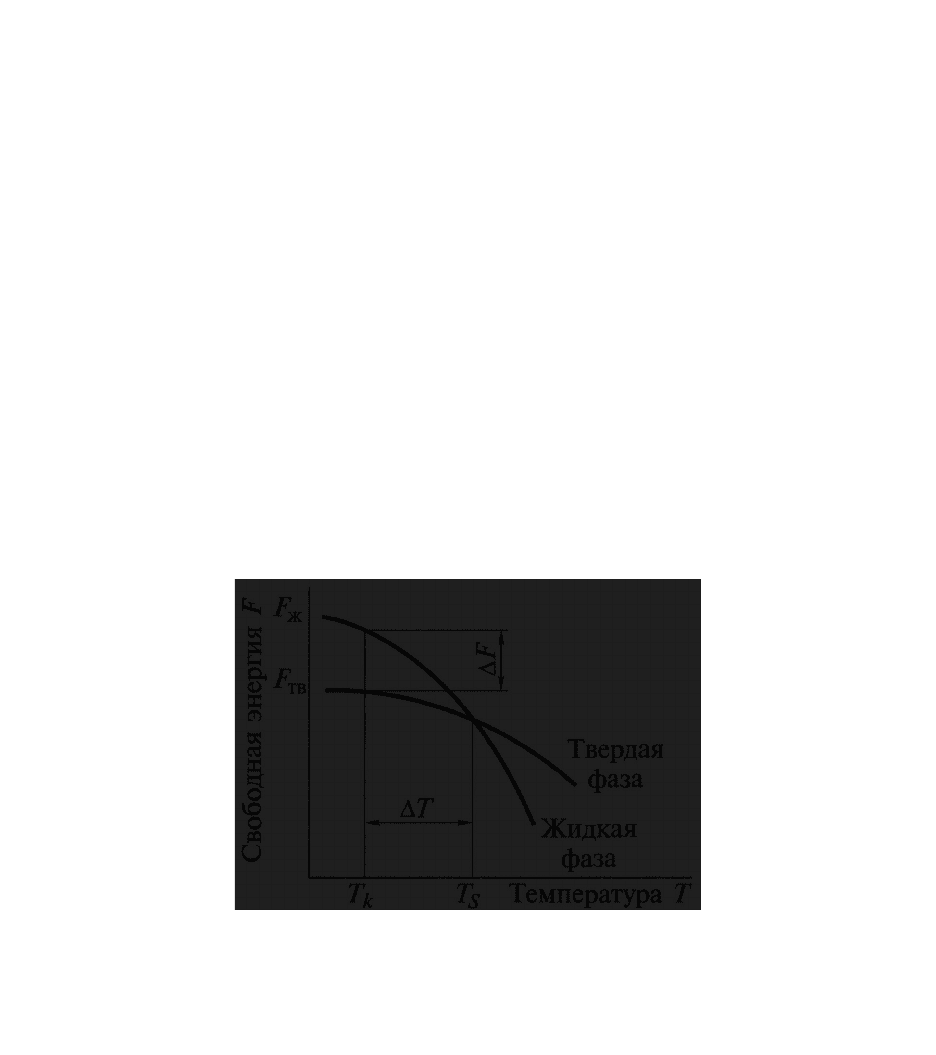
Изменение свободной энергии жидкого и твердого вещества показано
на рис. 2.
Рис. 2. Изменение свободной энергии (F) жидкого (JF
X
) и твердого (JF
TB
)
металла в зависимости от температуры:
твж
FFΔF
При наличии фазового перехода из твердого в жидкое состояние, и
наоборот, эти кривые должны пересекаться. Точка пересечения
соответствует равенству свободных энергий твердой и жидкой фазы, что
говорит о возможности сосуществования в металле при данных условиях как
твердых, так и жидких фаз. Физический смысл температуры Т
s
, при которой

наблюдается равенство свободных энергий твердой и жидкой фазы
выражается как температура фазового равновесия: плавление-
кристаллизация. При температуре выше T
s
более устойчив жидкий металл,
имеющий меньший запас свободной энергии, а ниже этой температуры более
устойчив твердый металл. Процесс кристаллизации будет развиваться лишь в
том случае, если жидкий металл переохладить до температуры ниже
температуры плавления, т.е. охладить ниже T
s
.
Температура, при которой практически начинается процесс
кристаллизации, называется фактической температурой кристаллизации Т
к
.
Разность между температурами T
s
и Т
к
называется степенью
переохлаждения:
KS
TTΔT
Процесс перехода металла из жидкого состояния в твердое можно
описать с помощью кривых охлаждения в координатах время τ —
температура Т.
На рис. 3 показаны кривые охлаждения, характеризующие
кристаллизацию чистых металлов при охлаждении с разной скоростью (υ
1
, υ
2
,
υ
3
).
Рис.3. Кривые охлаждения чистого металла: ΔТ
1
, ΔТ
2
,ΔТ
3
– степени
переохлаждения при скоростях υ
1
, υ
2
, υ
3
соответственно (υ
1
< υ
2
< υ
3
)
Кристаллизация происходит при постоянной температуре, поэтому на
кривой охлаждения появляется горизонтальная площадка (остановка в

падении температуры), образование которой объясняется выделением
скрытой теплоты кристаллизации. Во время плавления происходит
поглощение теплоты, которая расходуется на повышение энергии атомов, т.е.
на разрушение кристаллической решетки металла. Эта теплота называется
скрытой. В процессе кристаллизации происходит обратное явление, а
именно выделение энергии в виде скрытой теплоты кристаллизации,
которая задерживает падение температуры.
При очень медленном охлаждении степень переохлаждения мала и
кристаллизация происходит при температуре, близкой к равновесной. С
увеличением скорости охлаждения степень переохлаждения возрастает (кри-
вые, соответствующие скоростям охлаждения υ
2
и υ
3
), и процесс
кристаллизации протекает при температурах значительно более низких, чем
равновесная температура кристаллизации.
Необходимая для кристаллизации степень переохлаждения зависит от
природы и чистоты металла. Чем чище металл, тем большее переохлаждение
требуется для возникновения зародышей твердых кристаллов [1].
Вопрос 19. В чем сущность производства стали из чугуна? Какие
существуют разновидности процессов получения стали? Дайте их
сравнительную характеристику.
Стали – железоуглеродистые сплавы, содержащие практически до 1,5
% углерода, при большем его содержании значительно увеличиваются
твёрдость и хрупкость сталей и они не находят широкого применения.
Основными исходными материалами для производства стали являются
передельный чугун и стальной лом (скрап). Содержание углерода и примесей
в стали значительно ниже, чем в чугуне. Поэтому сущность любого
металлургического передела чугуна в сталь – снижение содержания углерода
и примесей путем их избирательного окисления и перевода в шлак и газы в
процессе плавки. Железо окисляется в первую очередь при взаимодействии
чугуна с кислородом в сталеплавильных печах:
2Fe+O2=2FeO+Q.
Одновременно с железом окисляются кремний, фосфор, марганец и
углерод. Образующийся оксид железа при высоких температурах отдаёт свой
кислород более активным примесям в чугуне, окисляя их.
Процессы выплавки стали осуществляют в три этапа.
Первый этап – расплавление шихты и нагрев ванны жидкого металла.
Температура металла сравнительно невысокая, интенсивно происходит
окисление железа, образование оксида железа и окисление примесей:
кремния, марганца и фосфора. Наиболее важная задача этапа – удаление
фосфора. Для этого желательно проведение плавки в основной печи, где
шлак содержит CaO. Фосфорный ангидрид P
2
O
5
образует с оксидом железа
нестойкое соединение (FeO)
3
x P
2
O
5
. Оксид кальция CaO - более сильное
основание, чем оксид железа, поэтому при невысоких температурах
связывает P
2
O
5
и переводит его в шлак:
2P+5FeO+4CaO→(CaO)
4
x P
2
O
5
+5Fe.
Для удаления фосфора необходимы невысокие температура ванны
металла и шлака, достаточное содержание в шлаке FeO. Для повышения
содержания Feo в шлаке и ускорения окисления примесей в печь добавляют
железную руду и окалину, наводя железистый шлак. По мере удаления
фосфора из металла в шлак, содержание фосфора в шлаке увеличивается.
Поэтому необходимо убрать этот шлак с зеркала металла и заменить его
новым со свежими добавками CaO.
Второй этап – кипение металлической ванны – начинается по мере
прогрева до более высоких температур. При повышении температуры более
интенсивно протекает реакция окисления углерода, происходящая с
поглощением теплоты:
FeO+C=CO+Fe-Q.
Для окисления углерода в металл вводят незначительное количество
руды, окалины или вдувают кислород. При реакции оксида железа с
углеродом, пузырьки оксида углерода CO выделяются из жидкого металла,
вызывая «кипение ванны». При «кипении» уменьшается содержание
углерода в металле до требуемого, выравнивается температура по объему
ванны, частично удаляются неметаллические включения, прилипающие к
всплывающим пузырькам СО, а также газы, проникающие в пузырьки СО.
Все это способствует повышению качества металла. Следовательно, этот
этап - основной в процессе выплавки стали.
Также создаются условия для удаления серы. Сера в стали находится в
виде сульфида (FeS), который растворяется также в основном шлаке. Чем
выше температура, тем большее количество сульфида железа FeS
растворяется в шлаке и взаимодействует с оксидом кальция CaO:
FeS+CaO=CaS+FeO.
Образующееся соединение CaS растворяется в шлаке, но не
растворяется в железе, поэтому сера удаляется в шлак.
Третий этап – раскисление стали заключается в восстановлении оксида
железа, растворённого в жидком металле. При плавке повышение
