Контрольная работа по биохимии
Подождите немного. Документ загружается.

Контрольная работа
по биохимии
вариант 1
студентка 3 курса ИЗДО
факультет АФК
группа 11-а
Новикова И.А.

В чем суть процесса биологического окисления? Чем отличаются
аэробное и анаэробное окисление? Опишите ферментную систему,
осуществляющую аэробное окисление в митохондриях. Какие пищевые
вещества необходимы для синтеза компонентов этой системы?
Биологическое окисление - это совокупность реакций окисления субстратов в
живых клетках, основная функция которых - энергетическое обеспечение
метаболизма. Биологическое окисление веществ в тканях организма, как и процесс
горения, сопряжено с освобождением энергии. Установлена взаимосвязь процесса
окисления с фосфорилированием АДФ: энергия, выделяющаяся при окислении
питательных веществ, не только рассеивается в виде тепла, но и накапливается в
молекулах АТФ.
При обмене веществ в организме человека протекают окислительно-
восстановительные реакции. Процесс окисления любого вещества связан с отдачей
электронов окисляемым веществом (донором электронов), а процесс
восстановления — с присоединением электронов к какому-то веществу (акцептору
электронов). В ходе этой реакции высокоэнергетические электроны молекулы
водорода переходят на низкоэнергетическую орбиту атома кислорода и теряют
часть энергии. В живых организмах в целях сохранения целостности клетки
выделение энергии происходит постепенно.
Процесс биологического окисления питательного вещества — субстрата (S) в
клетках организма протекает с участием специфических ферментов и переносчиков
водорода (А) согласно следующей схеме:
Конечным акцептором водорода в реакциях биологического окисления в клетках
организма человека могут быть органические вещества и кислород вдыхаемого
воздуха. Процессы биологического окисления питательных веществ в клетках,
протекаемые с участием кислорода воздуха, называются тканевым дыханием.
2
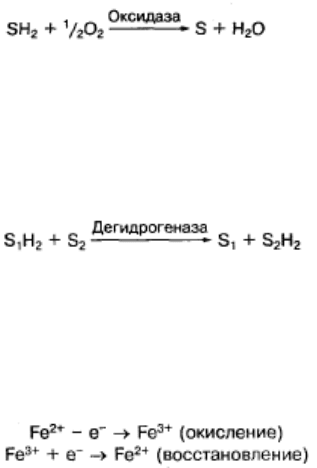
Выделяют аэробные и анаэробные реакции биологического окисления
веществ. Если акцептором водорода является кислород — это аэробный, или
дыхательный тип окисления. Протекает он с участием ферментов оксидаз:
Если акцептором водорода является не кислород, а какое-либо органическое
вещество, то такой тип окисления является анаэробным. В анаэробных реакциях
участвуют ферменты дегидрогеназы:
Кроме этих реакций в клетках протекают окислительно-восстановительные
реакции с изменением валентности атомов железа, как это имеет место при
передаче водорода на кислород в системе дыхательной цепи митохондрий:
Освобождаемая в реакциях биологического окисления энергия может
рассеиваться в виде тепла или улавливаться в процессе синтеза макроэргических
соединений. Поэтому выделяют свободное и сопряженное окисление.
Свободное окисление не взаимосвязано с переходом энергии биологического
окисления в энергию макроэргических соединений. Выделяющаяся энергия
рассеивается в виде тепла. Этот вид энергообразования в клетках важен для
теплорегуляции и детоксикации вредных продуктов обмена веществ. Наблюдается
он при отдельных видах мышечной деятельности и интенсивной разминки.
Сопряженное окисление связано с переходом свободной энергии,
выделяющейся в процессе биологического окисления, в доступную для
использования форму энергии — макроэргические связи АТФ или другие виды
энергии, например ионный градиент. Различают такие виды сопряженного
окисления, как субстратное фосфорилирование и окислительное
фосфорилирование.
Субстратное фосфорилирование — это синтез АТФ за счет переноса
высокоэнергетического ортофосфата (Н3Р04) от окисляемого субстрата на АДФ.
Такое фосфорилирование происходит в основном в мышцах при анаэробном
3
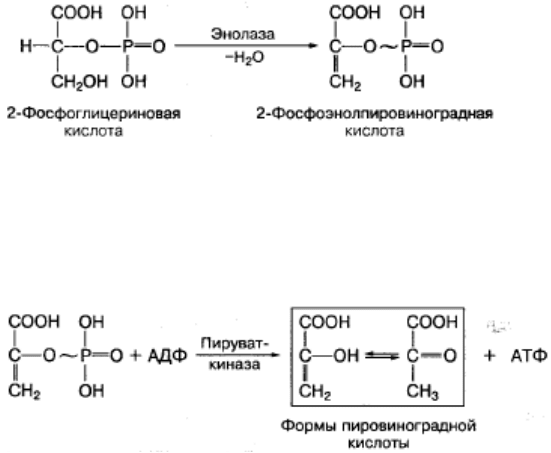
окислении глюкозы с участием высокоспецифических ферментов. Примером может
служить окисление 2-фосфоглицериновой кислоты в процессе превращения ее в
пировиноградную кислоту. Механизм образования АТФ в этой реакции связан с
внутримолекулярным окислением 2-фосфоглицериновой кислоты и превращением
ее в макроэргическое соединение — фосфоэнолпировиноградную кислоту:
Фосфоэнолпировиноградная кислота благодаря ферменту пируваткиназе
способна передавать высокоэнергетический фосфат на АДФ с образованием АТФ и
пировиноградной кислоты:
За счет реакций субстратного фосфорилирования образуется сравнительно
небольшое количество АТФ в клетке.
Окислительное фосфорилирование — это синтез АТФ за счет энергии,
которая выделяется при переносе электронов по дыхательной цепи от окисляемых
питательных веществ к атомарному кислороду. Окислительное фосфорилирование
является основным механизмом образования АТФ в аэробных условиях.
Субстратное фосфорилирование и окислительное фосфорилирование
характеризуются разной степенью сопряженности между реакциями,
протекающими с освобождением и накоплением энергии. При субстратном
фосфорилировании окисление тесно связано с образованием первичного
макроэргического соединения. При окислительном фосфорилировании окисление в
дыхательной цепи непосредственно не связано с синтезом АТФ и первоначально
используется для образования протонного потенциала, который в дальнейшем
приводит к синтезу АТФ. Энергия протонного потенциала может затрачиваться и на
4
другие виды работы, поэтому образование АТФ не является единственным и
обязательным следствием окисления.
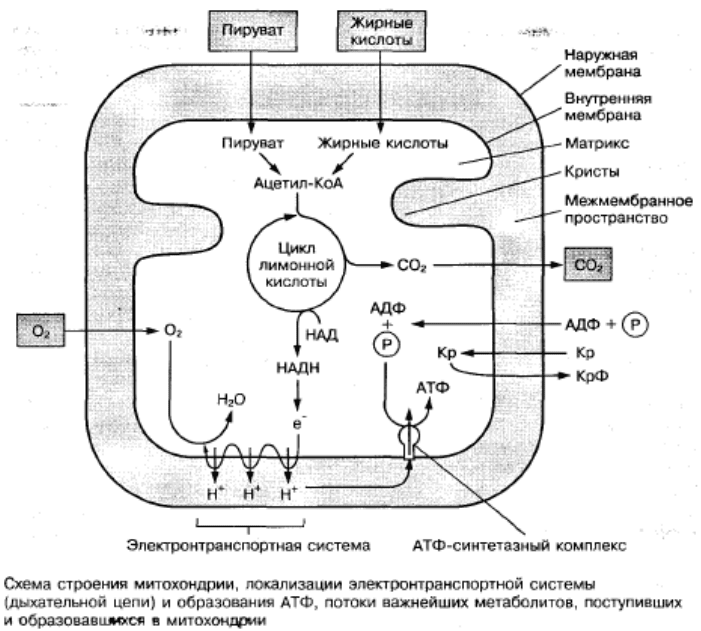
Митохондрии являются местом заключительного этапа окисления
питательных веществ и преобразования энергии в форму, доступную для
использования клеткой. В митохондриях образуется до 90% АТФ, необходимой для
жизнедеятельности организма. Такая специфическая функция этих органелл клетки
связана с особенностями их строения. Митохондрии имеют гладкую наружную и
складчатую внутреннюю мембраны, а также внутреннее содержимое, которое
называется матриксом. В матриксе находятся ферменты окисления пирувата и
жирных кислот, а также в высокой концентрации растворимые ферменты цикла
лимонной кислоты. Здесь же содержатся АДФ, кофермент (коэнзим)А, НАД
(никотинамидадениндинуклеотид, окисленный) и все вещества, обеспечивающие
митохондриальный синтез белка.
Наружная мембрана отделяет внутреннюю часть митохондрий от цитоплазмы
клетки. Она содержит различные белки, образующие широкие каналы, по которым
легко проникают молекулы веществ с молекулярной массой до 10 000 дальтон. В
5
ней находятся также ферменты, расщепляющие липиды и способствующие их
последующему перемещению в матрикс митохондрий.
Внутренняя мембрана митохондрий образует многочисленные складки,
выступающие внутрь матрикса, которые называются кристами. Кристы
увеличивают общую поверхность внутренней мембраны в несколько раз. Структура
крист создает возможность упорядоченного расположения на ней многочисленных
белков-ферментов. Во внутренней мембране находятся главные ферментные
комплексы, участвующие в передаче электронов на кислород (дыхательная цепь) и
обеспечивающие процесс окисления. На ее поверхности, обращенной в сторону
матрикса, находятся ферменты, осуществляющие синтез АТФ за счет энергии
процесса окисления (АТФ-синтетазный комплекс). Внутренняя мембрана
митохондрий регулирует перенос метаболитов в матрикс и выход из него таких
веществ, как АТФ, АДФ, отдельных аминокислот,жирных кислот, ионов Са и др.
Эта мембрана практически непроницаема даже для многих малых молекул, так как
на ней создается электрохимический градиент протонов водорода (Н+).
Узкое пространство между наружной и внутренней мембранами представляет
собой межмембранное пространство. В нем находятся ферменты, которые
катализируют перенос фосфата от АТФ на другие нуклеотиды и на свободные
молекулы креатина.
Митохондрии могут передвигаться в клетке и находиться в ней в том месте,
где в большей мере используется энергия АТФ. В работающих мышцах они
располагаются между миофибриллами и обеспечивают энергией процесс
сокращения. В клетках может находиться до 200 митохондрий в зависимости от
функциональной активности организма. Так, при тренировке с использованием
упражнений аэробной направленности количество митохондрий в скелетных
мышцах существенно увеличивается.
В матриксе митохондрий протекает цикл лимонной кислоты (или цикл
трикарбзновых кислот), который является центральным путем метаболизма
("котлом сгорания") углеводов, жиров и аминокислот, а также извлечения энергии
из окисляемых веществ. Он включает 8 основных реакций, в ходе которых
6
происходит постепенное окисление ацетил-КоА (активная форма уксусной
кислоты) до образования конечного продукта обмена СО2 с накоплением энергии в
виде трех молекул НАДН, двух молекул ФАДН2 и молекулы ГТФ
(гуанозинтрифосфат). Два атома углерода в молекуле ацетил-КоА (кофермент
(коэнзим) А) при полном обороте цикла превращаются в две молекулы СО2.
Таким образом, в цикле лимонной кислоты происходит окисление питательных
веществ и извлечение энергии в виде высокоэнергетического водорода его
переносчиками НАД (никотинамидадениндинуклеотид, окисленный) и ФАД
(флавинадениндинуклеотид, окисленный). Восстановленные переносчики (НАДН –
никотинамидадениндинуклеотид, восстановленный и ФАДН2 –
флавинадениндинуклеотид, восстановленный) доставляют водород к внутренним
мембранам митохондрий, где передают его на так называемую дыхательную цепь.
В этой цепи происходит передача электронов к молекулярному кислороду с
образованием молекулы Н2О и создается электрохимический градиент
концентрации Н+, за счет энергии которого происходит синтез АТФ в процессе
окислительного фосфорилирования.
7
Какие химические превращения происходят в процессе пищеварения
белков? Как осуществляется защита пищеварительной системы от
самопереваривания? Назовите конечные продукты пищеварения белков и
пути их дальнейших превращений в организме.
Белки пищи в ротовой полости не расщепляются, так как слюна не содержит
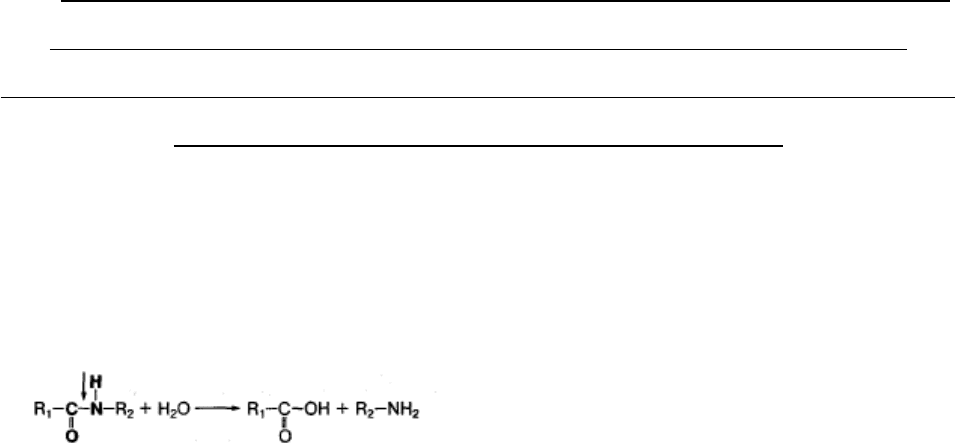
гидролитических ферментов. Химическое расщепление белков начинается в
желудке под воздействием протеолитических ферментов (пептидгидролаз), которые
расщепляют пептидные связи между аминокислотами:
Эти ферменты образуются клетками слизистой оболочки желудка, тонкого
кишечника и поджелудочной железы в неактивной форме. Такая форма ферментов
предотвращает самопереваривание белков в клетках, где они синтезируются, и
стенок желудочно-кишечного тракта.
В желудке переваривание белков происходит при участии фермента
желудочного сока пепсина, который образуется из неактивного пепсиногена под
воздействием соляной кислоты. Пепсин проявляет максимальную ферментативную
активность в сильно кислой среде при рН 1-2. Кроме того, под воздействием
соляной кислоты происходит набухание и частичная денатурация белков, что
приводит к увеличению поверхности соприкосновения фермента с белками. Все это
облегчает процесс расщепления белков в желудке. Пепсин расщепляет пептидные
связи белковых молекул, в результате чего образуются высокомолекулярные
пептиды и простетические группы.
В двенадцатиперстной кишке образовавшиеся пептиды подвергаются
дальнейшему расщеплению при участии ферментов сока поджелудочной железы и
кишечного сока - трипсина и химотрипсина. Поджелудочная железа вырабатывает
неактивный фермент трипсиноген, который под действием фермента слизистой
оболочки тонкого кишечника — энтерокиназы превращается в активный трипсин.
Трипсин воздействует на другой неактивныи фермент поджелудочного сока —
химотрипсиноген, превращая его в активный химотрипсин. Трипсин и химотрипсин
8
проявляют максимальную активность в слабощелочной среде при рН 7,8. Они
расщепляют белки (пептиды и полипептиды) на более простые соединения —
низкомолекулярные пептиды (олигопептиды) и некоторое количество свободных
аминокислот.
Окончательное расщепление низкомолекулярных пептидов до аминокислот
происходит в тонком кишечнике под действием высокоспецифических ферментов
аминопептидаз, карбоксипептидаз и дипептидаз. Превращение белков, как и
углеводов, происходит не только в полости кишки, но и на поверхности клеток
слизистой оболочки (контактное или пристеночное пищеварение). В полости кишки
расщепляются преимущественно белковые молекулы, а на поверхности клеток
(между микроворсинками) - относительно небольшие пептиды. Образовавшиеся
свободные аминокислоты и некоторые простые пептиды при помощи сложных
биохимических процессов всасываются в кровь и доставляются в печень и другие
ткани.
Белки, не расщепившиеся в тонком отделе кишечника, подвергаются
расщеплению в толстом кишечнике под воздействием пептидаз, которые
синтезируются находящейся здесь микрофлорой. Ферменты микрофлоры толстого
кишечника способны расщеплять многие аминокислоты пищи с образованием
различных токсичных веществ: фенола, крезола, индола, сероводорода,
меркаптанов и др. Такое превращение аминокислот в толстом кишечнике
называется гниением белков. Токсические вещества всасываются в кровь и
доставляются в печень, где подвергаются обезвреживанию. Весь процесс
переваривания белков в желудочно-кишечном тракте занимает в среднем 8-12 ч
после принятия пищи. Всасывание аминокислот в кишечнике может включать
разные механизмы их транспорта через стенку кишечника и капилляров: осмос,
диффузию и активный транспорт. Особая роль в процессе всасывания принадлежит
ворсинкам слизистой оболочки кишечника, в которых происходит АТФ-зависимый
транспорт аминокислот, сопряженный с транспортом ионов натрия (Na+) или
водорода (Н+).
9
Аминокислоты, образовавшиеся при расщеплении белков пищи и поступившие
в ткани, используются преимущественно для биосинтеза специфических для
организма белков. Ежедневно в организме образуется около 1,3 г белка на 1 кг
массы тела, что и определяет суточную норму его потребления. Белки в клетках
организма постоянно синтезируются, так как имеют ограниченное время жизни.
Так, период полураспада белков печени составляет примерно 9 дней, белков мышц
— 120 дней, а все белки организма обновляются приблизительно за 130—150 суток.
Процессы биосинтеза белков играют очень важную роль в процессах роста и
развития организма в восстановлении и адаптации при спортивной деятельности.
Аминокислоты, не использованные непосредственно для синтеза белка или
образовавшиеся при внутриклеточном распаде белков, подвергаются дальнейшим
превращениям.
Имеется несколько типов реакций превращения аминокислот, характерных для
внутриклеточного обмена. Это реакции дезаминирования, трансаминирования
(переаминирования) и декарбоксилирования.
Дезаминирование аминокислот связано с потерей NН2-группы и образованием
свободного аммиака и кетокислот. Реакции дезаминирования протекают при
участии ферментов дезаминаз или оксидаз. Кроме аммиака, при дезаминировании
аминокислот образуются окси- и кетокислоты. Различают несколько видов процесса
дезаминирования: восстановительное, гидролитическое, внутримолекулярное и
окислительное. У животных и человека преобладают два последних вида
дезаминирования.
Окислительное дезаминирование аминокислот интенсивно протекает при
увеличении потребления энергии в клетке, так как эта реакция сопровождается
извлечением энергии в виде высокоэнергетического Н2 в составе восстановленного
НАДН2 или ФАДН2. Наиболее активно окислительному дезаминированию
подвергается глутаминовая кислота, что связано с высокой активностью
глутаматдегидрогеназы, обнаруженной почти во всех тканях:
10
