Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов
Подождите немного. Документ загружается.


I
шва 2
Термодинамическое описание лот явления лается через вы-
ражение свободной поверхностной энергии Гиббса
С, - Лет,
2.1
1де А - величина поверхности, а — поверхностное- натяжение.
Любой проиесе, ведущий к уменьшении! свободной поверх-
ностной
энергии, является самопроизвольным. Для капли жидко-
сти ло уменьшение достилается сокращением величины поверх-
ности — она принимает сферическую форму. Дш
твердого
тела
-
жесткой системы — сокращение А невозможно. Для него G умень-
шается за
счет
поверхностного натяжения.
Атомы
или молекулы газа,
абсорбируясь на поверхности, компенсируют некоторую часть не-
уравновешенных cm и тем самым уменьшают поверхностное на-
тяжение.
Итак,
причина адсорбции --- ненасышенность поверхностных
атомов и молекул
твердого
тела
— особое состояние, в котором
находятся его частицы па поверхности по сравнению с их состоя-
нием
внутри объема фазы.
2.2. Тепловой
эффект
адсорбции
Чтобы выяснить
знак
теплового эффекта адсорбционных процес-
сов,
рассмотрим известное термодинамическое соотношение
\М=.\С+
T.\S.
(2.2)
Здесь \ff — изменение поверхностной энтальпии системы, \G —
изменение ее поверхностной свободной энергии, Л5 — изменение
поверхностной энтропии, 7 -- абсолютная температура.
JJ самопроизвольном процессе адсорбции G уменьшается. Эн-
фопия
при адсорбции также уменьшается, поскольку число степе-
ней
свободы у молекулы на поверхности уменьшается по сравне-
нию
с ее состоянием н газотюй фазе. Оно может сократился на
одну поступательную степень для нелокализованной адсорбции или
на
три — ,гля локализованной. Число вращательных степеней сво-
боды также может уменьшиться ;т,ш несферических молекул.
Поекшьку в правой части уравнения (2.2) оба члена при ад-
сорбции имеют отрицательное значение, следовательно, и измене-
ние
лггальпии также имеет
знак
минус, т.е. тепловой эффект
знак
плюс. Это шачит. что при адсорбции должна выделяться теплота.
Действительно, практически все адсорбционные процессы экю-
термичны. Исключения очень редки, они найдены лишь для не-
Hpupoda
аОсорбциинных
сил
Чипы
шкороции
19
скольких
случаев
хсмосорбции, для которой изменения энтропии
зависят не шлько от изменения характер;! движения молекул, но
и
от химическою виш моде ист вия с адсорбентом.
2.3. Адсорбционные силы. Физическая адсорбция
Взаимодействие
между
молекулами и атомами адсорбата и части-
цами
адсорбеша может быть физическим и химическим.
В первом
случае
между
ними
действуют
молекулярные ваи-дер-
ваальсовы силы. Это те же силы, которые вызывают конденсацию
паров в жидкость, отклонения реальных газов от законов идеаль-
ных газов. Они
могут
быть
трех
видов.
В основном это дисперсионные силы. Иногда их называют так-
же электрокинстическими или лондоновскими силами но имени уче-
ною,
их открывшего. Они вызываются согласованным (синхронным)
изменением электронной плотности сближающихся молекул. В мо-
лекулах
газовой фазы, разделенных большими расстояниями, элек-
троны к;1ждой молекулы л питаются независимо, образуя диполи. При
сближении молекул изменение плотности электронного облака пе-
рестает быть независимым, поскольку мгновенный диполь одной
молекулы индупирует дипольный момент в соседней, что приводит
к
ныигрыпгу энергии. Действительно, квантово-химические расчеты
покашвакл,
что энергия системы с согласованным изменением
>лек
тронной плотности меньше, чем ;тдя системы с независимо
двигающимися электронами. Величина этого выитрыша энергии при
конденсации
пара представляет собой
теплоту
конденсации. При
приближении молекулы к поверхности
твердою
тела
в
результате
ыаимодействия ее мгновенного диполя с мгновенными диполями
частиц
твердою
тела
также во .шикают дисперсионные силы и выиг-
рываемая энергия
дает
основной вклад в тепловой
э(}х})ект
атсорб-
пии,
который близок по порядку величины к теплоте конденса-
ции,
но, в обшем
случае,
не равен ей: движение электронов согла-
суется ;иш разных по природе атомов или молекул. В большинстве
случаев
теплота алсорбции несколько больше теплоты конденсации.
Так,
теплота конденсации парообрашого азота равна 5.9 кДж/моль
i
1.4 KKai/моль). теплота ваи-дер-ваальсоьой адсорбции азота на
л;слас
составляет 8,5- 12.5 кДж/моль (2—3 ккал/моль).
Кроме дисперсиотитого, может проявляйся и
другого
вида
шаимодейетвие. а именно ориентациопное, а соответствующие ван-
лер-ваальсовы силы называются ориенчационными. Оно возника-
ет, котла по.тярные малскулы, имеющие постоянный диполь, па-
пример,
молекулы воды, аммиак;!, спиртом абсорбируются па по-

20
I
Глава
2
верхности
с
постоянными электростатическими зарядами,
т.е. по-
верхности, имеющей ионы
или
диполи, например,
для
ионных
кристаллов NaCl,
NaJ, KC1, Mgo,
BaSO
4
или для
гидроксилиро-
ванной
поверхности силикагелей (дипольные моменты гидроксиль-
ных групп). Свое название
эти
силы получили потому,
что в
пере-
численных
случаях
происходит ориентация дипольных молекул
адсорбата
в
соответствии
с
расположением
и
знаком электричес-
ких зарядов
на
поверхности адсорбента. При такой ориентации также
выигрывается энергия, которая является вкладом
в
общий тепло-
вой эффект ван-дер-ваальсовой адсорбции.
Наконец,
третий
вид
называют индукционным взаимодействи-
ем,
а
соответствующие силы
—
индукционными.
Оно
обусловлено
наведением (индукцией)
в
адсорбированных молекулах дипольных
моментов
под
влиянием зарядов поверхности
или
индукцией
ди-
польных моментов
в
частицах адсорбента
под
влиянием адсорби-
рующихся диполей.
Все
эти три
вида взаимодействия приводят
к
ван-дер-ваальсо-
вой адсорбции. Вклад
их
различен,
он
зависит
от
природы адсор-
бата
и
адсорбента. Можно сказать только,
что
дисперсионное
взаимодействие
присутствует
во
всех
случаях
ван-дер-ваальсовой
ад-
сорбции
и оно, как
правило, вносит наибольший вклад
в
выиг-
рыш энергии. Ясно,
что
ориентационное
и
индукционное взаимо-
действия возможны только
при
наличии электрического заряда хотя
бы
у
одного
из
партнеров взаимодействующих систем.
2.3.1. Потенциальная энергия взаимодействия
при
физической адсорбции
Как
известно, потенциальная энергия дисперсионного взаимодей-
ствия
двух
изолированных атомов, разделенных расстоянием
г,
скла-
дывается
из
энергии притяжения
U
d
(r) и
энергии отталкивания
U
r
(r),
возникающей из-за перекрывания электронных оболочек
близко расположенных атомов. Приближенно
эта
энергия (потен-
циал Леннард-Джонса) дается выражением
[1]
U
r
=U
d
(r) + U
r
(r) =
-C-r-*
+
Br-
i2
, (2.3)
где константа С зависит
от
поляризуемости
и
магнитной восприимчи-
вости атомов,
В —
эмпирическая константа.
Если потенциальную энергию
U
r
двух
атомов, разделенных
бесконечным расстоянием
г,
принять нулевой,
то
изменение обоих
членов уравнения
(2.3)
можно выразить кривыми
7, 2
(рис. 2.2),
а
суммарное выражение
—
кривой
3.
Таким образом, потенциальная
Природа
адсорбционных
сил.
Типы
адсорбции
21
Рис.
2.2.
Изменение
потенциальной
энергии
дис-
персионного
взаимодействия
U, двух
изолиро-
ванных
атомов
в
зависимости
от
расстояния
г
между
их
центрами.
Потенциальные
энергии:
притяжения
(/),
отталкива-
ния
(2),
суммарная
(3).
энергия
дисперсионного взаимодействия
(от-
рицательные ординаты
на
рисунке)
с
умень-
шением расстояния
между
атомами сначала
будет
падать,
а
затем возрастать. Минимум
кривой
соответствует
состоянию равновесия,
когда молекула находится
на дне так
назы-
ваемой потенциальной
ямы.
В общем
случае
необходимо
учесть
так-
же потенциальную энергию ориентационно-
го взаимодействия постоянных диполей
U\i = —F\i- cos 8,
(2.4)
где
ц —
дипольный момент,
F —
сила электрического поля,
6 —
угол
между
осями диполя
и
направлением поля,
а
также потенци-
альную энергию индукционного взаимодействия
U
a
=-F
2
a/2,
(2.5)
где
а —
поляризуемость.
При
физической адсорбции изменение потенциальной энергии
молекулы, приближающейся
к
поверхности твердого тела, описы-
вается кривой, подобной той, которая изображена
на
рис.
2.2.
Только
в
этом
случае
необходимо просуммировать потенциальные энергии
взаимодействия каждого атома, входящего
в
молекулу,
с
каждым
атомом твердого тела. Поскольку,
как это
видно
из
уравнения (2.3),
потенциальная энергия очень быстро падает
с
расстоянием, обыч-
но
ограничиваются суммированием взаимодействий
100—200
бли-
жайших
пар, а для
остальных, если нужно, выполняют интегриро-
вание
[3].
Правда,
и
такие расчеты возможны лишь
для
простых
сис-
тем типа
газ —
идеальная кристаллическая решетка. Более того, полу-
чаемые результаты являются весьма приближенными из-за многих
допущений.
Тем не
менее они
дают
общее представление
о
характе-
ре взаимодействия молекулы, приближающейся
к
поверхности.
При
этом глубину потенциальной
ямы
кривой взаимодействия обычно
называют адсорбционным потенциалом. Соотношение адсорбцион-
ного потенциала
и
теплоты адсорбции хорошо видно
из
графика,
который читатель может найти
в
монографии
[2].

Iлина
2.3.2.
Особенности физической адсорбции
Важно отмстить следующие особенности физической адсорбции,
вытекающие из природы описанных явлений. Во-первых, это сла-
бый вид взаимодействий. Поскольку он вызван не электронны-
ми
переходами, а лишь изменением характера движения электро-
нов
у прежних хозяев — частиц адсорбента и алсорбата, выигрыш
энергии
невелик. Адсорбированные частицы при этом сохраняют
свою молекулярную природу, т.е. они в химическом смысле
неиз-
менны.
Поэтому возникающее взаимодействие часто называют мо-
лекулярным.
Во-вторых, выигрыш энерши, т.е. теплота адсорбции, количест-
венно
зависит от химической природы взаимодействующих частиц
как
из-за изменения соотношения вкладов различных взаимодейст-
вий,
так и из-за того, что каждый вид взаимодействия зависит от
.Ачектрониых орбиталей партнеров и величины дшкхтьньгх моментов.
В-третьих,
поскольку электроны остаются у своих хозяев, воз-
можен коллективный характер указанных взаимодействий, т.е. мо-
лекула адсорбата, нейтральная или заряженная, может взаимо-
действовать не тол],ко с ближайшей частицей абсорбента, нейт-
ральной или заряженной, по и с другими его часгипами, в
прин-
ципе,
со всеми частицами твердого тела (рис. 2.3, а). Конечно, это
взаимодействие очень быстро убывает с расстоянием и основной
вклад вносит взаимодействие ближайших частиц, тем пс менее, в
той itш иной мере все частицы принимают в нем участие.
В-четвертых,
укачанный вид взаимодействии возможен не только
между
частицами атсорбата и адсорбента, ной
между
самими частицами
адеорбата (рис. 2.3, б). Это означает, с о;шой стороны, возможность
образования второго и последующих адсорбированных слоев (вср-
тикальные взаимодействия), с другой — возможность взаимодействия
а б
Рис 2.3.
Вшимодейгпше
адсорбированной
молекулы
со
MHOI ИМИ
час-
тицами "тердого тела (а) и адсорбированных молекул л руг с дру-
гом (й).
Природа
адсорбционных
сил Типы
шкпрбции
23
молекул
iipyi
с
другом
в пределах каждого адсорбированного слоя
(юризонтадьные взаимодействия). Это важное следствие
будет
рассмотрено в исследующих
г;1авах.
2.4. Адсорбционные силы. Химическая адсорбиия
Поверхность твердого те;ш может быть нсиасыщена также и в хими-
ческом отношении, т.е. атомы и молекулы поверхности
могут
быть
способны к химическому взаимодействию с газовой фазой. Пред-
ставим себе, что твердое тело, частицы которого связаны хими-
ческими связями, расколото тем или иным образом на части. При
гаком раскалывании рвутся химические связи. Поэтому свежеобразо-
вапная
поверхность химически ненасышена, она готова к химичес-
кому взаимодействию с газовой фазой. Предположим, что раска-
лывание произведено в воздушной среде. Тогда свежеобразованная
поверхность тотчас вступит во взаимодействие с компонентами
воздуха,
например, с кислородом. Ее химический "голод"
будет
утолен. Так, поверхности многих металлов при комнатной темпе-
ратуре
ИМСКУТ
хемосорбированный кислород. Если тем или иным
способом удалить кислород, поверхность снова станет способна к
химическому взаимодействию. Наиба ice распространенный способ —
восстановление водородом, а затем удаление хсмосорбированного
водорода при нагревании в вакууме.
В зависимости от условий ;гго взаимодействие может иметь
различный характер. Если условия подходящи, происходит настоя-
щая
гетерогенная реакция
между
твердым телом и газом. При этом
образуется новое химическое соединение, прочность связей в ко-
тором больше, чем прочность связей в твердом теле. Поэтому свя-
зи
поверхностных атомов и молекул
могут
рваться, в реакцию
всту-
пают все новые и новые слои твердого тела, т.е. реакция идет в
глубь
твердого тела. В результате такой реакции образуется новая
газообразная или твердая фаза. В первом
случае
практически нет
офаничений
и при достаточном времени все твердое тело может
быть превращено в новую фазу. Во втором
случае
новая твердая
фаза может быть аморфной или представлять кристаллическую ре-
шетку с иными параметрами, чем исходное вещество. Дальнейшее
протекание реакции зависит от условий диффузии молекул таза
чере) слой новой фазы к фронту реакции или атомов твердого тела
к
поверхности раздела га) — твердое тело. Если диффузия затруд-
нена,
реакция быстро приостанавливается (например, тонкие ок-
сидные пленки алюминия); если транспорт вещества может про-
должа|ься, образуются очень толстые слои новой фазы (например,

Гтва
2
оксиды
железа толщиной в согни нанометров). Случай гетегхисн-
ной
химической реакции в дальнейшем мы не
будем
рассматри-
вать, это отдельная область науки, называемая топохимией.
Имеется,
однако, и другая возможность: связи в твердом теле
MOIVT
оставаться неразорванными и только ею поверхностные ча-
сишы.
в силу указанных выше причин,
могут
вступать в химичес-
кое
юаимодействие с [азовой фазой. Некоторой аналогией
могут
служить непредельные оркшические соединения, которые способ-
ны
вступать в химическое взаимодействие без разрыва остающихся
связей,
При таком взаимодействии
raja
с твердым телом новой фазы
не
образуется, на поверхности имеется лишь один слой химически
связанных
атомов или молекул. Это явление получило название
.химической адсорбции. Часто оно называется также хсмосорбпией.
Эют термин неточен, поскольку, как это
ВИДНО
ИЗ первой главы,
он
допускает химическое взаимодействие газовой фазы не только
с
поверхностью твердого тела, но также и с сю объемом. Тем не
менее,
мы
будем
использовать сю из-за широкой распространен-
ности,
по-видимому, в силу его краткости.
Итак,
при химической адсорбции образуется химическая связь
между
адсорбированными атомами или молекулами и частицами
твердого тела. В отличие от физической адсорбции, когда электро-
ны
атомов или молекул адсорбата и адсорбента остаются у своих
"хозяев" и лишь меняется характер их движения, химическая связь
при
хемосорбции возникает в результате обмена электронов
между
адсорбированными атомами и молекулами и поверхностью твердо-
го тела. Как и при химической реакции, имеются два основных тина
этой
смязи: ковалентпая, образующаяся при обобществлении элек-
троном
и передаче их в совместное обладание связываемыми час-
тинами,
и
ионная,
образующаяся при передаче электронов от ад-
сорбата к адсорбенту или наоборот. В чипом виде оба типа енязи
практически
не встречаются и более распространена промежуточ-
ная
полярная связь, при которой электронная пара, связывающая
атомы, принадлежит обеим частицам не в одинаковой степени, а
находится большую часть времени у одной из них.
Пример
существования
ipex
типов взаимодействия представ-
ляет система
углерод
- кислород [4|. Если опыт ведется при - 196 °С,
происходит только физическая адсорбция кислорода на
угле
или
саже. В интервале от —196 до 200
*"(_'.
кроме физической адсорбции
кислорода, наблюдается также ею химическая адсорбция. Дока-
зательством натичия хемосорбции является го обстоятельство, чго
при
снижении давления вплоть до нулевого не весь адсорбирован-
ным
кислород выделяется в газовую
среду,
т.е. десорбируетен, чаеп>
Природа
адсорбционных
сил. Типы
адсорбции
25
сю остается в прочно связанном хемоеорбированном слое и толь-
ко
при повышении температуры его удается полностью удалить с
адсорбента. Соотношение физической и химической адсорбции при
росте температуры опыта изменяется в сторону уменьшения доли
физической
адсорбции.
Наконец,
при температуре выше 200 °С про-
исходит топохимическая реакция с образованием углекислого газа
и
значительным обгаром угля, связанным с расходом его на реак-
цию.
Из этого примера можно видеть, во-первых, что химическую
адсорбцию и топохимическую реакцию можно четко различить тем,
что продуктом десорбции в первом
случае
является то же веще-
ство, которое хемосорбировалось, во втором
случае
образуется новое
химическое вещество. Во-вторых, тип взаимодействия {химическая
адсорбция или топохимическая реакция) зависит не только от
природы системы, по и or температуры. При повышенных темпе-
ратурах
увеличивается вероятность разрыва связей в твердом теле и
вероятность преодоления активационного барьера реакции.
2.5. Критерии физической и химической адсорбции
Хотя теоретическое разграничение
двух
видов адсорбции совершенно
ясно,
их экспериментальная диагностика часто бывает затрудни-
тельна. Ниже мы рассмотрим опытные критерии физической и
химической адсорбции.
Специфичность.
Поскольку хемосорбцию можно рассматривать
как
поверхностную химическую реакцию,
следует
ожидать, что она
будет
резко специфичной, т.е. химическое взаимодействие данного
адсорбата может быть совершенно различным на разных адсорбен-
тах (требующих, например, различных условий — температуры и
да клен ия) вплоть до того, что это взаимодействие для определен-
ных систем может не наблюдаться. В большинстве случаев это дейст-
вительно так. Например, водород хорошо хсмосорбирустся на пере-
ходных металлах, но совсем не сорбируется на серебре; переход от
поверхностного взаимодействия кислорода с ними к объемному
внедрению и образованию оксидов сильно зависит от температуры
и
природы металла. Если на платине и палладии кислород при
комнатной
температуре образует только хемосорбированный слой,
то па никеле и железе происходит также его внедрение в припо-
верхностные слои метаада с суммарным количеством поглощен-
ного кислорода до 1.7 и 3.7 монослоя соответственно [5]. С другой
стороны,
физическая адсорбция, как правило, мало специфична. В
IT
7
будут
приведены примеры, свидетельствующие о близких ад-

26
Г. шва
сорбционных свойствах по
азоту,
аргону и криптону для многих
весьма распространенных адсорбентов, таких как кремнеземы, ок-
сиды алюминия и титана, металлические порошки, углеродные
адсорбенты. Есть, праатд, случаи, в которых специфичность выра-
жена довольно сильно. Так, адсорбция указанных газов на органи-
ческих полимерах |6| значительно меньше. При специальном хими-
ческом модифицировании поверхности, например, при замене гид-
роке ильных групп поверхности кремнеземов на органические ра-
дикалы или фтор адсорбция паров воды, метанола и бензола сни-
жалась в нсско;п>ко раз [7].
Тепловой
эффект.
Теплоты химической адсорбции близки к
те плотам химических реакций, а физической — к теплотам кон-
денсации, т.е. различие тех и
других
состаатяст примерно один
порядок
величин. Численные значения теплот хсмосорбиии обыч-
но
составляют
80—400
кДж/моль, теплот физической адсорбции —
10 -50 кДж/моль. Однако,
хотя
высокие теплоты
всегда
свидетель-
ствуют
о химической адсорбции, низкие теплоты не указывают
однозначно на наличие физической адсорбции. Известны случаи,
когда химическая адсорбция происходит с небольшим выделением
теплоты. Так, при хемосорбции водорода на оксиде хрома [8] ми-
нимальная
теплота составляла всего 13 кДж/моль.
Температура. Д;ш каждой системы можно выделить две темпера-
турные области, в каждой из которых происходит преимуществен-
но
один из указанных видов адсорбции. Обычно химическая адсорб-
ция
происходит при более высоких
температурах.
Однако нередко
оба вила адсорбции
идут
одинаково хорошо в одной температур-
ной
области. Это, главным образом, случаи низкотемпературной
хемосорбпии. сопровождающейся сильной физической адсорбци-
ей (например, адсорбция оксида
углерода
на железе) [10].
Скорость.
Физическая адсорбция, как и конденсация пара, не
требует
энергии активации, поэтому на открытой поверхности она
идет практически мгновенно, а точнее, с той скоростью, с какой
молекулы адсорбтива достшают поверхности. Скорость химической
адсорбции часто зависит от температуры, что дало повод Гэйло-
ру назвать ее активированной адсорбцией. С
другой
стороны, фи-
зическая адсорбция можс! лимитироваться медленной скоростью
транспорта вещества к поверхности топких пор и эксперименталь-
но
это
будет
восприниматься как замененная адсорбция; одна
ко
многие хемосорбшюнпые процессы практически не
требуют
энергии
активации и
идут
очень быстро лаже при низких темпера-
турах
(хемосорбция кислорода и оксида
уыерода
на переходных
Meiauax).
Природа
адсорбционных
сил. !'ипы
адсорбции
27
Обратимость. Физическая адсорбция почти
всегда
обратима в
ел ношении изменения давления и температуры; химическая адсорб-
ция
очень часто необратима. Однако нежесткость
структуры
некото-
рых адсорбентов приводит к
тому,
что прямой и обратный адсорб-
ционные
процессы при физической адсорбции
могут
не совпадать.
С
другой
стороны, нередки случаи обратимой химической адсорб-
ции-
Так. на переходных мета;шах часть хемоеорбированного во-
юрода связывается необратимо,
другая
часть -- обратимо.
Число
адсорбированных
слоев.
В силу природы адсорбционных
сил.
как говорилось, химическая адсорбция мономолекулярна,
физическая
— полимолекулярна. Но, во-первых, в тонкопористых
адсорбентах число физически адсорбированных слоев (вплоть до
одного слоя) может сильно ограничиваться размером пор. Во-вто-
рых, химическая адсорбция часю сопровождается экспериментально
Фудно отличимыми процессами растворения газа в объеме твер-
дого
тела
in
и
процессами внедрения атомов адсорбата в поверх-
постные слои адсорбента, к пределе переходящими в топохими-
ческое взаимодействие с образованием новой объемной фазы; в
результате
может поыощагься большое количество адсорбтива.
значительно превышающее емкость монослоя.
Таким
образом, каждый из перечисленных признаков в
отде;1Ъ-
ности не может однозначно указывать на тип адсорбционного вза-
имодействия. Все они вместе шитые, однако,
дают
возможность
практически безошибочно определить тип экспериментально наб.лю-
даемой адсорбции.
2.6. Количественное выражение величины адсорбции
Во многих работах очень часто адсорбцию выражают в миллилит-
рах пи а при стандартных (нормальных) условиях*. Этот способ не
очень удобен, поскольку он
требует
пересчета для перехода от
экспериментальных к нормальным условиям. Кроме того, последу-
ющая интерпретация адсорбции, почти нее]да связанная с ее моле-
кулярной или атомарной природой,
требует
пересчета на количе-
ство адсорбированных молекул. Поэтому логичнее величшгу адсорб-
ции
сразу выражать в молях (обозначение моль, mol) адсорбата,
как
это делается в подавляющем большинстве отечественных работ.
Очень часто используют до.ш этой единимы: тысячные — милли-
мили (ммоль, mrnol) или миллионные — микромоли (мкмоль,
* Обож;пию1 ml STP 11.Ш мл НТД ( тандартнычи Iнормальными) услоиин
ми
принято с'пгпгь О "С и I атм

28
Глава
2
цпю1).
Переход от одной системы единиц к
другой
делается на ос-
нове известных соотношений:
] мать занимает объем 22,4 л НТД,
1
ммоль занимает объем 22,4 мл НТД.
Адсорбированное количество относят обычно к 1 i адсорбента.
Такое выражение сложилось исторически, еще в те времена, ко(да
не
было способов измерения величины поверхности. Надо сказать,
что оно не позва-тяет видеть действительные причины различий в
величинах адсорбции — химические (природа поверхности) или
1сомстрическис (ве;шчина поверхности). Действительно, величина
адсорбции
яатяетсн
функцией обоих факторов и целесообразно один
из
них принимать постоянным, а варьировать
другой.
Поэтому Ки-
селев [11] предложил адсорбцию выражать в молях на 1 м' поверх-
ности
и назвал получаемые значения абсолютными величинами ад-
сорбции.
В
литературе
иногда их называют также удельной адсорб-
цией.
Эти
величины сразу
дают
предстаачение о зависимости ад-
сорбции
от химической природы поверхности.
2.7. Адсорбция как
функция
двух
переменных.
Изотермы,
изобары и изостеры адсорбции
Для данной системы адсорбат — адсорбент при установившемся
ран-новесии
адсорбированное количество а начнется функцией
двух
переменных - равновесного давления Р и температуры Т:
а=ДР,Т).
(2.6)
При
изучении адсорбции одну m этих
трех
величин по;цержи-
15лют
постоянной и
исследуют
функциональную зависимость
двух
других.
Изотермой
адсорбции называется зависимость величины адсорб-
ции
от давления при постоянной температуре
a^f(P); Г = coast. (2,7)
Мате магическую форму этой зависимости мы
будем
подробно рас-
сматривать далее. При (графическом изображении по оси абсциа' откла-
дывают
давление, по оси ординат — величину адсорбции (рис. 2.4).
Давление раньше выражали чаше всего в мм ртутного столба (тор-
рах), теперь, с введением международной системы СИ, в паскалях
(I
торр =
13.^,3
Па). Очень часто для физической адсорбции давле-
ние
вы раж a
KIT
в относительных единицах как
долю
OJ даатепия на-
Природа
адсорбционных
cu.i. Типы
адсорбции
29
Рис. 2.4. Семейство изотерм адсорб-
ции.
Рис. 2.5. Семейство изобар адсорб-
ции.
сыщенного
пара адсорбтива Р
о
. Оно называется относительным
давлением и обозначается Р/Р$. Для данной системы адсорбат -
адсорбент
можно
построить семейство изотерм, каждая из которых
отвечает
своей температуре. Чем больше температура, тем мень-
ше величина адсорбции (см. рис. 2.4). Это
отвечает
принципу Лс-
Шателье. Как было сказано, физическая адсорбция —
всегда
экзо-
термический процесс, десорбция — эндотермический. Повышение
температуры можно осуществить только подводя к системе
теплоту.
Такое воздействие вызовет усиление того из направлений процес-
са, которое сопровождается поглощением теплоты, т.е. десорбцию.
В
результате,
равновесие сместится при повышении температуры в
сторону меньших величин адсорбции. Это ослабит влияние внеш-
него воздействия.
Зависимость
адсорбции от давления - наиболее распространен-
ный
способ количественною описания адсорбционных явлений, по-
скольку он наиболее просто осуществляется экспериментально: ампу.ш
с
адсорбентом помешается в термостат, а давление в системе очень
просто изменять, последовательно прибавляя или убавляя порции газа.
Рели
поддерживакуг постоянное давление, а изменяют темпера-
гуру,
то
получают
изобару адсорбции
а
=ф(7);
Р = const. (2.8)
По
оси абсцисс шкладывают
температуру
в
градусах
Цельсия
или
Кельвина, по оси ординат — величину адсорбции. Для разных
давлений можно посгроить семейство изобар (рис. 2.5). Чем больше
кипение,
тем больше, естественно, величина адсорбции. Из семей-

30
Глава
2
ства изотерм легко построить семейство изобар. Доя этого нужно
семейство изотерм рассекать вертикальными прямыми, соответст-
вующими постоянному давлению. Обратное построение — из изо-
бар изотермы — получают рассеканием семейства изобар.
Как
видно из рис. 2.5, величина адсорбции сильно зависит от
температуры, резко уменьшаясь с ее возрастанием.
На
рис. 2.6 приведена изобара адсорбции водорода на никеле в
широком
интервале температур. Крутая нисходящая кривая при
низких
температурах отражает быстрое уменьшение физической
адсорбции водорода с возрастанием температуры.
В области высоких температур физическая адсорбция водоро-
да пренебрежимо мала, однако химическая его адсорбция значи-
тельна; она также уменьшается с увеличением температуры. В про-
межуточной области адсорбция возрастает с температурой, что при
экзотермическом эффекте несовместимо с принципом Ле-Шателье.
Ът может указывать только на то, что измеряемые в этой облас-
ти величины неравновесны. При малых температурах только малая
часть молекул может преодолеть активационный барьер и хими-
чески связаться с поверхностью никеля, т.е. хемосорбировать-
ся.
При возрастании температуры их число возрастает и соответ-
ственно возрастает величина хемосорбции. Только при достаточ-
но
высоких температурах оно начинает убывать в соответствии с
тем, что в этой области главным фактором становится не доля
преодолевающих активационный барьер молекул, а среднее время
жизни
молекул на поверхности, которое тем меньше, чем выше
температура.
V, мл НТД/г р
8-
6-
4-
2-
-200
-100
0
100 /°С
Рис. 2.6. Изобара адсорбции водоро-
да на никеле при давлении 26,5 кПа
(260торр) [9].
Рис. 2.7. Семейство иэостер адсорб-
ции.
Природа
адсорбционных
сил, Типы
адсорбции
31
Наконец,
для поддержания постоянства количества адсорби-
рованного вещества необходимо давление изменять симбатно темпе-
ратуре. Зависимость давления от температуры при этом условии на-
зывают изостерой адсорбции:
a=const;
Р =
\|/(Г).
(2.9)
Семейство изостер адсорбции изображено на рис. 2.7. Как и в
двух
предыдуших случаях оно может быть получено из семейства
изобар или семейства изотерм, только рассечение должно быть сде-
лано
горизонтальной прямой. Обратное получение изотерм и изо-
бар из семейства изостер может быть сделано его сечением вер-
тикальной
или горизонтальной прямой соответственно.
Изостеры
напоминают кривые зависимости упругости насыщен-
ного пара от температуры. Формально их можно интерпретировать
как
зависимость упругости пара адсорбтива над адсорбированным
веществом от температуры. Это
сходство
не только формальное. Как
будет
видно при рассмотрении теплот адсорбции (гл. 3), оно явля-
ется более глубоким.
СПИСОК
ЛИТЕРАТУРЫ
1. Leiomrd-Jones J.E. // Physica (Eindhoven). —
1937.—Vol.4.
— P. 941.
2. Дженкок М., Парфнт Дж. Химия поверхностей раздела фаз. — М: Мир, 1984. —
269 с.
3.
Авгуль
Н.Н., Киселев А.В., Пошкус Д.П. Адсорбция газов и паров на однород-
ных поверхностях. — М.: Химия, 1975. — 384 с.
4. Дубинин М.М. // Поверхностные химические соединения и их роль в явлениях
адсорбции. — М.: Изд-во МГУ, 1957. — С. 9.
5. Карнаухов А.П. // Нанесенные металлические катализаторы превращения
угле-
водородов. — Новосибирск: Институт катализа, 1978. — Ч. 1. — С. 136.
6. Буянов» Н.Ё., Заграфская Р.В., Карнаухов А.П., Шепелнна А-С. // Кинетика и
катализ.
- 1983. - Т. 24. - С. 1187.
7 Нсймарк И.Е. // Адсорбция и пористость. — М.: Наука, 1976. — С. 27.
8. ВсеЬс RjV. // J.
Amer.
Chem. Soc. - 1938.
-Vol.60.-
P. 2912.
9. BentonA.F.,WhUeT.A.//J.Amer. Chem. Soc. - 1930.
-Vol.52.-
P. 2325.
10. Erametl P.H., Bmraner S. // J.
Amer.
Chem. Sec. - 1937. - Vol. 59. - P. 310, 1553.
11.
Киселев А.В. // Методы исследования структуры высокодисперсных и пористых
тел. - М.: Изд-во АН
СССР.
1953. - С. 86.
СПИСОК
ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
Прунауэр С. Адсорбция газов и паров. — М.. ИЛ., 1948. — Гл. I, 2.
Боресков
Г.К. Гетерогенный катализ. — М.: Наука, 1986. — Гл.4.
Киселев
А.В. Поверхностные япления. Адсорбция // Курс физической химии. Ред.
Я И. Герасимов. - М.: Химия, 1969. - Т. 1- - Гл. 16.
Грет С, Синг К. Адсорбция, удельная поверхность, пористость. — М.: Мир, 1984, —
Гл. 1.
Киреев
В.А. Курс физической химии, — М.: Госхимиздат, 1955. — Гл. 2.

Глава
3
ЭКСПЕРИМЕНТАЛЬНЫЕ
МЕТОДЫ
ИЗМЕРЕНИЯ
ВЕЛИЧИН АДСОРБЦИИ
И
ТЕПЛОТ АДСОРБЦИИ
3.1. Введение
Измерение
величины адсорбции обычно осуществляется либо ста-
тическими,
либо динамическими методами.
При
использовании статических методов сорбент помещают в
замкнутую систему и измеряют либо убыль адсорбтива Дл из газо-
вой
(или жидкой) фазы, либо его прибыль Дт на адсорбенте
(рис.
3.1, а). Величина адсорбции
а=
Дл= Am.
В динамических методах адсорбент находится в колонке, вклю-
ченной
в проточную систему. Через нее проходит газ-носитель, не
адсорбирующийся на адсорбенте и содержащий адсорбтив. Изме-
ряют изменение концентрации адсорбтива в газе-носителе, проис-
ходящее в результате адсорбции или десорбции (рис. 3.1, 6).
В настоящей главе принят следующий порядок изложения. Вна-
чале рассмотрены простейшие принципиальные схемы каждого из
методов для лучшего понимания основного принципа измерений.
Затем приведены детальные схемы действующих адсорбционных
установок и их подробное описание, которое может быть исполь-
зовано
для монтажа этих установок в лабораториях. При этом ука-
заны
усовершенствования, которые
п
позволили повысить точность изме-
рений
адсорбции и сделать работу
на
них более удобной. Хотя в пос-
леднее время западными фирмами
(Карло
Эрба в Италии, Майкро-
меритикс
Инструмент в США и ряд
других)
разработаны высокопроиз-
Рис. 3.1. Принципиальная схема изме-
рения
адсорбции.
Статический (а) и динамический (б) методы.
/ — колонка с адсорбентом; 2 — приборы
для измерения концентрации на
входе
и
выходе.
Экспериментальные
методы
измерения
величин
адсорбции
и
теплот
адсорбции
33
водительные автоматические адсорбционные установки, работаю-
щие
по заданной программе в отсутствие оператора, а также делаю-
щие
все необходимые вычисления величин адсорбции и парамет-
ров текстуры адсорбентов, эти установки пока еще очень дороги и
практически
недоступны не только для заводских лабораторий, но
и
для многих научно-исследовательских институтов. Поэтому в ус-
ловиях быстро возрастающей потребности в адсорбционных изме-
рениях,
вероятно, еще не один десяток лет адсорбционные
уста-
новки
будут
монтироваться собственными силами и их подробное
описание,
приводимое ниже, может быть полезным.
3.2.
Статические
методы
изучения
адсорбции
Измерение
адсорбции в этих методах осуществляется обычно в
вакуумных установках, изготовленных из стекла или металла. Ад-
сорбент предварительно откачивается при нагреве для удаления с
поверхности загрязнений или адсорбцированных на
воздухе
веществ.
Эта операция называется вакуумной тренировкой.
3.2.1. Объемный метод
Принципиальная
схема объемной установки, изготавливаемой обыч-
но
из стекла, показана на рис. 3.2. Адсорбент, помещенный в ам-
пулу
7, отделен от измерительной системы краном 4. Измеритель-
ная
система включает в себя прибор для измерения давления (на
рисунке показан ртутный U-образный манометр J) и прибор для
точного измерения и дозирования объема газа — бюретка 2. Через
краны
6 и 7 система соединяется с вакуумным насосом либо через
краны
6 и 8 с колбой, наполненной газом-адсорбтивом.
Порядок
измерения следующий. После тренировки образца,
которая
обычно проводится при повышенных температурах*, ваку-
умный насос отключают от системы краном 7 и из колбы, открыв
кран
8, набирают газ-адсорбтив в измерительную систему. Коли-
чество газа (в зависимости от массы загруженного адсорбента,
развитости его поверхности и желаемого положения эксперимен-
тальной точки на изотерме адсорбции) варьируют его объемом (опу-
ская
ртуть
в бюретке и освобождая таким образом один или не-
сколько
ее шариков) и давлением. Затем, поместив ампулу / в
При
измерении физической адсорбции обычно достаточна температура
300 "С, 1гри измерении хемосорбции ее повышают до
450—500
'С.
2 Чакп No 499

34
Глава
3
Рис. 3.2. Принципиальная схема
измерения
адсорбции объемным
методом.
/ — ампула с адсорбентом; 2 — га-
зовая
бюретка; 3 — ртутный U-ма-
нометр;
4—8 — краны; 9 — к ваку-
умному насосу; 10 — к колбе с за-
пасом газа.
термостат или в
сосуд
Дьюа-
ра с охладителем, открывают
кран
4. После того, как
уста-
новится
равновесие (давление
перестанет убывать) при фик-
сированном
положении ртути
в
бюретке измеряют равновес-
ное
давление.
Пусть п
х
и /*2 — количе-
ство молей адсорбтива в из-
мерительной системе до и
после установления равнове-
сия
соответственно, «
3
— ко-
личество молей адсорбтива, заполняющего свободный от адсорбента
объем ампулы (так называемый мертвый объем). Тогда величина
адсорбции
а^щ-щ-щ,
(3.1)
«!, /г, и я
3
вычисляют по уравнению состояния из соответствую-
щих объемов емкостей, содержащих газ, и его давления
п,=
п
2
=
Щ
(3.2)
У
х
— объем измерительной системы, содержащей
*заготовку»
газа,
в
том числе объем всех ее соединительных трубок, находимый спе-
циальной
калибровкой, выполняемой после монтажа установки,
У
2
— объем измерительной системы после установления равнове-
сия,
У
ъ
— мертвый объем, R — газовая постоянная, Г, и Т
2
—
абсолютные температуры. Температуру измерительной системы Т
х
при
впуске в нее газа и при установившемся равновесии обычно
поддерживают одинаковой; температура ампулы Т
2
может отличаться
от Т
х
в зависимости от того, при какой температуре необходимо
измерять адсорбцию.
Экспериментальные
методы
измерения
величин
адсорбции
и
теплот
адсорбции
35
При
вычислении щ и щ подставляется одинаковое давление
Р
2
, поскольку в момент измерения равновесного давления оно оди-
наково
в измерительной системе и ампуле.
Мертвый объем К
3
определяют калибровкой ампулы с адсорбен-
том — инертным газом (обычно гелием) до или после проведения
опыта, набирая его в измерительную систему, а затем впуская в
ампулу. Если измерительная система и ампула при калибровке на-
ходятся при одинаковой температуре, то используют закон Бой-
ля
— Мариотта
P;V;
=
P;(V;
+
V
3
),
<з.з>
где Р[ V{ — давление и объем калибровочного газа в измеритель-
ной
системе, Р
2
— давление после впуска газа в мертвый объем.
Проведя
указанные операции и вычисления, получают первую
точку изотермы. Следующие точки находят, добавляя газ в измери-
тельную систему (при закрытом кране 4) и учитывая при вычис-
лениях уже имеющееся на адсорбенте и в мертвом объеме количе-
ство адсорбтива.
3.2.2.
Объемная
адсорбционная
установка
повышенной
точности
,
В объемных адсорбционных установках точность определения вели-
чины
адсорбции зависит от точности измерения объема и давления
1^за, от точности термостатирования, а также от величины объема
так
называемого мертвого пространства, т.е. объема газа над адсор-
бентом в момент установления адсорбционного равновесия. Если
адсорбентом служит грубодисперсное твердое тело, имеющее
удель-
ную поверхность лишь несколько квадратных метров на грамм или
даже доли квадратного метра, или если изучается хемосорбция на
одном из компонентов сложного катализатора, весовое содержание
которого очень мало — до долей процента — адсорбционная
уста-
новка
должна обеспечивать весьма высокую точность измерений.
Повышенная
точность измерении в описываемой ниже
уста-
новке
достигалась хорошим термостатированием всех приборов, точ-
ным
измерением давлений ртутным U-манометром с помощью ка-
тетометра, тщательной калибровкой приборов до монтажа установки
и
соединительных трубок после ее спайки. Объем этих трубок был
минимальным
за счет компактного расположения приборов, ми-
нимального количества специально сконструированных и тщатель-
но
притертых небольших кранов, применения при спайке установ-
ки
капиллярной трубки диаметром 2—3 мм.
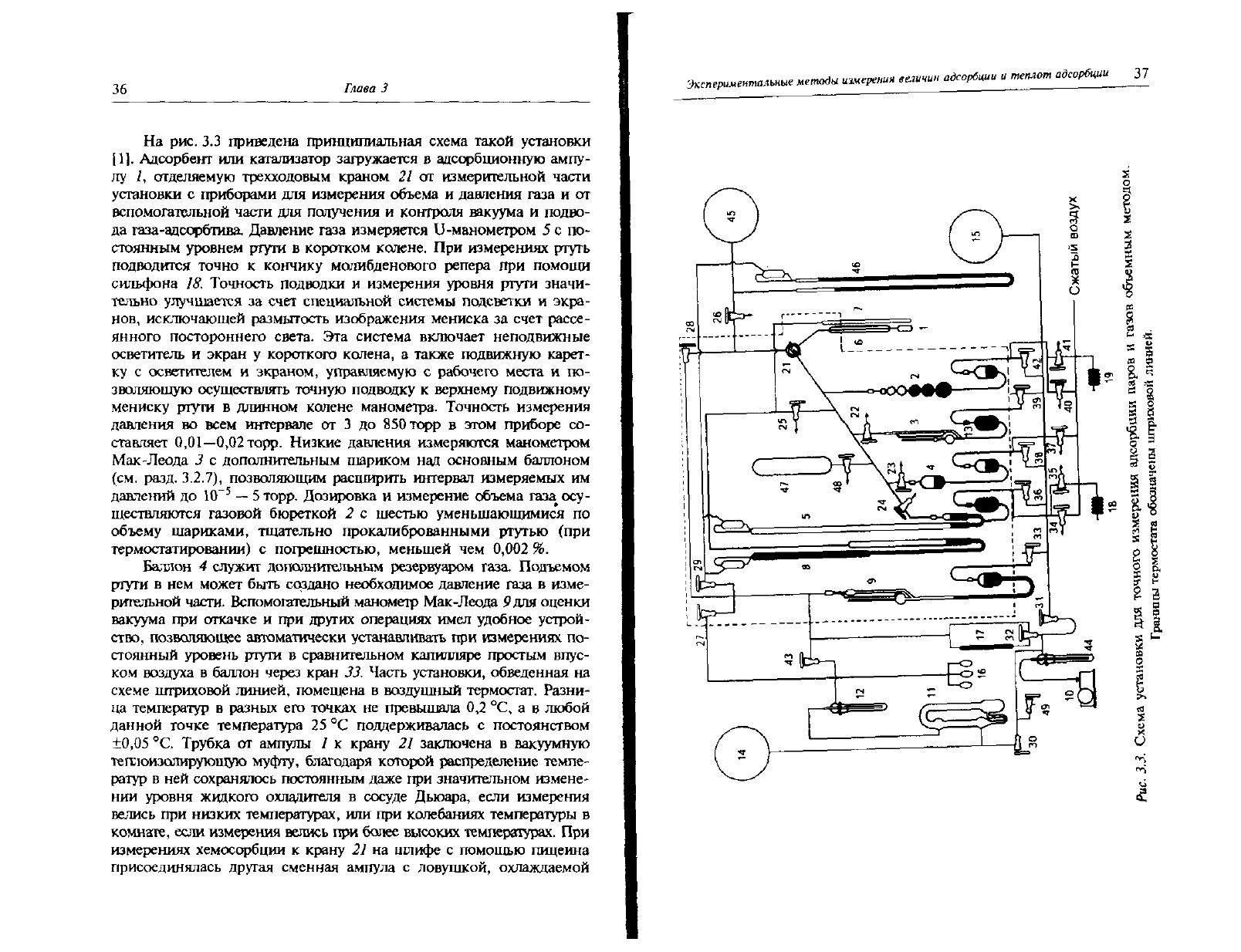
36
Глава
3
На
рис. 3.3 приведена принципиальная схема такой установки
[1].
Адсорбент или катализатор загружается в адсорбционную ампу-
лу Л отделяемую трехходовым краном 21 от измерительной части
установки с приборами для измерения объема и давления газа и от
вспомогательной части для получения и контроля вакуума и подво-
да газа-адсорбтива. Давление газа измеряется U-манометром 5 с по-
стоянным
уровнем ртути в коротком колене. При измерениях
ртуть
подводится точно к кончику молибденового репера при помощи
сильфона
18. Точность подводки и измерения уровня ртути значи-
тельно улучшается за счет специальной системы подсветки и экра-
нов,
исключающей размытость изображения мениска за счет рассе-
янного
постороннего света. Эта система включает неподвижные
осветитель и экран у короткого колена, а также подвижную карет-
ку с осветителем и экраном, управляемую с рабочего места и по-
зволяющую осуществлять точную подводку к верхнему подвижному
мениску
ртути в длинном колене манометра. Точность измерения
давления во всем интервале от 3 до 850торр в этом приборе со-
ставляет
0,01—0,02
торр. Низкие давления измеряются манометром
Мак-Леода 3 с дополнительным шариком над основным баллоном
(см.
разд.
3.2.7),
позволяющим расширить интервал измеряемых им
давлений до 10~
5
— 5 торр. Дозировка и измерение объема газа осу-
ществляются газовой бюреткой 2 с шестью уменьшающимися по
объему шариками, тщательно прокалиброванными
ртутью
(при
термостатировании) с погрешностью, меньшей чем
0,002
%.
Баллон
4 служит дополнительным резервуаром газа. Подъемом
ртути в нем может быть создано необходимое давление газа в изме-
рительной части. Вспомогательный манометр Мак-Леода 9 для оценки
вакуума при откачке и при
других
операциях имел удобное устрой-
ство, позволяющее автоматически устанавливать при измерениях по-
стоянный
уровень ртути в сравнительном капилляре простым впус-
ком
воздуха
в баллон через кран 33. Часть установки, обведенная на
схеме штриховой линией, помещена в воздушный термостат.
Разни-
ца
температур в разных его точках не превышала 0,2 °С, а в любой
данной
точке температура 25 °С поддерживалась с постоянством
±0,05
°С. Трубка от ампулы 1 к крану 21 заключена в вакуумную
теплоизолирующую
муфту,
благодаря которой распределение темпе-
ратур в ней сохранялось постоянным даже при значительном измене-
нии
уровня жидкого охладителя в
сосуде
Дьюара, если измерения
велись при низких температурах, или при колебаниях температуры в
комнате,
если измерения велись при более высоких температурах. При
измерениях
хемосорбции к крану 21 на ишифе с помощью пицеина
присоединялась
другая сменная ампула с ловушкой, охлаждаемой
Экспериментальные
метобы
измерения
еыичии
адсорбции
и
тегигот
адсорбции
37
