Дьяченко В.Г. Теория двигателей внутреннего сгорания
Подождите немного. Документ загружается.


348
достигает огромных значений. По мере увеличения объема очага
воспламенения и окончания электрического разряда (рис. 10.9)
температура в объеме очага воспламенения снижается до значе-
ния Т
z
, соответствующего определенному составу топливовоз-
душной смеси. Вокруг очага воспламенения к этому моменту
времени формируется фронт пламени, поверхность которого
близка к сфере. За фронтом пламени находятся продукты сгора-
ния при температуре Т
z
, впереди фронта пламени – топливовоз-
душная смесь, температура которой Т
см
значительно ниже
(рис. 10.9). Глубина фронта пламени
пл
= 0,1–1 мм (в зависи-
мости от вида топлива, состава топливовоздушной смеси, темпе-
ратуры и давления смеси). Условию стабилизации очага воспла-
менения и его дальнейшего увеличения без подвода энергии
извне соответствует радиус сферы r > r
кр
[8]. При r < r
кр
пламя
затухает, так как потери теплоты в окружающую среду превы-
шают подвод теплоты Q
х
реакцией окисления горючих компо-
нентов топлива.
Критический радиус сферы
r
кр
3
пл
(10.3)
и соответственно
см
3
крсмкр
см
4
3
TТСrQQ
zрх
, (10.4)
где с
рсм
,
см
– удельная массовая теплоемкость смеси при посто-
янном давлении и плотность смеси.
С обеднением топливовоздушной смеси, увеличением со-
держания остаточных газов в топливовоздушной смеси, пониже-
нием давления топливовоздушной смеси, увеличением интенсив-
ности ее турбулизации в зоне электродов свечи зажигания для
стабилизации очага воспламенения необходимо увеличивать
энергию электрического разряда. Критический радиус сферы оча-
га воспламенения также увеличивается.
§3. Процессы сгорания топливовоздушных смесей
Окисление горючих компонентов топливовоздушной смеси
происходит во фронте пламени, разделяющего топливовоздуш-
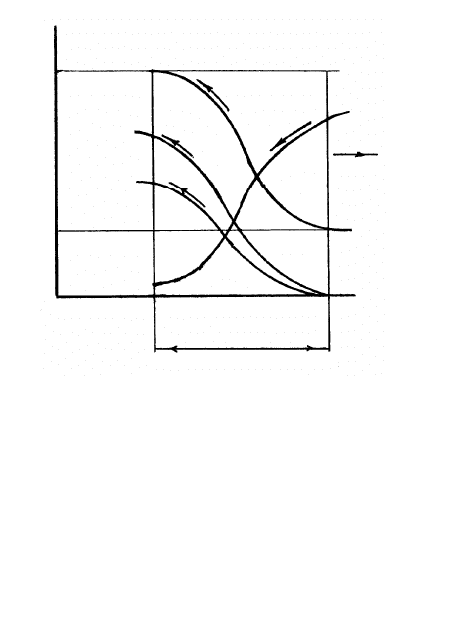
349
ную смесь и продукты окисления горючих компонентов
(рис. 10.10). При окислении углеводородов топлива во фронте
пламени снижается объемное
содержание кислорода r
О
2
и
возрастает объемное содержа-
ние двуокиси углерода r
СО
2
и
паров воды r
Н
2
О
. Температура
продуктов окисления углево-
дородов топлива за фронтом
пламени определяется в ос-
новном начальной температу-
рой смеси и соотношением
массы воздуха и топлива в
смеси. Глубина зоны фронта
ламинарного пламени в угле-
водородовоздушных смесях
стехиометрического состава
при атмосферном давлении
пл
1 мм, в смесях водорода
и воздуха
пл
0,1 мм [8].
Скорость, с которой фронт ламинарного пламени переме-
щается относительно топливовоздушной смеси в направлении,
перпендикулярном к поверхности фронта пламени, называется
нормальной скорость перемещения фронта пламени U
н
или ско-
ростью ламинарного горения.
Нормальная скорость пламени зависит от скорости химиче-
ских реакций во фронте пламени, скорости переноса теплоты и
активных центров из зоны горения (фронта пламени) в топливо-
воздушную смесь впереди фронта пламени.
Реакция распада молекул, например углеводорода, на не-
сколько простых молекул или соединений называется мономоле-
кулярными или реакциями первого порядка. Если в реакции
участвуют два исходных компонента, то такие реакции назы-
ваются бимолекулярными или реакциями второго порядка, а если
исходных компонентов три – реакциями третьего порядка. При
этом предполагается, что реакции осуществляются в результате
одновременного столкновения двух или трех молекул исходного
пл
х
Т
см
r
О
2
U
н
Т
пр.сг
Т
r
СО
2
r
Н
2
О
r
Н
2
О
Т,
r
О
2
,
r
СО
2
,
Рисунок 10.10 – Изменение температуры
и объемного содержания кислорода,
двуокиси углерода и паров воды во
фронте пламени в неподвижной
смеси:
труба, открытая с двух сторон;
U
н
– нормальная скорость распростра-
нения фронта пламени
350
вещества. Вероятность столкновения более чем трех разных мо-
лекул исходных компонентов пренебрежимо мала. Из молеку-
лярно-кинетической теории газов количество столкновений меж-
ду молекулами одного исходного компонента пропорционально
общему их числу
в единице объема (объемной концентрации ис-
ходного компонента), а если в реакции участвует несколько ис-
ходных компонентов, то вероятность столкновения молекул раз-
личных исходных компонентов пропорциональна произведению
количества молекул каждого исходного компонента в единице
объема (произведению объемных концентраций компонентов).
Если обозначить концентрации исходных компонентов в молях
на единицу объема через С
а
, С
b
, С
с
, а продуктов окисления через
С
1
и С
2
, то абсолютную скорость химических реакций можно
представить следующим образом:
для мономолекулярной реакции
a
CK
d
dC
1
1
;
a
CK
d
dC
1
2
; (10.5)
для бимолекулярной реакции
ba
CCK
d
dC
2
1
;
ba
CCK
d
dC
2
2
; (10.6)
для реакции третьего порядка
сba
СCCK
d
dC
3
1
;
сba
СCCK
d
dC
3
2
, (10.7)
где
332211
,,,,, КККККК – коэффициенты пропорциональнос-
ти (константы реакций окисления), которые зависят в основном
от температуры и физико-химических свойств компонентов.
Абсолютная скорость химической реакции моль/(м
3
с) –
количество вещества в молях, прореагировавших в единице
объема (м
3
) в единицу времени (с).
Объемная (молярная) концентрация каждого из исходных
компонентов реакций пропорционально давлению смеси. Поэто-
му количество молекул исходных компонентов, вступающих в
реакцию или же образовавшихся в единицу времени (абсолютная
В 1 см
3
газа при нормальных условиях (760 мм рт. ст., 0 С) содержится 2,6910
19
молекул
351
скорость реакций), может быть представлена в функции давления
смеси:
для мономолекулярной реакции
см11
1
рКCK
d
dC
a
; (10.8)
для бимолекулярной реакции
2
см22
1
рКСCK
d
dC
ba
; (10.9)
для реакции третьего порядка
3
см33
1
рКССCK
d
dC
сba
; (10.10)
для реакции n-го порядка
n
n
рК
d
dC
см
1
. (10.11)
Константы химических реакций зависят от энергии актива-
ции реагирующих компонентов и абсолютной температуры Т
смеси,
TR
E
nn
n
eAK
, (10.12)
где A
n
– константа для определенных реагирующих компонентов
реакции n-го порядка; Е
n
– энергия активации для определенных
реагирующих компонентов Дж/моль; R = 8,314 Дж/(мольК) –
универсальная газовая постоянная.
Энергия активации Е
n
– дополнительное количество энер-
гии, которое необходимо сообщить молю реагирующих компо-
нентов для повышения кинетической энергии молекул до уровня,
при котором возможен разрыв внутримолекулярных связей (сил
сцепления между атомами молекул).
Таким образом, абсолютная скорость реакции n-го порядка
см
см
1
const
TR
E
n
n
eр
d
dC
. (10.13)
Энергия активации реакций в зависимости от условий осу-
352
ществления реакции (давления, температуры, содержания в среде
молекул других веществ и других факторов) изменяется в широ-
ких пределах и для одних и тех же реагирующих компонентов.
Например, энергия активации реакции водорода с кислородом в
зависимости от давления и температуры изменяется в пределах
(4,2–17,6)10
4
Дж/моль 12; этана с кислородом – (12,6–23,3)10
4
Дж/моль 13; углеводородов моторного топлива – (2–16,8)10
4
Дж/моль 8. Определяющим фактором изменения абсолютных
скоростей реакций окисления углеводородов топлива является
температура смеси. Если принять абсолютную скорость реакций
окисления углеводородов топлива при
см
Т
= 300 К за единицу, то
с увеличением температуры отношение абсолютных скоростей
реакций окисления
К300
К300
1
1
см
см
'
смсм
'
смсм
'
см
см
T
T
R
E
ТT
ТT
R
E
Т
T
п
п
ее
ddC
ddC
. (10.14)
Скорость химических реакций окисления углеводородов
топлива возрастает интенсивно при увеличении температуры
смеси до 1000 К, а затем интенсивность ее увеличения снижается
тем в большей степени, чем выше температура смеси. Значитель-
ное влияние на скорость химических реакций окисления углево-
дородов топлива оказывает и энергия активации (табл. 10.1).
Таблица 10.1 – Влияние температуры и энергии активации на
абсолютную скорость реакций окисления углеводородов топлива
Энергия
активации,
Дж/моль
Температура смеси, К
300 500 1000 1500 2000
16,8
10
4
1
5,25
10
11
3,98
10
20
2,82
10
23
8,91
10
24
8,4
10
4
1
7,59
10
5
2,0
10
10
5,37
10
11
3,02
10
12
2,0
10
4
1 –
2,82
10
2
6,17
10
2
9,33
10
2
Основным источником активации реагирующих компонен-
тов является кинетическая энергия молекул реагентов, хаотичес-
ки движущихся с различными скоростями. При столкновении
353
молекул реагентов движущихся с повышенными скоростями
суммарная их энергия может оказаться больше энергии актива-
ции, произойдет при этом разрушение внутримолекулярных свя-
зей и возникновение активных частиц или соединений атомов со
свободными валентными связями. С ростом температуры возрас-
тает количество столкновений молекул с высоким уровнем кине-
тической энергии, возрастает скорость реакций. При этом исход-
ные компоненты реакций, например окисления углеводородов
топлива кислородом воздуха, превращаются в конечные продук-
ты не в результате прямых соударений молекул, а с образованием
промежуточных продуктов окисления – активных частиц (ато-
мов, осколков молекул с незамещенными свободными валентны-
ми связями). Активные частицы вступают в реакции с молекула-
ми исходных реагентов или промежуточными соединениями уже
при значительно меньших значениях энергии активации, т.е. ре-
акции, например, окисления углеводородов топлива многоста-
дийные. В результате ряда (цепи) последовательных преобразо-
ваний получаются конечные продукты реакций.
Теория цепных реакций разработана лауреатом Нобелевской
премии академиком Н.Н. Семеновым и сегодня является обще-
признанной. Теория цепных реакций взаимодействия различных
веществ включает следующие основные положения:
начальная скорость зарождения активных центров цепей
реакций бесконечно мала – а;
цепи реакций осуществляются через посредство атомов и
радикалов, вступающих в реакции;
активные частицы (атомы, радикалы) могут вступать в
реакции трех видов:
реакции, при которых в результате соударения образуется
столько же новых активных частиц, сколько и было до соударе-
ния (реакции продолжения цепей – б);
реакции, при которых в результате соударений количест-
во активных частиц в среде возрастает (разветвление цепей – в);
реакции, в результате которых происходит уменьшение
или уничтожение активных центров, превращение их в стабиль-
ные молекулы (обрыв цепей – г).
354
Рассмотрим для примера схему реакций окисления водоро-
да, одного из основных горючих компонентов моторного топли-
ва:
а – зарождение цепи
;МН2МН
;ОООО
;НО2ОН
2
322
22
б – продолжение цепи
;ООННОНО
;НОННОН
2
22
в – разветвление цепи
;О2НООН2
;ННОНО
;ОНООН
3
2
2
г – обрыв цепей
.стенкаН
;МОНМОН2
;ОННОН
;ННН
;ОНННО
222
222
2
2
Здесь М – стабильное соединение (молекула), точка над зна-
ком химического элемента – свободная валентная связь.
Схема реакций окисления молекул углеводородов, содер-
жащих от нескольких до десятков атомов углерода и водорода,
намного сложнее, реакции носят лавинообразный характер. На
основании анализа экспериментальных данных Н.Н. Семеновым
предложена следующая схема реакций окисления простейшего
углеводорода (метана):
а – зарождение цепи
;Н2ОНСОНОСН
;МННСМСН
;ОНОНСОСН
24
34
324
355
б – продолжение цепи
;НСОНОНСН
;ОНСОООНС
;НСОНОСО
;ОСНОННСНОНО
;НОНСНООНС
32224
22
2
2
23
в – разветвление цепи
;ОННСОСН
;ОНОНСОНСНО
2324
22
г – обрыв цепей
стенка.НО
стенка;Н
;НОСОНООНС
;ОННОН
;СООСО
222
2
2
Цепная реакция окисления метана начинается с образования
в результате соударения молекул кислорода и метана с высокой
кинетической энергией двух радикалов
3
НС
и
О
Н
. В последую-
щих элементарных актах взаимодействия принимают участие об-
разующиеся радикалы
Н
О
,
О
С
Н
; атомы
Н
,
О
. Реакции окисления
метана – слаборазветвленные реакции, что предопределяет отно-
сительно медленное горение метана. Образующаяся окись угле-
рода сгорает с образованием СО
2
(стабильного соединения) и ак-
тивных атомов со свободными валентными связями (
Н
и
О
).
При обрыве цепей реакций окисления углеводородов топли-
ва в продуктах сгорания за фронтом пламени образуются наряду
с конечными продуктами окисления (СО
2
, Н
2
О) промежуточные
соединения (СО, С
n
H
m
), твердые частицы, содержащие углерод,
твердые углеводороды, образовавшиеся при столкновении не-
скольких молекул углеводородов, полициклические углеводоро-
ды. Значительная часть углеводородов в отработавших газах обу-
словлена обрывом цепей реакций окисления в пограничном слое
у поверхности стенок надпоршневой полости, толщина которого
356
составляет 0,1–1 мм. Часть этих соединений является по отноше-
нию к живым организмам токсичными, часть – канцерогенными.
При сгорании этилированных бензинов в продуктах сгорания со-
держатся также соединения свинца, воздействие которых на жи-
вые организмы сопоставимо с воздействием канцерогенных со-
единений. Содержание твердых частиц в продуктах сгорания го-
могенных топливовоздушных смесей незначительно и зависит в
основном от количества масла, поступающего в надпоршневую
полость через поршневые кольца.
Во фронте пламени в реакциях окисления молекул углево-
дородов, содержащих азот, образуются также оксиды азота (NO
x
),
но основная часть окислов азота в продуктах сгорания приходит-
ся на окись азота, образующуюся при окислении азота за фрон-
том пламени в зоне максимальной температуры. Реакции окисле-
ния азота, как и углеводородов, являются в основном многоста-
дийными, носят цепной характер 8, 14, 15. Интенсивность обра-
зования окиси азота зависит от температуры и концентрации ки-
слорода в продуктах сгорания. Реакции образования окиси азота
из азота и кислорода обратимы:
N
2
+
О
NO +
N
– 13,610
4
Дж/моль;
N
+ O
2
NO +
О
+ 13,610
4
Дж/моль.
Первая реакция протекает с поглощением теплоты. С пони-
жением температуры реакции смещаются влево (в сторону обра-
зования исходных реагентов). При быстром охлаждении продук-
тов сгорания, как это имеет место в надпоршневой полости дви-
гателей, равновесие не успевает сместиться влево, происходит
“закалка” окиси азота. В продуктах сгорания остается практичес-
ки то же количество окиси азота, которое образовалось при высо-
кой температуре.
Так как в продуктах сгорания углеводородов за фронтом
пламени содержатся пары воды, возможны и другие реакции об-
разования окиси азота:
NHNOHON
2
;
HONOONH
2
.
Не исключаются при высокой температуре и бимолекуляр-
357
ные реакции окисления азота, сопровождающиеся поглощением
теплоты:
N
2
+ O
2
2NO – 18,110
4
Дж/моль.
По данным экспериментальных исследований в продуктах
сгорания двигателя с искровым зажиганием содержится в основ-
ном окись азота. Содержание двуокиси азота (NO
2
) не превышает
1 % от общего количества оксидов азота в продуктах сгорания
8. Окись азота продуктов сгорания в воздухе легко окисляется,
образуя двуокись азота.
Нормальная скорость распространения фронта пламени U
н
(рис. 10.10) в топливовоздушных смесях относительно невелика –
0,30–0,55 м/с 8. При турбулизации топливовоздушной смеси
она значительно возрастает (до 60–80 м/с). В турбулентном пла-
мени параметры топливовоздушной смеси (температура, ско-
рость) непрерывно изменяются, глубина фронта пламени при
этом значительно увеличивается. Наибольшее влияние на ско-
рость перемещения турбулентного пламени оказывает крупно-
масштабная турбулизация топливовоздушной смеси, вызываю-
щая не только расширение фронта пламени, но и образование
очагов горения смеси как впереди фронта пламени, так и за
фронтом пламени.
При сгорании топливовоздушных смесей в надпоршневой
полости двигателя давление и температура смеси вследствие вы-
деления теплоты при сгорании и перемещения поршня возраста-
ет, что также значительно увеличивает скорость сгорания смеси.
Благодаря этим факторам становится возможным осуществить
процесс сгорания топливовоздушной смеси в надпоршневом
объеме за 1–2 мс. Например, в карбюраторном двигателе ВАЗ-
2103 на режимах внешней скоростной характеристики момент
зажигания при n = 5600 об/мин осуществляется за 36 ПКВ до
ВМТ, а при n = 3000 об/мин – за 32 ПКВ (рис. 10.11). На ста-
билизацию очага зажигания уходит при n = 3000 об/мин 18
ПКВ¸ при n = 5600 об/мин – 23 ПКВ. Интенсивное сгорание то-
пливовоздушной смеси (резкое нарастание давления) начинается
примерно за 13–15 ПКВ до ВМТ. Максимального значения дав-
ление газов в надпоршневой полости достигает за 8–10 ПКВ по-
сле ВМТ, т.е. продолжительность интенсивного повышения дав-
