Борисова Т.Н., Варламов А.В., и др. Основы органической химии
Подождите немного. Документ загружается.

OH
+δ
−δ
H-C
O
H
H-C
O
OH
H-C
O
H
CH
3
OH
+
NaOH
H⎯C⎯H
OH
O
−δ
+δ
CH
3
-O
H
2
O
H-C
O
ON
a
+
метилат анион
гидридный
перенос
V. Реакции окисления
1. Альдегиды окисляются в мягких условиях до карбоновых кислот, проявляя
свойства восстановителей.
C
O
R
H
O
2
(воздух)
20
0
C
C
O
R
OH
KMnO
4
20
0
C
Ag(NH
3
)
2
OH
реактив Толленса
реактив Фелинга
Cu
+2
/ раствор
-Ag
-Cu
2
O
Реакции с реактивами Толленса (реакция серебряного зеркала) и Фелинга
относятся к качественным.
2. Кетоны окисляются деструктивно в жестких условиях под действием
KMnO
4
и K
2
Cr
2
O
7
в присутствии концентрированной серной кислоты после
образования енолов ( правило Попова).
Пример реакции
реагент: KMnO
4
/ H
2
SO
4
, t
0
C
CH
3
-CH-C-CH
2
-CH
3
CH
3
O
CH
3
-C=C-CH
2
-CH
3
CH
3
OH
CH
3
-CH-C=CH-CH
3
CH
3
OH
CH
3
-C-CH
3
O
CH
3
-CH
2
C
O
OH
+
CH
3
-CH-C
CH
3
O
OH
+
CH
3
-C
O
OH
2-метилпентанон-3
α
α
/
2-метилпропановая
кислота, изомасляная
уксусная кислота ацетон
пропионовая кислота
128
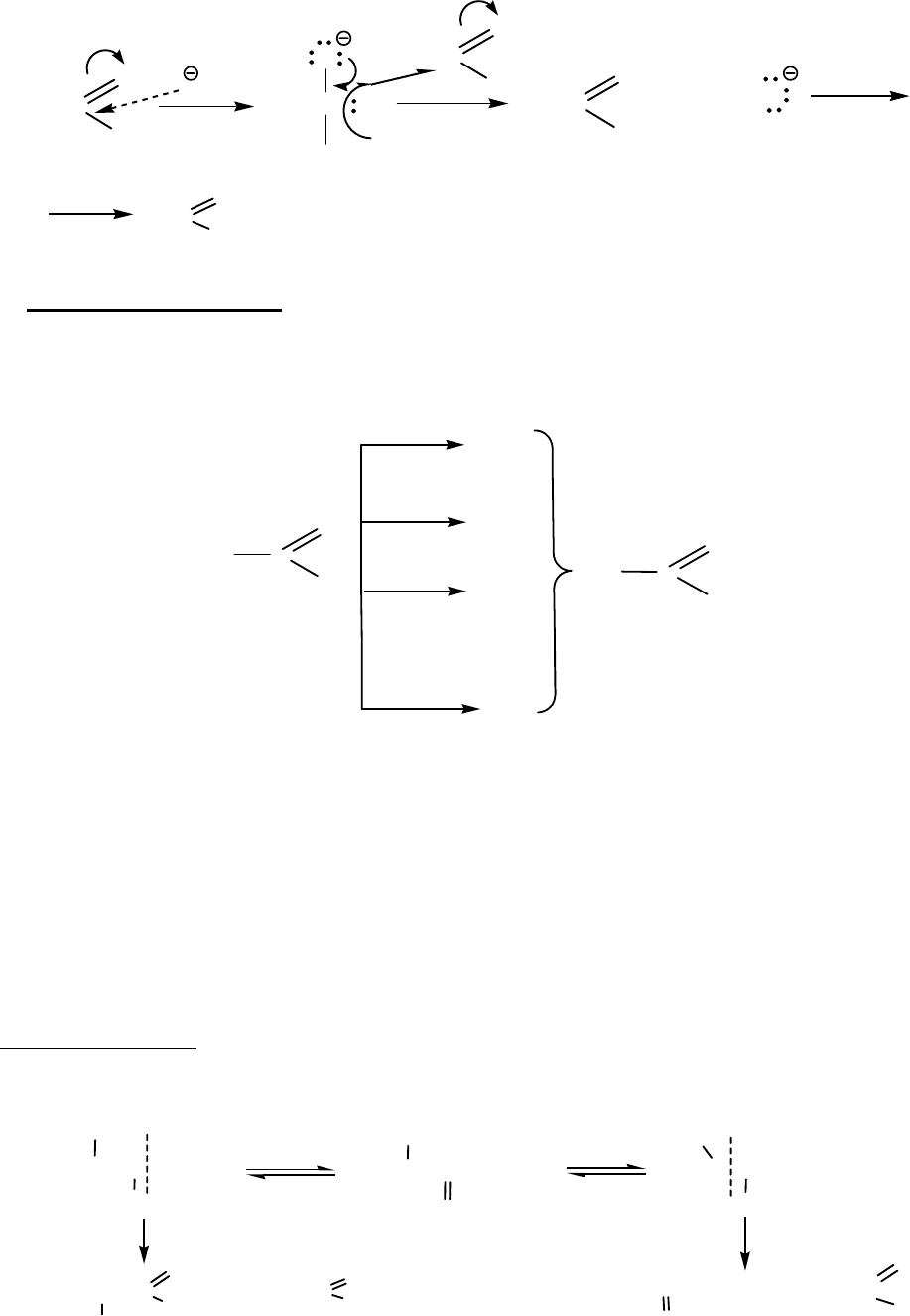
Таким образом, при окислении этилизопропилкетона образуются три
различные карбоновые кислоты и пропанон (ацетон). Анализ образующихся
смесей позволяет установить строение исходного кетона.
Реакционная способность α,β - непредельных альдегидов на примере
акролеина
CH
2
=CH-C
O
H
+δ
-
δ
-M, -I для карбонила
π,π − сопряжение
Характерны реакции по карбонильной группе и двойной связи.
CH
2
=CH-C
O
H
+δ
-δ
KCN
H
2
O
NaHSO
3
NH
3
H→Br
C
2
H
5
OH
H
CH
2
=CH-CH-C≡N
OH
CH
2
-CH
2
-C
O
H
CH
2
=CH-CH-SO
3
Na
OH
OC
2
H
5
CH
2
-CH
2
-C
O
H
Br
+δ
-δ
CH
2
-CH
2
-C
O
H
NH
2
1
234
нитрил 2-окси-3-бутеновой кислоты
гидросульфитное производное
3-этоксипропаналь (полуацетальное производное не
образуется - менее устойчиво, чем полученный продукт)
3-бромпропаналь
3-аминопропаналь
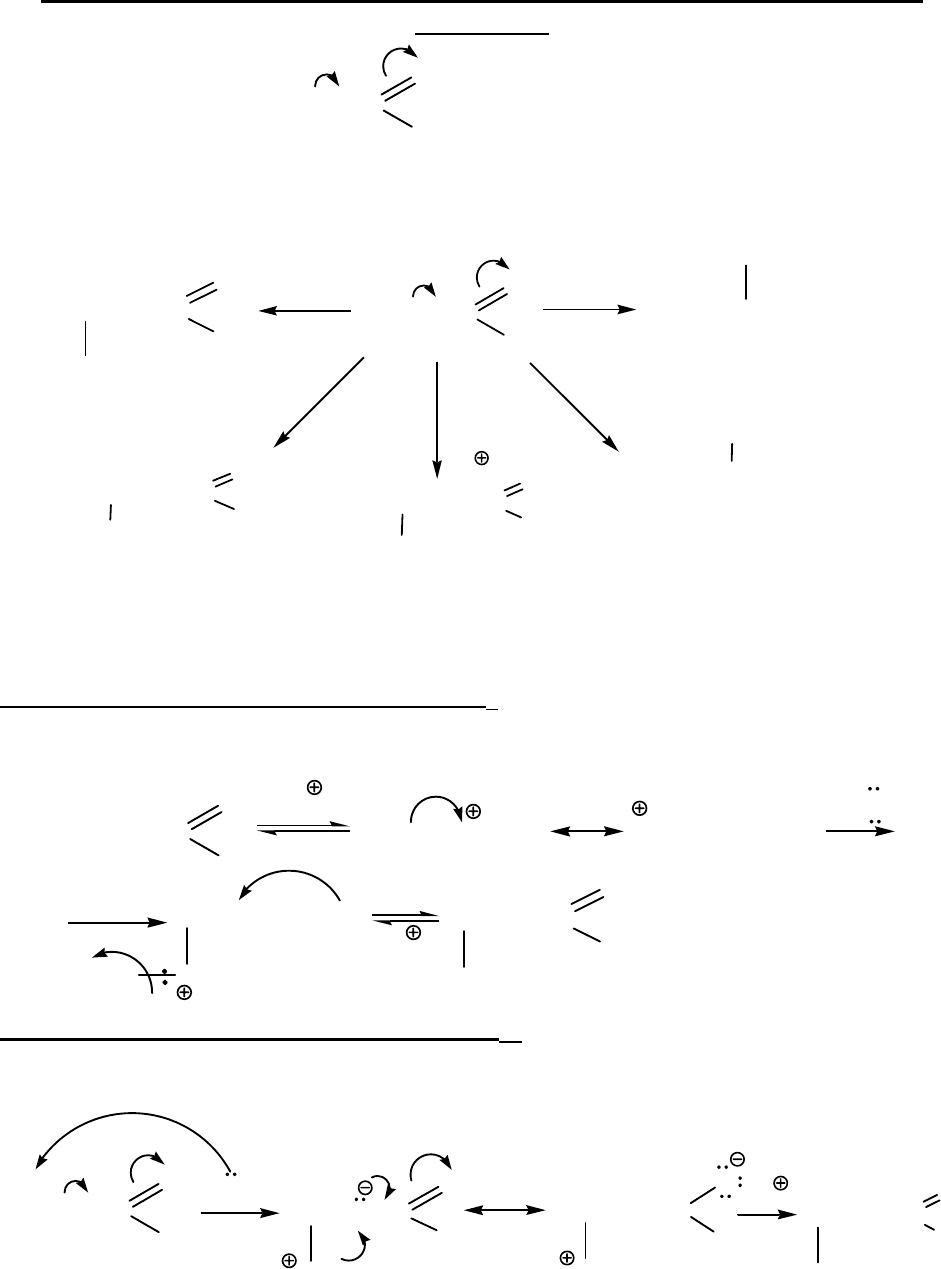
Ad
Nu
Ad
E
Ad
E
Ad
Nu
Ad
Nu
Механизм присоединения этанола, Ad
E
C
2
H
5
OH
H
CH
2
-CH
2
-C
O
H
OC
2
H
5
CH
2
=CH-C
O
H
CH
2
=CH-CH-OH CH
2
-CH=CH-OH
Nu
CH
2
-CH=CH-OH
O-C
2
H
5
H
-H
Механизм присоединения аммиака, Ad
Nu
CH
2
=CH-C
O
H
+δ
-δ
CH
2
-CH
2
-C
O
H
NH
2
NH
3
CH
2
-CH-C
O
H
NH
3
CH
2
-CH=C
O
H
NH
3
∼H
129
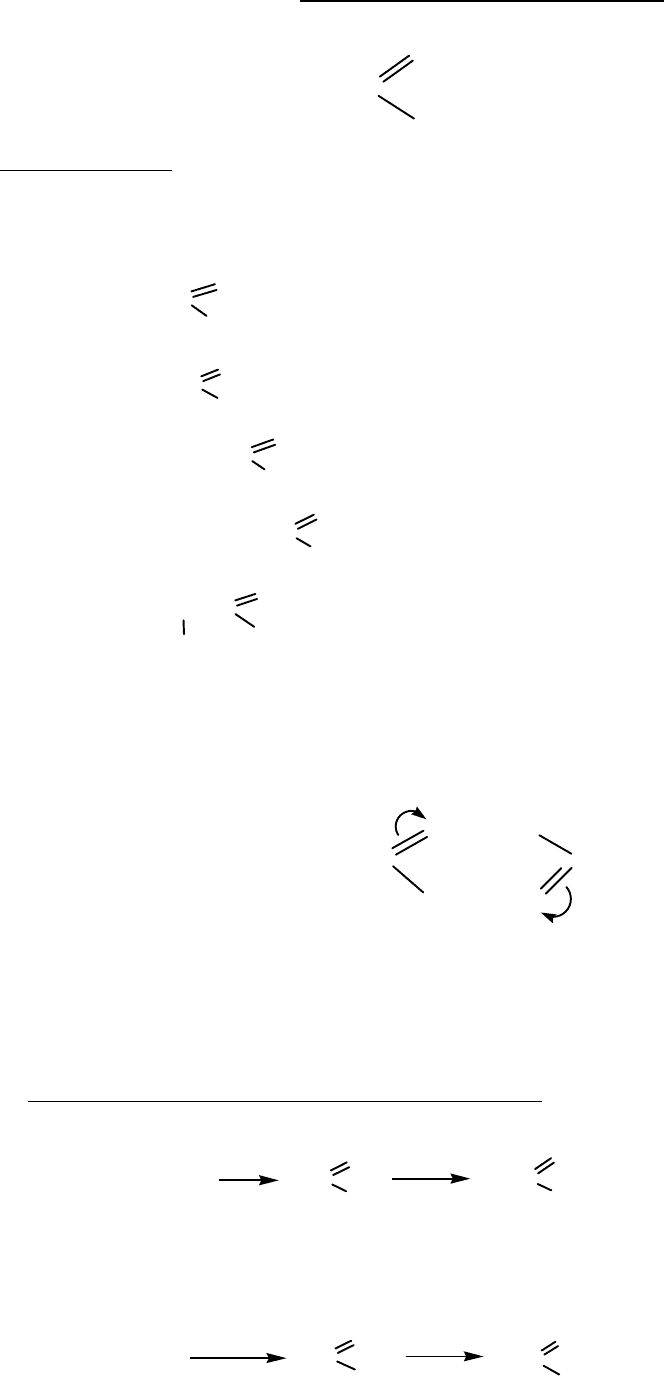
КАРБОНОВЫЕ КИСЛОТЫ
Функциональная группа
⎯C
O
OH
- карбоксил
Номенклатура
Суффикс – овая
H-C
O
OH
CH
3
-CH
2
-CH
2
-C
CH
3
-C
O
OH
CH
3
-CH
2
-C
O
OH
CH
3
-CH-C
CH
3
O
OH
метановая кислота, муравьиная
этановая кислота, уксусная
пропановая кислота, пропионовая
бутановая кислота, масляная
2-метилпропановая кислота, изомасляная
O
OH
Карбоновые кислоты имеют высокие температуры кипения, причиной
является образование ассоциатов за счет водородных связей.
R-C
O
O⎯H
C-R
O
H⎯O
....
......
+δ
-δ
+
δ
-
δ
+δ
-δ
+δ
-δ
Методы получения
1.
Карбонилирование щелочей и алкоголятов
а) CO + NaOH
H-C
O
ONa
HCl
H-C
O
OH
+ NaCl
метаноат натрия,
формиат
t
0
, p
R-ONa + CO
t
0
, p
R-C
O
ONa
HCl
R-C
O
OH
+ NaCl
R-алкил
б)
карбоновые кислоты
130
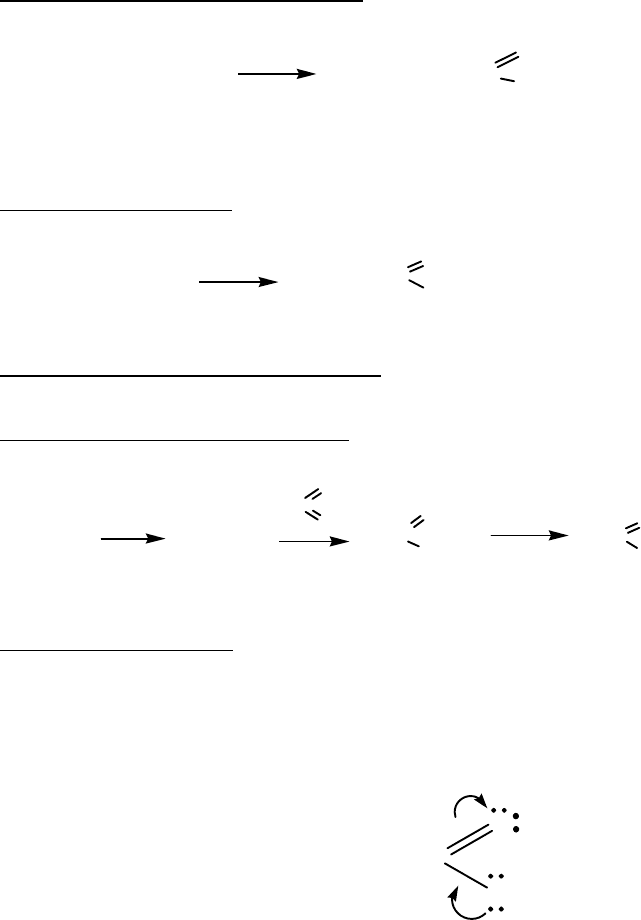
2. Металлокарбонильный синтез
карбоновые кислоты
t
0
, p
R-CH=CH
2
+ CO + H
2
O
Ni(CO)
4
R-CH
2
-CH
2
-C
O
OH
R-алкил
3. Окисление алканов
CH
3
-C
O
OH
O
2
(воздух)
катализатор
2
CH
3
-CH
2
-CH
2
-CH
3
4. Окисление спиртов, альдегидов (см. соответствующие темы).
5.
Синтез из реактива Гриньяра
HCl
R-C
O
OH
R-Br + Mg
R-MgBr
C
O
O
R-C
O
OMgBr
H
2
O
+ MgOHBr
R-алкил
6. Гидролиз нитрилов (см. тему “Производные карбоновых кислот”).
Реакционная способность карбоновых кислот
R⎯C→C
O
O←H
↑
↓
H
H
+δ
-
δ
-δ
α
+δ
Поляризация связей в молекулах карбоновых кислот
За счет р,π-сопряжения НПЭ атома кислорода гидроксильной группы и
р-электронов π-связи карбонила дефицит элекронной плотности на атоме
углерода карбонила (+δ) снижен. По этой причине карбоновые кислоты не
склонны вступать в реакции присоединения по карбонильной группе, в отличие
от альдегидов (кетонов). Кроме проявления ОН-кислотности, для карбоновых
кислот характерны реакции замещения гидроксильной группы и атома
водорода в α-положении.
I. ОН-кислотность карбоновых кислот
Карбоновые кислоты относятся к слабым кислотам, рКа ∼ 4-5.
131
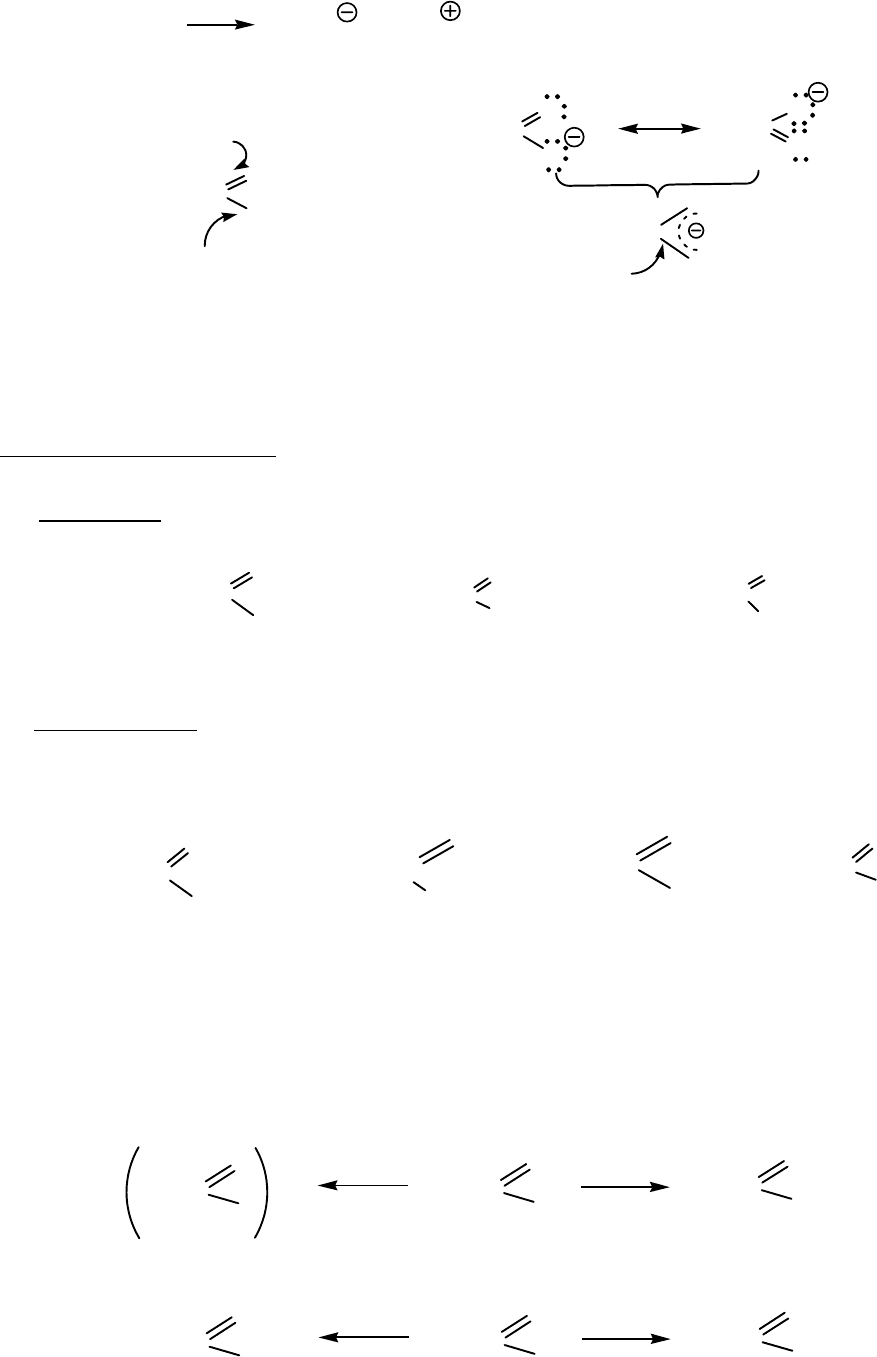
R-COOH + H
2
O
R-COO + H
3
O
карбоксилат-анион
R-C
O
O-H
1,23 Α
0
1,36 Α
0
R-C
O
O
R-C
O
O
R-C
O
O
0,127 нм
длины связей С-О
в карбоновых кислотах
Связи С-О в карбоксилат-анионе одинаковы по длине, электронная
плотность распределена равномерна.
Влияние заместителей на величину рКа карбоновых кислот:
1.
Донорные группы увеличивают прочность связи кислород-водород, это
приводит к увеличению рКа кислот, т.е. уменьшению их силы.
CH
3
-CH
2
→C
O
OH
H⎯C
O
OH
CH
3
→C
O
OH
рКа 3,75 4,76 4,86
2.
Акцепторные группы уменьшают электронную плотность связи кислород-
водород, это приводит к уменьшению рКа кислот, т.е. увеличению их силы.
C←C
O
OH
CH
3
→C
O
OH
↑
←
↓
Cl
Cl
Cl
>>
> CH←C
OH
↑
↓
Cl
Cl
O
CH
2
←C
↓
Cl
OH
O
рКа 0,66 1,25 2,87 4,76
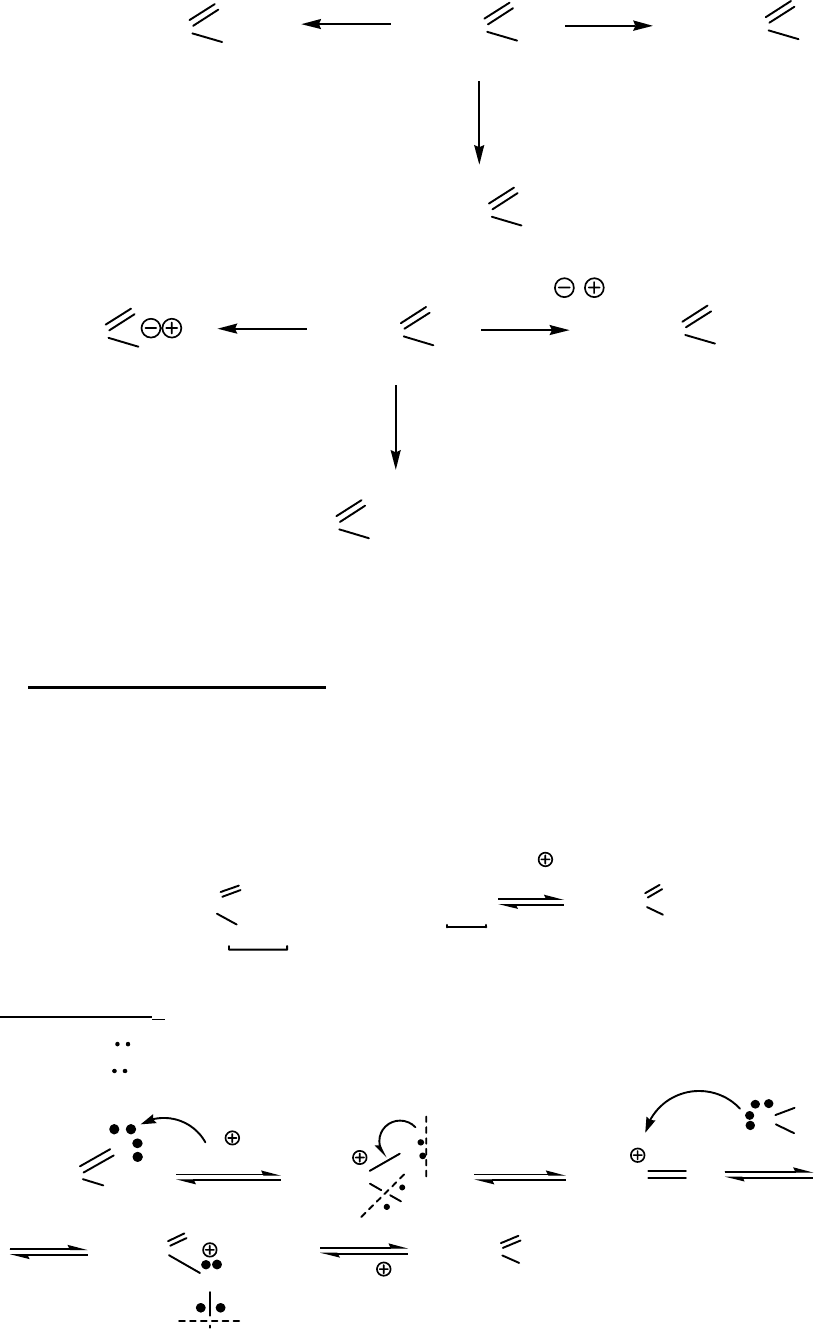
Карбоновые кислоты реагируют с металлами, оксидами металлов,
гидроксидами, аммиаком, солями более слабых кислот (OH, NH, CH - кислот).
При этом образуются соли.
CH
3
−C
O
OH
Na
CH
3
−C
O
ONa
CH
3
−C
O
O
Zn
-H
2
-H
2
Zn
2
ацетат натрия
этаноат,
ацетат цинка
CH
3
−C
O
OH
KOH
CH
3
−C
O
OK
CH
3
−C
O
OK
K
2
O
-H
2
O-H
2
O
ацетат калия
ацетат калия
132
CH
3
−C
O
OH
CH
3
−C
O
ONa
CH
3
−C
O
ONa
-H
2
O,-CO
2
Na
2
CO
3
CH
3
−C
O
ON
a
NaNH
2
или NaH
-NH
3
или -H
2
C
2
H
5
ONa
-C
2
H
5
OH
CH
3
−C
O
OH
CH
3
−C
O
ONa
CH
3
−C
O
O NH
4
ацетат аммония
CH
3
−C
O
OMgI
CH
3
MgI
CH
3
-C≡C Na
+ CH
3
-C≡CH
+ CH
4
NH
3
20
0
C
↑
↑
II. Реакции замещения ОН-группы
1.
Реакция этерификации
Этерификация протекает в присутствии сильных и средних кислот,
реакция обратима. В процессе реакции происходит замещение гидроксильной
группы на алкокси группу и образование сложных эфиров.
C
2
H
5
-O⎯H
CH
3
C
H
CH
3
-C
O
OC
2
H
5
+ H
2
O
этилэтаноат,
этилацетат
O
OH
+
Механизм S
N
Nu - C
2
H
5
-O-H
H
CH
3
-C
O
OH
CH
3
-C
O-H
OH
-H
2
O
CH
3
-C O
O
C
2
H
5
H
CH
3
-C
O
O-C
2
H
5
H
CH
3
-C
O
OC
2
H
5
-H
(Nu)
133
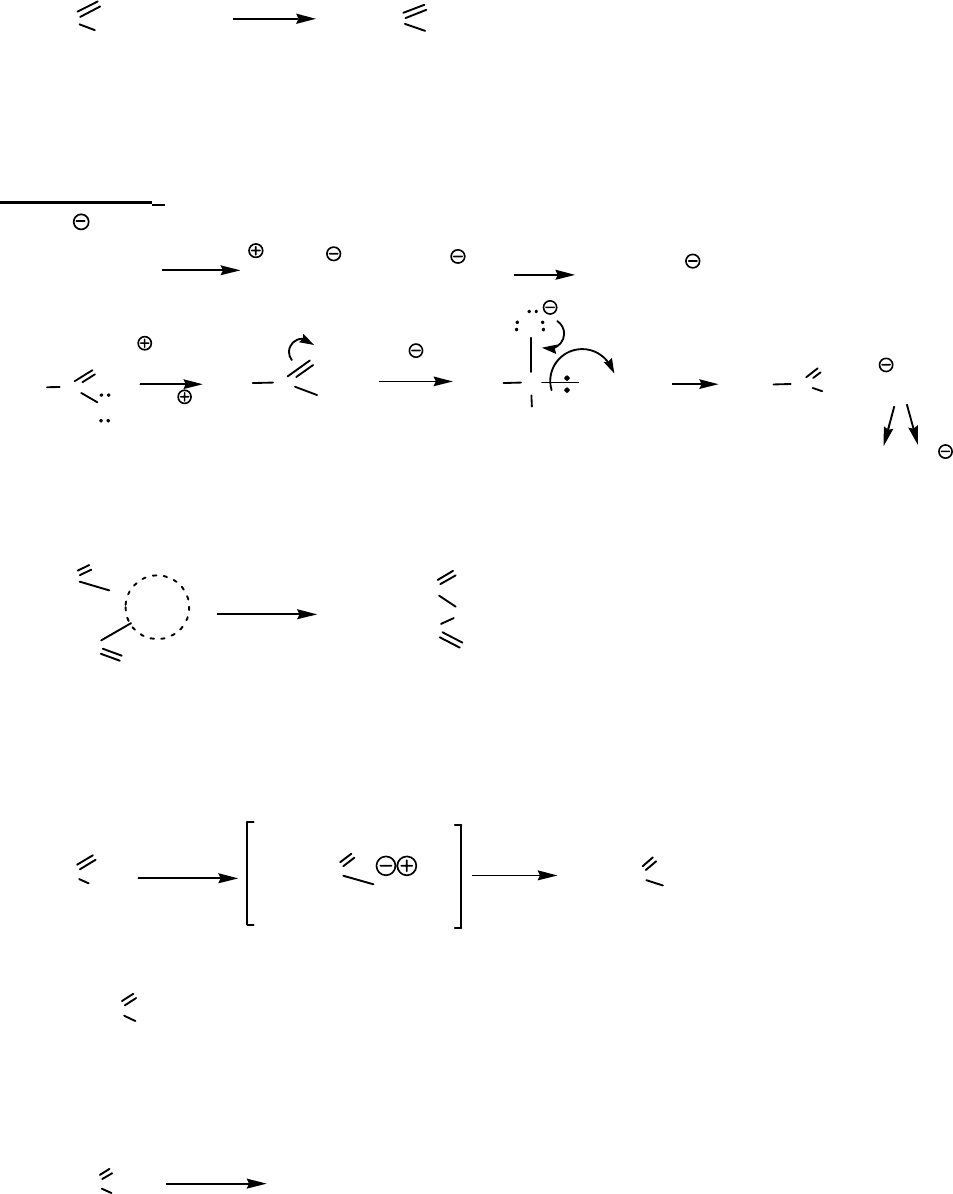
2. Превращение в хлорангидриды и ангидриды
а) синтез хлорангидридов
CH
3
−C
O
O-H
+ PCl
5
CH
3
−C
O
Cl
+ POCl
3
+ HCl
хлористый ацетил,
хлорангидрид уксусной кислоты
В качестве реагентов можно также использовать SOCl
2
, PCl
3
.
Механизм S
N
Nu - Cl
PCl
5
2
PCl
4
PCl
6
+PCl
6
PCl
5
+ Cl
C
O
OH
CH
3
C
O-PCl
4
O
CH
3
PCl
4
Cl
CO⎯PCl
4
Cl
CH
3
O
-δ
+δ
C
O
Cl
CH
3
+ O⎯PCl
4
O=PCl
3
Cl
- H
б) синтез ангидридов
CH
3
−C
O
O-H
CH
3
−C
O
O-H
P
2
O
5,
t
0
C
CH
3
−C
O
CH
3
−C
O
O
+ H
2
O
уксусный ангидрид
4. Образование азотсодержащих производных
а) синтез амидов
CH
3
−C
O
O-H
CH
3
−C
O
O NH
4
NH
3
P
2
O
5,
t
0
C
t
0
C
или
-H
2
O
CH
3
−C
O
NH
2
амид уксусной кислоты
ацетамид
CH
3
-CH
2
-C
O
NH
2
амид пропановой кислоты, пропиоамид
б) синтез нитрилов
CH
3
-CH
2
-C≡N
P
2
O
5,
t
0
C
-H
2
O
CH
3
−C
O
NH
2
нитрил уксусной кислоты
ацетонитрил
нитрил пропановой кислоты, пропионитрил
CH
3
-C≡N
1
2
3
134

4. Галоидирование по α - положению
а) хлорирование
CH
3
−COOH
Cl
2
hν, 117
0
C
CH
2
−C
O
O-H
Cl
+ HCl
хлорэтановая,
хлоруксусная кислота
R-CH
2
−COOH
CuCl
2
R-CH−COOH
+ HCl
LiCl
ДМФА, t
0
C
Cl
общий способ синтеза
б) бромирование (реакция Гелля- Фольгарда – Зелинского)
Br
2
+ HBr
PBr
3
R-CH
2
-COOH
R-CH-COOH
Br
5. Восстановление и окисление карбоновых кислот
а) восстановление
CH
3
−COOH
LiAlH
4
абс. ТГФ
(RCH
2
O)
4
AlLi
4H
2
O
4RCH
2
OH
Al(OH)
3
LiOH
+
+
Используется для получения высших спиртов:
1) LiAlH
4
4 C
11
H
23
COOH
C
11
H
23
CH
2
OH + Al(OH)
3
+ LiOH
додекановая,
лауриловая
кислота
деканол-1,
лауриловый спирт
2) 4 H
2
O
б) окисление
Карбоновые кислоты устойчивы к действию обычных окислителей,
возможно окисление связи С
α
- Н, если атом углерода в α - положении -
третичный.
t
0
C
CH
3
⎯C⎯COOH
H
CH
3
KMnO
4
CH
3
⎯C⎯COOH
OH
CH
3
т.
α
2-окси-2-метилпропановая кислота
135

ПРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ КИСЛОТ
Свойства и взаимные превращения
производные общая формула, примеры названий
функциональная группа
R-C
Cl(Br)
O
CH
3
-C
O
Cl
галогенангидриды
этаноил хлорид, хлорангидрид этановой
(уксусной) кислоты, хлористый ацетил
CH
3
-CH
2
-C
O
Cl
пропаноил хлорид, хлорангидрид пропановой
(пропионовой )кислоты, хлористый пропионил
ангидриды
R-C
O
O
C
O
C
O
O
C
O
C
O
O
CH
3
⎯
CH
3
⎯
CH
3
CH
2
⎯
CH
3
CH
2
⎯
ангидрид этановой
(уксусной) кислоты,
уксусный ангидрид
ангидрид пропановой
(пропионовой) кислоты,
пропионовый ангидрид
R-C
O
сложные эфиры
R-C
O
OR
1
O
OC
2
H
5
H-C
этилметаноат, этиловый эфир метановой
(муравьиной) кислоты, этилформиат
CH
3
-C
O
OCH
3
метилэтаноат,
метиловый эфир этановой
(уксусной) кислоты,
метилацетат
136

CH
3
-CH
2
-C
O
OC
2
H
5
этилпропаноат,
этиловый эфир пропановой
(пропионовой) кислоты,
этилпропионат
R-C
O
O M
O
ONa
H-C
соли
M - металл
метаноат натрия,
натриевая соль муравьиной
кислоты, формиат натрия
CH
3
-C
O
ONa
R-C
O
O
R-C
M
O
O
+2
этаноат натрия,
натриевая соль уксусной
кислоты, ацетат натрия
CH
3
-CH
2
-C
O
O
2
Ca
пропаноат кальция,
кальциевая соль пропановой
(пропионовой )кислоты
R-C
NH
2
O
амиды
O
NH
2
H-C
амид метановой
(муравьиной) кислоты,
формамид
R-C
NH-R
/
O
O
NH-CH
3
H-C
N-метилформамид
R-C
N
O
R
/
R
/
O
N(CH
3
)
2
H-C
N,N-диметилформамид
CH
3
-C
O
NH
2
амид этановой (уксусной)
кислоты, ацетамид
137
