Борисова Т.Н., Варламов А.В., и др. Основы органической химии
Подождите немного. Документ загружается.

Борисова Т.Н., Варламов А.В., Сорокина Е.А.,
Воскресенский Л.Г., Никитина Е.В.
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
ДЛЯ СТУДЕНТОВ МЕДИЦИНСКОГО ФАКУЛЬТЕТА
СПЕЦИАЛЬНОСТИ “ФАРМАЦИЯ”
Москва
2007

3
ОСНОВНЫЕ ПОНЯТИЯ
I. Типы связей в органических соединениях
1. Ковалентная
– это связь, образованная за счет обобществления
электронов двух атомов. Имеется два механизма образования ковалентной
связи:
а) при ковалентном механизме образования каждый из атомов, образующих
связь предоставляет по одному электрону:
1ē + 1ē (ē - электрон)
Примеры
Н-Н – ковалентная неполярная
Н-Cl – ковалентная полярная;
Полярность связи (поляризация связи) обозначается в органической химии с
помощью частичных зарядов ( δ ) и соответствует разнице в
электроотрицательности элементов (см. ниже соответствующую таблицу).
Например, CH
3
+δ
→Br
-δ
, H
+δ
→Br
-δ
б) при донорноакцепторном механизме образования один из атомов
предоставляет неподеленную пару электронов (НПЭ), а другой – вакантную
орбиталь.
2 ē + ( - вакантная орбиталь)
Примеры
NH
3
CH
3
NH
2
NH
4
CH
3
NH
3
H
H
+
+
2. Семиполярная – ковалентная связь, дополненная электростатическим
взаимодействием атомов (образована по донорно-акцепторному механизму).
CH
3
(CH
3
)
3
N
(CH
3
)
3
N⎯BF
3
(CH
3
)
3
N
BF
3
+
+
атом кислорода
OCH
3
BF
3
+
CH
3
O CH
3
BF
3
O
(CH
3
)
3
N O
3. Ионная – электростатическая связь между противоположно заряженными
ионами.
В органических соединениях из-за значительной разницы в
электроотрицательности элементов ионными являются связи между атомами
углерода (в sp-гибридизации), кислорода, азота, серы и щелочными и
щелочноземельными металлами.

4
Примеры
CH C Na CH
3
O Na CH
3
C
O
O
K
ацетиленид натрия
метилат натрия ацетат калия
CH
3
C
O
O
CH
3
C
O
O
Ca
+2
CH
3
NH Na
CH
3
S
K
ацетат кальция
метиламид натрия метилтиолат калия
(CH
3
COO)
2
Ca
Электроотрицательность элементов по Полингу.
Li 1,0 Be 1,5 B 2,0 H 2,1 C 2,5 N 3,0 O 3,5 F 4,0
Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 S 2,5 Cl 3,0
K 0,8 Ca 1,0 Se 2,5 Br 2,8
Rb 0,8 Sr 1,0 I 2,5
Cs 0,7 Ba 0,9
Данные по атому углерода
: C
sp3
2,5
C
sp2
2,8
C
sp
3,1
II. Типы гибридизаций атомов, участвующих в образовании органических
соединений
Для атома углерода.
1. Исходное невозбужденное состояние
(ИНС) 1s
2
2s
2
2p
2
Атом С имеет четыре валентных ē.
2s
2p
1s
2. Варианты перераспределения валентных электронов атома углерода за счет
гибридизации
Гибридизация
– выравнивание валентных электронных облаков по форме и
энергии. Гибридные орбитали изображаются в виде несимметричных гантелей.
1) Валентные ē sp
3
-гибридизованного атома углерода участвуют в
образовании четырех равноценных σ- связей с помощью 4-х неспаренных ē.
sp
3
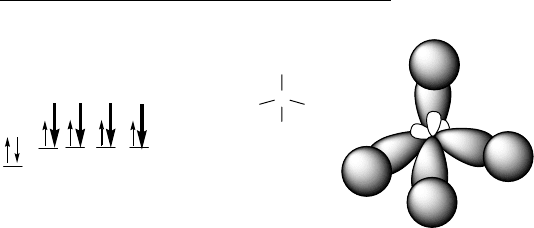
5
Оси четырех sp
3
– орбиталей направлены к вершинам
тетраэдра, валентные углы равны 109
о
28
′
.
Для изображения СН-связей в молекуле метана (СН
4
) возможны два
варианта: а) схема заполнения подуровней; б) объемная модель.
Модели молекул метана и этана.
2sp
3
1s
H
H
HH
а)
б)
C
H
H
H
H
CH
3
-CH-O−CH
2
-CH
3
Cl
KC≡N
CH
3
OH
KOH
спирт, t
0
C
CH
3
-CH
2
-O−CH-C≡N
CH
3
CH
3
-CH-O−CH
2
-CH
3
OCH
3
CH
2
=CH-O−CH
2
-CH
3
1
2
12
1
2
3
1-этоксиэтен,
винилэтиловый эфир
нитрил 2-этокси-
пропановой кислоты
1-этокси-1-метоксиэтан
-HCl
-KCl
-HCl
ТИОЛЫ
(тиоспирты, меркаптаны)
Номенклатура
CH
3
-S-H метантиол, метилмеркаптан
CH
3
-CH
2
-S-H этантиол, этилмеркаптан
Методы получения
1. CH
3
-I + Na SH
CH
3
-SH + NaI
2. CH
3
-CH=CH
2
H
2
S
CH
3
-CH-CH
3
SH
H
2
S
hυ
CH
3
-CH
2
-CH
2
-SH
пропантиол-1
пропантиол-2
Реакционная способность
R-S←H
+
δ
−δ
1. SH-Кислоты, слабые.
R-S-H > R-O-H
как кислоты
2. Нуклеофилы.
R-S-H>R-O-H
как нуклеофилы
как нуклеофилы
R-S > R-O
тиолат-
анион
102
Некоторые свойства тиоспиртов
1. Тиолы как кислоты и нуклеофилы.
CH
3
-CH
2
-SH
Na
NaOH
CH
3
-CH
2
-S Na
+ H
2
-H
2
O
этантиолат натрия
CH
3
-CH
2
-S Na
+ CH
3
-CH
2
-Br
S
N
2
-NaBr
CH
3
-CH
2
-S-CH
2
-CH
3
диэтилсульфид
S
N
2
CH
3
-CH=CH
2
CH
3
-S←H
+δ
−δ
H
CH
3
-CH-CH
3
S-CH
3
метилизопропил
сульфид
Ad
E
2. Некоторые специфические свойства тиолов.
CH
3
-CH
2
-SH
KMnO
4
I
2
-2HI
400
0
C
CH
3
-CH
2
-S-S-CH
2
-CH
3
CH
2
=CH
2
+ H
2
S
дисульфид
CH
3
-CH
2
-SO
3
H
этилгидросульфат
ТИОЭФИРЫ
(органические сульфиды)
Номенклатура
CH
3
-S-CH
3
диметилсульфид
CH
3
-S-CH
2
-CH
3
метилэтилсульфид
Методы получения
+Na
2
S
CH
3
-S-CH
3
+ NaI
CH
3
-CH=CH
2
H
2
S
CH
3
-CH
2
-S Na
CH
3
-CH
2
-S-CH
3
диметилсульфид
CH
3
-I
+CH
3
-I
+ NaI
метилэтилсульфид
CH
3
-CH-S-CH-CH
3
CH
3
CH
3
диизопропилсульфид
2
2
103
Реакционная способность
Более слабые основания, чем простые эфиры, но обладают бо́льшей
нуклеофильностью.
Некоторые свойства тиоэфиров
CH
3
-S-CH
3
CH
3
-CH
2
-Br
CH
3
-S-CH
2
-CH
3
CH
3
Br
бромид диметилэтилсульфония
S
N
2
Аналогично идет реакция со спиртами в присутствии минеральных
кислот и с диалкилсульфатами. Тиоэфиры легко окисляются:
KMnO
4
CH
3
SCH
3
O
O
CH
3
-S-CH
3
H
2
O
2
CH
3
COOH
HNO
3
CH
3
-S-CH
3
O
диметилсульфон
диметилсульфоксид
АМИНЫ
Функциональная группа: -NH
2
аминогруппа
Классификация
– по числу алкильных групп любого типа при атоме азота.
CH
3
-NH
2
CH
3
-CH-NH
2
CH
3
первичные
метанамин
метиламин
2-пропанамин
изопропиламин
CH
3
-NH-CH
3
CH
3
-CH-CH
2
-NH-CH
3
CH
3
вторичные
N-метилметанамин
диметиламин
1-N-метил-2-метилпропанамин,
метилизобутиламин
1
2
3
CH
3
-N-CH
3
CH
3
-CH-CH
2
-N-CH
3
CH
3
третичные
N,N-диметилметанамин
триметиламин
1-N,N-диметил-2-метилпропанам
ин
диметилизобутиламин
1
2
3
CH
3
CH
3
Кроме названий по IUPAC, амины общепринято называют, используя
названия углеводородных остатков.
Методы получения
1. Аммонолиз спиртов
CH
3
-OH
NH
3
Al
2
O
3,
500
0
C
CH
3
-NH
2
+ H
2
O
метанамин, метиламин
104
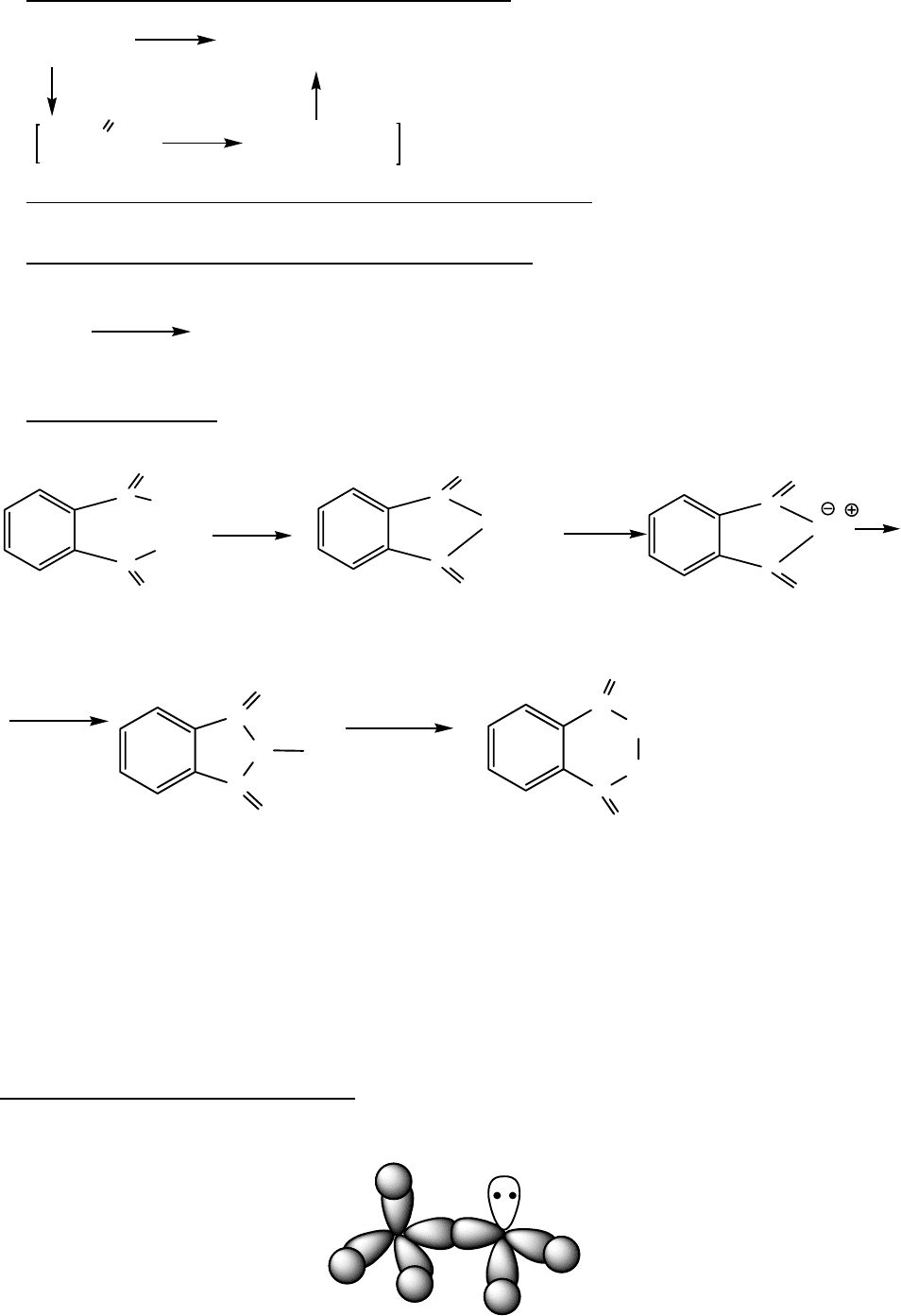
2. Восстановительное аминирование спиртов (альдегидов)
CH
3
CH
2
-OH
NH
3
Cu, 250
0
C, p
CH
3
-CH
2
-NH
2
-H
2
CH
3
-C-H
O
NH
3
CH
3
-CH=NH
этанамин, этиламин
+ H
2
O
+ H
2
3. Каталитическое гидрирование амидов и нитрилов
(см. в теме “Кислоты”)
4. Каталитическое гидрирование нитроалканов
2H
2
Ni (Pt, Pd)
CH
3
-NH
2
+ 2H
2
O
CH
3
NO
2
5. Синтез Габриэля
NH
3
C
O
OH
C
O
OH
t
0
C
-H
2
O
C
O
C
O
N←H
+δ
−δ
KOH
-H
2
O
C
O
C
O
N K
фталевая кислота
фталимид фталимид калия
R
п
-Br
-KBr
NH
2
-NH
2
+
R
п
-NH
2
гидразид фталевой кислоты
алкиламин
R
п
-первичный алкил
C
NH
NH
C
O
O
C
N
C
O
O
R
n
Строение и изомерия аминов
Амины и их четвертичные соли (основания), как и аммиак имеют
пирамидальное (тетраэдрическое) строение.
Модель молекулы метиламина
C
N
105
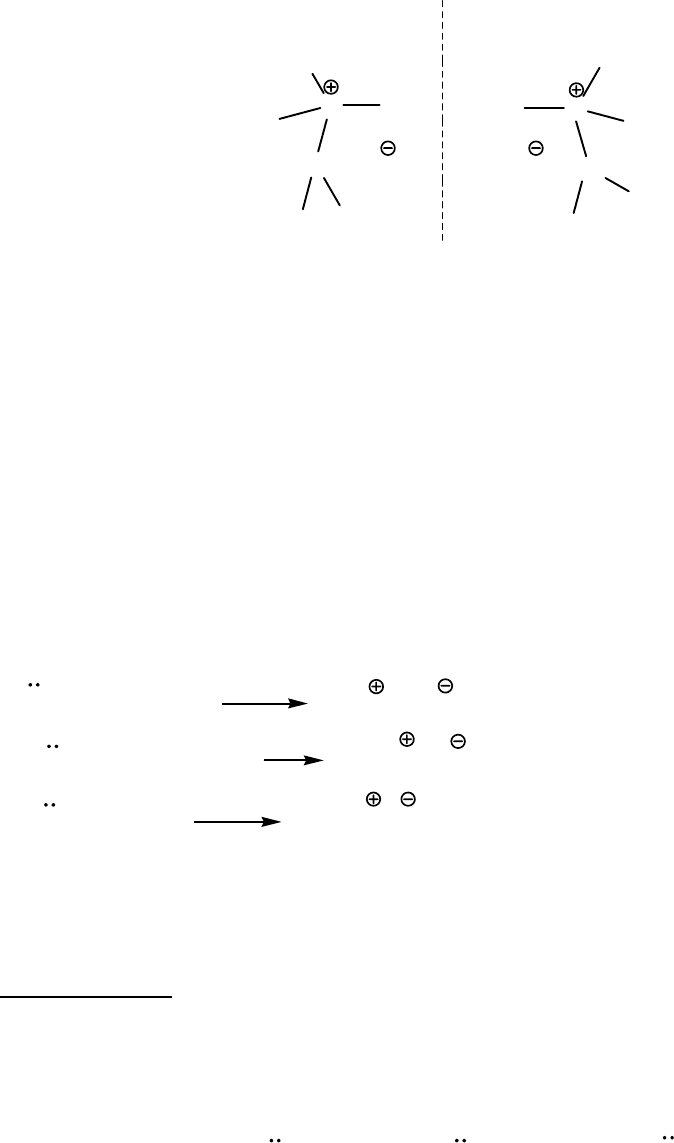
Четвертичные соли и основания при наличии четырех различных
заместителей у атома азота являются асимметрическими и обладают
оптической активностью.
N
CH
3
CH
2
CH
3
CH
2
CH
2
CH
CH
3
CH
3
CH
3
N
CH
2
CH
3
CH
2
CH
2
CH
3
CH
CH
3
CH
3
CH
3
I
I
энантиомеры иодида метилэтилпропилизопропиламмония
Реакционная способность аминов
Амины обладают осно́вными и нуклеофильными свойствами,
обусловленные наличием НПЭ у атома азота. Амины являются слабыми NH-
кислотами.
1. Осно́вные свойства аминов
Амины, реагируя с кислотами при 20
0
С, образуют соли, а с водой –
гидроксиды.
CH
3
-NH
2
+ H→Cl
−δ
+δ
CH
3
-NH
3
Cl хлорид метиламмония
(CH
3
)
2
NH
+ H→ OSO
3
H (CH
3
)
2
NH
2
гидросульфат диметиламмония
OSO
3
H
+δ
−
δ
(CH
3
)
3
N
+ H→OH
(CH
3
)
3
NH
OH гидроксид триметиламмония
+δ
−
δ
Насколько легко атом азота аминов связывается с протонами зависит от
электронного характера заместителей (донор, акцептор) при атоме азота и
степени сольватации образовавшегося катиона.
а) в газовой фазе
На основность аминов в газовой фазе влияют только электронные
эффекты заместителей. Доноры увеличивают электронную плотность на атоме
азота, следовательно увеличивают основные свойства амина. Соответственно
акцепторные группы снижают основность.
CH
3
→NH
2
CH
3
→NH←CH
3
CH
3
→N←CH
3
↑
CH
3
>>
pK
b
9,8 10,7 10,6
106
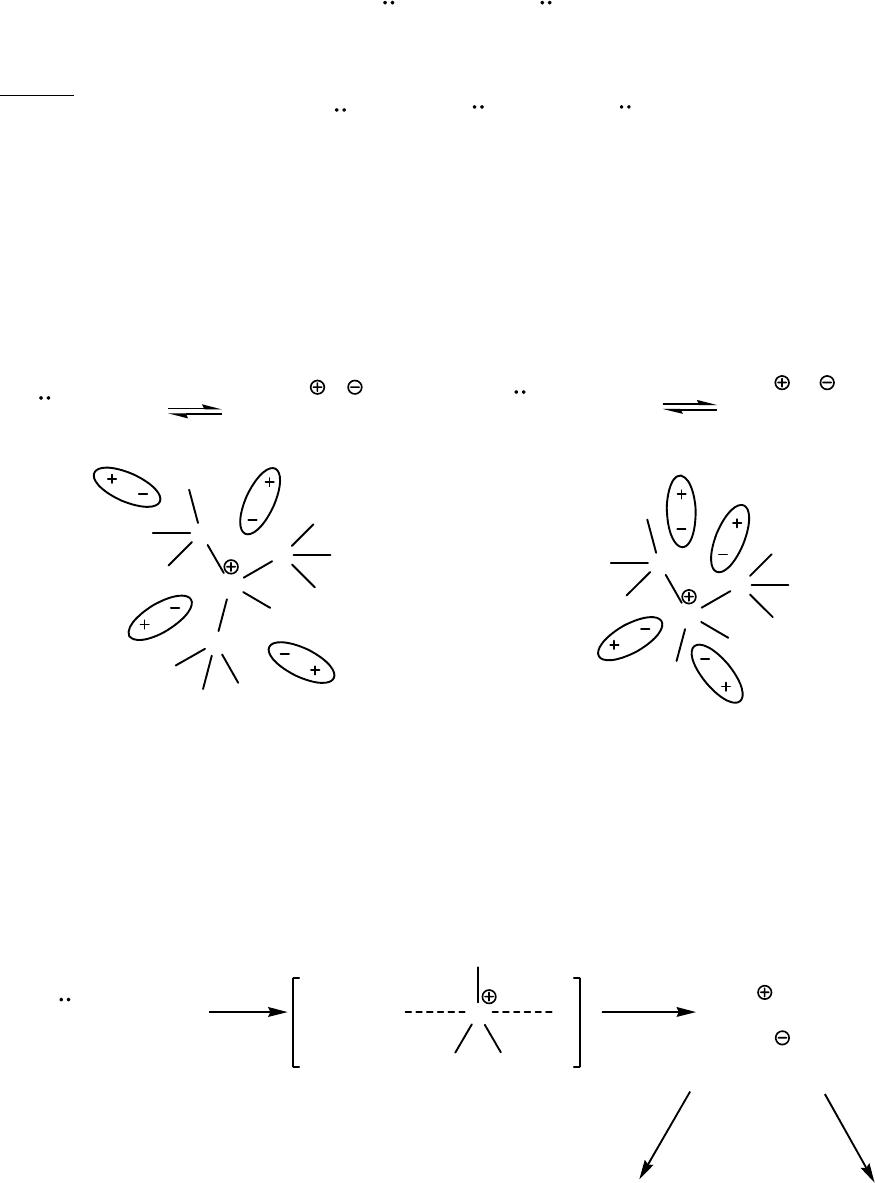
CF
3
←NH
2
< CH
3
→NH
2
б) в воде
CH
3
−NH
2
(CH
3
)
2
NH
(CH
3
)
3
N
>
>
pK
b
3,26 3,35 4,22
В воде диметиламин - более сильный амин, чем триметиламин. Это
связано с тем, что образующиеся из этих аминов катионы по-разному
сольватированы молекулами воды. Сильно разветвленный
триметиламмониевый катион менее эффективно сольватируется, чем
диметиламмониевый, вследствие этого менее стабилен и легко распадается.
+δ−δ
(CH
3
)
3
N + H→OH
(CH
3
)
3
NH OH
+
δ
−
δ
CH
3
NH
2
+ H→OH
CH
3
NH
3
OH
N
C
H
C
C
H
H
H
H
H
H
H
H
H
N
C
H
H
C
H
H
H
H
H
H
катионный центр малодоступен катионный центр стабилизирован
диполями воды
2. Нуклеофильные свойства
1. Алкилирование (реакция Гофмана)
а) моноалкилирование
CH
3
−NΗ
2
−CH
3
CH
3
−NH
2
а)+ CH
3
-I
S
N
2
CH
3
−NH
2
C
H
H
H
I
I
NaOH
NH
3
изб.
CH
3
−NH−CH
3
CH
3
−NH−CH
3
+
+ NaI + H
2
O
NH
4
I
йодид диметиламмония
− δ
− δ
При моноалкилировании аминов образуется четвертичная соль, из
которой новый амин можно выделить действием более сильного основания или
избытком аммиака.
б) Исчерпывающее метилирование – реакция амина с избытком йодистого
метила (возможно исчерпывающее алкилирование).
107
