Биронт В.С. и др. Механические свойства сплавов и фазовые превращения
Подождите немного. Документ загружается.


ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1
Механические свойства металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-11-
хрупких материалов является характеристикой сопротивления разрушению, а
для пластичных – характеристикой сопротивления деформации.
Напряжение разрушения определяют как истинное. При этом нагруз-
ку разрушения делят на конечную площадь поперечного сечения образца по-
сле разрушения F
к
:
ê
ê
ê
P
S.
F
=
Все рассчитанные таким образом величины являются характеристи-
ками прочности материала.
Пластичность, т.е. способность деформироваться без разрушения,
характеризуется изменениями размеров образца. При испытании на разрыв
определяют следующие характеристики пластичности:
относительное удлинение
ê0
0
100%
−
δ=
⋅
ll
l
;
относительное сужение
0к
0
FF
100 %
F
−
Ψ=
⋅
,
где l
к
, F
к
–
соответственно, длина рабочей части и площадь поперечного сече-
ния образца после разрыва.
Рассчитанные характеристики механических свойств после испытания
на растяжение заносятся в протокол.
Испытания на ударный изгиб. Ударная вязкость характеризует
удельную работу, затрачиваемую на разрушение при ударе образца с надре-
зом. Ударная вязкость испытывается на маятниковом копре с постоянным
запасом работы маятника по ГОСТ 9454-78 «Металлы. Метод испытания на
ударный изгиб при пониженной, комнатной и повышенной температурах».
Стандарт распространяется на черные и цветные металлы и сплавы и уста-
навливает метод испытания при температурах от –100 до +1 000 °С. Метод
основан на разрушении ударом маятникового копра образца с концентрато-
ром напряжений. В результате испытания определяют полную работу, затра-
ченную при ударе К, или ударную вязкость КС.
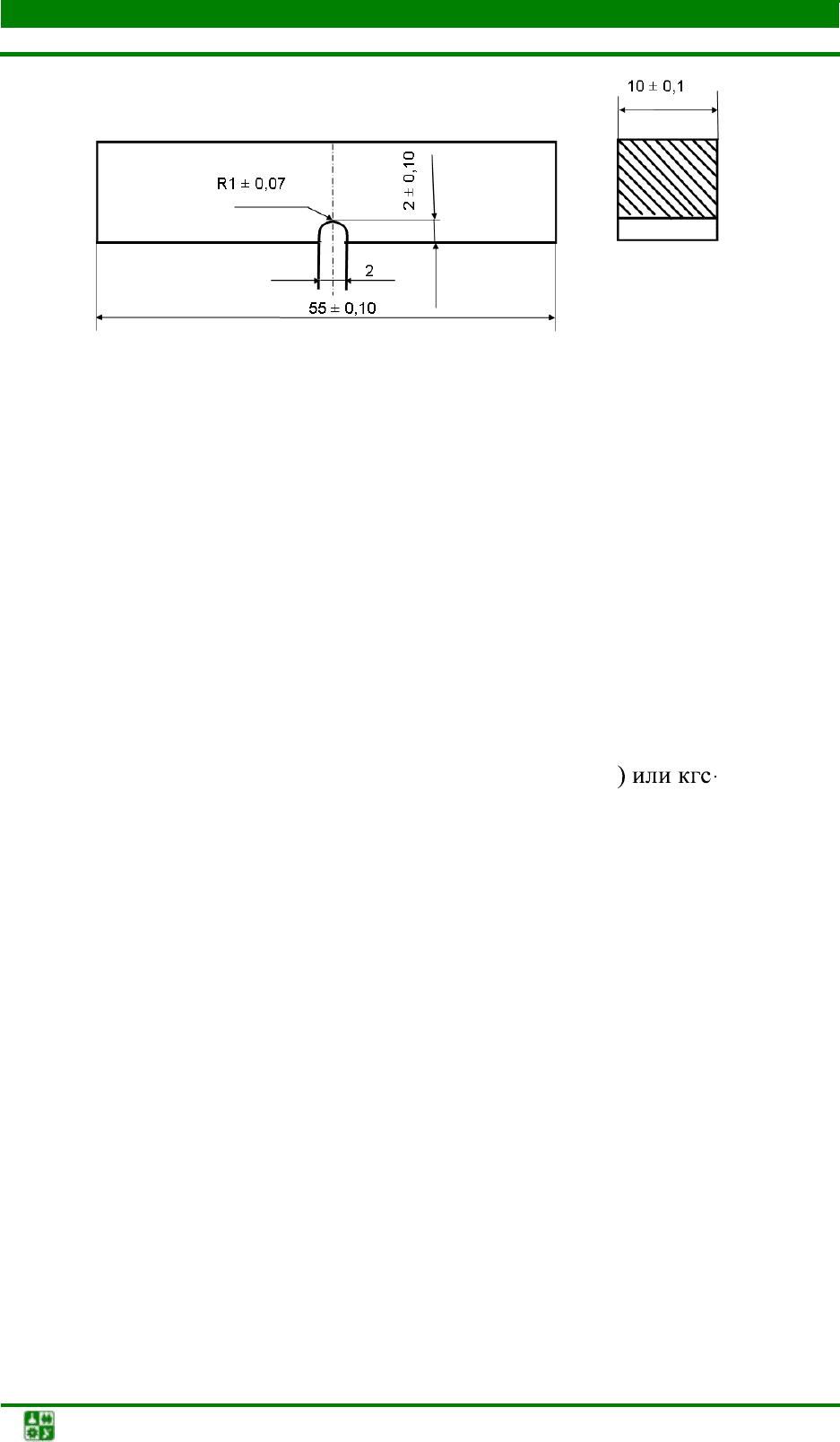
Используют образцы прямоугольной формы с концентратором типа
U, V, T (усталостная трещина). Наиболее распространенными образцами яв-
ляются образцы размерами 55×10×10 мм с U-концентратом 2×2 мм (рис. 1.6
).
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1
Механические свойства металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-12-
Рис. 1.6. Стандартный образец с U-образным
надрезом для испытаний на ударный изгиб
На разрушение ударом образца затрачивается только часть энергии
маятника, в связи с чем маятник после разрушения образца продолжает дви-
гаться, отклоняясь на определенный угол. Чем больше величина работы, за-
трачиваемой на разрушение образца, тем на меньший угол он отклоняется от
вертикали после разрушения. По величине этого угла и определяют работу
удара К или работу, затраченную на разрушение образца. Работу разрушения
K относят к площади поперечного сечения образца S
0
в месте излома и тем
самым находят KC – ударную вязкость:
0
KC K/S=
,
где К измеряется в Дж (кгс·м), S
0
– в м
2
(см
2
).
В зависимости от вида концентратора ударная вязкость обозначается
KCU, KCV, KCT и имеет размерность МДж/м
2
(МДж/см
2
м/см
2
.
К
К
о
о
н
н
т
т
р
р
о
о
л
л
ь
ь
н
н
ы
ы
е
е
в
в
о
о
п
п
р
р
о
о
с
с
ы
ы
и
и
з
з
а
а
д
д
а
а
н
н
и
и
я
я
1. Охарактеризовать типы механических испытаний.
2. Как определить твердость по Бринеллю? Каковы условия испыта-
ний, значения твердости?
3. Как определить твердость по Роквеллу? Каковы условия испыта-
ний, значения твердости?
4. Как определить твердость по Виккерсу? Каковы условия испыта-
ний, значения твердости?
5. Записать единицы измерения твердости по Бринеллю, Роквеллу и
Виккерсу.
6. Какие методы испытаний механических свойств относят к статиче-
ским, динамическим и циклическим испытаниям?
7. Изобразить первичную диаграмму растяжения для пластичного ма-
териала.
8. Как по диаграмме растяжения определить временное сопротивле-
ние разрыву?
9. Какие построения необходимо провести на диаграмме растяжения
для определения предела текучести?

ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 1
Механические свойства металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-13-
10. Какие типы образцов используют для расчета механических
свойств при испытании на растяжение?
11. По каким формулам определяют временное сопротивление разры-
ву и предел текучести?
12. По каким формулам находят относительное удлинение и относи-
тельное сужение?
13. Какие характеристики вычисляют при испытании на ударный изгиб?
14. Какие образцы используют при испытании на ударный изгиб?
15. Чем различается ударная вязкость, обозначаемая КСU , КСV,
КСТ?
З
З
а
а
д
д
а
а
н
н
и
и
е
е
п
п
о
о
с
с
а
а
м
м
о
о
с
с
т
т
о
о
я
я
т
т
е
е
л
л
ь
ь
н
н
о
о
й
й
р
р
а
а
б
б
о
о
т
т
е
е
Определить механические характеристики по результатам испытаний
на растяжение и ударный изгиб образцов из алюминиевых сплавов и инстру-
ментальных сталей.
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-14-
П
П
Р
Р
А
А
К
К
Т
Т
И
И
Ч
Ч
Е
Е
С
С
К
К
О
О
Е
Е
З
З
А
А
Н
Н
Я
Я
Т
Т
И
И
Е
Е
2
2
К
К
р
р
и
и
с
с
т
т
а
а
л
л
л
л
и
и
з
з
а
а
ц
ц
и
и
я
я
м
м
е
е
т
т
а
а
л
л
л
л
о
о
в
в
Ц
Ц
е
е
л
л
ь
ь
з
з
а
а
н
н
я
я
т
т
и
и
я
я
:
:
изучить процессы и механизмы гомогенной и гетерогенной кристал-
лизации металлов, изменение свободной энергии системы, кристаллизацион-
ные параметры, форму и размеры кристаллов.
С
С
о
о
д
д
е
е
р
р
ж
ж
а
а
н
н
и
и
е
е
р
р
а
а
б
б
о
о
т
т
ы
ы
:
:
1. Изучить теоретический материал.
2. Рассмотреть факторы, влияющие на форму и размер зерен в литом
металле.
3. Провести анализ механизмов роста различных кристаллов.
К
К
р
р
а
а
т
т
к
к
и
и
е
е
т
т
е
е
о
о
р
р
е
е
т
т
и
и
ч
ч
е
е
с
с
к
к
и
и
е
е
с
с
в
в
е
е
д
д
е
е
н
н
и
и
я
я
Кристаллизация металлов может осуществляться как при переходе из
жидкого состояния в твердое, так и в твердом состоянии при переходе из од-
ной аллотропической формы в другую. Во втором случае такое превращение
носит название фазовая перекристаллизация.
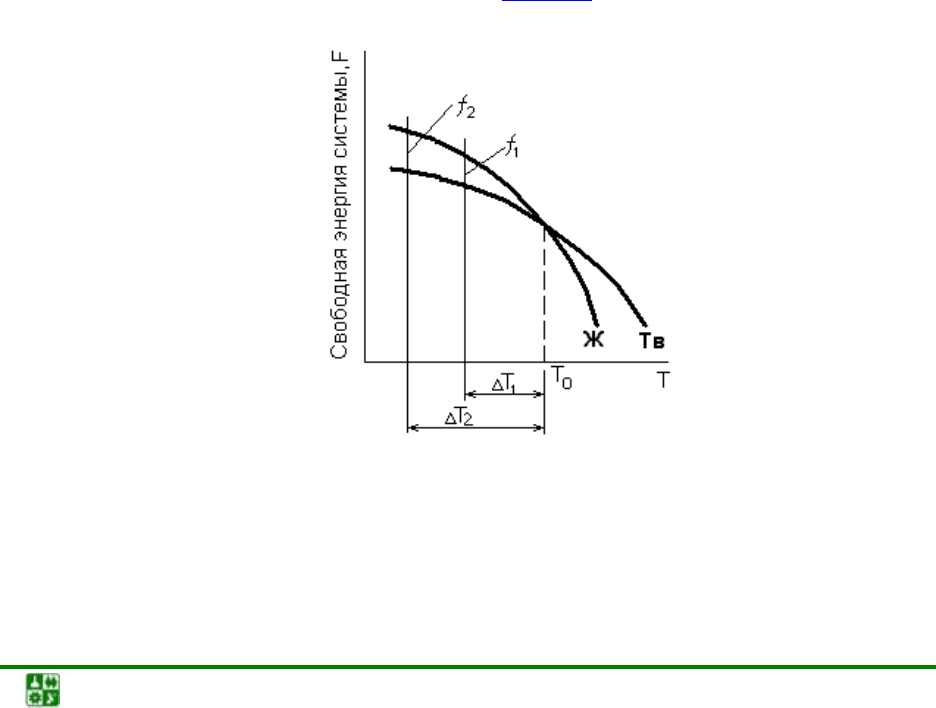
Кристаллизация металлов, кривые охлаждения. Зависимость сво-
бодной энергии Гиббса жидкой и твердой фаз от температуры. Основной
причиной и движущей силой процесса кристаллизации является стремление
вещества к устойчивому в термодинамическом отношении состоянию, т.е. к
наименьшему запасу свободной энергии (рис. 2.1
).
Рис. 2.1. Зависимость изменения свободной энергии системы жидкой и твердой
фаз от температуры

ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2
Кристаллизация металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-15-
Температура Т
0
соответствует равенству свободных энергий твердой и
жидкой фаз и является температурой фазового равновесия плавления или
кристаллизации.
При температуре Т
1
> Т
0
запас свободной энергии жидкой фаз меньше,
чем твердой. В этих условиях устойчивой фазой будет жидкость. При пони-
жении температуры ниже Т
0
меньшей энергией обладает твердая фаза, кото-
рая и становится стабильной в данных условиях, т.е. f
тв
< f
ж
.
В условиях переохлаждения ΔТ образование кристалла объемом V
приводит к снижению объемной свободной энергии:
ΔF
об
= V·Δf,
где Δf – удельная объемная энергия.
Изучение кривых охлаждения реальных металлов показывает, что за-
твердевание начинается не при температуре Т
0
, а при Т
S
< Т
0
. Это объясня-
ется тем, что при образовании новой фазы должна появиться граница между
двумя фазами, на что расходуется часть свободной энергии системы. Тем-
пература Т
S
называется температурой затвердевания, разность температур
ΔТ = Т
0
– Т
S
– степенью переохлаждения.
При кристаллизации происходит выделение скрытой теплоты пре-
вращения, что приводит к остановке в понижении температуры, а на кривой
охлаждения фиксируется площадка. В некоторых случаях выделение теплоты
при кристаллизации настолько велико, что температура поднимается не-
сколько выше температуры Т
S
.
Необходимость переохлаждения при кристаллизации обусловлена ря-
дом причин. Затвердевание жидкости начинается с образования зародышей
очень малых размеров и приводит к образованию межфазной границы между
жидкой и твердой фазами. Такая граница на начальном этапе кристаллизации
характеризуется большой относительной протяженностью по отношению к
объему формирующихся кристаллов. При этом известно, что любая граница
является своеобразным дефектом кристаллического строения, а следователь-
но, обладающей более высоким уровнем свободной энергии по сравнению со
свободной энергией жидкости и твердой фазы.
Образование границы – поверхности раздела – требует затраты по-
верхностной свободной энергии Δ F
пов
, которая пропорциональна удельной
величине поверхностного натяжения на границе раздела фаз σ и протяженно-
сти поверхности твердой частицы S:
ΔF
пов
= S ⋅ σ = 4πr
2
⋅ σ,
где r – радиус частиц.
Поскольку процессы, протекающие с увеличением свободной энер-
гии, не могут происходить самопроизвольно, то при температуре Т
0
появле-
ние стабильных кристаллов оказывается невозможным.
Наличие флуктуаций энергии, однако, приводит к непрерывному по-
явлению и исчезновению твердой фазы таким образом, что суммарная энер-
гия системы не изменяется и процесс кристаллизации не происходит.

ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2
Кристаллизация металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-16-
В условиях переохлаждения свободная энергия системы уменьшается
на величину объемной свободной энергии ΔF
об
, пропорциональную удельной
энергии превращения Δf и объему твердой частицы:
ΔF
об
=
3
4
f V f r.
3
∆⋅ =∆⋅ π
Таким образом, суммарная величина свободной энергии системы при
кристаллизации равна
ΔФ = –ΔF
об
+ ΔF
пов
или
23
4
Ф S fV 4r f r
3
∆ = ⋅σ−∆ ⋅ = π σ−∆ ⋅ π
.
Если анализируют изменение энергии Гиббса при кристаллизации, то
результирующее изменение энергии Гиббса описывают выражением
ΔG = – ΔG
об
+ ΔG
пов
или ΔG
об
= – VΔg
об
+ Fγ,
где
Δg
об
– удельная объемная энергия; F – площадь межфазной поверхности
кристалла; γ
– удельная межфазная поверхностная энергия.
Если представить кристалл в виде куба с ребром а, то формула примет
вид
ΔG = – a
3
Δg
об
+ 6a
2
γ.
Гомогенная и гетерогенная кристаллизация, зарождение кристал-
лов. Понятие критического зародыша. Кристаллизационные параметры
Таммана. Процесс кристаллизации состоит из следующих двух стадий:
1) образование центров кристаллизации (зародышей);
2) рост кристаллов вокруг этих центров.
Первый процесс может идти двумя путями: гомогенным и гетероген-
ным. Гомогенное зарождение кристаллов связано с флуктуационным образо-
ванием зародышей в случайных участках объема чистого расплава металлов.
В реальных расплавах такое зародышеобразование происходит крайне редко,
так как в них встречаются нерастворимые частицы (оксиды, нитриды и др.),
являющиеся центрами зародышеобразования. Кристаллизация с гомогенным
образованием зародышей носит название гомогенной или самопроизвольной
кристаллизации.
Нерастворимые частицы расплава или стенки литейной формы явля-
ются готовыми центрами зародышеобразования. Зарождение кристаллов на
готовых центрах, или подложках, называют гетерогенным, а кристаллизацию
с неоднородным зародышеобразованием технически чистых металлов – ге-
терогенной или несамопроизвольной кристаллизацией. Гетерогенное образо-
вание зародышей на готовой подложке энергетически выгодно, так как по-
верхностная свободная энергия F
пов
системы уменьшается, потому что имеет-
ся исходная граница между подложкой и зарождающимся кристаллом, т.е.
нет необходимости формировать новую поверхность. Следовательно, зарож-
дение на готовой поверхности характеризуется меньшим приростом межфаз-
ной поверхностной энергии и, соответственно, меньшей работой образования
критического зародыша. Поэтому в реальных металлических расплавах глав-
ную роль играет гетерогенное зарождение кристаллов.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2
Кристаллизация металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-17-
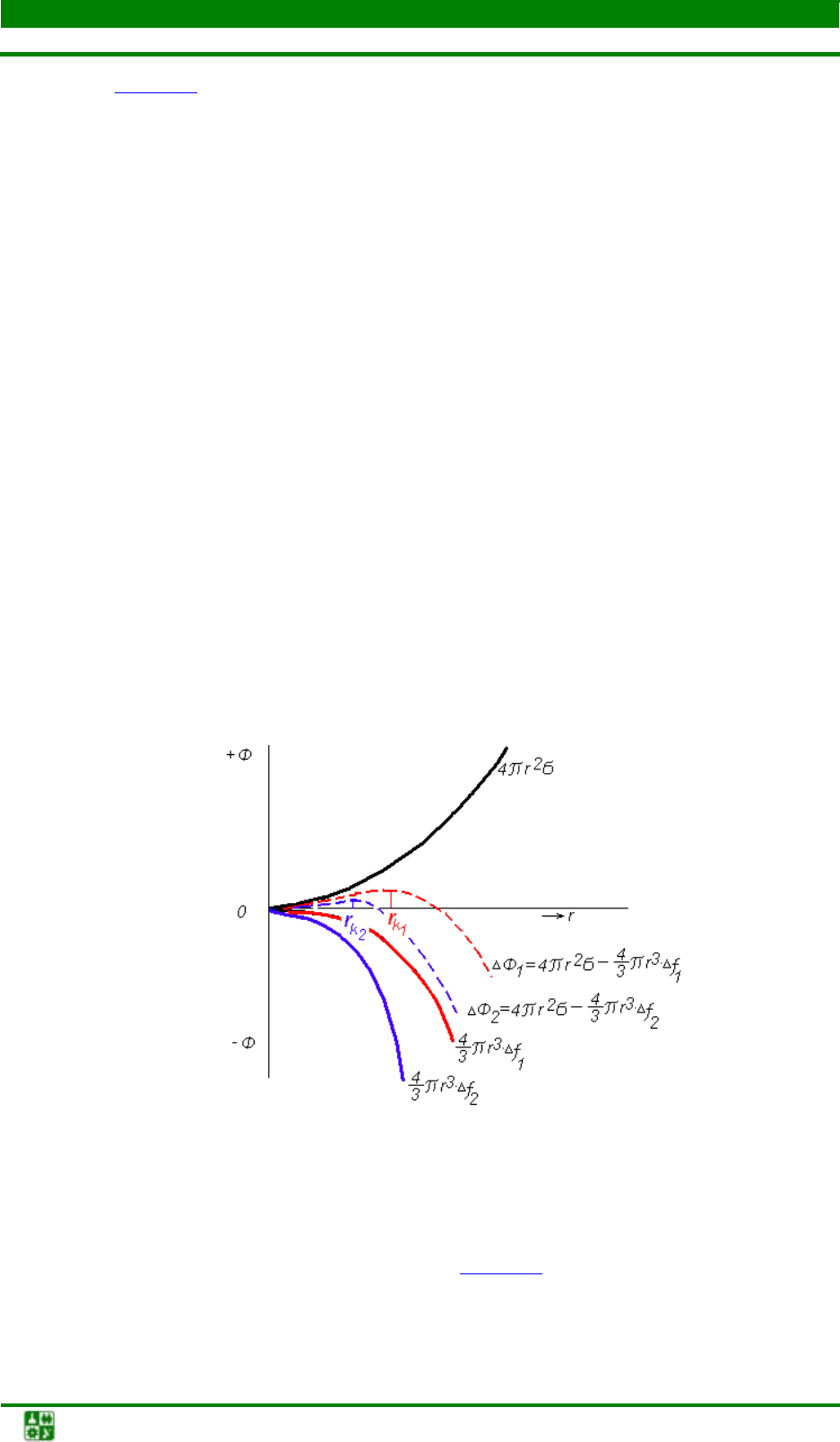
На рис. 2.2 показано изменение суммарной энергии системы при кри-
сталлизации в зависимости от размера зародыша, штриховые линии являются
геометрической суммой объемной и поверхностной энергии – функцией из-
менения величины полной свободной энергии системы. Максимальная точка
на кривых определяется размером зародыша, названным критическим заро-
дышем r
к
. При образовании кристалла размером меньше r
к
свободная энергия
системы Ф возрастает. Если размер кристалла будет равен или больше r
к
, то
свободная энергия системы уменьшается. Таким образом, самопроизвольный
процесс зародышеобразования при гомогенной кристаллизации оказывается
невозможным до тех пор, пока размер кристалла твердой фазы не достигнет
размера r
к
. Переохлаждение ∆Т = Т
0
– Т
S
должно быть таким, чтобы разница
свободных энергий жидкой и твердой фаз
обеспечивала бы появление в сис-
теме запаса свободной энергии, достаточной для образования критического
зародыша.
После образования зародыша критического размера присоединение к
твердым кристаллам новых атомов приводит к значительному увеличению
отрицательного члена выражения Δ Ф = –ΔF
об
+ ΔF
пов
, превышающего рост
поверхностной энергии. В связи с чем рост объема твердой фазы обуславли-
вает непрерывное уменьшение свободной энергии системы, процесс кри-
сталлизации продолжается самопроизвольно. Самопроизвольно процесс мо-
жет развиваться лишь в том случае, если размер образовавшихся частиц
больше критического.
Рис. 2.2. Изменение суммарной свободной энергии системы при кристаллизации
в зависимости от размера образующегося зародыша и степени переохлаждения
Степень переохлаждения оказывает определяющее влияние на размер
критического зародыша. Как показано на рис. 2.2
, чем больше степень пере-
охлаждения, тем меньше размер критического зародыша
r
к
. Это обуславлива-
ется увеличением выигрыша в изменении объемной свободной энергии с по-
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2
Кристаллизация металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-18-
вышением степени переохлаждения, так как размер критического зародыша
описывается выражением
r
к
= 4σ/Δf
об
.
Если металл подвергнуть быстрому охлаждению до температуры ниже
Т
S
,
то кристаллизация при Т
S
произойти не успеет и, следовательно, процесс
образования кристаллов твердой фазы будет осуществляться при более низ-
ких температурах, т.е. в условиях большей степени переохлаждения. Пони-
жение реальной температуры кристаллизации по сравнению с равновесной
температурой кристаллизации (степень переохлаждения) зависит от началь-
ной скорости охлаждения. Применяя различные скорости охлаждения, удает-
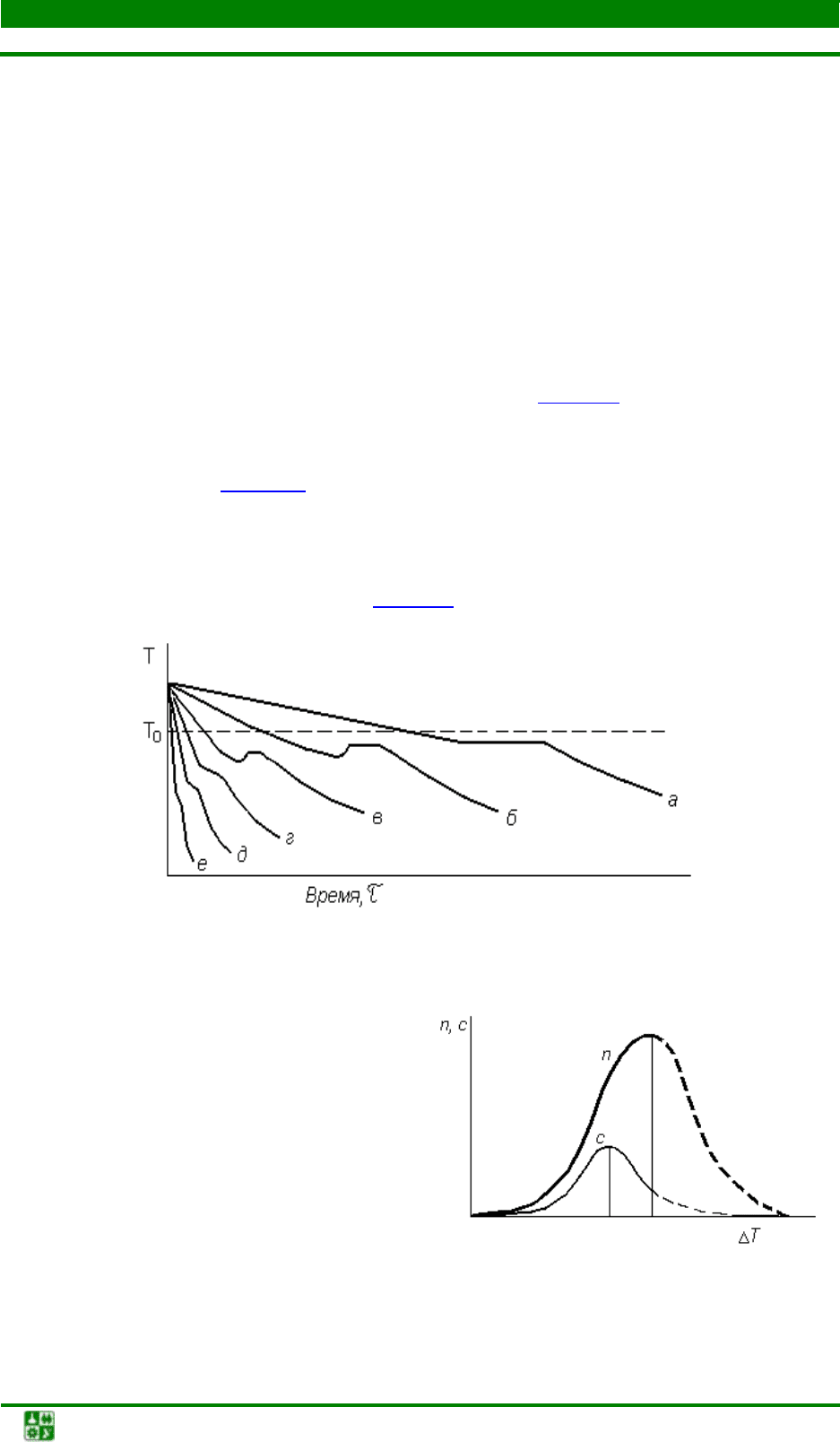
ся получить различные степени переохлаждения (рис. 2.3
).
Кинетика кристаллизации при разных степенях переохлаждения отли-
чается. Это можно видеть из кривых изменения свободной энергии системы:
при ∆Т
2
> ∆Т
1
(см. рис. 2.1), когда f
2
> f
1
и, следовательно, отрицательный
член суммарной свободной энергии системы значительно возрастает по аб-
солютной величине, уменьшая уровень энергии, который необходимо пре-
одолеть для образования критического зародыша, и саму величину критиче-
ского зародыша (индексы 1 и 2 на рис. 2.2
).
Рис. 2.3. Термические кривые кристаллизации при различных скоростях
охлаждения: от а до е – увеличение скорости охлаждения системы
Рис. 2.4. Зависимость кристаллизационных
параметров Таммана от степени переохла-
ждения
Чем меньше критический размер зародыша, тем большее число частиц
сумеют преодолеть критический энергетический барьер и стать зародышами
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2
Кристаллизация металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-19-
критических размеров. Следовательно, чем больше степень переохлаждения,
тем больше зародышей образуется за единицу времени. Зависимость кри-
сталлизационных параметров Таммана от степени переохлаждения показана
на рис. 2.4
, где n – число центров кристаллизации, образующихся в единицу
времени; с – линейная скорость роста кристаллов.
Рост числа зародышей наблюдается не бесконечно. При определенных
низких температурах в связи с естественным уменьшением скорости проте-
кания диффузионных процессов подвижность атомов, необходимая для про-
текания процесса кристаллизации, снижается и теоретически при очень
больших переохлаждениях может уменьшиться до нуля (штриховые части
кривых). Однако для металлов при кристаллизации из жидкого состояния
практически удалось обнаружить только восходящие части кривых Таммана.
Механизмы роста кристаллов. Формы металлических кристал-
лов. После образования центров кристаллизации протекает рост кристаллов
путем последовательного присоединения атомных слоев на поверхности об-
разовавшихся зародышей (рис. 2.5
).
а б в
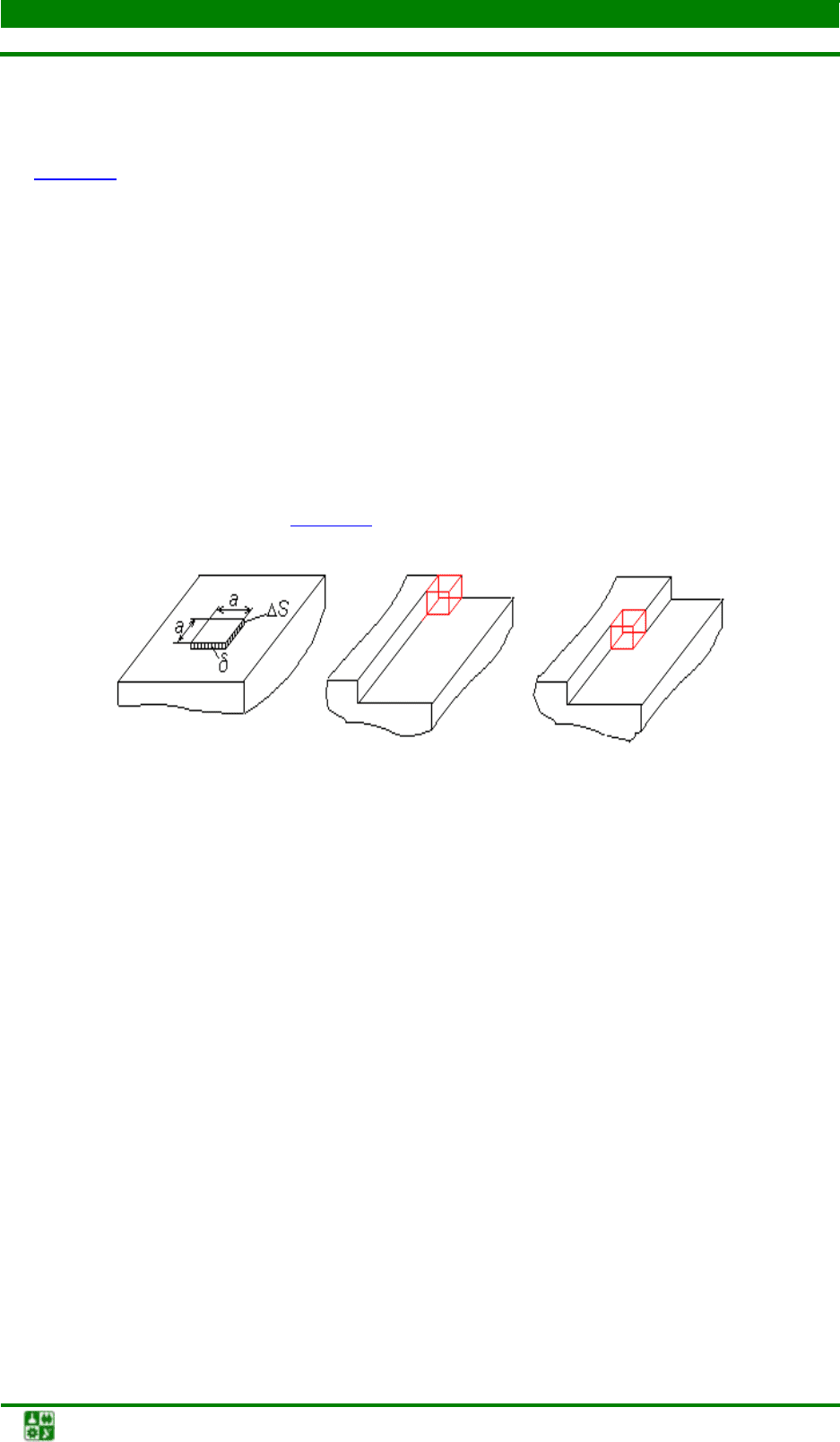
Рис. 2.5. Атомно-гладкая поверхность кристалла; а – одиночный
атом на поверхности; б – присоединение атома к ступеньке;
в – присоединение атома к излому на ступеньке
Рост кристалла происходит путем появления на поверхности кристал-
ла двухмерного зародыша (а), который может иметь размеры меньше или
больше критического. Механизм роста зависит от атомного строения грани-
цы раздела кристалл–жидкость. Используют представление о двух крайних
типах этого строения: атомно-гладкой и атомно-шероховатой границе.
При образовании двухмерного зародыша происходит уменьшение
свободной энергии системы за счет фазового перехода и увеличение ее за
счет образования дополнительной поверхности раздела, т.е.
∆Ф = –∆V ⋅ ∆f + ∆S ⋅ σ.
Таким образом, эта функция оказывается аналогичной для рассмот-
ренного выше трехмерного зародыша, т.е. для условий роста кристалла пу-
тем присоединения двухмерного зародыша на плоскость ранее образовавше-
гося кристалла существует такой размер двухмерного зародыша, меньше ко-
торого он оказывается неустойчивым и растворяется. Такой слой называется
критическим двухмерным зародышем.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ 2
Кристаллизация металлов
Механические свойства сплавов и фазовые превращения. Метод. указания к практическим занятиям
-20-
При малых степенях переохлаждения размер критического двухмер-
ного зародыша велик, поэтому возникающих двухмерных зародышей весьма
мало, и рост кристаллов в этих условиях происходит очень медленно. Чем
больше степень переохлаждения, тем меньше линейные размеры двухмерно-
го зародыша и тем меньшее значение энергии требуется для его образования,
т.е. с увеличением степени переохлаждения скорость роста кристаллов воз-
растает (кривая линейного роста кристаллов аналогична кривой количества
центров кристаллизации, возникающих в единицу времени).
В случае атомно-гладкой границы все позиции атомов поверхностно-
го слоя кристалла заняты (рис. 2.5
). Одиночный атом на гладкой поверхности
слабо связан с кристаллом, поэтому необходимо формирование двухмерного
зародыша. После возникновения двухмерных зародышей рост кристалла об-
легчается с точки зрения уменьшения энергетических затрат при росте кри-
сталла. Наиболее благоприятным участком присоединения атомов к кристал-
лу является тройной пространственный угол, при этом требуется минималь-
ная площадь дополнительно образующейся границы кристалла. Такое при-
соединение происходит до полной достройки атомного слоя; дальнейший
рост возможен только после появления нового двухмерного зародыша. Этот
рост называется боковым или ступенчатым.
Важную роль в процессе роста кристалла играют дефекты кристалли-
ческого строения, в частности винтовая дислокация. При этом рост кристалла
происходит путем заполнения ступеньки по винтовой линии, когда ступенька
в течение всего цикла не исчезает, а только перемещается, обеспечивая не-
прерывный рост кристалла без образования двухмерных зародышей.
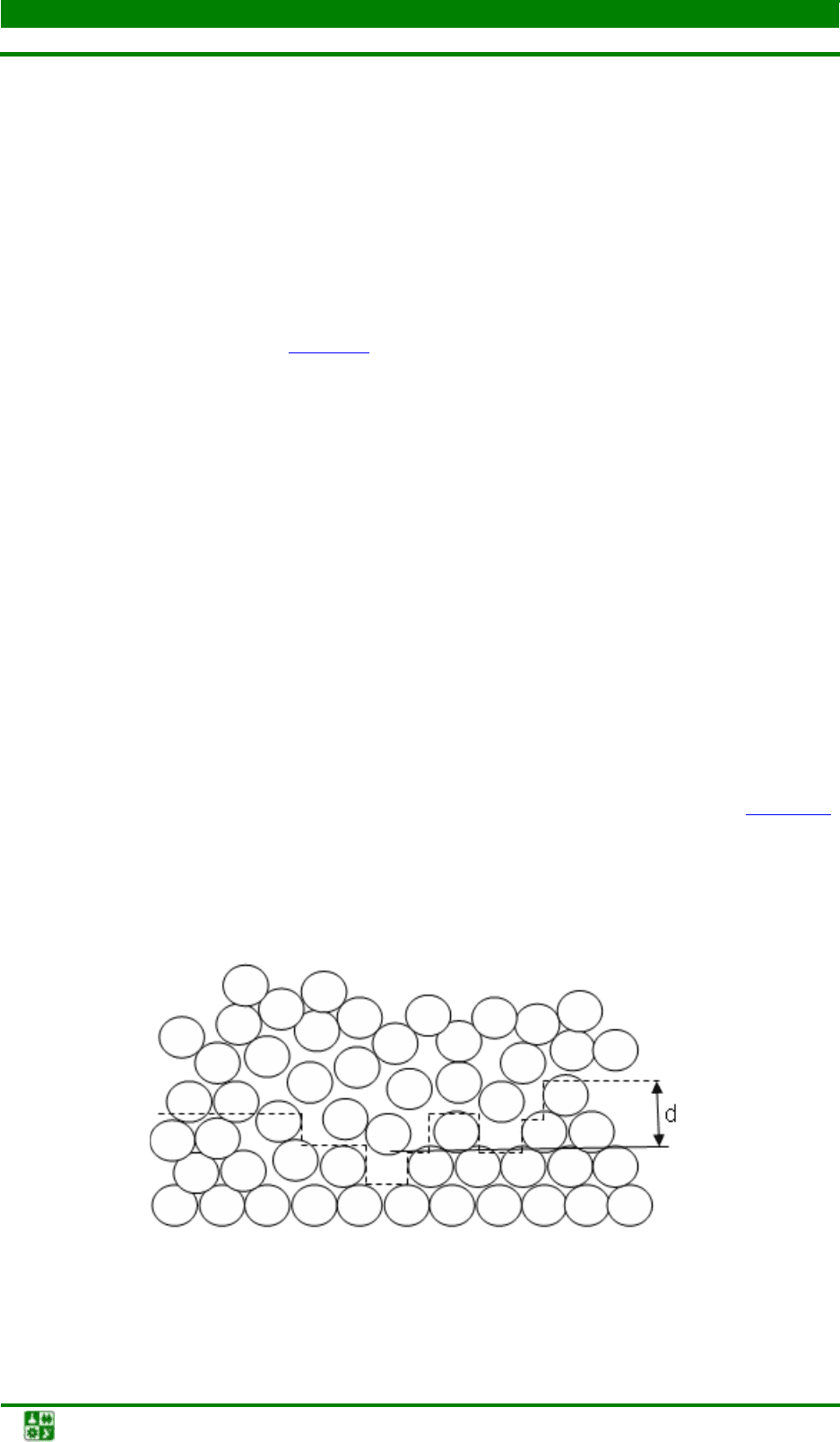
На атомно-шероховатой границе раздела происходит постепенный
переход от структуры расплава к структуре кристалла. На схеме (рис. 2.6
)
пунктир условно отделяет атомы, принадлежащие жидкой фазе, от атомов
твердой фазы. Фактически же граница является размытой и имеет ширину в
несколько атомных диаметров.
Рис. 2.6. Строение атомно-шероховатой поверхности раздела
кристалл–жидкость (d – граница раздела)
Жидкость
