Беломестных В.Н., Теслева Е.П., Чинахов Д.А. Основы современного естествознания
Подождите немного. Документ загружается.

61
тру металла, пары которого были в установке. Оказалось, что это рас-
стояние точно равно напряжению, необходимому для освобождения од-
ного электрона с внешней электронной оболочки атома Hg (потенциалу
ионизации), известному из оптических исследований.
Результат более чем странный, не вписывавшийся в обычные пред-
ставления о свойствах вещества, известные к началу XIX в. Оказалось,
что
энергию электронов в атоме нельзя изменить на произвольную ве-
личину. Она либо меняется порциями, либо не меняется совсем. Причем
эта порция достаточна велика. Следовательно, и энергия частицы (а
не только поля!) меняется порциями – квантами. Франк и Герц по-
лучили Нобелевскую премию в 1925 г.
Таким образом, мы видим, что в
начале XIX в. принципиальным
образом претерпели изменения представления о материи: и о веществе,
и о поле. Но в одном они оставались неизменными: электромагнитное
излучение по своим свойствам считалось резко отличающимся от элек-
тронов и других “частиц” материи. Некоторое сближение наметилось,
когда у излучения были обнаружены свойства, характерные для частиц
– корпускулярные свойства.
Однако волновые свойства считались при-
сущими только электромагнитному полю.
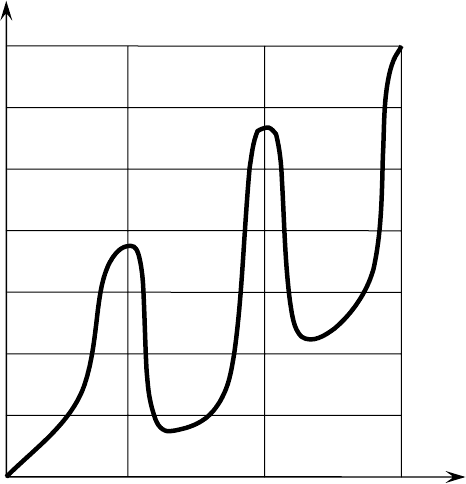
Рис. 10. Опыт Франка-Герца
Поэтому так настороженно была встречена гипотеза Луи де Бройля
(1924) об универсальности, применимости не только к полю, но и к ве-
ществу, волновых представлений, корпускулярно-волнового дуализма.
5
350
300
250
200
150
100
50
0
10
15
I, mА
U, В
62
Действительно, идеи де Бройля могли показаться безумными. Он ут-
верждал, что не только фотоны, но и электроны и любые другие части-
цы обладают как корпускулярными, так и волновыми свойствами. В
1925 г. Эйнштейн писал другу о диссертации де Бройля: “Прочтите ее!
Хотя и кажется, что ее писал сумасшедший, написана она солидно…”
В
одной из поздних работ де Бройль так излагает существо своей идеи:
“Теория света страдала редкой болезнью раздвоения между волновой
теорией, с одной стороны, и теорией фотонов – с другой. Чтобы испра-
вить положение, следовало воспользоваться принципом “чем хуже, тем
лучше” и принести эту болезнь на здоровую доселе теорию вещества. В
оптике в течение столетия слишком пренебрегали корпускулярным спо-
собом рассмотрения по сравнению с волновым; не делалась ли в теории
вещества обратная ошибка?”…
На первый взгляд, гипотеза де Бройля опровергается повседневным
опытом. В окружающих нас предметах и нас самих волновые свойства
не проявляются. Оценим длину волны де Бройля для электрона и пы
-
линки массой 0,001 г. Соотношение де Бройля: λ = h/mυ. m
e
=9.1 ⋅ 10
–
31
кг, U∼1 кВ, λ
е
=10
–9
м = 1 нм. Дифракцию электрона можно экспери-
ментально наблюдать на кристаллической решетке. Для пылинки λ
п
∼10
–
32
м и нет объектов в природе, на которых можно наблюдать волновые
свойства.
Г.П. Томсон (1927 г.) и независимо от него П.С. Тартаковский (не-
которое время работал в Томске) получили дифракционную картину
при прохождении электронного пучка через металлическую фольгу. В
1949 г. В. А. Фабрикант, А.М. Биберман и Н.Г.
Сушкин наблюдали ди-
фракцию одиночных электронов.
В классической физике частица обладает свойством двигаться по
вполне определенной траектории и в любой момент времени мы можем
точно определить ее координаты и скорость. Волна этим свойством не
обладает. Она не имеет координат. Нет смысла говорить о длине волны
в данной точке пространства. Тогда из
корпускулярно-волнового дуа-
лизма вытекает совершенно неожиданное правило: если мы точно знаем
координаты частицы, то мы совсем не знаем ее скорости, и наоборот.
Реализуется принцип неопределенности Гейзенберга (1927 г.)
Приведем простейшее рассуждение, приводящее к формулировке
этого принципа. Пусть мы хотим определить координаты и скорость
электрона. Для этого мы должны осветить его (
свет в качестве измери-
тельного устройства!) и зафиксировать координату x. Но длина волны
света конечна и равна λ. Тогда, очевидно, мы можем измерить коорди-
наты тела с точностью до длины волны света (как с помощью обычной
63
линейки можно измерить длину с точностью до min деления – 1 мм). То
есть точность определения координаты Δx и λ.
При измерении часть энергии кванта света – фотона будет передана
электрону. То есть неточность в определении энергии электрона (и его
скорости υ) будет определяться величиной энергии фотона. Импульс
частицы пропорционален ее длине волны, то есть
Δυ и 1/λ. Тогда Δx ⋅
Δυ∼1 – это есть соотношение неопределенности. Здесь не важно, какая
постоянная величина стоит справа. Важно одно: неопределенности ко-
ординаты и импульса связаны друг с другом.
Одно из следствий принципа неопределенности состоит в изме-
нении наших взглядов на принцип причинности. Под принципом при-
чинности мы понимаем
наличие причинно – следственной связи между
явлениями природы. Законы классической физики полностью опреде-
ляют судьбу физической системы при условии, что вся необходимая
информация нам известна в некоторый определенный момент времени.
Пример тому – астрономические расчеты движения небесных тел. В
квантовой физике, физике микромира, мы никогда не знаем состояния
системы с точностью большей,
чем это допускается принципом неопре-
деленности. Мы вынуждены перейти на вероятностное описание яв-
лений микромира. По яркому выражению Эйнштейна, “природа играет
в кости…”
Один из основателей современной физики, датский ученый Н. Бор
сформулировал еще одно принципиальное положение, описывающее
наши взгляды на природу вещества – принцип дополнительности. Со-
гласно этому принципу, получение экспериментальной
информации об
одних физических величинах, описывающих микрообъект, связано с по-
терей информации о других величинах, дополнительных к первым. Та-
кими взаимно дополнительными величинами являются, например, ко-
ордината частицы и ее скорость (кинетическая и потенциальная энер-
гия; напряженность электрического поля в данной точке и число фото-
нов). С физической точки зрения
этот принцип (по Бору) объясняется
влиянием измерительного прибора (макроскопический объект!) на со-
стояние микрообъекта. При точном измерении одной из величин до-
полнительная к ней в результате взаимодействия с прибором пре-
терпевает такое изменение, что ее последующее измерение теряет
всякий смысл. Именно здесь впервые появляется проблема взаимодей-
ствия измерительного прибора и
исследуемого объекта. При измерении
мы изменяем объект и получаем информацию не о независимом от нас
объекте, а о результате взаимодействия объекта и прибора.
64
Другая сторона принципа дополнительности состоит в возмож-
ности описания квантовых систем с разных точек зрения. Атом можно
описывать и как “планетарную” систему, и как подобное волне состоя-
ние. Каждое из описаний правильно, но применимо в различных усло-
виях. Способ описания выбирает исследователь!
Еще один принцип квантовой физики – принцип тождественно-
сти,
согласно которому невозможно экспериментально различить оди-
наковые частицы. Действительно, в классической механике мы всегда
можем различить два одинаковых шара, проследив их траектории до и
после столкновения. В квантовой механике такая возможность отсутст-
вует, т.к. мы можем определить только вероятность обнаружения час-
тицы в той или иной точке пространства. Так, все
электроны Вселенной
тождественны, мы не имеем способа пометить один из них и следить
только за ним.
Отметим, что сегодня мы знаем примеры проявления квантовых
свойств частиц и в макроскопических масштабах. Например, известно
так называемое явление сверхтекучести жидкого гелия при температу-
рах ниже 2 К. Жидкость течет так, будто отсутствует ее вязкость.
Или
сверхпроводимость (отсутствие сопротивления постоянному электри-
ческому току), НТСП (низкотемпературная сверхпроводимость), ВТСП
(высокотемпературная сверхпроводимость).
65
Лекция №10. ЕСТЕСТВЕННО-НАУЧНАЯ ПРОБЛЕМАТИКА
УСТОЙЧИВОГО РАЗВИ ТИ Я В СИСТЕМЕ ПРИРОДА –
ОБЩЕСТВО – ЧЕЛОВЕК
В гигантской фабрике естественных процессов
принцип энтропии занимает место директора,
который предписывает вид и течение всех сде-
лок. Закон сохранения энергии играет лишь роль
бухгалтера, который приводит в равновесие де-
бет и кредит.
Ф.Вальд. “Царица мира и ее тень”.
Окружающий нас мир: мир неживой природы, мир растений, мир
животных – представляют собой системы, не находящиеся в состоянии
термодинамического равновесия. Последнее по отношению к окру-
жающему нас миру является некой абстракцией, слишком упрощенной
моделью. Тем не менее в огромном большинстве практически важных
случаев она приводит к правильным результатам.
Для равновесных состояний
понятие времени не существует и оно
в явном виде в термодинамику не входит. Однако термодинамика по-
зволяет сделать выводы об общих закономерностях происходящих про-
цессов и их направлениях. Языком термодинамики являются функции
состояния, подобно тому, как основными понятиями классической ме-
ханики являются координаты и импульсы частиц, а квантовая механика
описывает процессы
на языке волновых функций. В основе термодина-
мики лежат четыре фундаментальных закона, которые в силу их общно-
сти и аксиоматичности называют “началами”.
Нулевое начало. “Существует функция состояния – температура.
Равенство температур во всех точках есть условие равновесия двух сис-
тем или двух частей одной и той же системы”. Понятие температуры
определено
только для состояния равновесия. Физический же смысл
температуры наиболее отчетливо проявляется в молекулярно-
кинетической теории. Здесь температура выступает как мера средней
энергии теплового движения молекул. Для системы в состояниях, силь-
но отличающихся от равновесных, понятие температуры вообще теряет
смысл. Так, например, нельзя говорить о температуре газа во фронте
сильной ударной
волны или газа, подвергнутого воздействию мощного
лазерного излучения.
Первое начало (закон сохранения энергии). “Каждая термодинами-
ческая система обладает характеристической функцией состояния –
энергией. Эта функция состояния возрастает на величину сообщенного
системе тепла dQ и уменьшается на величину совершенной системой
66
внешней работы dA. Для изолированной системы справедлив закон со-
хранения энергии”. Первое начало термодинамики можно записать в
виде: dU = dQ – dA, где U – внутренняя энергия (энергия хаотического
движения всех микрочастиц системы и их взаимодействия). Для изоли-
рованной системы, т. е. для системы, не обменивающейся с окружаю-
щей средой ни веществом, ни энергией dU = 0, U = const и имеет место
закон
сохранения энергии.
Второе начало (энтропия и энергия). “Каждая термодинамическая
система обладает функцией состояния, называемой энтропией S. При
реальных (неидеальных) процессах энтропия изолированной системы
возрастает”. dS = dQ/T, dU = TdS – dA.
Это фундаментальное уравнение объединяет первое и второе нача-
ла и в нем по существу заключена вся равновесная термодинамика.
Наиболее глубоко смысл энтропии вскрывается при ее статистической
интерпритации
. В соот ветствии с принципом Больцмана энтропия свя-
зана с вероятностью состояния системы p
t
(число различных способов,
которыми можно задать фиксированное макросостояние) соотношени-
ем: S = kln p
t
, где k – постоянная Больцмана. Для изолированной систе-
мы энтропия не может убывать: dS≥0.
Третье начало (тепловая теорема Нернста). “При абсолютном нуле
температуры энтропия принимает значение S
0
, не зависящее от давле-
ния, агрегатного состояния и других характеристик вещества. Эту вели-
чину можно положить равной нулю”. В отличии от нулевого, первого и
второго начал теорема Нернста не вводит в термодинамику новой
функции состояния, однако именно она делает функции состояния чис-
ленно определенными и практически полезными.
Появление в системе
потоков (тепла, массы и т. д.) нарушает стати-
стическое равновесие. Однако, если процессы, возмущающие равнове-
сие, менее интенсивны, чем процессы, которые формируют равновесие,
то можно говорить с определенной степенью точности о локальном
равновесии, то есть о равновесии в физически бесконечно малом объе-
ме. Идея о локальном термодинамическом равновесии была впервые
высказана
И. Пригожиным и оказалась очень плодотворной в термоди-
намике необратимых процессов. Принцип локального равновесия явля-
ется постулатом и его справедливость вытекает из совпадения результа-
тов теории с экспериментальными данными.
Гипотеза о линейных связях потоков и термодинамических сил ле-
жит в основе линейной термодинамики необратимых процессов (диф-
фузии, теплопроводности, внутреннего трения
и т. д.). Ключевым прин-
ципом здесь является соотношение взаимности Онсагера (соотношение
симметрии для кинетических коэффициентов:L
ij
=L
ji
). Оно выражает
67
свойство неравновесной системы, согласно которому если на поток I
i
,
соответствующий необратимому процессу i, влияет сила X
j
, то на поток
Y
j
сила X
i
оказывает воздействие с тем же перекрестным коэффициен-
том. За открытие соотношений взаимности, которое по праву может
считаться поворотным пунктом в истории термодинамики, Онсагеру
была присуждена Нобелевская премия по химии в 1968 году.
Общим свойством открытых (незамкнутых) систем (т. е. систем,
способных обмениваться веществом и энергией с внешней средой) яв-
ляется их
самоорганизация. Установление этого факта является заслу-
гой неравновесной термодинамики, причем именно неравновесность
служит источником упорядоченности (порядка). В качестве примеров
формирования структур вдали от равновесных и периодических процес-
сов в химии и экологии (модель хищник – жертва) рассмотрим следую-
щее.
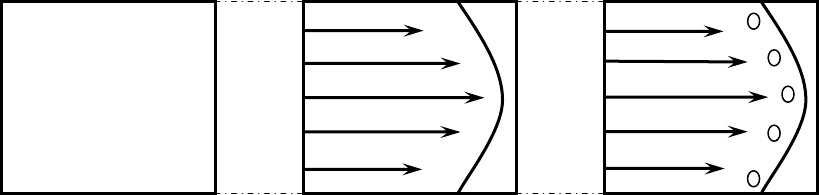
1.Переход ламинарного течения в турбулентное. При термоди-
намическом равновесии вода находится в
покое. Если нарушить равно-
весие, создав, например, градиент давления, то вода начнет переме-
щаться в сторону меньших давлений. До некоторой критической скоро-
сти течение будет ламинарным, т.е. вода будет перемещаться как бы
слоями, параллельными направлению течения. При переходе через не-
которое критическое значение скорости υ
с
картина движения жидкости
удивительным образом преобразуется: поток станет турбулентным (рис.
11). Проблема перехода к турбулентности в гидродинамике
Рис. 11. Движение жидкости: а – термодинамическое равновесие,
б – ламинарное течение (
υ<υ
с
), в – турбулентное течение (
υ>υ
с
)
одна из самых интригующих и трудных. Она решается вот уже более
ста лет, однако сколь-нибудь надежного количественного описания воз-
никновения турбулентности до сих пор нет. Одна из самых красивых
картин возникновения турбулентности предложена академиком Л.Д.
Ландау в 1944 г. Согласно его схеме, турбулентность есть результат по-
следовательной потери устойчивости
течений с менее сложной структу-
рой и формированием течений с более сложной структурой.
2. Ячейки Бенара – модель самоорганизации биосферы. Если слой
а)
б) в)
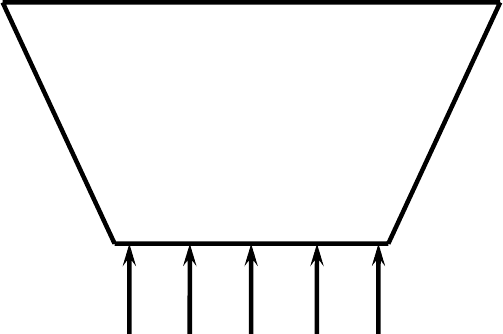
68
жидкости сильно нагреть, то возникает разность (градиент) температур
ΔТ между нижней и верхней поверхностями (рис. 12). Такой темпера-
турный градиент называется инверсным, т.к. жидкость у нижней по-
верхности вследствие теплового расширения имеет меньшую плот-
ность, чем вблизи верхней поверхности. Из-за наличия силы тяжести
(mg) и выталкивающей силы Архимеда (ρgV) такая система оказывается
неустойчивой, поскольку легкий нижний и тяжелый
верхний слои стре-
мятся поменяться местами. Однако вследствие вязкости (внутреннего
трения) при небольших градиентах температуры движение не возникает
и тепло передается только путем теплопроводности. Лишь при дости-
жении некоторого критического значения температурного градиента
появляется конвекционный поток, обладающий характерной структурой
в виде шестиугольных ячеек, содержащих около 10
21
атомов. Внутри
ячеек жидкость поднимается вверх. А по краям опускается вниз. Такую
картину достаточно просто наблюдать при кипении воды в сосуде с тол-
стым дном.
Рис. 12. Эффект Бенара
Ячейки Бенара по сравнению со слабонеоднородным распределе-
нием параметров в покоящейся жидкости являются более высоко орга-
низованной структурой, возникающей вследствие коллективного дви-
жения молекул в жидкости. Поскольку система обменивается со средой
только теплом и в стационарных условиях получает (при температуре
Т
1
) такое же количество тепла Q, что и отдает (при Т
2
<Т
1
), то выходит,
что система отдает энергию среде (
ΔS = Q/T
1
– Q/T
2
<0). Другими слова-
ми, внутренняя структура или самоорганизация поддерживается за счет
поглощения отрицательной энтропии.
Считается, что ячейки Бенара, если говорить упрощенно, как бы в
миниатюре воспроизводят условия, необходимые для существования
жизни на Земле. Земля-матушка получает высококачественную энергию
ρ
1
Т
1
> Т
2
ρ
1
<
ρ
2
ρ
2
Т
2
Т
1
69
от Солнца-батюшки, перерабатывает ее, что сопровождается ростом эн-
тропии, и выбрасывает ее в космическое пространство вместе с нарабо-
танной энтропией. Среди прочего именно это обстоятельство обеспечи-
вает жизнедеятельность на Земле.
3. Модель Лотки-Вольтерра (хищник-жертва). Кроме рассмот-
ренных выше пространственных структур возможны и временные. В
качестве примеров временных структур
часто используют различные
вариации модели “хищник-жертва” (модель Лотки-Вольтерра). Популя-
ции подобных пар типа волки – косули или рыси – зайцы по наиболее
существенному фактору изменяются известным образом. Возрастание
жертв (косуль, зайцев) приводит к интенсивному росту хищников (вол-
ков, рысей). На каком-то этапе хищников становится так много, что это
приводит
к естественной убыли жертв. Тогда недостаток в пище
уменьшает численность хищников, а количество жертв опять идет “в
гору”. В результате повторения биологических циклов по численности
хищников и их жертв работает природный колебательный процесс, на-
поминающий, математический маятник или колебательный контур.
Впечатляющими в плане примеров пространственных, временных
и пространственно-временных структур являются
некоторые химиче-
ские реакции, особенно классической считается реакция Белоусова-
Жаботинского. В ней исследуются окислительно-восстановительные
реакции Се
3+
– Се
4+
, Се
4+
– Се
3+
в растворе серной кислоты Н
2
SO
4
, мало-
новой кислоты СН
2
(СООН)
2
, сульфата церия Се
2
(SO
4
)
3
и бромата калия
КBrO
3
. За ходом реакции можно следить по цвету: красный (избыток
Се
3+
), синий (Се
4+
). Оказалось, что цвет раствора периодически (при
конкретных концентрациях указанных веществ период составляет 4 ми-
нуты) изменяется от одного до другого. Изучение подобных реакций,
как правило, преследует цель понять механизм биологических часов.
Обычной чертой рассмотренных примеров является то, что в ходе
неравновесного процесса из пространственно однородного состояния
самопроизвольно (спонтанно) возникает пространственная или
времен-
ная структура. Такие структуры И. Пригожин назвал диссипативными,
а за разработку их теории в 1977 г. ему была присуждена Нобелевская
премия. Диссипативные структуры “легализовали” существование жиз-
ни. По Пригожину: “Жизнь больше не выглядит как островок сопротив-
ления второму началу термодинамики или как деятельность каких-то
демонов Максвелла. Она возникает теперь как
следствие общих законов
физики с присущей ей специфической кинетикой химических реакций,
протекающих в далеких от равновесия условиях. Благодаря этим специ-
альным кинетическим законам потоки энергии и вещества создают
флуктуационный и структурный порядок в открытых системах”.

70
Самоорганизация носит пороговый характер: новая структура все-
гда является результатом неустойчивости и возникает из флуктуаций. В
докритическом режиме они затухают, а в закритическом усиливаются и
делают устойчивым новый режим, новую структуру, которая возникает
вслед за неустойчивостью. Диссипативные системы демонстрируют
кооперативное поведение своих микропроцессов, и самоорганизация в
системе связана с формированием структуры
более сложной, чем пер-
воначальная. Такой переход сопровождается понижением порядка сим-
метрии. Дадим расшифровку этого выражения на примере структурного
фазового перехода типа порядок-беспорядок в твердом теле.
Рассмотрим в качестве исходного структурного состояния кристал-
лическую решетку монокристалла нитрата натрия (NaNO
3
), выращенно-
го из расплава ( температура плавления 581 К). Разупорядоченная фор-
ма нитрата натрия при этом (пространственная группа элементарной
ячейки R
3 m) связывается с ориентацией плоских четырехатомных
групп NO
3
по двум равновероятным позициям, в результате чего исче-
зает дальний порядок в подрешетках из нитрат-ионов. С понижением
температуры до 549 К возникает упорядоченная форма NaNO
3
, когда в
последовательных слоях группы NO
3
строго ориентированы и различа-
ются поворотом на угол π по отношению друг к другу. При этом пере-
ход к структурному порядку сопровождается одновременным пониже-
нием симметрии решетки кристалла (пространственная группа элемен-
тарной ячейки R
3 с).
Земля – открытая система, и все живое на Земле есть явление пла-
нетарно-космического масштаба. Принцип минимума производства эн-
тропии Пригожина выполняется только в окрестности состояния равно-
весия. Природные процессы живого увеличивают свободную энергию
биосферы, а косного (неживого) – уменьшают свободную энергию сре-
ды. Взаимодействие живого и косного вещества под действием потока
лучистой энергии обеспечивает планетарный цикл – круговорот матери-
ально-энергетических затрат. Функциональное назначение живого –
выполнять функцию положительной обратной связи в глобальном про-
цессе самоорганизации в пространстве и времени. Конец XX века при-
нес ощущение научной революции, сравнимой с возникновением собст-
венного научного метода в эпоху Галилея. В центре внимания исследо-
вателей вновь
оказались самые фундаментальные свойства окружающе-
го мира: эволюция систем во времени и геометрия природы. Однако ха-
рактер интереса к этим понятиям изменился. Картина мира стала пере-
осмысляться, наполняясь новыми образами (катастрофы, бифуркации,
хаос, фракталы).
