Барышев Г.А. Материаловедение
Подождите немного. Документ загружается.


6. Определить температуру критических точек и время кристаллизации эвтектики (длину ступени эвтектического
превращения в сплавах). Время выразить в масштабе в миллиметрах. Данные занести в табл. 2.
7. По полученным экспериментальным данным для разных сплавов построить диаграмму фазового равновесия Pb – Sb.
Содержание отчёта
1. Краткое описание методики построения диаграммы фазового равновесия термическим методом.
2. Запись результатов измерения температуры в зависимости от времени в виде табл. 1.
3. Кривые охлаждения исследованных сплавов с обозначением критических точек.
4. Результаты определения критических точек сплавов (табл. 2).
5. Диаграмма состояния системы Pb–Sb, построенная по экспериментальным данным.
Контрольные вопросы
1. Методика термического анализа сплавов.
2.
За счёт чего при кристаллизации чистого металла температура остаётся постоянной?
3. Как строится диаграмма состояния?
Литература: [1; 2].
Лабораторная работа 6
ИЗУЧЕНИЕ ДВОЙНЫХ ДИАГРАММ СОСТОЯНИЯ
Цель работы
: изучить свойства равновесной диаграммы состояния, методы прогнозирования с её помощью фазового
состава и структуры сплавов в зависимости от их химического состава и температуры.
Краткая теория
Диаграмма состояния
показывает равновесный фазовый состав сплавов в зависимости от их химического состава,
температуры, давления и других внешних факторов.
Сплав
– это вещество, полученное сплавлением, спеканием, электролизом или другими методами из двух или более
химических элементов. Его обычно рассматривают как систему, состоящую из компонентов и фаз.
Система
– определённый объём, заполненный компонентами и фазами, находящимися при конкретных температурных
условиях и давлении.
Компоненты
– это чистые химические элементы, из которых состоит сплав. Например, свинец (Pb), золото (Au), железо
(Fe) и т.д. Если в состав системы входит один компонент, то она называется однокомпонентной (Fe), если два компонента, то
двухкомпонентной (Au – Ag), из трёх (Fe – C – W) – трёхкомпонентной. Многокомпонентными считаются сплавы, в составе
которых более трёх компонентов. Иногда в качестве компонента может быть химическое соединение.
Фаза
– это однородная часть сплава, отделённая границей раздела, при переходе через которую кристаллическая
решётка, химический состав и свойства резко изменяются.
Двойная диаграмма строится в координатах температура–химический состав сплавов. Температуру обычно указывают в
градусах Цельсия.
Химический состав
показывает концентрацию (количество) компонентов. Так как их сумма в каждом сплаве или фазе
всегда равна 100 %, принято указывать по горизонтальной оси на диаграмме увеличение слева направо содержания
компонента, который находится справа. Содержание второго элемента – остальное до 100 %. В качестве единиц измерения
химического состава используют как весовые, так и атомные проценты.
Линии на двойной диаграмме (их обычно называют фазовыми) разделяют области с различным фазовым составом,
поэтому на них происходят фазовые превращения.
Важнейшими фазовыми линиями на диаграмме являются:
●
ликвидус
– геометрическое место точек температур начала кристаллизации;
●
солидус
– геометрическое место точек температур конца кристаллизации.
Правильность построения диаграмм состояния проверяют по правилу фаз.
Правило фаз Гиббса
– это математическая зависимость между числом фаз (Ф), числом компонентов (К), числом
внешних переменных (П) и определяет число степеней свободы (С) равновесной системы:
С = К – Ф + П.

Числом степеней свободы
С (вариантность) называется число независимых переменных, действующих на систему,
величину которых можно изменять, не нарушая числа и номенклатуры входящих в неё фаз.
Чаще всего внешними независимыми переменными являются температура
Т
и давление
Р
. В таком случае П = 2. Если
на систему дополнительно действует ещё один внешний параметр (например, мощное электрическое поле), то П = 3 и т.д.
Рис. 1. Примеры нонвариантных превращений
на двойных диаграммах состояния:
а
– эвтектическое;
б
– перитектическое;
в
– эвтектоидное;
г
– перитектоидное;
д
– образование химического соединения
по перитектическому превращению
В металловедении часто рассматривают системы, где действует только один внешний переменный фактор –
температура. Остальные считаются постоянными. В этом случае
С = К – Ф + 1.
Например, если рассматривать чистый металл (К = 1) в момент затвердевания, когда в равновесии находятся две фазы –
жидкая и твёрдая (Ф = 2), то С = 1 – 2 + 1 = 0 – система безвариантна. Иначе – кристаллизация чистого металла должна
протекать при постоянной температуре.
При эвтектическом (Ж → +
В
тв
), перитектическом (
А
тв
+ Ж → β или γ + Ж →
A
n
B
m
), эвтектоидном (β → + γ) или
перитектоидном (γ + δ → ) превращениях (рис. 1) в двухкомпонентной системе (К = 2) в равновесии находятся три фазы (Ф
= 3). Эти превращения протекают при постоянной температуре (С = 0).
Пример. Схема эвтектического превращения (в точке
b
на рис. 2) Ж → + β, Ф = 3, П = 1, С = 2 – 3 + 1 = 0.
Температура постоянна (участок 2–2' кривой охлаждения на рис. 2).
При выпадении из жидкой фазы кристаллов α (Ф = 2) в двухкомпонентной системе (К = 2) вариантность С = 1.
Кристаллизация такого сплава должна идти в интервале температур (отрезок 1–2 на рис. 2).
Рис. 2. Пример выполнения расчётов фазового состава и
структуры сплава с помощью двойной диаграммы
Порядок выполнения работы
1. Вычертить в тетради в масштабе 2 : 1 указанную преподавателем диаграмму состояния (рис. 3, 4).
2. Заполнить диаграмму фазами, для чего необходимо:
• проанализировать диаграмму состояния: найти типы превращений, идущих при постоянной температуре на вашей
диаграмме: эвтектическое, эвтектоидное, перитектическое, перитектоидное. Концы фазовых линий, соответствующих этим
превращениям, упираются в однофазные области (показаны на рис. 1);
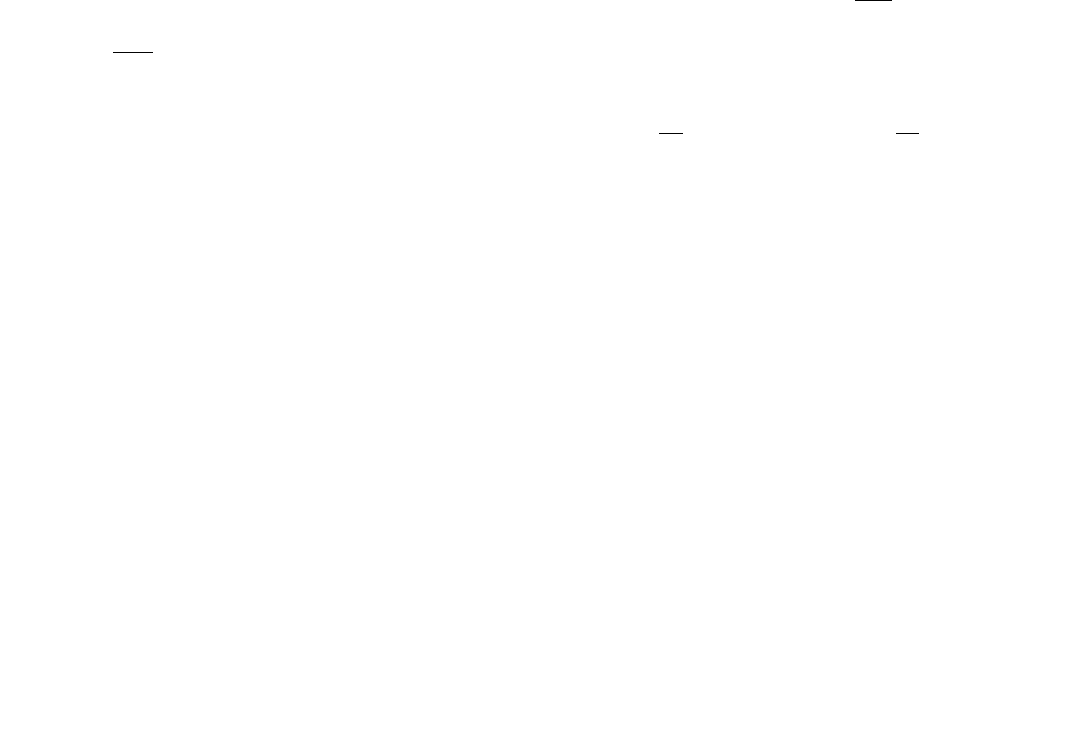
• найти и обозначить все однофазные области на диаграмме (жидкую и твёрдые);
• применив правило отрезков, заполнить все двухфазные области на диаграмме.
Правило отрезков
для описания фазового состава сплава.
Для описания фазового состава при температуре
t
1
сплава в
двухфазной области
надо
провести из точки сплава
X
влево и вправо от неё горизонтальную линию постоянной температуры
t
1
до границ данной области до пересечения с линиями диаграммы (показаны стрелками в точках
m
и
n
на рис. 2). Отрезок
mXn
называется
конòда
и позволяет описать фазовый состав сплава
X
.
1) Однофазные области, в которые упираются концы коноды, указывают, какие фазы присутствуют в нашем сплаве (α
+ β).
Этот пункт правила отрезков поможет заполнить диаграмму фазами.
Пример: область
abd
на рис. 2 лежит между однофазными областями α и Ж, поэтому она состоит из двух фаз α + Ж.
2) Проекция точки
m
на ось концентраций – точка
1
t
α
покажет химический состав α-раствора при температуре
t
1
(13 %
B
и остальное – 87 %
А
). Проекция точки
n
на ось концентраций – точка
1
t
β
покажет химический состав β-раствора (74 %
B
и
остальное – 26 %
А
).
3) Точка сплава
X
разбивает коноду
mXn
на отрезки
mX
и
Xn
.
Количество фазы пропорционально длине отрезка коноды, противоположного этой фазе.
Измеряем длину коноды
mXn
и отрезков
mX
и
Xn
(обычно в мм)
.
Количество фазы α –
%100×=
α
mXn
Xn
Q
и количество
фазы β
%100
mXn
mX
Q
=
β
при температуре
t
1
.
Примечание: больше количество той фазы, к которой точка сплава ближе на коноде.
Пример. На рис. 2 точка сплава
X
ближе к α-раствору. Поэтому
%3,72%100
65
47
==
α
Q
,
а
%7,27%100
65
18
==
β
Q
.
3.
Описать
фазовый
состав
сплава
X
при
температуре
t
в
соответствии
с
выданным
преподавателем
заданием
,
используя
правило
отрезков
.
Фазовый
состав
сплава
показывает
:
•
какие
фазы
в
него
входят
;
•
химический
состав
каждой
фазы
;
•
количество
каждой
фазы
.
4.
Построить
кривую
охлаждения
сплава
X
в
координатах
температура
t–
время
τ
(
для
каждого
отрезка
кривой
указать
вариантность
системы
с
помощью
правила
фаз
Гиббса
).
Для
этого
через
точку
Вашего
сплава
X
надо
провести
вертикальную
линию
от
оси
химического
состава
до
жидкой
фазы
на
двойной
диаграмме
.
Эта
линия
сплава
при
пересечении
с
фазовыми
линиями
двойной
диаграммы
даст
критические
точки
Вашего
сплава
,
в
которых
в
нём
происходят
фазовые
превращения
.
Их
положение
надо
перенести
на
ось
температур
графика
кривой
охлаждения
и
пронумеровать
1, 2, 3
и
т
.
д
.
Кривая
охлаждения
начинается
с
точки
0
на
оси
температур
,
лежащей
на
100…200 °
С
больше
,
чем
самая
верхняя
критическая
точка
(
рис
. 2).
Будет
ли
падать
температура
при
охлаждении
Вашего
сплава
,
покажет
число
степеней
свободы
,
рассчитанное
по
правилу
фаз
Гиббса
С
=
К
–
Ф
+ 1 = 3 –
Ф
.
Там
,
где
изменяется
значение
С
,
обязательно
на
кривой
охлаждения
образуется
перегиб
,
а
если
С
= 0,
то
образуется
ступенька
(
фазовое
превращение
идет
при
постоянной
температуре
).
Если
сплав
пересекает
горизонтальные
линии
эвтектики
,
эвтектоида
,
перитектики
или
перитектоида
(
надо
написать
уравнение
этого
превращения
рядом
с
кривой
),
то
в
этих
точках
С
= 0.
На
оси
времени
графика
масштаб
отсутствует
,
так
как
равновесные
диаграммы
строятся
в
предположении
бесконечно
медленного
охлаждения
.
5.
Нарисовать
структуру
сплава
после
полного
охлаждения
.
Структура
сплава
показывает
форму
,
размеры
и
взаимное
расположение
зёрен
каждой
фазы
в
материале
.
Для
этого
надо
поэтапно
рисовать
структуру
сплава
в
конце
каждого
участка
термической
кривой
.
Рассмотрим
это
на
примере
рис
. 2.
В
точке
1
структуру
рисовать
не
надо
(
сплав
жидкий
).
В
точке
2
на
отрезке
db
сплав
на
диаграмме
состоит
из
двух
фаз
α
-
раствора
и
жидкости
ближе
к
α
.
Поэтому
в
структуре
больше
первичных
кристаллов
α
I
,
чем
жидкости
.
На
участке
2–2
'
зерна
α
I
неизменны
,
а
жидкость
состава
точки
b
испытывает
эвтектическое
превращение
β
+
α
→
Ж
. Поэтому в точке
2
' вместо жидкости будут зерна эвтектики (пластинчатой на рис. 2). При дальнейшем
охлаждении сплава
X
его фазовый состав меняется, так как уменьшается растворимость компонента
В
в α-растворе (по
кривой
df
) и компонента
А
в β-растворе (по кривой
eg
); кроме того меняется и величина отрезков (количество каждой фазы).
В сплаве есть структурно свободные зерна α-раствора, на границах которых при охлаждении выделяются атомы компонента
В
в виде вторичных зерен β
II
.
При ответе на вопрос: «Опишите структуру Вашего сплава после полного охлаждения» – следует сказать (на примере
рис. 2):
Структура
сплава
состоит
из
зёрен
пластинчатой эвтектики (α + β) и первичных огранённых зерен α-раствора, на
границах которых круглые включения β
II
.
Контрольные вопросы
1. Какие типы твёрдых сплавов есть на Вашей диаграмме? Покажите по периметру соответствующие им области на
диаграмме.
2. Покажите линии ликвидуса и солидуса на Вашей диаграмме. Что они обозначают?
3. Что показывает фазовый состав сплава?
4. Опишите структуру сплава.
5. Сформулируйте правило фаз Гиббса.
6. Что называется полиморфизмом?
Литература: [1; 2].
а
)
б
)
в
)
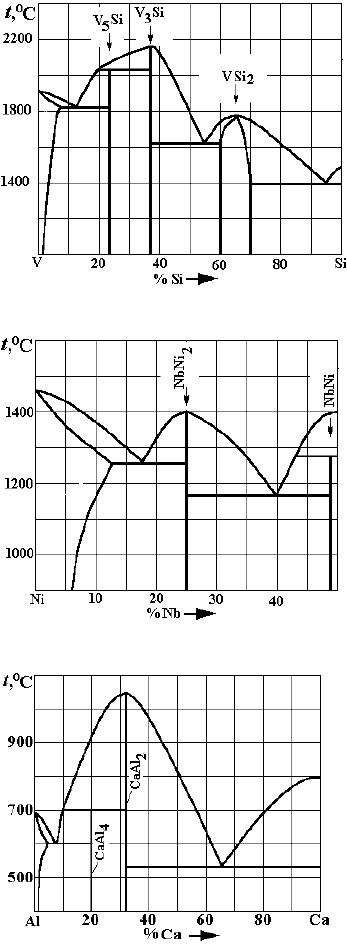
Рис. 3. Варианты заданий по двойным диаграммам состояния:
а
– V–Si;
б
– Ni–Nb;
в
– Al–Ca;
г
– Bi–Te;
д
– Mg–Pb;
е
– Al–Li
г
)
д
)
е
)
Рис. 3. Окончание
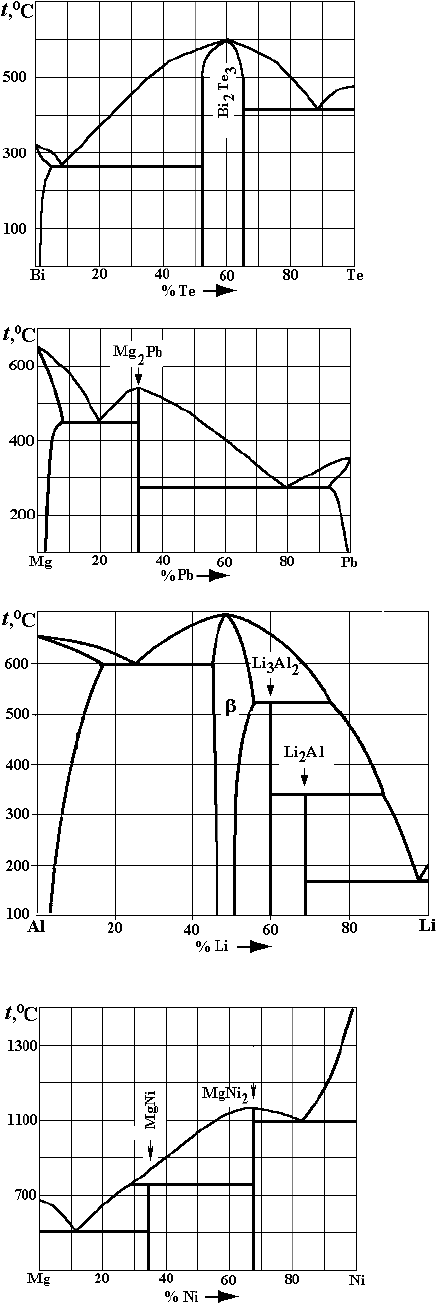
а
)
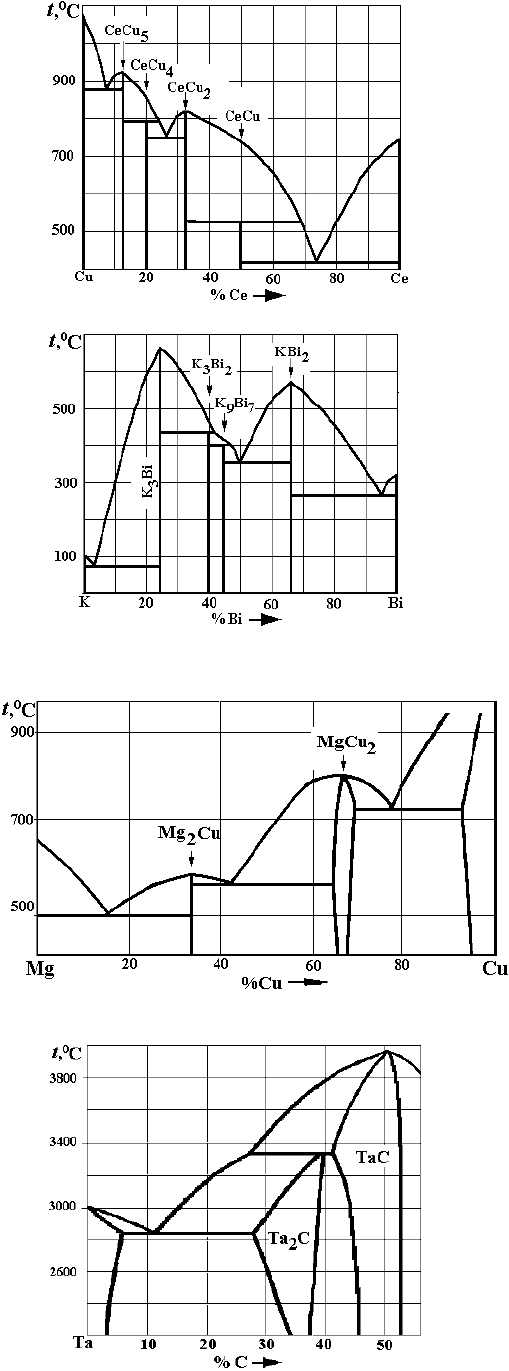
б
)
в
)
Рис. 4. Варианты заданий по двойным диаграммам состояния:
а
– Mg–Ni;
б
– Cu–Ce;
в
– K–Bi;
г
– Mg–Cu;
д
–Ta–C;
е
– W–C
г
)
д
)
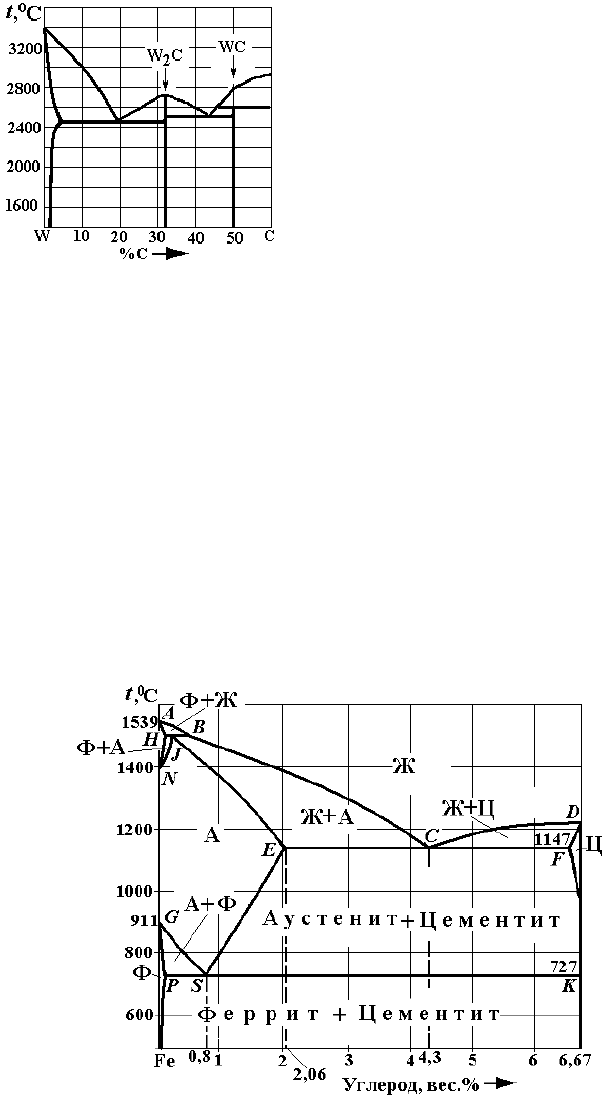
е
)
Рис. 4. Окончание
Лабораторная работа 7
МИКРОАНАЛИЗ ОТОЖЖЕННЫХ СТАЛЕЙ
Цель работы
: знакомство с равновесной структурой и свойствами отожжённых сталей, определение марки стали
металлографическим меодом.
Приборы и принадлежности
: металлографические микроскопы, микрошлифы.
Краткая теория
Основой для определения фаз и структурных составляющих железоуглеродистых сплавов в равновесном состоянии
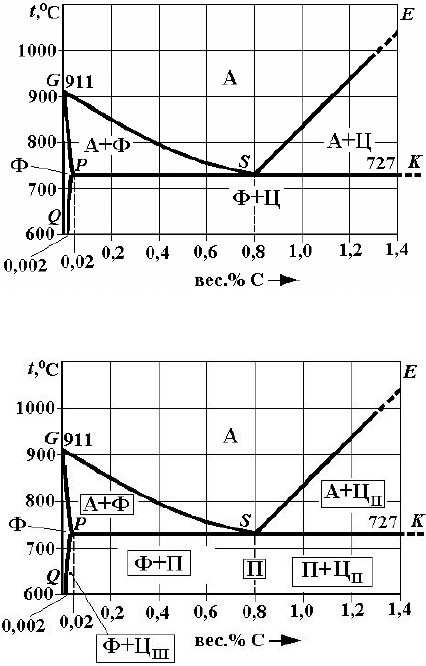
является равновесная диаграмма железо-углерод (рис. 1). Практический интерес представляет часть этой диаграммы до
содержания 6,67 % вес. углерода. Поэтому обычно эту диаграмму называют железо-цементит. В твёрдом состоянии углерод
образует с железом твёрдые растворы, механические смеси и химическое соединение. Большинство их имеют исторически
сформировавшиеся названия.
Рис. 1. Равновесная диаграмма железо-углерод
Цементит
(Ц) – это карбид железа Fe
3
C, содержащий 6,67 % углерода. Он имеет сложную орторомбическую решётку.
Железо (Fe) – полиморфный металл, который с увеличением температуры меняет свою кристаллическую решётку:
ниже 911 °С это объёмноцентрированная кубическая (ОЦК) решётка; выше 911 °С, но ниже 1392 °С – гранецентрированная
кубическая (ГЦК) решётка; выше 1392 °С и до плавления при 1539 °С – снова ОЦК.
Феррит
(Ф) – это твёрдый раствор углерода в ОЦК-железе (в низкотемпературном α или высокотемпературном δ).
Максимальная растворимость углерода в α-железе составляет около 0,02 % (точка
Р
) при 727 °С. При охлаждении
растворимость падает до 0,002 % С. При рассмотрении под микроскопом феррит наблюдается в виде зёрен различных
оттенков.
а
)
б
)
Рис. 2. «Стальной угол» диаграммы состояния железо-углерод:
а
– заполнение фазами;
б
– заполнение структурными составляющими
При температурах выше линии
GSE
равновесной фазой является
аустенит
(А) – твёрдый раствор углерода в ГЦК –
железе (в γ-железе). Максимальная растворимость углерода в γ-железе – 2,14 % (точка
Е
) при 1147 °С, а при уменьшении
температуры до 727 °С падает до 0,8 % С.
На диаграмме Fe-Fe
3
C (рис. 1) существуют три нонвариантных превращения: перитектическое – на линии HJB,
эвтектическое – ECF и эвтектоидное – PSK.
Железо-углеродистые сплавы (углерода больше 2,14 %), испытывающие эвтектическое превращение, получили
название
чугуны
.
Сталями
называют сплавы с содержанием углерода меньше 2,06 % углерода. При затвердевании и последующем
охлаждении эти сплавы всегда проходят через одну и ту же обширную область аустенита. Поэтому структура и свойства с т
а л е й мало зависят от условий кристаллизации и в основном определяются процессами при охлаждении из аустенита (рис.
2).
При температурах ниже 727 °С все отожжённые углеродистые стали состоят из двух фаз: феррита и цементита (рис. 2,
а
).
В результате фазовых превращений в твёрдом состоянии при медленном охлаждении в сталях образуются следующие
структурные составляющие: перлит, избыточный феррит, вторичный цементит и третичный цементит. Обычно структуру
отожжённой стали выявляют травлением 5 % раствором азотной кислоты в спирте.
Избыточный феррит образуется из аустенита ниже линии
GS
. Вторичный цементит начинает выделяться ниже линии
ES
, а третичный цементит – ниже линии
PQ
в результате уменьшения предельной растворимости углерода в аустените и
феррите, соответственно (рис. 2,
б
).
В малоуглеродистых сталях, содержащих менее 0,02 % углерода (точка
Р
), структура состоит из феррита и третичного
цементита. Цементит III выделяется на границах светлых зёрен феррита в виде светлых едва заметных прожилок (см. рис. 3).
Стали с содержанием менее 0,02 % С называют техническим железом (при изготовлении из них сердечников
трансформаторов они получают название электротехническая сталь).
При небольшом переохлаждении до температур ниже 727 °С во всех сплавах правее точки
Р
аустенит состава
эвтектоидной точки
S
(0,8 % С) распадается на эвтектоидную смесь феррита и цементита, которая называется
перлитом
:
орторомб
С%6,67
ОЦК
С%0,002
ГЦК
С%0,8
ЦФА +→
.
Сталь
,
содержащую
0,8 %
С
,
называют
эвтектоидной
(
классификация
по
положению
на
диаграмме
состояния
)
.
Стали
,
содержащие
менее
0,8 %
С
,
но
больше
0,02 %
С
,
называют
доэвтектоидными
,
а
более
0,8 %
С
–
заэвтектоидными.
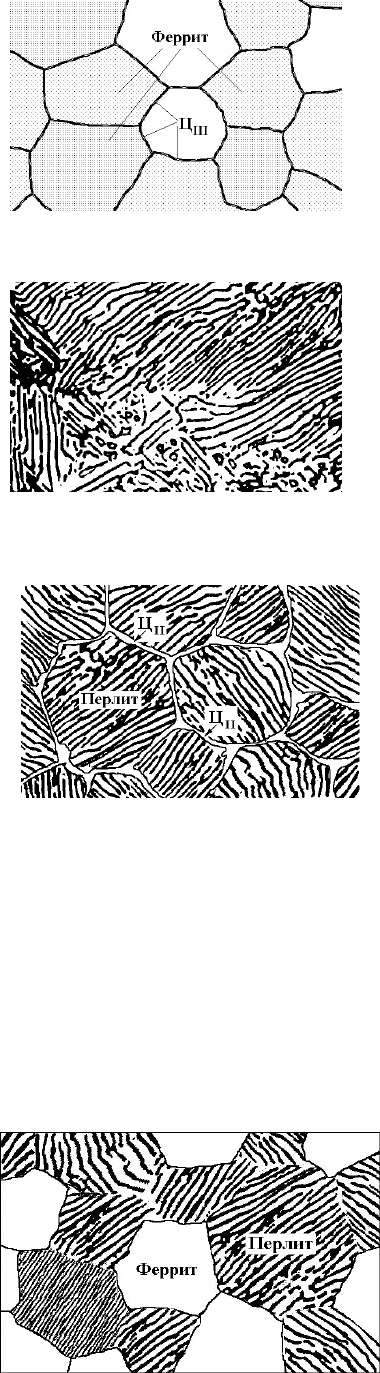
Рис. 3. Микроструктура технического железа. 250
×
××
×
Рис. 4. Микроструктура эвтектоидной стали
с пластинчатым перлитом. 250
×
××
×
Рис. 5. Микроструктура заэвтектоидной стали
с пластинчатым перлитом
Структура
эвтектоидной стали
– перлит, она состоит из зёрен (колоний), в которых чередуются пластины феррита и
цементита. При малом увеличении изображение пластинок сливается, и перлит выглядит как тёмные зёрна (рис. 4).
В
заэвтектоидной стали
на границах аустенитных зерен при охлаждении выделяется вторичный цементит (Ц
II
) в
виде сплошной светлой сетки, которая хорошо видна между тёмными колониями перлита (рис. 4).
Рис. 6. Микроструктура доэвтектоидной стали

Рис. 7. Влияние содержания углерода на свойства отожжённых сталей
Чем больше углерода в заэвтектоидной стали, тем больше в ней вторичного цементита. Применяя специальную
обработку, можно получить вторичный цементит в зернистой форме.
Структура доэвтектоидной стали (рис. 6) состоит из светлых зёрен феррита и тёмных зёрен перлита. Чем больше
углерода в доэвтектоидной стали, тем больше в ней перлита.
Фазовый состав и структура сталей тесно связаны с их механическими свойствами (рис. 7). При комнатной температуре
они все представляют механическую смесь фаз феррита и цементита. Поэтому твёрдость по Бринеллю стали линейно растёт
с увеличением содержания углерода.
Временное сопротивление разрыву (предел прочности σ
в
) при содержании в стали до 0,8 % углерода также
увеличивается линейно. В этом диапазоне качественные стали используют для изготовления деталей машин и называются
конструкционными. Принято обозначать их маркой – сталь 10 или сталь 80, где число указывает концентрацию углерода в
сотых долях.
При содержании углерода больше 0,8 % кривая прочности резко падает, а твёрдость продолжает линейно расти.
Причина этого – охрупчивание стали за счёт зернограничного выделения вторичного цементита. Такие углеродистые
качественные стали используют для изготовления инструмента (который требует повышенную твёрдость) – они
маркируются – сталь У7, У8, У13, где число показывает содержание углерода в десятых долях процента.
Пример. Сталь У13 содержит 13 × 0,1 % С = 1,3 % углерода.
Порядок выполнения работы
1. ИЗУЧИТЬ НА МЕТАЛЛОГРАФИЧЕСКОМ МИКРОСКОПЕ СТРУКТУРЫ ОБРАЗЦОВ, ПРЕДЛОЖЕННЫХ
ПО ЗАДАНИЮ.
2. Схематично зарисовать структуры в тетрадь и дать их краткое описание.
3. По структуре определить класс каждой стали по положению на диаграмме состояния железо-углерод
(доэвтектоидная, эвтектоидная, заэвтектоидная).
4. Определить примерное содержание углерода в доэвтектоидной стали по структуре.
Для этого на рисунок структуры доэвтектоидной стали (рис. 8) надо наложить сетку из равномерно расположенных
точек (можно использовать точки пересечения линий линованной бумаги, на которой нарисована структура).
Сначала подсчитывают общее число точек
N
О
, попавших на рисунок, затем количество из них – на перлитных зернах
N
П
. Долю перлита в структуре определяют по формуле
%100
О
П
П
×=
N
N
F
.
Пример. Общее число точек на структуре на рис. 8 равно 25. Из них на перлит попало – 16 точек (показаны
крестиками).
