Вступительные экзамены и олимпиады по химии в Московском университете: 2007
Подождите немного. Документ загружается.

Факультет биоинженерии и биоинформатики. Решения задач и ответы
71
Ответ: 56 кДж/моль.
6. Поскольку реакция протекает в замкнутом (постоянном) объеме, в расчетах можно вместо
концентраций использовать количества веществ.
Пусть к моменту достижения равновесия прореагировало
х моль водорода. Тогда:
I
2
(газ) + H
2
(газ) ⇄ 2HI(газ)
Исходные количества
0.05 0.25 0
Прореагировало х х
Равновесные количества 0.05–х 0.25–х 2х
4
)25.0()05.0(
4
2
=
−⋅−
=
хх
х
K
p
.
4
х
2
= 4(0.0125 + х
2
– 0.3х);
х = 0.0417.
ν(I
2
) = 0.05 – 0.0417 = 0.0083 моль;
ν(H
2
) = 0.25 – 0.0417 = 0.2083 моль;
ν(HI) = 0.0834 моль.
Ответ: ν(I
2
) = 0.0083 моль; ν(H
2
) = 0.2083 моль; ν(HI) = 0.0834 моль; К
р
= 4.
7. 1) CuSO
4
+ 2NaOH → Cu(OH)
2
↓ + Na
2
SO
4
;
2) Cu(OH)
2
+ 2HCl → CuCl
2
+ 2H
2
O;
3) CuCl
2
+ 2AgNO
3
→ 2AgCl↓ + Cu(NO
3
)
2
;
4) 2Cu(NO
3
)
2
⎯→⎯
o
t
2CuO + 4NO
2
↑ + O
2
↑;
5) 3CuO + 2NH
3
⎯→⎯
o
t
3Cu + N
2
↑ + 3H
2
O;
6) Cu + CuCl
2
→ 2CuCl.
Ответ: А – Cu(OH)
2
, Б – CuCl
2
, В – Cu(NO
3
)
2
, Г – CuO, Д – Cu, Е – CuCl.
8. 1) CH
3
–CH
3
+ Cl
2
⎯⎯→⎯
свет
CH
3
–CH
2
Cl + HCl;
2) CH
3
–CH
3
⎯⎯→⎯
o
tNi,
H
2
C=CH
2
+ Н
2
;
3) CH
2
=CH
2
+ H
2
O ⎯→⎯
+
H
CH
3
–CH
2
–OH;
4) C
2
H
5
OH + CH
3
COOH ⎯⎯⎯⎯→⎯
.
42
концSOH
СН
3
СООС
2
Н
5
+ H
2
O;
5) СН
3
СООС
2
Н
5
+ H
2
O ⎯→⎯
+
H
CH
3
–CH
2
–OH + CH
3
COOH;
6) CH
3
COOH + NaOH → CH
3
COONa + H
2
O.
9. ν(соли) = 0.05 · 250 / 1000 = 0.0125 моль.
а) Рассмотрим случай одновалентного металла:
2Me + H
2
SO
4
→ Me
2
SO
4
+ H
2
↑
ν(Me) = 0.025 моль;
М
Ме
= 0.7 / 0.025 = 28 г/моль, металла с такой молярной массой нет.
б) Теперь рассмотрим случай двухвалентного металла:
Me + H
2
SO
4
→ MeSO
4
+ H
2
↑,
ν(Me) = 0.0125 моль;
М
Ме
= 0.7 / 0.0125 = 56 г/моль, это железо Fe. В зависимости от условий
(концентрация кислоты, температура) возможны следующие реакции:
Fe + 4HNO
3(разб)
→ Fe(NO
3
)
3
+ NO↑ + 2H
2
O;
8Fe + 30HNO
3(разб)
→ 8Fe(NO
3
)
3
+ 3N
2
O↑ + 15H
2
O;
10Fe + 36HNO
3(разб)
→ 10Fe(NO
3
)
3
+ 3N
2
↑ + 18H
2
O;
8Fe + 30HNO
3(разб)
→ 8Fe(NO
3
)
3
+ 3NН
4
NO
3
+ 9H
2
O.
Ответ: железо.
10. Выделение газа: Zn + 2NaOH + 2H
2
O → Na
2
Zn(OH)
4
+ H
2
↑;
ν(H
2
) = ν(Zn) = 65/65 = 1 моль; V(H
2
) = 22.4 л.
Реакции, происходящие при пропускании смеси газов над катализатором:
СН
3
–СН=СН
2
+ Н
2
⎯⎯→⎯
o
tPt,
С
3
Н
8
;
СН≡ СН + 2Н
2
⎯⎯→⎯
o
tPt,
С
2
Н
6
.
По условию,
V(С
3
Н
8
) = 2 л; V(С
2
Н
6
) = 5.2 л; осталось V(Н
2
) = 22.4 – 2 – 5.2 · 2 = 10 л;
суммарный объем газов после реакции
V
∑
= 2 + 5.2 + 10 = 17.2 л.
Факультет почвоведения. Решения задач и ответы
72
φ(С
3
Н
8
) = 2/17.2 = 0.1163 или 11.63%; φ(С
2
Н
6
) = 5.2/17.2 = 0.3023 или 30.23%;
φ(Н
2
) = 10/17.2 = 0.5814 или 58.14%.
35.15
2.17
210302.5442
=
⋅+
⋅
+⋅
=
cp
M
г/моль.
Ответ: 11.63% С
3
Н
8
; 30.23% С
2
Н
6
; 58.14% Н
2
; 15.35 г/моль.
Решение варианта ПВ–2007–3
1. Нитроэтан CH
3
–CH
2
–NO
2
и глицин (аминоуксусная кислота) NH
2
–CH
2
–COOH.
2. Ar и K
+
.
3. Например: HNO
3
+ NaOH → NaNO
3
+ H
2
O;
2HNO
3
+ Na
2
SiO
3
→ H
2
SiO
3
↓ + 2NaNO
3
;
4HNO
3
+ Сu → Cu(NO
3
)
2
+ 2NO
2
↑ + 2H
2
O;
2HNO
3(конц.)
+ S → H
2
SO
4
+ 2NO↑.
4. Поскольку продуктами горения газа являются только СО
2
и Н
2
О, газ состоит из углерода,
водорода и, возможно, кислорода. Искомая брутто-формула – С
х
Н
y
O
z
. Запишем уравнение
горения, учтя при этом, что объемы газов, измеренные при одинаковых условиях, пропор-
циональны количеству веществ газов. Отсюда следует, что данные объемы газов можно ис-
пользовать в качестве коэффициентов в уравнении реакции. В этой задаче разделим для
удобства каждый коэффициент (объем) на 3:
2С
х
Н
y
O
z
+ 7O
2
→ 4СO
2
+ 6Н
2
O.
Отсюда
х = 4 / 2 = 2; у = 12 / 2 = 6; z = 6 + 8 – 14 = 0. Следовательно, искомое вещество – это
этан C
2
H
6
.
Ответ: С
2
Н
6
.
5. Реакция нейтрализации: HI + KOH → KI + H
2
O + Q.
16.0
1000
802
=
⋅
=ν
HI
моль; 0125.0
56
1.0082.147.6
=
⋅⋅
=ν
КOH
моль; следовательно, в недостатке
находится щелочь. Теплоту нейтрализации рассчитываем по щелочи:
56
0125.0
7.0
==Q кДж/моль.
Ответ: 56 кДж/моль.
6. Поскольку реакция протекает в замкнутом (постоянном) объеме, в расчетах можно вместо
концентраций использовать количества веществ. Количества прореагировавших Н
2
и I
2
рав-
ны 0.05 · 0.2 = 0.01 моль, а количество образовавшегося к моменту установления равновесия
HI в два раза больше – 0.02 моль:
I
2
(газ) + H
2
(газ) ⇄ 2HI(газ)
Исходные количества
0.025 0.05 0
Прореагировало 0.01 0.01
Равновесные количества 0.015 0.04 0.02
67.0
015.004.0
02.0
2
р
=
⋅
=К
Ответ
: К
р
= 0.67.
7. 1) Cr + 2HCl → H
2
↑ + CrCl
2
;
2) CrCl
2
+ 2KOH → 2KCl + Cr(OH)
2
↓;
3) 2Cr(OH)
2
+ H
2
O
2
→ 2Cr(OH)
3
↓;
4) 2Cr(OH)
3
+ 3Br
2
+ 10KOH → 6KBr + K
2
CrO
4
+ 8H
2
O;
5) 2K
2
CrO
4
+ H
2
SO
4
→ K
2
SO
4
+ K
2
Cr
2
O
7
+ H
2
O;
6) K
2
Cr
2
O
7
+ 4H
2
SO
4
+ K
2
SO
3
→ Cr
2
(SO
4
)
3
+ 4K
2
SO
4
+ 4H
2
O.
Ответ: А – CrCl
2
, Б – Cr(OH)
2
, В – Cr(OH)
3
, Г – K
2
CrO
4
, Д – K
2
Cr
2
O
7
, Е – Cr
2
(SO
4
)
3
.
8. 1) CH
3
–CH
2
–COONa + NaOH ⎯→⎯
o
t
CH
3
–CH
3
↑ + Na
2
CO
3
;
2) CH
3
–CH
3
+ Cl
2
⎯⎯→⎯
свет
CH
3
–CH
2
Cl + HCl;

Факультет биоинженерии и биоинформатики. Решения задач и ответы
73
3) CH
3
–CH
2
Cl + NaOH ⎯⎯→⎯
спирт
CH
2
=CH
2
+ NaCl + H
2
O;
4) CH
2
=CH
2
+ H
2
O ⎯→⎯
+
H
CH
3
–CH
2
–OH;
5) CH
3
–CH
2
–OH ⎯⎯⎯⎯⎯⎯⎯→⎯
> C150 .)(
o
42
tконцSOH
CH
2
=CH
2
+ H
2
O;
6) CH
3
–CH
2
–OH ⎯⎯⎯⎯⎯⎯⎯→⎯
< CtконцSOH
o
150 .)(
42
CH
3
–CH
2
–O–CH
2
–CH
3
+ H
2
O.
9. ν(соли) = 0.2 · 2000 / 1000 = 0.4 моль.
а) Рассмотрим случай одновалентного металла:
2Me + H
2
SO
4
→ Me
2
SO
4
+ H
2
↑,
ν(Me) = 0.8 моль;
М
Ме
= 26 / 0.8 = 32.5 г/моль, металла с такой молярной массой нет.
б) Рассмотрим случай двухвалентного металла:
Me + H
2
SO
4
→ MeSO
4
+ H
2
↑,
ν(Me) = 0.4 моль; М
Ме
= 26 / 0.4 = 65 г/моль, это цинк Zn.
Zn + 2H
2
SO
4
(конц) → ZnSO
4
+ SO
2
↑ + 2H
2
O.
Ответ: цинк.
10. Выделение газа: Mg + 2HCl → MgCl
2
+ H
2
↑.
Ν(Н
2
) = ν(Mg) = 48 / 24 = 2 моль, V(H
2
) = 44.8 л (н.у.).
Реакции, происходящие при пропускании газов над катализатором:
Н
2
С=СН–СН=СН
2
+ 2Н
2
⎯⎯→⎯
o
tPt,
С
4
Н
10
;
Н
2
С=СН
2
+ Н
2
⎯⎯→⎯
o
tPt,
С
2
Н
6
.
По условию,
V(С
4
Н
10
) = 11.2 л; V(С
2
Н
6
) = 14 л; осталось V(Н
2
) = 44.8 – 2 · 11.2 – 14 = 8.4 л;
суммарный объем газов после реакции
V
∑
= 33.6 л.
φ(С
4
Н
10
) = 11.2 / 33.6 = 0.3333 или 33.33%; φ(С
2
Н
6
) = 14 / 33.6 = 0.4167 или 41.67%;
φ(Н
2
) = 8.4 / 33.6 = 0.25 или 25.0%.
33.32
6.33
24.8582.113014
ср.
=
⋅+⋅+⋅
=М
г/моль.
Ответ: 33.33% С
4
Н
10
; 41.67% С
2
Н
6
; 25.0% Н
2
; 32.33 г/моль.
Ответы к варианту ПВ–2007–4
1. Этанол СH
3
–CH
2
–OH и диметиловый эфир CH
3
–O–CH
3
.
2. Ne и Na
+
.
3. Например: KOH + CO
2
→ KHCO
3
;
KOH + HCl → KCl + H
2
O;
2KOH + CuCl
2
→ Cu(OH)
2
+ 2KCl;
KOH + Cl
2
→ KCl + KСlO.
4. C
2
H
4
.
5. 56 кДж/моль.
6. К
р
= 0.67.
7. А – NH
3
, Б – NO, В – NO
2
, Г – HNO
3
, Д – NH
4
NO
3
, Е – N
2
O.
8. 1) C
2
H
4
+ Cl
2
→CH
2
Cl–CH
2
Cl;
2) CH
2
Cl–CH
2
Cl +2NaOH ⎯⎯→⎯
спирт
C
2
H
2
+ 2NaCl + 2H
2
O;
3) 3C
2
H
2
⎯⎯⎯⎯→⎯
С600уголь,
о
C
6
H
6
;
4) C
6
H
6
+ CH
3
Cl ⎯⎯→⎯
3
FeCl
C
6
H
5
–CH
3
+ HCl;
5) 5C
6
H
5
–CH
3
+6KМnO
4
+ 9H
2
SO
4
→ 5C
6
H
5
–COOH + 6MnSO
4
+ 3K
2
SO
4
+ 14H
2
O;
6) C
6
H
5
–COOH + NaOH → C
6
H
5
–COONa + H
2
O.
9. Алюминий. Возможные реакции:
Al + 4HNO
3
(разб) → Al(NO
3
)
3
+ NO↑ + 2H
2
O;
8Al + 30HNO
3
(разб) → 8Al(NO
3
)
3
+ 3N
2
O↑ + 15H
2
O;
10Al + 36HNO
3
(разб) → 10Al(NO
3
)
3
+ 3N
2
↑ + 18H
2
O;
8Al + 30HNO
3
(разб) → 8Al(NO
3
)
3
+ 3NН
4
NO
3
+ 9H
2
O.
10. 33.33% С
3
Н
8
; 16.67% С
2
Н
6
; 50.0% Н
2
. М
ср
= 20.67 г/моль.
Факультет наук о материалах. Решения задач и ответы
74
Факультет наук о материалах
Решения варианта ФНМБ-2007-1
1. ν(Ag) = N / N
A
= 700 / 6.02·10
23
= 1.16 · 10
–21
моль;
m(Ag) = ν · M = 1.26 · 10
–19
г.
Ответ: 1.26 · 10
–19
г.
2. Растворение голубого осадка Cu(OH)
2
в присутствии этиленгликоля с образованием темно-
синего раствора:
CH
2
CH
2
OH
OH
+ Cu(OH)
2
Cu
CH
2
CH
2
CH
2
CH
2
O
OHO
OH
2
2H
2
O
Для этанола такая реакция не характерна.
3. Суммарное уравнение радиоактивного распада можно записать следующим образом:
βα=
−
+
+
0
1
4
2
206
82
238
92
PbU mn
С учетом того, что как сумма зарядов, так и сумма массовых чисел всех частиц в правой и
левой частях уравнения должны совпадать (баланс зарядов и материальный баланс), состав-
ляем систему уравнений:
238 = 206 + 4
n
92 = 82 + 2
n – m
Решение этой системы дает
n = 8, m = 6.
Ответ: 8 α-распадов, 6 β-распадов.
4. CH
2
Cl–CH
2
–CH(CH
3
)–CH
3
+ KOH ⎯⎯→⎯
спирт
CH
2
=CH–CH(CH
3
)–CH
3
+ H
2
O + KCl;
CH
2
=CH–CH(CH
3
)–CH
3
+ HCl ⎯→ CH
3
–CHCl–CH(CH
3
)–CH
3
;
CH
3
–CHCl–CH(CH
3
)–CH
3
+ KOH ⎯⎯→⎯
спирт
CH
3
–CH=C(CH
3
)–CH
3
+ H
2
O + KCl;
CH
3
–CH=C(CH
3
)–CH
3
+ HCl ⎯→ CH
3
–CH
2
–CCl(CH
3
)–CH
3
.
5. 1) H
2
S + I
2
⎯→ S + 2HI (здесь H
2
S – восстановитель, а I
2
– окислитель);
2) 3H
2
O
2
+ K
2
Cr
2
O
7
+ 4H
2
SO
4
⎯→ Cr
2
(SO
4
)
3
+ K
2
SO
4
+ 3О
2
↑ + 7H
2
O (в этой реакции H
2
O
2
– восстановитель, а K
2
Cr
2
O
7
– окислитель).
6. 4P
(белый)
+ 3KOH + 3H
2
O ⎯→⎯
o
t
PH
3
+ 3KH
2
PO
2
;
2P
(белый)
+ 3Cl
2
(недост.) ⎯→⎯
o
t
2PCl
3
;
PCl
3
+ Cl
2
⎯→⎯
o
t
2PCl
5
;
PCl
5
+ 4H
2
O ⎯→ H
3
PO
4
+ 5HCl;
H
3
PO
4
+ K
2
CO
3
⎯→ K
2
HPO
4
+ CO
2
↑ + H
2
O;
2K
2
HPO
4
⎯→⎯
o
t
K
4
P
2
O
7
+ H
2
O.
7. 1) Пусть концентрация анионов [OH
–
] составляет х моль/л, тогда [H
+
] = 10
–4
· х моль/л.
K
W
= [OH
–
][H
+
] = 10
–4
х
2
= 10
–14
, отсюда x = [OH
–
] = 10
–5
моль/л, [H
+
] = 10
–4
· х = 10
– 9
моль/л,
соответственно pH = –lg[H
+
] = 9.
2) CH
3
NH
3
OH ⇄ CH
3
NH
3
+
+ OH
–
(или CH
3
NH
2
+H
2
O ⇄ CH
3
NH
3
+
+ OH
–
, форма записи не
влияет на результат расчета).
Факультет наук о материалах. Решения задач и ответы
75
)(]OHNHCH[
]NHCH][OH[
0
2
33
33
-
дис.
xc
x
K
−
==
+
, отсюда c
o
= x
2
/ K
дис.
+ x = 1.07 · 10
–5
моль/л.
Ответ: рН = 9; 1.07 · 10
–5
моль/л.
8. 2CH
4
⎯→ ⎯⎯⎯→⎯
C
o
1200
C
2
H
2
+ 3H
2
;
C
2
H
2
+H
2
O ⎯⎯⎯→⎯
++
H ,
2
Hg
CH
3
CH=O;
CH
3
CH=O + H
2
⎯⎯→⎯
Ni ,
o
t
CH
3
CH
2
OH;
5CH
3
CH
2
OH + 4KМnO
4
+ 6H
2
SO
4
⎯→ 5CH
3
COOH + 4MnSO
4
+ 2K
2
SO
4
+ 11H
2
O;
2CH
3
COOH + P
2
O
5
⎯→ (CH
3
CO)
2
O + 2HPO
3
;
(CH
3
CO)
2
O + CH
3
CH
2
OH ⎯→ CH
3
COOC
2
H
5
+ CH
3
COOH.
9. Уксусной кислоты было
ν
о
= m / M = 5.40 / 60 = 0.09 моль.
В газовой фазе устанавливается равновесие:
2CH
3
COOH ⇄ (CH
3
COOH)
2
(1)
Найдём суммарное количество вещества мономера (М) и димера (D) в газовой фазе:
ν
1
= pV / RT = (43.7 · 5.40) / (8.31 · 473) = 0.06 моль.
Пусть образовалось x моль димера, тогда осталось (0.09 – 2x) моль мономера:
x + (0.09 – 2x) = 0.09 – x = 0.06, отсюда x = 0.03 моль, а 0.09 – 2x = 0.03 моль.
N(D) = ν(D) · N
A
= 0.03 · 6.02·10
23
= 1.81·10
22
молекул димера находится в газовой фазе.
К
дим.
= [D] / [M]
2
= (ν(D) · V) / ν(M)
2
= 0.03 · 5.40 / 0.03
2
= 180.
Ответ: 1.81·10
22
; 180.
10. V = l · h · d = 10 · 2 · 0.2 = 4 см
3
– объём вытравленной в латуни бороздки.
M = V · ρ = 4 · 8.16 = 32.64 г – масса латуни, удаленной фрезерованием из бороздки.
M
ср
= M
Cu
·χ
Cu
+ M
Zu
·χ
Zu
= 64 · 0.57 + 65 · 0.43 = 64.43 г/моль – средняя молярная масса
латуни;
ν
M
= m / M
ср
= 32.64 / 64.43 = 0.507 моль – суммарное количество вещества металлов в
растворившейся порции латуни;
На аноде: Cu – 2e → Cu
2+
(для Zn – аналогично, оба металла двухвалентны);
ν
e
= 2ν
M
= 0.507 · 2 = 1.014 моль – суммарное количество электронов, пошедшее на
окисление латуни;
ν
e
(общ) = ν
e
/ η = 1.014 / 0.5 = 2.028 моль – общее количество электронов, прошедшее
через электролизёр.
Q = ν
e
(общ) · F = I · t, поэтому
t = (ν
e
(общ) · F) / I = 2.028 · 96500 / 100 = 1957.0 c = 32.6 мин = 0.54 ч.
Ответ: 0.54 ч.
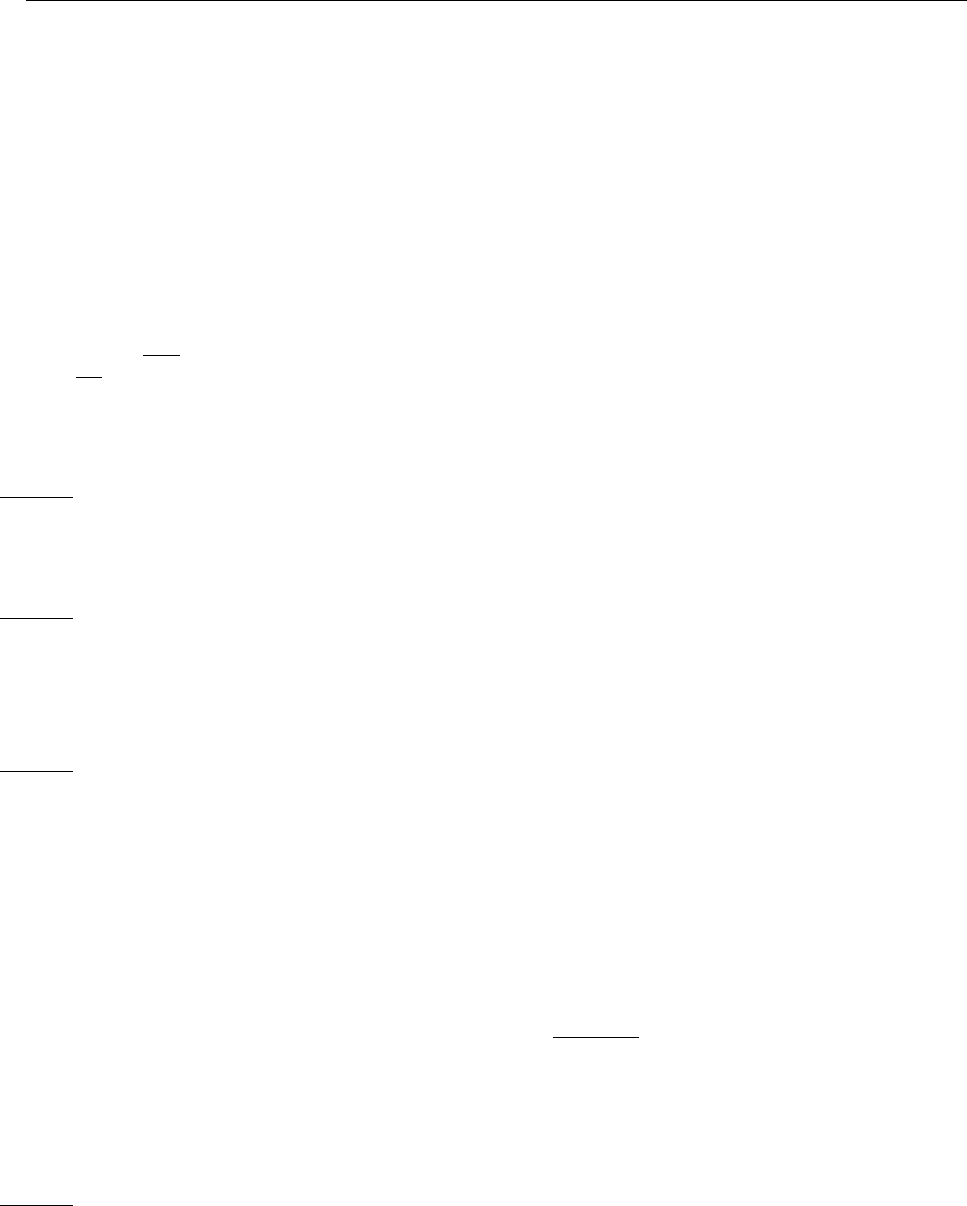
Геологический факультет. Решения задач и ответы
76
Геологический факультет
Решение варианта ГБ-2007-1
1. Sn
+4
; Ca[Sn(OH)
6
].
2. KМnO
4
; 2KМnO
4
+ 10KCl + 8H
2
SO
4
→ 5Cl
2
+ 2MnSO
4
+ 8H
2
O + 6K
2
SO
4
.
3. ω(NaOH) = 1.3 ⋅ 40 / (1000 ⋅ 1.2) = 0.0433 или 4.33%.
4. 2KМnO
4
(тв) + 16HCl(конц) → 2KCl + 2MnCl
2
+ 5Cl
2
↑ + 8H
2
O;
2AlBr
3
+ 3K
2
CO
3
+ 3H
2
O → 2Al(OH)
3
↓ + 6KBr + 3CO
2
↑.
5. CuSO
4
+ BaCl
2
→ BaSO
4
↓ + CuCl
2
;
CuSO
4
+ 2KOH → Cu(OH)
2
↓ + K
2
SO
4
.
6. По правилу Вант-Гоффа скорость реакции возрастает с температурой следующим образом:
10
21
1
2
TT
v
v
−
γ=
В нашем случае температурный коэффициент γ = 3.5, а (85 – 30) / 10 = 5.5; значит, скорость
реакции возрастет в 3.5
5.5
≈ 983 раза.
Ответ: скорость возрастет в 983 раза.
7. C
2
H
6
+ Cl
2
⎯→⎯
νh
C
2
H
5
Cl + HCl;
2C
2
H
5
Cl + 2Na → C
4
H
10
+ 2NaCl (реакция Вюрца);
C
4
H
10
+ Br
2
⎯→⎯
νh
CH
3
–CH
2
–CH(Br)–CH
3
+ HBr.
Ответ: A – C
2
H
5
Cl; B – C
4
H
10
; C – CH
3
–CH
2
–CH(Br)–CH
3
.
8. MnO
2
+ 4HCl → MnCl
2
+ Cl
2
↑ + 2H
2
O;
2KBr + Cl
2
→ 2KCl + Br
2
;
2KCl + 2H
2
O ⎯⎯⎯⎯→⎯
электролиз
H
2
↑ + Cl
2
↑ + 2KOH;
3Cl
2
+ 6KOH ⎯→⎯
o
t
5KCl + KСlO
3
+ 3H
2
O.
Ответ: Х – Сl
2
.
9. a) CH
2
=CH–CH
2
–CH
3
+ H
2
O ⎯⎯→⎯
+
H
CH
3
–CH(OH)–CH
2
–CH
3
;
б) CH
3
–CH(Br)–CH
2
–CH
3
+ NaOH(водн.) → CH
3
–CH(OH)–CH
2
–CH
3
+ NaBr;
в) CH
3
–C(О)–CH
2
–CH
3
+ H
2
⎯⎯→⎯
кат
CH
3
–CH(OH)–CH
2
–CH
3
.
10. Состав смеси: x моль CaC
2
и y моль CaCO
3
. При добавлении к смеси кислоты происходят
следующие реакции:
CaC
2
+ 2HCl → CaCl
2
+ С
2
H
2
↑;
CaCO
3
+ 2HCl → CaCl
2
+ CO
2
↑ + H
2
O.
Полученная газовая смесь (
x моль С
2
H
2
и y моль CO
2
) имеет плотность по воздуху 1.27, т.е.
ее средняя молярная масса
М
ср
= 1.27 ⋅ 29 = 36.83 =
yx
yx
+
+
4426
. В полученном при выпарива-
нии раствора остатке содержится (
x + y) моль CaCl
2
массой m = 111(x + y) = 55.5 г. Решение
системы из двух уравнений дает
x = 0.2 моль, y = 0.3 моль. Тогда масса исходной смеси со-
ставляла
m(исх) = 0.2 ⋅ 64 + 0.3 ⋅ 100 = 42.8 г;
а массовая доля карбида кальция в смеси равна
ω(CaC
2
) = 0.2 ⋅ 64 / 42.8 = 0.2991 или 29.91%.
Ответ: 42.8 г; 29.91% CaC
2
.
Ответы к варианту ГБ-2007-2
1. [Zn(OH)]
3
PO
4
; P
+5
.
2. KI.
3. 0.35%.
5. CuCl
2
.
6. Скорость увеличится в 15.6 раза.
7. A – 2-хлорпропан; В – 2,3-диметилбутан; С – 2-бром-2,3-диметилбутан.
8. X
1
– ZnO; X
2
– Zn; X
3
– Na
2
[Zn(OH)
4
].
10. 62.9 г; 31.3% BaCO
3
.

Физико-химический факультет. Решения задач и ответы
77
Физико-химический факультет
Решения варианта I-ФХБ-2007-1
1.
2. Na
2
SO
3
+ BaCl
2
→ BaSO
3
↓ + NaCl;
Na
2
SO
3
+ H
2
SO
4
→ Na
2
SO
4
+ SO
2
↑ + H
2
О;
Na
2
SO
3
+ Cl
2
+ 2NaOH(конц.) → Na
2
SO
4
+ 2NaCl + H
2
O;
4Na
2
SO
3
⎯→⎯
o
t
3Na
2
SO
4
+ Na
2
S.
3. По принципу Ле-Шателье а) при увеличении объема положение равновесия в этой системе
не изменится, б) увеличение концентрации одного из исходных веществ увеличивает выход
конечного продукта.
4. а) 6P + 5HIO
3
+ 9H
2
O → 6H
3
PO
4
+ 5HI;
б) 3CuO + 2NH
3
⎯→⎯
o
t
3Cu + N
2
+ 3H
2
O;
в) 2HBr + Mn(OH)
2
→ MnBr
2
+ 2H
2
O.
5. Обозначим неизвестное соединение как С
х
Н
y
O
z
N
k
. Тогда можно выразить соотношение:
x : y : z : k =
12
5.12
:
1
33.8
:
13
0.50
:
14
167.29
= 1.042 : 8.33 : 3.125 : 2.083 = 1 : 8 : 3 : 2.
Формула соединения CH
8
O
3
N
2
или (NH
4
)
2
CO
3
– карбонат аммония.
Ответ: (NH
4
)
2
CO
3
.
6. 1) Cl
2
+ H
2
⎯→⎯
νh
2HCl;
2) Fe + 2HCl → FeCl
2
+ H
2
↑;
3) 2FeCl
2
+ Cl
2
⎯→⎯
o
t
2FeCl
3
4
4) 2Fe + 3Cl
2
→ 2FeCl
3
;
5) Cl
2
+ Cu ⎯→⎯
o
t
CuCl
2
;
6) 2FeCl
3
+ Cu → 2FeCl
2
+ CuCl
2
.
Ответ: Х
1
– HCl, X
2
– FeCl
3
.
7. Обозначим за х количество вещества цинка, вступившего в реакцию:
2AgNO
3
+ Zn → Zn(NO
3
)
2
+ 2Ag↓,
х 2х
тогда изменение массы пластинки можно выразить как Δm = 120 ⋅ 0.057 = 6.84 г; с другой
стороны,
Δm = (108 ⋅ 2 – 65)x = 151х, отсюда х = 6.84 / 151 = 0.045 моль.
Исходная масса нитрата серебра равнялась
m(AgNO
3
) = 170 ⋅ 0.045 · 2 = 15.4 г.
Ответ: 15.4 г.
Физико-химический факультет. Решения задач и ответы
78
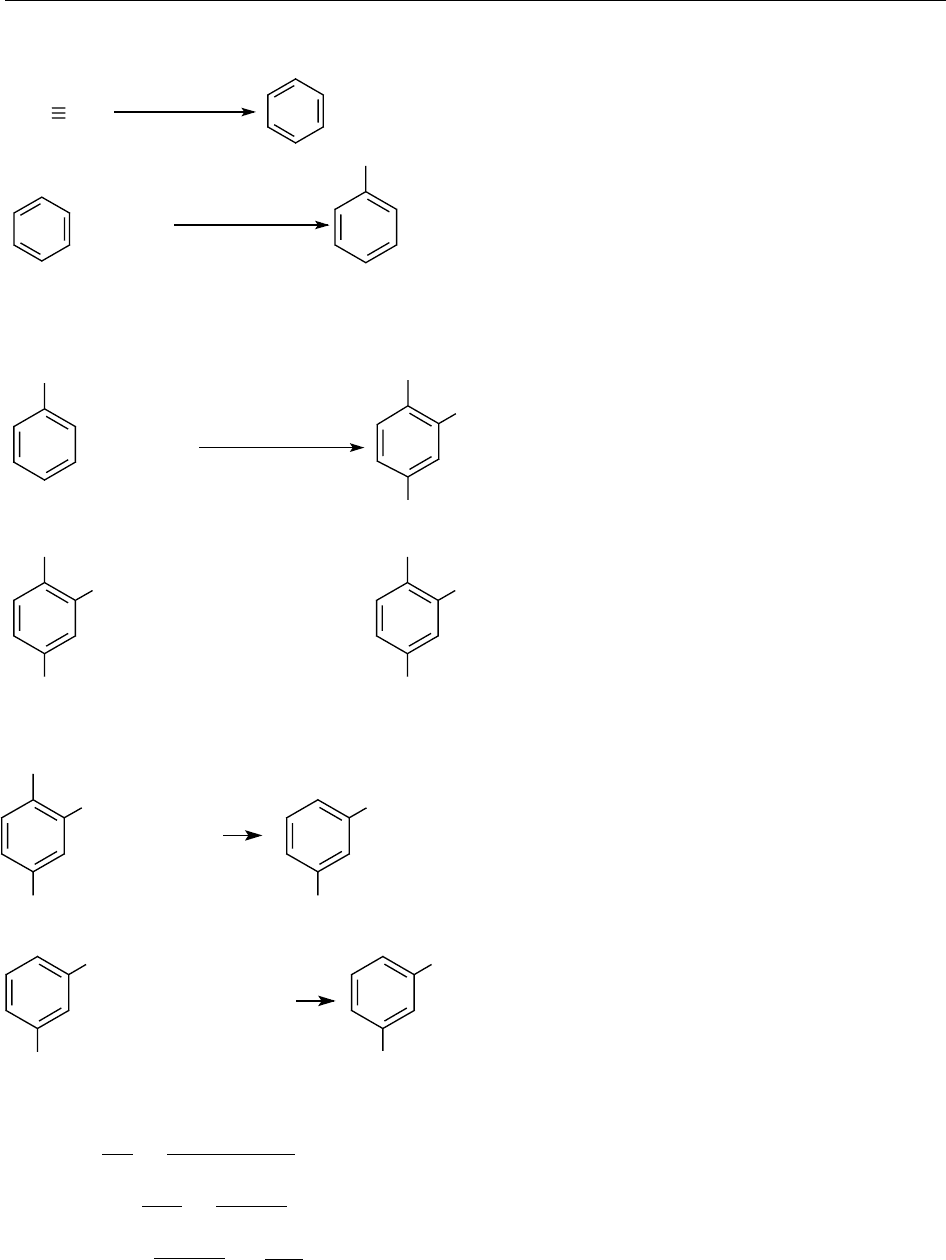
8.
C, 550
o
C
CH
3
3 CH CH
AlBr
3
+CH
3
Br
+ HBr
CH
3
+ 2 H
2
O
H
2
SO
4
CH
3
NO
2
NO
2
CH
3
NO
2
NO
2
+ 6KMnO
4
+ 9H
2
SO
4
= 5
COOH
NO
2
NO
2
+ 3K
2
SO
4
+ 6MnSO
4
+ 14H
2
O
5
+ 2HNO
3
COOH
NO
2
NO
2
+ K
2
CO
3
+ H
2
O
t
o
NO
2
NO
2
NO
2
NO
2
+ 6Fe + 14HCl
NH
3
Cl
NH
3
Cl
+ 6FeCl
2
+ 4H
2
O
+ 2KOH
9. ν(газа) =
RT
pV
=
293314.8
2.697.03.101
⋅
⋅⋅
= 0.25 моль;
M(газа) =
ν
ρV ⋅
=
25.0
13.12.6 ⋅
= 28 г/моль, следовательно, газ – это CO.
M(соли) =
(соли)
(соли)
ν
m
=
25.0
17
= 68 г/моль. Обозначим неизвестную соль как C
x
H
y
COONa.
Тогда
M(C
x
H
y
COONa) = 12x + y + 67 = 68; отсюда 12x + y = 1.
Единственное решение, имеющее смысл:
x = 0; y = 1. Следовательно, соль – формиат натрия
HCOONa. Действительно, СО можно получить из муравьиной кислоты или формиатов:
2HCOONa + H
2
SO
4
(конц.) ⎯→⎯
o
t
2CO↑ + Na
2
SO
4
+ 2H
2
O.
0.25 0.25

Физико-химический факультет. Решения задач и ответы
79
Реакция серебряного зеркала:
2HCOONa + 4[Ag(NH
3
)
2
]OH ⎯→⎯
o
t
4Ag↓ + Na
2
CO
3
+ (NH
4
)
2
CO
3
+ 6NH
3
↑ + 2H
2
O.
0.25 0.5 0.5
Осадок – это серебро. Масса выделившегося серебра:
m(Ag) = M ⋅ ν = 108 ⋅ 0.5 = 54 г.
Ответ: HCOONa; СО; 54 г серебра.
10. ν(Ca
3
(PO
4
)
2
) = m / M = 46.5 / 310 = 0.15 моль.
Количество вещества NaOH в растворе:
ν(NaOH) = V ⋅ ρ ⋅ ω / M(NaOH) = 295 ⋅ 1.1 ⋅ 0.08 / 40 = 0.649 моль.
Реакция получения фосфора:
Ca
3
(PO
4
)
2
+ 5C + 3SiO
2
⎯→⎯
o
t
3CaSiO
3
+ 2P + 5CO.
0.15 0.3
Сжигание фосфора и растворение полученного оксида:
4P + 5O
2
⎯→⎯
o
t
2P
2
O
5
0.3 0.15
P
2
O
5
+ 3H
2
O → 2H
3
PO
4
0.15 0.3
m(конечного раствора) = m(р-ра NaOH) + m(P
2
O
5
) = 295.5 ⋅ 1.1 + 142 ⋅ 0.15 = 346.35 г.
В результате реакции фосфорной кислоты со щелочью получим смесь солей:
H
3
PO
4
+ 2NaOH → Na
2
НPO
4
+ 2H
2
O
0.3 0.6 0.3
ν(NaOH изб.) = 0.649 – 0.6 = 0.049 моль.
Na
2
HPO
4
+ NaOH → Na
3
PO
4
+ H
2
O
0.049 0.049 0.049
ν(Na
2
HPO
4
) = 0.3 – 0.049 = 0.251 моль.
Итак, раствор после завершения реакций содержит следующие соли: 0.049 моль Na
3
PO
4
и
0.251 моль Na
3
PO
4
. Рассчитаем массовые доли солей в растворе:
ω(Na
3
PO
4
) = m(соли) / m(р-ра) = M ⋅ ν / m(р-ра) = 164 ⋅ 0.049 / 346.35 = 0.0232 или 2.32%;
ω(Na
2
HPO
4
) = m(соли) / m(р-ра) = M ⋅ ν / m(р-ра) = 142 ⋅ 0.251 / 346.35 = 0.1029 или
10.29%.
Ответ: 2.32% Na
3
PO
4
; 10.29% Na
2
HPO
4
.
Ответы к варианту I-ФХБ-2007-2
1.
Схемы реакций:
OHCH
3
CH
2
CH
2
OH
HBr
NaOH
OH + H
2
OCH
3
CH
2
CH
2
Br
ONa + H
2
OCH
3
CH
2
CH
2
OH
2. KBr + AgNO
3
→ KNO
3
+ AgBr↓;
2KBr + Pb(NO
3
)
2
→ 2KNO
3
+ PbBr
2
↓;
2KBr + Cl
2
→ 2KCl + Br
2
;
2KBr + MnO
2
+ 2H
2
SO
4
⎯→⎯
o
t
Br
2
+ K
2
SO
4
+ MnSO
4
+ 2H
2
O.

Физико-химический факультет. Решения задач и ответы
80
3. а) Равновесие сместится в сторону конечных продуктов, б) внесение катализатора не влия-
ет на равновесие в системе.
4. а) CO + 2HNO
3
→ 2NO
2
+ CO
2
+ H
2
O;
б) H
2
SO
3
+ Br
2
+ H
2
O → 2HBr + H
2
SO
4
;
в) 4NO
2
+ 4KOH + O
2
→ KNO
3
+ 2H
2
O.
5. CH
3
COONa.
6. 1) S + H
2
⇄ H
2
S;
2) 2H
2
S + 3O
2
→ 2SO
2
+ 2H
2
O;
3) 3S + 6NaOH
⎯→⎯
o
t
2Na
2
S + Na
2
SO
3
+ 3H
2
O;
4) Na
2
SO
3
+ 2HCl → SO
2
↑ + 2NaCl + H
2
O;
5) P
2
S
5
+ 8H
2
O → 2H
3
PO
4
+ 5H
2
S;
6) 2P + 5S
⎯→⎯
o
t
P
2
S
5
.
7. 8.34 г.
9. HCOOK; CO; Δm(трубки) = 7.28 г.
10. 9.0% Na
2
HPO
4
; 21.89% NaH
2
PO
4
.
