Таирова А.Р., Кузнецов А.И. Общая химия. Теоретические основы. Решение типовых задач
Подождите немного. Документ загружается.


Степень окисления является формализованным отображением общей
валентности элемента в соединении, определяемой суммой его
ковалентности и электровалентности.
Степени окисления можно рассчитать квантовохимически на
основании рассмотрения распределения электронной плотности в
молекуле. Однако гораздо раньше для расчета степеней окисления элемента
в его соединениях выработаны простые и удобные эмпирические правила,
не требующие трудоемких квантово-химических расчетов. В краткой форме
они приведены были выше. Рассмотрим их подробнее.
В простых веществах степень окисления, элемента всегда равна нулю.
Нулевые значения степени окисления имеют, например, атомы в молекулах
водорода (Н
2
), кислорода (О
2
), серы (S
3
, S
4
, S
6
, S
8
, . . . Sn где n обычно
принимает значения
порядка постоянной
Авогадро), в чистых
металлах (Me) и др.
В простых веществах
только благородных
газов, представляющих
собой одноатомные
молекулы при н.у.,
валентность элемента
равна нулю. Атомы
остальных элементов
проявляют ненулевую
валентность
Рис. 24. Наиболее распространенные степени окисления первых 35 например, валентность
элементов. Линиями соединены высшие и низшие степени окисления углерода в алмазе
равна четырем. Однако степень окисления углерода при этом принимается
равной нулю, так как нет преимущественных смещений электронной плотности
между эквивалентными атомами углерода и, следовательно, нет оснований
представить вещество алмаз, состоящим из ионов С
4+
и С
4–
. Поэтому степень
окисления является лишь отображением валентности, но не совпадает с ней.
В сложных соединениях некоторые элементы проявляют всегда одну и
ту же степень окисления, но для большинства элементов она может
принимать несколько значений
1
.
8.2. Окислительно-восстановительные реакции. Рассмотрим
основные положения теории окислительно-восстановительных реакций.
1
Постоянную степень окисления имеют щелочные элементы (+ 1), бериллий, магний,
щелочноземельные элементы (+2), фтор (- 1). Для водорода в большинстве соединений характерна
степень окисления +1, а в его соединениях с ч-элементами и в некоторых других соединениях она равна
- 1. Степень окисления кислорода, как правило, равна - 2; к важнейшим исключениям относятся
пероксидные соединения, где она равна - 1, и фторид кислорода OF
2
, в котором степень окисления кислорода
равна +2.
Степень окисления иона элемента равна заряду иона.
Для элементов с непостоянной степенью окисления ее значение всегда нетрудно подсчитать, зная
формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю.
131

1. Окислением называют процесс отдачи электронов атомом,
молекулой или ионом. Степень окисления при этом повышается. Например:
А1 - 3ē = А1
3+
Н
2
- 2ē = 2Н
+
Fe
2+
- ē = Fe
3+
2С1
–
- 2ē = С1
2
2. Восстановлением называют процесс присоединения электронов
атомом, молекулой или ионом. Степень окисления при этом понижается.
Например:
S + 2ē =S
2-
, С1
2
+2ē =2С1
-
, Fe
3+
+ ē
= Fe
2+
3. Атомы, молекулы или ионы, отдающие электроны, называют
восстановителями. Во время реакции они окисляются. Атомы, молекулы или
ионы, присоединяющие электроны, называют окислителями.
Во время реакции они восстанавливаются. Так как атомы, молекулы
и ионы входят в состав определенных веществ, то и эти вещества
соответственно называют окислителями или восстановителями
4. Окисление всегда сопровождается восстановлением и, наоборот,
восстановление всегда связано с окислением, что можно выразить
уравнениями:
восстановитель - ē ↔ окислитель
окислитель +ē ↔ восстановитель
Окисление-восстановление — это единый, взаимосвязанный процесс.
Окисление приводит к повышению степени окисления восстановителя, а
восстановление — к ее понижению у окислителя.
Повышение или понижение степени окисления атомов отражается в
электронных уравнениях: окислитель принимает электроны, а восстановитель
их отдает. При этом не имеет значения, переходят ли электроны от одного
атома к другому полностью и образуются ионные связи или электроны только
оттягиваются к более электроотрицательному атому и возникает полярная
связь. О способности того или иного вещества проявлять окислительные,
восстановительные или двойственные (как окислительные, так и
восстановительные) свойства можно судить по степени окисления атомов
окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не
может ее повысить (отдать электроны) и проявляет только окислительные
свойства, а в своей низшей степени окисления не может ее понизить (принять
электроны) и проявляет только восстановительные свойства. Атом же
элемента, имеющий промежуточную степень окисления, может проявлять как
окислительные, так и восстановительные свойства.
Например:
N
5+
(HNO
3
) S
6+
(H
2
SO) проявляются только окислительные свойства;
N
4+
(NO
2
) S
+4
(SO
2
)
N
3+
(HNO
2
)
N
2+
(NO) S
2+
(SO) проявляют окислительные и
132

N
+
(N
2
O) восстановительные свойства;
N
0
(N
2
) S
0
N
-
(NH
2
OH) S
-1
(H
2
S
2
)
N
2-
(N
2
H
4
)
N
3-
(NH
3
) S
2-
(H
2
S) проявляются только восстановительные свойства
При окислительно-восстановительных реакциях валентность атомов
может и не меняться. Например, в окислительно-восстановительной реакции
Н
0
2
+ С1
0
2
= 2H
+
Cl
валентность атомов водорода и хлора до и после реакции
равна единице. Изменилась их степень окисления. Валентность определяет
число связей, образованных данным атомом, и поэтому знака заряда не имеет.
Степень же окисления имеет знак плюс или минус.
Таблица 21
Важнейшие восстановители и окислители
Восстановители Окислители
Металлы, водород, уголь
Оксид углерода (II) СО
Сероводород H
2
S, сульфид натрия
Na
2
S, оксид серы (IV) SO
2
,
сернистая кислота H
2
SO
3
и ее соли,
тиосульфат натрия Na
2
S
2
O
3
Иодоводород HI, бромоводородная
кислота HBr, соляная кислота HCl
Хлорид олова (II) SnCl
2
, сульфат
железа (II) FeSO
4
, сульфат
марганца (II) MnSO
4
, сульфат
хрома (III) Cr
2
(SO
4
)
3
Азотистая кислота HNO
2
, аммиак NH
3
,
гидразин N
2
H
4
, оксид азота (II) NO
Фосфористая кислота H
3
PO
3
,
ортомышьяковистая кислота
H
3
AsO
3
, гексоцианоферрат (II)
калия K
4
[Fe(CN)
6
]
Альдегиды, спирты, муравьиная и
щавелевая кислоты, глюкоза
Катод при электролизе
Галогены
Оксид марганца (VII) Mn
2
O
7
, оксид
марганца (IV) MnO
2
, перманганат
калия KMnO
4
, манганат калия
K
2
MnO
4
Оксид хрома (VI) CrO
3
, хромат калия
K
2
CrO
4
, дихромат калия K
2
Cr
2
O
7
Азотная кислота HNO
3
Кислород O
2
, озон O
3
, пероксид
водорода H
2
O
2
Серная кислота H
2
SO
4
(конц.),
селеновая кислота H
2
SeO
4
Оксид меди (II) CuO, оксид серебра (I)
Ag
2
O, оксид свинца (IV) PbO
2
Ионы благородных металлов (Ag
+
, Au
3+
,
и др.)
Висмутат натрия NaBiO
3
, персульфат
аммония (NH
4
)
2
S
2
O
8
,
гексацианоферрат (III) калия
K
3
[Fe(CN)
6
], хлорид железа (III)
Гипохлориты, хлораты, перхлораты
Царская водка, смесь
концентрированных азотной и
плавикивой кислот
133

Анод при электролизе
8.3. Составление уравнений окислительно-восстановительных
реакций. Для составления уравнений окислительно-восстановительных
реакций и определения коэффициентов применяют два метода: метод
электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает
изменение степени окисления элементов в реакциях. Ионно-электронный
метод учитывает характер химической связи в молекуле и наличие тех ионов,
которые в действительности существуют в растворе, например, MnO
4
-
, SO
4
2-
,
Cr
2
O
7
2-
. При реакциях окисления-восстановления электроны не берутся откуда-
то со стороны, а только переходят от одних атомов или ионов к другим,
поэтому число электронов, принятых окислителем, равно числу электронов,
отданных восстановителем. При составлении уравнений окислительно-
восстановительных реакций для того, чтобы правильно написать продукты
реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса. Подбор коэффициентов в реакции
методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
P+HNO
3
→
разб.
Разбавленная азотная кислота с а) неактивными металлами (Cu), б)
неметаллами (P, As, S) и в) производными этих неметаллов (AsH
3
, PH
3
, As
2
S
3
)
образует оксид азота (II), понижая свою степень окисления:
P+HNO
3
→ NO +
разб.
Атом элемента в своей высшей положительной степени окисления
является окислителем, следовательно, окислитель
N
5+
+ 3ē → N
2+
Атом фосфора проявляет восстановительные свойства в данной реакции,
отдавая электроны с последнего энергетического уровня и повышая свою
степень окисления до +5.
P
0
– 5ē → P
+5
Следовательно, молекулярное уравнение реакции имеет следующий вид:
P + HNO
3
→ NO + H
3
PO
4
разб.
2) Определить величину и знак степени окисления элементов до реакции и
после реакции.
+5 0 +2 +5
HNO
3
+ P → NO + H
3
PO
4
3) Составить электронный баланс
N
5+
+ 3ē → N
2+
5
P
0
– 5ē → P
5+
3
134

4) Подставить найденные коэффициенты в уравнение реакции.
5HNO
3
+ 3P + 2H
2
O → 5NO + 3H
3
PO
4
5) Подсчитать количество атомов водорода в правой и левой части
равенства и уравнять их за счет добавления молекул воды в ту часть равенства,
где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов
кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной
реакции, подобрав коэффициенты к нему: FeSO
4
+ KMnO
4
+ H
2
SO
4
→ Fe
2
(SO
4
)
3
+ + MnSO
4
+ K
2
SO
4
+ H
2
O. Определяем степень окисления элементов до
реакции и после реакции.
+2 +7
+3
+2
FeSO
4
+ KMnO
4
+ H
2
SO
4
→ Fe
2
(SO
4
)
3
+ MnSO
4
+ K
2
SO
4
+ H
2
O
Составляем уравнения электронного баланса
2Fe
2+
- 2ē → 2Fe
3+
5
Mn
+7
+ 5ē → Mn
2+
2
Подставляем найденные коэффициенты в уравнение реакции.
Подсчитываем количество групп
2
4
SO
в правой части уравнения (15+2+1=18),
добавляем в левую часть равенства недостающие
2
4
8SO
-группы в виде
коэффициента при H
2
SO
4
. уравниваем число атомов водорода в правой и левой
части равенства.
Правильность написанного уравнения проверяем по числу атомов
кислорода в правой и левой части равенства.
10FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
→ 5Fe
2
(SO
4
)
3
+ 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
8.3.2. Ионно-электронный метод. При составлении электронно-ионных
уравнений следует исходить не из изменения степени окисления элементов в
реагирующих веществах, а нужно учитывать действительно существующие
ионы в водном растворе с точки зрения теории электролитической
диссоциации. Например, если реакция происходит с участием перманганата
калия, то в реакции окислителем будут ионы MnO
4
-
, а не ионы Mn
7+
, так как
перманганат калия в водном растворе диссоциирует KMnO
4
↔K
+
+MnO
4
-
. При
этом вещества неионного характера и недиссоциирующие изображаются в
электронных уравнениях в виде молекул: NH
3
, CO, NO
2
, SiO
2
, P.
В окислительно-восстановительных реакциях могут получаться различные
продукты реакции в зависимости от характера среды – кислой, щелочной,
нейтральной. Для таких реакций в молекулярной схеме необходимо указывать
окислитель, восстановитель и вещество, характеризующее реакцию среды
(кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо
руководствоваться правилами стяжения, указывать ионы, характеризующие
реакцию среды: H
+
, OH
-
, H
2
O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O
+2
образует с ионами H
+
молекулы воды:
135
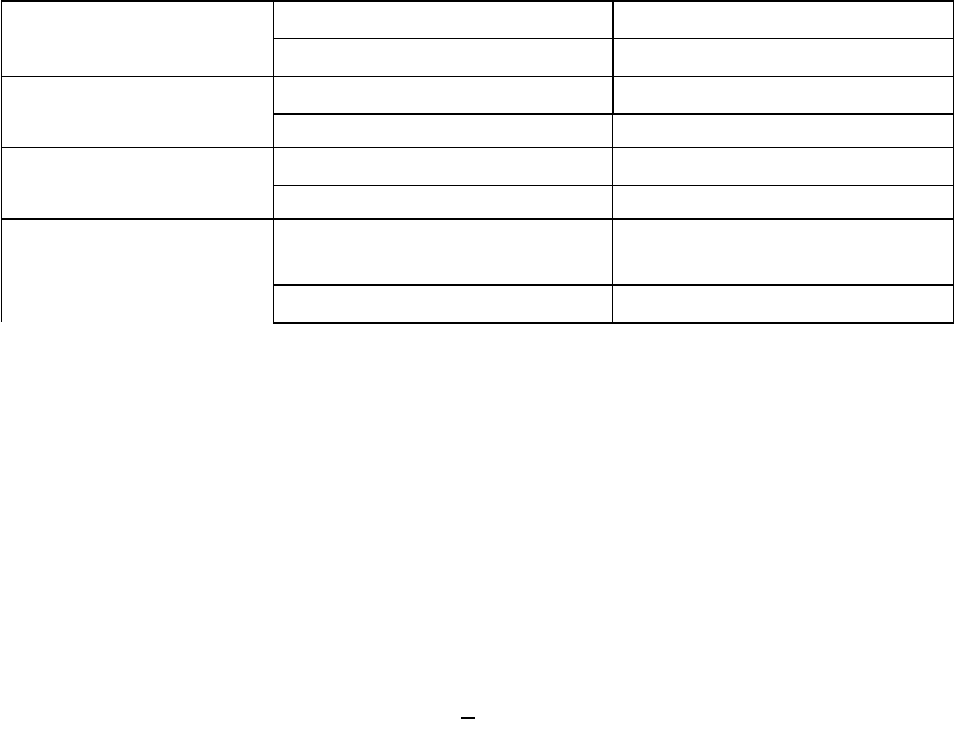
Изб. O
2–
+2H
+
=H
2
O
2. В нейтральной или щелочной среде избыток ионов O
2-
образует с
молекулами воды гидроксид – ионы:
Изб. O
2–
+ H
2
O=2OH
–
3. В щелочной среде недостаток ионов O
2–
компенсируется двумя ионами
OH
-
, одновременно образуется одна молекула воды:
2OH
–
H
2
O+O
2–
Реакция среды
Избыток ионов О
2–
Недостаток ионов О
2–
окислитель восстановитель
Кислая
Н
+
Н
2
О Н
2
O 2Н
+
изб. O
2–
+ 2H
+
= Н
2
О Н
2
О 2Н
+
+ O
2–
Нейтральная
H
2
O OH
–
Н
2
O 2Н
+
изб. О
2–
+ Н
2
О 2OН
–
Н
2
О 2Н
+
+ О
2–
Щелочная
Н
2
O ОН
–
2OН
–
Н
2
О
изб. О
2–
+ Н
2
O 2OН
–
2OН
–
Н
2
О + О
2–
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при
пропускании сероводорода Н
2
S через подкисленный раствор перманганата
калия КМnO
4
При протекании реакции малиновая окраска исчезает и раствор мутнеет.
Опыт показывает, что помутнение раствора происходит в результате
образования элементарной серы из сероводорода:
H
2
S S +2H
+
В этой схеме число атомов одинаково в левой и правой частях. Для
уравнивания зарядов надо от левой части схемы отнять два электрона, после
чего можно стрелку заменить на знак равенства:
H
2
S – 2
е
= S+2H
+
Эта первая полуреакция — процесс окисления восстановителя H
2
S.
Обесцвечивание раствора связано с переходом иона МnО
-
4
(он имеет
малиновую окраску) в ион Mn
2+
(почти бесцветный и лишь при большой
концентрации имеет розоватую окраску), что можно выразить схемой
MnO
4
–
Mn
2+
Опыт показывает, что в кислом растворе кислород, входящий в состав
ионов MnO
-
4
, вместе с ионами водорода в конечном итоге образует воду.
Поэтому процесс перехода записываем так:
МnО
-
4
+ 8H
+
Мn
2+
+ 4Н
2
О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды.
Поскольку исходные вещества имеют семь положительных зарядов (7+), а
конечные - два положительных (2+), то для выполнения условия сохранения
зарядов надо к левой части схемы прибавить пять электронов:
MnO
-
4
+ 8H
+
+5e
-
= Mn
2+
+4H
2
О
136

Это вторая полуреакция – процесс восстановления окислителя – иона
MnO
-
4
.
Для составления общего (суммарного) уравнения реакции надо уравнение
полуреакций почленно суммировать, предварительно уравнять число
отданных и полученных электронов. В этом случае по правилам нахождения
наименьшего кратного определяют соответствующие множители, на которые
умножаются равенства полуреакций. Сокращенно запись проводится так:
H
2
S – 2ē = S + 2H
+
5
MnO
4
–
+ 8H
+
+ 5ē = Mn
2+
+ 4H
2
O 2
5H
2
S + 2MnO
4
–
+ 16H
+
= 5S + 10H
+
+ 2Mn
2+
+ 8H
2
O
Сократив на 10 Н
+
, окончательно получим
5Н
2
S + 2МnО
-
4
+ 6Н
+
=5S + 2Mn
2+
+ 8Н
2
О
Проверяем правильность составленного ионного уравнения. В примере
число атомов кислорода в левой части 8, в правой 8; число зарядов в левой
части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от
ионного уравнения перейти к молекулярному, поступаем так: в левой части
ионного уравнения к каждому аниону подбираем соответствующий катион, а к
каждому катиону — анион. Затем такие же ионы в таком же количестве
записываем и в правую часть уравнения, после чего ионы объединяем в
молекулы:
5H
2
S + 2MnO
4
–
+ 6H
+
= 5S + 2Mn
2+
+ 8H
2
O
2K
+
3SO
4
2–
= 2K
+
3SO
4
2–
5H
2
S + 2KMnO
4
+ 3H
2
SO
4
= 5S + 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
Пример 2. Реакция среды кислая
1. Составить схему реакции
K
2
SO
3
+ KMnO
4
+ H
2
SO
4
K
2
SO
4
+ MnSO
4
+ H
2
O
SO
3
2-
+ MnO
4
-
+ 2H
+
SO
4
2-
+ Mn
2+
Из опытных данных знаем, что окислителем является КМnO
4
. Ион MnO
4
-
восстанавливается в кислой среде до Мn
2+
(фиолетово-малиновая окраска иона
MnO
4
-
становится бесцветной, переходя в Мn
2+
- ион), следовательно, ион
SO
3
2
- будет являться восстановителем, переходя в ион SO
4
2-
.
2. Составить электронно-ионные уравнения
а) для окислителя
MnO
4
-
+ 8H
+
= Mn
2+
+ 4H
2
O
Из ионной схемы видно, что, ион MnO
4
-
– превращается в ион Мn
2+
, при
этом освобождаются ионы О
2-
, которые по правилу стяжения в кислой среде
связываются ионами Н
+
, образуя молекулы Н
2
O.
б) для восстановителя
SO
3
2-
+ H
2
O = SO
4
2-
+ 2H
+
Из ионной схемы видно, что ион SO
3
2-
превращается в ион SO
4
2-
. Для
этого превращения необходимо добавить ион О
2-
, который берется из
молекулы H
2
O (реакция протекает в водной среде), при этом освобождаются
два иона Н+.
137

3. Подсчитать число зарядов в правой и левой части равенства, добавляя
или уменьшая необходимое число электронов. Алгебраическая сумма зарядов
в обеих частях равенства должна быть одинакова.
MnO
4
-
+ 8H
+
+ 5ē = Mn
2+
+ 4H
2
O
SO
3
2-
+ H
2
O - 2ē = SO
4
2-
+ 2H
+
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и
восстановителе:
MnO
4
-
+ 8H
+
+ 5ē = Mn
2+
+ 4H
2
O 2
+
SO
3
2-
+ H
2
O - 2ē = SO
4
2-
+ 2H
+
5
5. Написать суммарное электронно-ионное уравнение, учитывая
найденные коэффициенты:
2MnO
4
-
+ 16H
+
+ 5SO
3
2-
+ 5H
2
O =2Mn
2+
+ 8H
2
O + 5SO
4
2-
+ 10H
+
.
6. Сократить в левой и правой части уравнения 10 Н
+
и 5Н
2
O. Получается
ионное уравнение:
2MnO
4
-
+ 6H
+
+ 5SO
3
2-
= 2Mn
2+
+ 5SO
4
2-
+ 3H
2
O
7. По ионному уравнению составить молекулярное уравнение реакции:
2KMnO
4
+ 5K
2
SO
3
+ 3H
2
SO
4
= 2MnSO
4
+ 6K
2
SO
4
+ 3H
2
O
8. Число ионов и атомов каждого элемента в правой и левой части
равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
KCrO
2
+ Br
2
+ KOH → K
2
CrO
4
+ KBr +H
2
O
CrO
2
–
+ Br
2
+ OH
–
→ CrO
4
2–
+ Br +H
2
O
Окислителем в данной реакции является молекула брома, следовательно,
восстановителем будет являться метахромит калия, а именно ион СrO
2
–
.
2. Составить электронно-ионное уравнение
а) для окислителя
Вr
2
→ 2Вr
–
б) для восстановителя
СrO
2
–
+ 4OН
–
→ СrО
4
2–
+ 2Н
2
О
Из ионной схемы видно, что ион CrO
2
–
превращается в ион СгО
4
2–
.
Каждый недостающий ион О
2–
берется по правилу стяжения из двух
гидроксильных ионов (среда щелочная ОН
-
), при этом одновременно
образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти
коэффициенты при окислителе и восстановителе.
CrO
2
–
+ 4OH
–
- 3ē
→ CrO
4
2–
+ 2H
2
O 2
Вr
2
0
+ 2ē
→ 2Br
–
3
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
2CrO
2
–
+ 8OH
–
+ 3 Br
2
0
→ 2CrO
4
2–
+ 6Br + 4H
2
O
5. По ионному уравнению составить молекулярное уравнение реакции.
2KcrO
2
+ 8KOH + 3Br
2
→ 2K
2
CrO
4
+ 6KBr + 4H
2
O
138

6. Число атомов и ионов каждого элемента в правой и левой части
уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
K
2
SO
3
+ KMnO
4
+ H
2
O → MnO
2
↓ + K
2
SO
4
SO
3
2–
+ MnO
4
–
+ H
2
O → MnO
2
+ SO
4
2–
Окислителем является КМnO
4
, так как ион элемента в своей высшей
степени окисления не способен более отдавать электроны (Мn
+7
).
Восстановителем является сульфит калия K
2
SO
3
.
2. Составить электронно-ионное уравнение
а) для окислителя
МnO
4
-
+ 2Н
2
O→ MnO
2
0
+ 4OН
-
В нейтральной среде избыток ионов кислорода стягивается с молекулами
воды, образуя гидроксид-ионы.
б) для восстановителя
SO
3
2-
+ Н
2
O → SO
4
2-
+ 2Н
+
Из ионной схемы видно, что ион SО
3
2-
превращается в ион SO
4
2-
, для этого
необходимо добавить один ион О
2-
, который берется из молекулы Н
2
O
(реакция протекает в водной среде). При этом освобождаются два иона Н
+
.
3. Подсчитать число зарядов в правой и левой части равенства. Найти
коэффициенты при окислителе и восстановителе.
MnO
4
–
+ 2Н
2
O + 3ē → MnO
2
0
+ 4OН
–
2
SO
3
2–
+ Н
2
O – 2ē → SO
4
2–
+ 2Н
+
3
4.Написать электронно-ионное уравнение, учитывая найденные
коэффициенты:
2MnO
4
–
+ 3SO
3
2–
+ 7H
2
O → 2MnO
2
+ 3SO
4
2–
+ 8OH + 6H
+
или
2MnO
4
–
+ 3SO
3
2–
+ 7H
2
O → 2MnO
2
+ 3SO
4
2–
+ 6H
2
О + 2OH
–
Сокращаем левую и правую часть равенства на 6Н
2
0. Получаем
окончательное ионное уравнение.
2МnO
4
-
+ 3SO
3
2-
+ Н
2
O 2МnО
2
+ 3SO
4
2-
+ 2OН
-
5. По ионному уравнению составить молекулярное уравнение реакции.
2КМnO
4
+ ЗК
2
SО
3
+ H
2
O 2МnО
2
+ 3K
2
SO
4
+ 2КОН
6. Число атомов и ионов каждого элемента в правой и левей части
уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в
соединениях NН
3
, HNO
2
, HNO
3
, H
2
S, Н
2
SO
3
, Н
2
SО
4
, MnO
2
и КМnO
4
,
определите, какие из них могут быть только восстановителями, только
окислителями и какие проявляют как окислительные, так и восстановительные
свойства.
Решение. Степень окисления азота в указанных соединениях
соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S),
соответственно, равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn),
соответственно, равна: + 4 (промежуточная), +7 (высшая). Отсюда: NН
3
, H
2
S
139

— только восстановители; HNO
3
, H
2
SO
4
, КMnО
4
— только окислители; НNО
2
,
Н
2
SО
3
, MnO
2
— окислители и восстановители.
Пример 6. Могут ли происходить окислительно-восстановительные
реакции между следующими веществами: a) H
2
S и HI; б) H
2
S и Н
2
SО
3
; в) Н
2
SО
3
и НС1O
4
?
Решение:
а) Степень окисления в Н
2
S n(S) = -2; в HI n(I) = -1. Так как и сера и иод
находятся в своей низшей степени окисления, то оба вещества проявляют
только восстановительные свойства и взаимодействовать друг с другом не
могут;
б) в H
2
S n(S) = -2 (низшая), в H
2
SO
3
n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н
2
SО
3
является окислителем;
в) в Н
2
SO
3
n(S) = +4 (промежуточная); в НС1O
4
n(Сl) = +7 (высшая).
Взятые вещества могут взаимодействовать, Н
2
SО
3
в этом случае будет
проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной
реакции, идущей по схеме:
+7 +3 +2 +5
KMnO
4
+ H
3
PO
3
+ H
2
SO
4
→ MnSO
4
+ H
3
PO
4
+ K
2
SO
4
+ H
2
O
Решение. Если в условии задачи даны как исходные вещества, так и
продукты их взаимодействия, то написание уравнения реакции сводится, как
правило, к нахождению и расстановке коэффициентов. Коэффициенты
определяют методом электронного баланса с помощью электронных
уравнений. Вычисляем, как изменяют степень окисления восстановитель и
окислитель, и отражаем это в электронных уравнениях:
восстановитель 5 Р
3+
- 2ē = Р
5+
процесс окисления
окислитель 2 Mn
7+
+ 5ē = Mn
2+
процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно
числу электронов, которые присоединяет окислитель. Общее наименьшее
кратное для отданных и принятых электронов 10. Разделив это число на 5,
получаем коэффициент 2 для окислителя и продукта его восстановления, а при
делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его
окисления. Коэффициент перед веществами, атомы которых не меняют свою
степень окисления, находят подбором. Уравнение реакции будет иметь вид:
2KMnO
4
+ 5H
3
PO
3
+ 2H
2
SO
4
= 2MnSO
4
+ 5H
3
PO
4
+ K
2
SO
4
+ 3H
2
O
Пример 8. Составьте уравнение реакции взаимодействия цинка с
концентрированной серной кислотой, учитывая максимальное восстановление
последней.
Решение. Цинк, как любой металл, проявляет только восстановительные
свойства. В концентрированной серной кислоте окислительная функция
принадлежит сере (+6). Максимальное восстановление серы означает, что она
приобретает минимальную степень окисления. Минимальная степень окис-
ления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы
140
