Соколов Д.И. Шпаргалки по химии
Подождите немного. Документ загружается.


-i:
г
--------------------
~
г----~-----T-----------,
49.
Ароматические
углеводороды
I
50.
Природные
источники
(арены)
углеводородов
и
их
пере
работка
I
I
I
I
Гидрогалогенирование
сопряженных
Натуральиый
и
синтетический
каучуки
диенов:
Натуральный
каучук
получают
из
млеч
CH2-CH-CH~CH2
+
НВг
-7
ного сока
(латекса)
каучуконоспого
дере
-7
СНЗ-СН~СН-СН'ВГ
ва
гевеи,
растущего
в
тропических
лесах
или
-7
СНЗ-СНВГ-СН~СН,
Бразилии.
Каучук
-
это
стереорегуляр
Применение.
Диеновые
углеводороды
ный
полимер,
в
котором
молекулы
изоп
Типичными
представителями
аромати
Наиболее
важные
источники
-
природ
ческих
углеводородов
являются
производ
ный
газ
и
попутные
нефтяные
газы,
нефть,
ные
бензола,
т.
е.
такие
карбоцикличес
каменный
уголь.
кие
соединения,
в
молекулах
которых
рена
соединены
друг
с
другом
по схеме
1,4-
применяют
для
синтеза
каучуков.
ПРИРОZlный
газ.
В
его
состав
входят
ме
имеется
циклическая
группировка
ИЗ
присоединения
с
цис-
конфигурацией
по
тан
(80-97
%),
этан
(0,5-4
%),
пропан
Реакции
полимеризации
мономеров.
шести
атомов
углерода
-
бензольное,
или
лимерной
цепи:
(до
1
%),
бутан
(о,
1-0,2
%),
азот
и
дру
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
гие
газы.
Чем
выше
молекулярная
масса
углеводорода,
тем
меньше
его
содержится
в
природиом
газе.
Примеnение.
Природный
газ
использу
ется
как
дешевое
топливо
в
котельных
печах,
а
тю<же
для
получения
ацетилена,
этилена,
водорода,
сажи,
пластмасс,
ук·
сусной
кислоты,
красителей,
медикамен
тов.
Попутиые
нефтяные
газы.
Представля
ют
собой
топливо
И
ценное
энергетичес
кое сырье.
В
них
меньше
метана,
но
боль
ше
его
гомологов.
Извлечение
углеводородов
и
получение
непредельных
углеводородов
1.
Газовый
бензин
(смесь
пентана,
гек
сана
и
др.)
-
добавка
к
бензину
для
улуч
шения
пуска
двигателя.
2.
Пропан-бутановая
фракция
(смесь
пропана
и
бутана)
-
применяется
в
виде
сжиженного
газа
как
топливо.
3.
Сухой
газ
-
используется
для
получе
ния
C H
,
И
др.,
а
также
как
топливо.
z
2
Н
2
Полимеризация
осуществляется
под
вли
ароматическое,
кольцо.
Общая
формула
янием
катализаторов
или
инициаторов.
СН"
Н
СН,
Н
СНз
Н
ароматических
углеводородов
СnН'n_б'
I I I I I I
l,4-nрисоединения:
С=С
С=С
С=С
Электронное
строение
бензола.
Каждый
I I I I I I
nСН2~СН-СН~СНЗ
(катализатор)
-7
атом
углерода
в
молекуле
бензола
нахо
...
-СН,
СНз-СН,
СНз-СН,
СН,-·.·
-7
(-СН,
-СН~CH
-СН,
-)n
дится
в
состоянии
sр'-гибридизации.
Он
цис-полиизопрен
(каучук)
(бутаноаый
каучук)
связан
с
двумя
соседними
атомами
угле
Транс-полимер
изопрена
также
встре
nCH,~CH-CH=CH2
(катализатор)
-7
рода
и
атомом
водорола
тремя
а-связями.
чается
в
природе
в
виде
гуттаперчи.
В
результате
образуется
плоский
шести
I
СНЗ
угольник:
все
шесть
атомов
углерода и
СН, СН,
-
СН,
Н
C~'
~H,-
...
-7
(-CH2-CH~C-CH,-)n
I I I I
все
а-связи
с-с
и
С-Н
лежат
в
одной
С=С С=С С=С
I
плоскости.
Электронное
облако
четверто
I f I I I I
I
I
I
I
I
СНЗ
...
-СН,
Н
СН"СН,-СН,
Н
го
электрона
(1t-электрона),
не
участвую
(изопреновый
каучук)
щего
в
гибридизации,
имеет
форму
ганте
транс-полиизопрен
(гуттаперча)
1.2-nрисоединения:
ли
и
ориентировано
перпендикулярно
к
Натуральный
каучук
обладает
уникаль
nСН,
~CH
-СН
~CH,
(катализатор)
-7
плоскости
бензольного
кольца.
Такие
ным
комплексом
свойств:
БЫСОJCОЙ
теку
-7
(-СН,-СН-)n
1t-электронные
облака
соседних
атомов
уг
честью,
устойчивостью
к
износу,
клейко
I
лерода
перекрываются
над и
под
плоско
стью,
водо-
и
газонепроницаемостью.
Для
СН=СН,
стью
кольца.
В
результате
шесть
1t-элект
придания
каучуку
необходимых
физико
ронов
образуют
общее
электронное
обла
механических
свойств:
прочности,
элас
~----~------I
ко
и
единую
химическую
связь
для
всех
ТИЧНОСТИ,
СТОЙКОСТИ
К
действию
раство
рителей
и
агрессивных
химических
сред
-
I
I
I
I
I
I
I
атомов
углерода.
Две
области
большой
гидроксидов
R(OH),
увеличивается,
а
кис
электронной
плотности
расположены
по
латный
-
ослабевает.
каучук
подвергают
вулканизации
нагре
обе
стороны
плоскости
а-связей.
1t-злект
ванием
до
130...140
'с
с
серой_
Атомы
серы
RO,'
+
3Н'
Р
R(ОН)З
Р
RЗ-
+
30Н
(R -
элемент)
Мышьяк,
сурьма
и
висмут
плохо
ра
створяются
в
воде.
С
увеличением
поряд
кового
номера
элемента
восстановитель
ные
СВОЙСтва
водородных
соединений
RН
з
усиливаются,
а
устойчивость
уменьшает~
СА.
ронное облако
обусловливает
сокращение
присоединяются
по
месту
разрыва
иеко
расстояний
между
атомами
углерода.
В
торых
двойных
связей
и
линейные
моле
Нефть.
В
ее
состав
входят
циклопара
молекуле
бензола
они одинаковы и
равны
~
кулы
каучука
<сшиваютс,!>
в
более
круп
фины,
предельные
и
непредельпые
углево
0,14
нм.
Наиболее
точно
это
отражает
дороды,
арены.
Фракции:
ные
трехмерные
молекулы
-
получается
структурная
формула
бензола
в
виде
пра
резина,
которая по
прочноети
значитель
1.
Газолиновая
фракция
бензиноа
(40...
вильного
шестиугольника
с
окружностью
но
превосходит
не
вулканизированный
200
"с).
(C,H
12
-С
ll
Н,,).
и
фор
внутри
(1).
Однако
часто
пользуются
(40
...
70
'с),
бензин
(70
...
каучук.
Наполненные
активной
сажей
Газолин
мулой
Кекуле
с
указанием
двойных
свя
120
'С)
-
автомобильное
топливо.
каучуки
в
виде
резин
используют
для
из
зей
(Щ:
готовления
автомобильных
шин
и
других
2.
Лигроиноаая
фракция.
(150
...
*
резиновых
изделий.
250
ос)
-
(С'Н"--СI<Н
ЗО
)'
Горючее
для
трак
о
о
торов.
II
3.
Керосиновая
фракция
(180
...
I
I
I
I
I
I
I
I
Гомологический
ряд
бензола
имеет
об
300
'с)
-
(C
12
H,.-С"Н
зв
)
•
Керосин
исполь
щую
формулу
СnН'n_о'
СН,
СН,
ОСН,
Осн,
орто-ксилол
мета-ксилол
(1,2-диметил·
(l,3·диметил·
бензол) бензол)
сн,
О
СН,
пара·нсилол
(l.4·диметил.
бензол)
зуется
как
горючее
для
тракторов
и
ра
кет.
4.
Фракция
газойля
(выше
275
"С)
-
дизельное
топливо.
5.
{)статок
-
мазут.
Фракции
мазута:
соляровые
масла
-
дизельное
топливо,
смазочные
масла,
вазелин,
парафИВ.
Пос·
ле
отгонки
-
гудрон.
Получение
I
I
3Н
процесс
расщепления
углеводородов,
со
Крекинг
нефти
увеличивает
выход
бен
Циклогексан
(Pt
или
Pd, 300
ос)
зина
(65-
70
%).
Крекингом
называется
-7
L_~
~
~
I
L
~
С
Н
66
+
_...J
I
2'
~
~
59
58

------------T-----~----,
держвщихся
в
нефти,
в
результате
кото
рого
образуются
углеводороды
с
меньшим
количеством
атомов
углерода
в
молекуле,
образуются
более
простые
утлеводородные
цепи:
С"Н
З4
....
С,Н"
+ C,H
1
•
(гексадекаи)
(октан)
(октен)
С,Н"
С
,Н
ю
+
С
,Н,
С,Н,
С,Н.
+
С,Н,.
Полиэтилен
и
этиловый
спирт.
Ради
кальный
механизм.
СН,
-(СН,).
-СН,
(t")
....
....
СН,
-(СН,).
-СН,
* +
*СН,
-(СН,),
-СН,
СН,
-(СН,),
-СН, -СН,
*
....
....
СН,
-(СН,),
-CH~CH,
+
2Н*
СН,
-(СН,).
--{;Н,
* +
Н*
....
....
СН,-(СН,).-СН,.
Пиролизом
называют
разложение
орга
нических
веществ
без
доступа
воздуха
при
высокой
температуре
(выше
700
·С).
Про
дукты
пиролиза:
зтилен,
ацетилен,
бен
зол,
толуол.
При
термическом
крекинге
(470...550
ОС)
образуются
углеводороды
с
неразветвлен
ной
цепью
атомов
углерода.
В
этом
бензи
не
содержится
много
непредельных
и
пре
дельных
углеводородов,
он
имеет
большую
детонационную
стойкость.
Непредельные
углеводороды
легче
окисляются
и
поли
меризуются;
они
менее
устойчивы
при
хранении,
поэтому
к
ним
добавляют
ан
тиокислители.
Каталитический
крекинг
(450...500
ОС)
в
присутствии
катализатора
идет
с
боль
шой
скоростью,
происходит
изомериза
ция
молекул
углеводородов.
Такой
бен
зин
имеет
большую
детонационную
стой
кость,
содержит
меньше
непределъных
углеводородов
и
более
устойчив
при
хра
нении.
Применение.
Нефть
используют
для
получения
взрывчатых
веществ,
антифри
зов,
лекарственных
мазей,
парфюмерии,
горючего,
растворителей,
каучука,
рези
ны,
пластмасс,
высокомолекулярных
со
единений
(лавсан).
I
1
1
I
I
1
1
Метилциклогексан
(Pt, 300
ОС)
....
I
....
С.Н,-СН,
+
3Н,.
1
си
--{;Н
-си -си
-си
-си
(Pt
300
'С)
....
3
.2 .2
:l 2 3 9
1
....
бензол
+
4Н,_
3НС=СН
(600
ОС,
С)
....
....
бензол
(метод
Зелинского)
С.Н.
+
СН,
-Вг
(A1Cl,)
....
С.Н,-СН,
+
НВг
С,Н,
+
CH,~CH,""
С.Н,-С,Н,
Фнзическне
свойства.
Бензол
и
его
бли
жайшие
гомологи
-
бесцветные
жидко
сти
со
специфическим
запахом.
Аромати
ческие
углеводороды
легче
воды
и
в
ней
не
растворяются,
одиако
они
легко
ра
створяются
в
оргаиических
растворите
лях
-
спирте,
эфире,
ацетоне.
Химические
свойства
1.
Галогенирование:
С.Н.
+
Вг,
(FeCl"
t")
....
С.Н,Вг
+
НВг
*
2.
Нитроваиие:
С.Н.
+ HONO, (H,SO" t·)
....
....
C.H,NO, +
Н,О.
3.
Сульфирование:
С.Н.
+ H,SO,
....
C.H.SO,H +
Н,О
4.
Алкиллирование:
С.Н,
+
СН,-Вг
(AlCl,)
....
С.Н,-СН,
+
НВг
5.
Гидрирование:
С.Н.
+
Н,
....
С.Н"
6.
Галогенирование
на
свету:
С.Н.
+ 3Cl,
(свет)
....
C,H,Cl,
Реакции
окисления.
Бензол
очень
стоек.
Окисляются
только
боковые
цепи.
1.
С.Н,-СН.
+ [30]
(КМПО,)
....
....
С.Н,-СООН
+
Н,О
2.
Горение
(коптящее
пламя):
2С.Н.
+
150,
....
12СО,
+
6Н,о.
Реакция
полимеризации
стирола:
nC,H,-CH~CH,
....
n(-СН,-СН-)
I
С,Н.
Примененне.
Бензол
используется
для
получения
красителей,
медикаментов,
взрывчатых
веществ,
средств
защиты
ра
стений,
пластмасс,
синтетических
воло
кон,
в.
также
в
качестве
растворителя
орга
нических
веществ.
L_~
~
~
г----~-----------------,
1
51.
Спирты
1
Спирты
-
соединения
алифатического
ряда,
содержащие
одну
или
несколько
1
гидроксильных
гр~'пп.
Общая
формула
1
спиртов
с
одной
гидроксильной
группой
R-OH.
1
Классификация.
Спирты
классифици
1
руют
по
следующим
структурным
призна
кам:
1.
По
числу
гидроксильных
групп
I
спирты
подразделяются
на
одноатомные
I
(одна
группа
-ОН:
С,Н.ОН).
многоатомные
(две
и
более
групп
-ОН:
НО-СН,-СН,-ОН
I
этиленгликоль
(этандиол),
НО-СН,
1
СН(ОН)-СН,
-ОН
глнцерин
(пропантриол
1,2,3).
Двухатомные
спирты
с
двумя
ОН·
1
группами
при
одном
и
том
же
атоме
угле
1
рода
R-CH(OH),
неустойчивы
и,
отщепляя
воду,
сразу
же
превращаются
в
альдеги
1
дЫ
R-CH~O.
Спиртов
R-С(ОН),
не
суще
I
ствует.
2.
В
зависимости
от
того,
с
каким
атомом
углерода
(первичным,
вторичным
1
или
третичным)
связана
гидроксильная
группа,
различают
спирты
первичные
R-
1
СН,
-ОН,
вторичные
R,CH-OH,
третичвые
1 R,C-OH. 3.
По
строению
радикалов,
свя
занных
с
атомом
кислорода,
спирты
под
1
разделяются
на
предельные,
или
алкано
1
лы
(например
СН,СН,
-ОН),
непредельные,
или
алкенолы
(CH,~CH-CH,-OH),
арома
I
тические
(c,H,CH,-~H).
Непредельные
I
спирты
с
ОН-группои
при
атоме
yг~epo:
да,
соединенном
с
др!гим атомом
двоинои
I
связью,
очень
неустоичивы
и
сразу
же
изо
1
меризуются
в
альде~иды
или
Keт~Hы._Ha
пример,
виниловыи
спирт
?Н,-СН
ОН
1
превращается
в
уксусныи
альдегид
1
CH,-CH~O.
Фнзические
свойства.
Эти
свойства
1
спиртов
зависят
от
строения
углеводород
I
ного
радикала
и
положения
гидроксиль
ной
группы.
Первые
представители
гомо
I
логического
ряда спиртов
-
это
жидко
I
сти,
высшие
спирты
-
твердые
вещества.
Метанол,
этанол
и
пропанол
смешивают
I
ся
с
водой
в
любых
соотношениях.
С
рос
1
том
молекулярной
массы
растворимость
спиртов
в
воде
резко
падает.
Высшие
спир
1
ты
не
рас'rворяются
в
воде.
Растворимость
спиртов
с
разветвленной
структурой
1
выше,
чем
у
спиртов,
имеющих
неразвет
1
вленное,
нормальное
строение.
Низшие
спирты
обладают
характерным
алкоголь
1
ным
запахом,
запах
средних
гомологов
-
I
сильный
и
часто
неприятныЙ.
Высшие
спирты
практически
не
имеют
запаха.
I
рактерным
запахом
плесени.
Низшие
гли
коли
-
вязкие
бесцветные
ЖИДКОСТИ,
не
имеющие
запаха;
хорошо
растворимы
в
воде
и
этаноле,
обладают
сладким
вку·
сом.
С
введением
второй
гидроксильной
группы
в
молекулу
происходит
повыше
ние
плотности
и
температуры
кипения
спиртов.
Спирты
обладают
аномально
вы
сокими
температурами
кипения
по
срав
нению
со
многими
классами
органических
соединений.
Такие
Саойства
спиртов
объ
ясняются
особенностями
их
строения
-
образованием
межмолекулярных
водород
ных
связей.
Полученне
С,Н,Сl
+
КОН
С,Н
5
ОН
+
КСl
СО
+
2Н,
(220 300
'С,
р,
Си
или
ZnO) ....
....
СН,ОН
СИ,=<:Н,
+
НОН
(280...300
'С,
р,
Н,ю,)
....
....
С,Н.ОН
С.Н"О,
....
2С,Н,ОН
+
2СО,
(брожение)
СН,
-СНВг-СН,
+
Н,О
....
....
СН,-СН(ОН)-СН,
+
НВг
Химические
свойства.
В
химическнх
реакциях
гидроксисоединений
возможно
1-- - - -
-:J.<
- - - - -
1 52.
Простые
эфиры
Простые
эфиры
-
это
органические
ве
I
щества,
молекулы
которых
состоят
из
уг
I
леводородных
радикалов,
соединенных
атомом
кислорода:
R'-O-R",
где
R'
и
I
R"
_
различные
или
одинаковые
ради
1
каJIЫ.
Простые
эфиры
рассматриваются
как
1
производные
спнртов.
Названия
этих
со
1
едивений
строятся
из
названий
радика
лов
(в
порядке
возрастания
молекулярной
~
массы)
и
слова
.эфнр
•.
Например,
СН,ОСН,
-
диметиловый
эфир;
С,Н.ОСН,
-
метилэтиловый
эфир.
I
Полученне
1
Симметричные
простые
эфиры
R-O-R
получают при
межмолекулярной
дегидра
1
тации
спиртов:
,
1
С,Н,ОН
+
С,Н,ОН
(t<.140
С,
H,SO,)
....
1 ....
СН
з
-СН,
-О-СН,
-СН,
При
этом
в
одной
молекуле
спирта
раз
1
рывается
связь
О-Н,
а
в
другой
-
СВЯЗЬ
1
С-О.
Несимметричные
простые
эфиры
R-O-R'
образуются
при
взанмодействии
I
алКОГOJIята
и
галогевоводорода
(синтез
Вилъ
Lтретич=~рты~ада~ОСОбым~~~сона~
~-~
60
61
г-----------------~----I
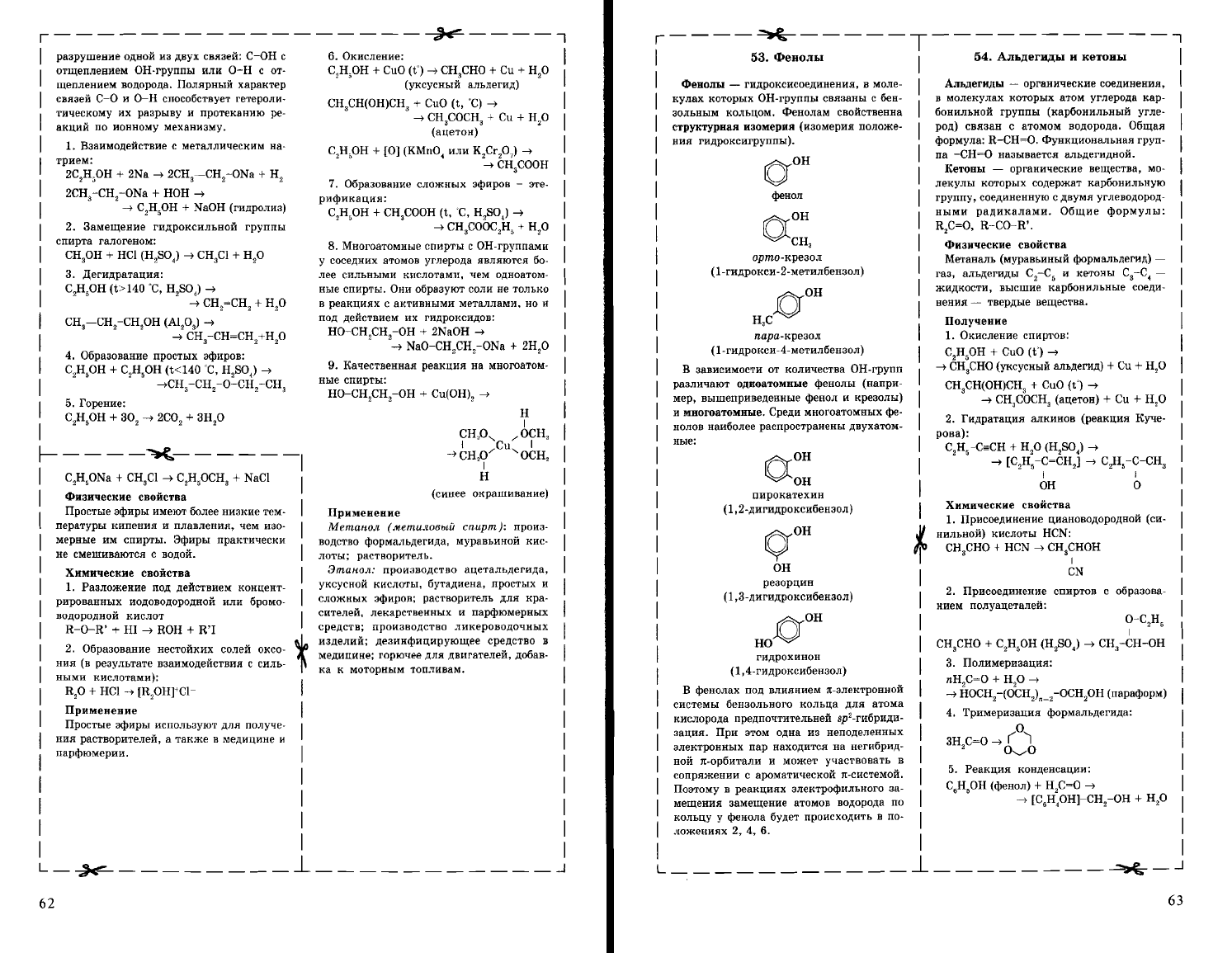
разрушение
одной
из
двух
связей:
с-он
с
отщеплевием
ОН-группы
или
О-Н
с
от
щеплением
водорода.
Полярный
характер
связей
С-О
и
о-н
способствует
гетероли
тическому
их
разрыву
и
протеквнию
ре
акций
по
ионному
механизму.
1.
Взаимодействие
с
металлическим
на
трием:
2С,Н,ОН
+ 2Na
....
2CH,-СН
2
-ОNа
+ Н
2
2CH,-СН
2
-ОNа
+
НОН
....
--'>
С,Н
5
ОН
+ NaOH
(гидролиз)
2.
Замещение
гидроксильной
группы
спирта
галогеном:
СН,ОН
+
НС!
(H,SO,)
--'>
СН,С!
+
Н,О
3.
Дегидратация:
С,Н,ОН
(t>140
'С,
H,SO,)--'>
--'>
СН,=СН,
+
Н,О
СН,-СН
2
-СН,ОН
(Al,O,)
--'>
--'>
СН,-СН=СН
2
+Н
2
О
4.
Образование
простых
эфиров:
С,Н,ОН
+
С,Н
5
ОН
(t<140
'С,
H,SO,)
....
~СН
з
-сн,
-О-СН,
-СНз
5.
Горение:
С,Н,ОН
+
30,
--'>
2СО,
+
3Н,О
~
- - -
-~-
- - -
--1
C,H
5
0Na
+
СН,С!
--'>
с
2
н
5
осн,
+ NaCl
4>изические
свойства
Простые
эфиры
имеют
более
низкие
тем
пературы
кипения
и
плавления,
чем
изо
мерные
им
спирты.
Эфиры
прзктически
не
смешиваются
с
ВОДОЙ.
Химические
свойства
1.
Разложение
под
действием
концент
рированных
иодоводородной
или
бромо
водородной
кислот
R-Q-R'
+
НI
....
ROH +
R'I
2.
Образование
нестойких
солей
оксо
ния
(в
результате
взаимодействия
с
силь
НЫМИ
кислотами):
R,O +
НС!
....
[RPИJ'Cl
Применение
Простые
зфиры
используют
для
получе
ния
растворителей,
а
также
в
медицине
и
парфюмерии.
1
1
I
I
1
1
1
6.
Окисление:
С,н,он
+
СиО
(С)
--'>
СН,СНО
+
Си
+
HP
(уксусный
альдегид)
СН,СН(ОН)СН
з
+
СиО
(t,
'С)
--'>
--'>
СН,СОСН,
+
Си
+
Н
2
О
(ацетон)
С,н,он
+
[О]
(КМпО.
или
К,Сг
2
О
7
)
....
--,>СН,СООН
7.
Образование
сложных
эфиров
-
эте
рификвция:
С,Н,ОН
+
СН,СООН
(t,
'С,
H,SOJ
--'>
....
СН,СООС,Н,
+
Н,О
8.
Многоатомные
спирты
с
ОН-группамн
у
соседних
атомов
уг
леродв
являются
бо
лее
СИЛЬНЫМИ
кислотами,
чем
одноатом
ные
спирты.
Они
обрвзуют
соли
не
только
в
реакциях
с
активными
металлами,
но
J{
под
действием
их
гидроксидов:
НО-СН,СН,-ОН
+ 2NaOH
....
--'>
NaO-СН,СН,-ОNа
+
2Н,О
9.
Качественная
реакция
на
многоатом
ные
спирты:
НО-СН
2
СН,-ОН
+
Си(ОН),
....
н
1
СНР,
"ОСН,
I
Си
I
....
СНо"
'ОСН
'1 2
Н
(синее
окрашивание)
Применение
М
етаltол
(метиловый
спирт):
проиэ
водство
формальдегида,
муравьиной
кис
лоты;
растворитель.
Эта
пол:
производство
ацетальдегида,
уксусной
КИСЛОТЫ,
бутадиена,
ПрОСТЫХ
и
сложных
эфиров;
растворитель
для
кра
сителей,
лекарственных
и
парфюмерных
средств;
производство
ликероводочных
изделий;
дезинфицирующее
средство
в
L_~--------~-----------~
г----~-----T-----------I
I
53.
Фенолы
I
Фенолы
-
гидроксисоединения,
в
моле
1
кулах
которых
ОН-группы
связаны
с
бен
зольным
кольцом.
4>енолам
свойственна
структурная
изомерия
(изомерия
положе
1
ния
гидроксигруппы).
1
он
1
О
1 v
фенол
1
rAr
oH
I
СА
СН,
I
орто-крезол
(1-гидрокси-2-метилбензол)
оон
Н,С
nара-крезол
(l-гидрокси-4-метилбензол)
В
зависимости
от
количества
ОН-групп
различают
одиоатомные
фенолы
(напри
мер,
вышеприведенные
фенол
икрезолы)
н
многоатомные.
Среди
многоатомных
фе
нолов
наиболее
распространены
двухатом
ные:
оОН
V
OH
пирокатехин
(I,2-дигидроксибензол)
уон
он
резорцив
(
1,3-дигидроксибензол)
оон
1
HO
V
гидрохинон
I
I
(1,4-гидроксибензол)
В
фенолах
под
влиянием
1t-злектровной
I
системы
бензольного
кольца
для
атома
кислорода
предпочтительней
sр2_
ги
бриди
1
зация.
При
этом
одна
из
неподеленных
1
электронных
пар
находится
на
негибрид
ной
1t-орбитали
и
может
участвовать
в
1
сопряжении
с
ароматической
л-системой.
Поэтому
в
реакциях
электрофильного
за
1
мещения
замещение
атомов
водорода
по
1
I
кольцу
у
фенола
будет
происходить
в
по
ложениях
2,
4,
6.
I
1
54.
Альдегиды
н
кетоиы
1
I
Альдегиды
-
ОрГ8.1Iичеекие
соединения,
I
в
молекулах
которых
атом
углерода
кар-
1
1
бонильной
группы
(карбонильный
угле-
I
1
род)
связан
с
атомом
водорода.
Общая
формула:
R-CH=O.
4>ункциональная
груп-
I
1
па
-CH~O
называется
альдегидной.
1
Кетоны
-
органические
вещества,
мо-
I
лекулы
которых
содержат
карбонильную
I
1
группу,
соединенную
с
двумя
углеводород
1
ны~и
ра~ик~л~ми.
Общие
формулы:
1
R,C-O,
R
СО
R . 1
1
4>нзические
свойства
1
1
Метаналь
(муравьиный
формальдегид)
-
газ
альдегиды
С
-С
и
кетоны С -С
- 1
' 2
fj
3
..
жидкости,
высшие
карбонильные
соеди-
1
нения
-
твердые
вещества.
Получение
I
1.
Окисление
спиртов:
С,Н,ОН
+
СиО
(t')
--'>
--'>
СН,СНО
(уксусный
альдегид)
+
Си
+
Н,О
СН,СН(ОН)СН
з
+
СиО
«()
--'>
--'>
СН,СОСН,
(ацетон)
+
Си
+
Н,О
2.
Гндратация
алЮlНов
(реакция
Куче
рова):
С'Н
5
-С"СН
+
Н,О
(H
2
SO.)
--'>
--'>
[C,H,-C~CH,]
....
C,H,-С-СН
з
I
ii
ОН
О
Химические
свойства
l
1.
Присоединение
циановодородной
(си
нильной)
кислоты
HCN:
СИ,СНО
+HCN
....
СН,СНОН
I
CN
2.
Присоединение
спиртов
с
образова
нием
полуацеталей:
О-С,Н,
I
СН,СНО
+
С,Н,ОН
(H,SO,)
--'>
СНз-СН-ОН
3.
Полимеризация:
nH2C~0
+
Н,О
....
--'>
НОСН,
-(ОСН,),_,
-ОСНрН
(параформ)
4,
Тримеризация
формальдегида:
О
3HC~0--,>
('1
2
0-.......-0
5.
Реакция
конденсации:
С,Н,ОН
(фенол)
+
Н,С-О
--'>
--'>
[c,h.oH]-СН,-ОН
+
Н
2
О
*
I
медицине;
горючее
для
двигателей,
ка
к
моторным
топливам.
I
1
I
1
1
1
1
добав
L
~
~-~
62
63

--
I
------------T-----~----I
г----~-----T-----------I
Дальнейшее
взаимодействие
с
другими
Получение
I
55.
Карбоиовые
кислоты
56,
Жиры
молекулами
формальдегида
и
фенола
при-
Кумольный
способ:
I
I
Карбоиовые
кислоты
-
органические
Жиры
-
это
сложные
эфиры
глицерина
соединения,
содержащие
одну
нли
ие-
и
высших
одноатомных
карбоновых
кис
водит
к
образованию
фенолформальдегид
уИ,
i
09-
И
-О
9-
0
i-
ОИ
уН,
и,so.
2[0]
вых
смол:
nС,Н,ОН
(фенол)
+
(n-l)Н,С-О
сколько
карбоксильных
групп
-СООН,
лот.
....
I
....
НОС,Н,
-[
-СН,
-C,HpНJ.,
-СН,
-С,НРН+
СИ,
СИ,!
связанных
с
углеводородным
радикалом.
О
"
+н,о
кумол
гидропероксид
Карбоксильная
группа
содержит
две
фун-
;----------;
СНгО:Н
ИОтС-R
I
: Q
кциональные
группы:
карбонил
>С=О
и
I I :
(изопропилбензол)
изопропилбензола
6.
Реакция
кротоновой
конденсации:
I
гидроксил-ОН,
непосредственно
связанные
СН
-
о:
Н
+
НО
+
С
-
R'
СН,СНО
+
СН,СНО
_
I
I
I
I
....
СИ,
I
друг
с
другом:
I I : :
О
-3Нр
....
CH,cH~CH-CHO
+
н,о
-ООИ+9=0
",
си-о:н
ио+ё-R"
R
-<~'
7.
Гидратация
с
получением
спиртов:
гл:цер~~---~~сшие
I
СН,
СН,СНО
+
Н,
....
СН,СН,ОН
о-н
..
I
фенол
+
Н,
карбоновые
ацетон
СН,СОСН,
....
СНзСН(ОН)СН,
Классификация
карбоиовых
кнслот,
По
кислоты
Фенолы
яв.mпoтc.я
более
Сильными
кис
R-CH~O
+
2[Аg(Nи,),]ОН
....
I
подразделяются
иа:
одноосновные
(моио
I
Химические
свойства
8.
количеству
карбоксильиых
групп
кислоты
Реакция
«серебряного
зеркала.:
9.
II
лотами,
чем
спирты
и
вода.,
т.
К.
за
счет
....
RCOOH
+
2Лg,!.
+ 4NH, +
Н,о
карбоновые
)
и
многоосновные
(дикарбо-
СИ,-
О
-
С
-
I
новые,
трикарбоновые
и
т.
~И
-?-
R
9.
*
участия
неподеленной
электронной
пары
кислорода
в
сопряжении
с
It-электронной
д.);
по
харак
9.
Окисление
гидроксидом
меди
(П)
с
I
теру
~
-
Н'
углеводородного
радикала
различа
образоаанием
красно-кирпичного
осадка
СистемОЙ
бензольного
кольца
полярность
ют
кислоты:
предельные,
непредельные
и
СИ
-0-
С -
R"
Си,О:
связи
О-Н
увеличивается.
R-CH=O +
2Си(0Н)2
I
ароматические.
2
....
Феиолы
реагируют
с
гидроксидами
ще
....
RCOOH
+
Си
2
О,!.
+
2Н,о
жир
Получение
I
I
I
I
I
I
лочных
и
щелочноземельных
металлов,
образуя
соли
-
феноляты:
С,н,он
+ NaOH
....
C,H,ONa +
И,о
Для
фенолов
свойственны
реакции
по
ОН-группе,
а
также
по
бензольному
коль
цу
(при
этом
необходимо
помнить,
что
за
мещеиие
атомов
водорода
по
кольцу
у
фенола
будет
происходить
в
положениях
Применение
МеmаlШJlЬ
(муравьиный
а.льдегuд):
полу
чение
фенолформальдегидных
смол;
полу
чение
мочевиноформальдегидных
(карба
мидных)
смол:
полноксиметиленовые
по
лимеры;
синтез
лекарственных
средств
(уротропии).
I
I
I
I
I
I
I
I
I
I
I
I
I
Общее
название
таких
соединений
триглицериды
или
триацилглицерины,
где
ацил
-
остагок
карбоновой
кислоты
-C(O)R.
В
состав
природных
триглицери
дов
входят
остатки
насыщенных
кнслот
(пальмитиновой
С
lБ
Н
31
СООН,
стеариновой
С"Н
3Б
СООН)
иненасыщенных
(олеиновой
С
I1
Н
зз
СООН,
линолевой
С
17
Н"СООН).
Жиры
содержатся
во всех
растениях
и
животных
организмах.
Животиые
жиры
(бараний,
свиной,
говяжий
и
т.
п.),
как
1.
Окисление
первичных
спиртов
и
аль
дегидов:
С,Н,ОН
+
[О]
(КМпО,
или
К,сг,о7)
....
....
СНзСООН
2.
Промышленный
синтез
муравьиной
кислоты;
а)
каталитическое
окисление
метана
2СН,
+
30,
(t",
кат.)
....
2Н-СООН
+
2Н,О
2,4,6).
б)
нагревание
оксида
углерода
(П)
с
гид
роксидом
натрия
1
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
Для
обнаружения
фенолов
используется
качественная
реакция
с
хлоридом
железа
(ПI).
Одноатомные
фенолы
дают
устойчи
вое
сине·
фиолетовое
окрашивание,
ЧТО
связано
с
образованием
комплексных
со
единений
железа.
I1рименение
Фенолы
используют
для
произаодства
фенолформальдегидных
смол;
они
также
являются
полупродуктами
в
органическом
синтезе.
СО
+ NaOH
(р;
200
'С)
....
....
H-СООNа
(Н,SO,)
....
Н-СООН
правило,
являются
твердыми
веществами
~
с
высокой
температурой
плавления
(ис
ключение
-
рыбий
жир).
Жиры
состоят
3.
Промышленный
синтез
уксусной
кис
главным
образом
из
триглицеридов
пре
лоты:
дельных
кислот.
Растительные
жиры
(под
а)
каталИТическое
окисление
бутана
солнечное,
соевое,
хлопковое
и
другие
2СН,-СН
2
-СН
2
-СН,
+ 502 (t",
кат.)
....
масла)
-
жидкости
(исключение
-
коко
....
4СИ,СООН
+
2Н,о
совое
масло).
В
состав
триглицеридов
ма
б)
нагревание
смеси
оксида
углерода
(П)
сел
входят
остатки
непредельных
кислот.
и
метанола
в
присутствии
катализатора
Жидкие
жиры
превращают
в
твердые
под
давлением
путем
реакции
гидрогенизации
(гидриро
СН,ои
+
СО
(t',
кат.,
р)
....
сн,сООН
вания).
При
этом
водород
присоединяется
4.
Синтез
ароматических
кислот
окис
по
двойной
связи,
содержащейся
в
угле
лением
гомологов
бензола:
водородном
радикале
молекул
масел:
СН,
О
О
56
+
6КМпО,
+ 9H,SO,(t")
-->
11
11
СН,-О-
С
-С"И"
СН,-О-С
-С"Н"
I
\
I
I
I
I
I
I
I
I
I
СООИ
I I Q
3Н,
I I Q
....
5 6 + 3K
2
SO,
+ 6MnSO, +
14Н,о
СИ
-0-
С
-C"H,,~CH-O-C
-С"И"
IJ
Q
Pt,
tI I I I
I
I
~
I
I
~
I
I
I
L_~
СИ,-О-С-С"Н"
СИ,О-С-С"Н"
5.
Гидролиз
функциональных
производ
I
I
~ ~
олеиновыи
стеариновыи
ных:
сложных
эфиров,
ангидридов,
гало
I
L
триглицерид
триглицерид
генангидридов,
амидов.
~
~-~
64
65
I

г-----------T-----~----,
Продукт
гидрогенизации
масел
-
твер
дый
жир
(искусственное
садо,
саломас).
Маргарин
-
пищевой
жир,
состоит
из
смеси
гидрогенизированных
масел
(подсол
нечного,
кукурузного,
хлопкового
и
др.),
ЖИВОТНЫХ
жиров,
молока
и
вкусовых
добавок
(соли,
сахара,
витаминов
и
др.).
Жирам
как
сложным
эфирам
свойствен
на
обратимая
реакция
гидролиза,
ката
лизируемая
минеральными
кислотами.
При
участии
щелочей
гидролиз
жиров
происходит
необратимо.
Продуктами
в
этом
случае
являются
мыла
-
СОЛИ
выс
ших
карбоновых
кислот и
щелочных
ме
таллов:
Q
СН,О-С
-С"Н"
I I Q
СН-О-С
-C1,H"
+ NaOH
~
I I Q
СН,-О-С
-С,Д"
жир
СН,ОН
I
О
~
СН
-
ОН
+"
I
3С
Н
-С-ОNа
СН,ОН
"
3б
глицерин
стеарат
натрия
(мыло)
Натриевые
соли
-
твердые
мыла,
кали
евые
-
жидкие.
Реакция
щелочного
гид
ролиза
жиров
называется
омылением.
Все
загрязнения
гидрофобны,
поэтому
стирка
в
чистой
воде
малоэффективна.
Молеку
ла
кислотного
остатка
состоит
из
двух
частей:
радикала
R,
который
выталки
ваетси водой,
и
группы
-СОО-.
которая
полярна,
гидрофильна
и
легко
прилипает
к
частицам
загрязнения.
В
мыльном
ра
створе
вода,
выталкивая
из
своей
среды
углеводородные
радикалы,
удаляет
вмес
те
с
ними
и
группу
-СОО-,
которая
адсор
бирована
на
поверхности
загрязняющей
частицы;
тем
самым
загрязнение
удаляет
ся
вместе
с
кислотным
OCTaTJ<OM.
Обычное
мыло
плохо
стирает
в
жёсткой
воде
и
со·
всем
не
стирает
в
морской
воде,
TaJ<
как
содержащиеся
в
ней
ионы
кальция
и
маг
ния
дают
с
высшими
кислотами
нераство
римые
в
воде
соли:
2RCOO-
+
Са
~
(RCOO),Ca'!'
в
современных
моющих
средствах
не
пользуют
натриевые
соли
высших
алкил
сульфокислот,
которые
не
связываются
ионами
кальция
в
нерастворимые
соли.
L_~
66
Физические
и
химические
свойства
Кислотные
свойства
карбоновых
кис
лот
обусловлены
смещением
электронной
плотности
к
карбонильному
кислороду
и
вызванной
этим дополнительной
(по
срав
нению
со
спиртами)
поляризации
связи
О-Н.
В
водном
растворе
карбоновые
кис
лоты
диссоциируют
на
ионы:
R-COOH
~
~
R-COO- +
Н'.
Растворимость
в воде
и
высокие
температуры
кипения
кислот
обусловлены
образованием
межмолекуляр
ных
водородных
связей.
1.
Кислотные
свойства:
2RCOOH
+
Mg
~
(RCOO),Mg +
Н,
2RССЮН
+ NaOH
~
RCOONa +
Н,О
2СН,СООН
+
СаО
~
(СН,ССЮ),Са
+
HP
2СН,СН,СООН
+ Na,CO, ~
~
2CH,CH,COONa +
Н,О
+
СО,
*
СН,СН,ССЮН
+
NaНCO,
~
~
СН СН
COONa
+
Н
О
+
СО
3 2 2 2
I 2.
Образование
сложных
эфиров
-
эте
рификация:
I
I
I
I
I
I
I
I
I
I
I
I
I
С,Н,ОН
+
СН,СООН
(t" H,SO,)
~
~
СН,СООС,Н,
+
Н,О
Омыление
(гидролиз)
сложного
эфира
СН,ССЮС,Н,
+ NaOH
~
~
СН
соо-
Na
t
+
С
Н
ОН
" ,
3.
Образование
амидов:
RCOOH
+
NH,
~
RCOONH, +
Н,О
RCOOBr +
NH,
-)
RCOONH, +
НВг
RCOOH
+
R"-NH,
(t')
~
~
RCOONH-R" +
Н,О
4.
Галогенирование:
СНз-СН,-СООН
+
Bг,~
~
CH,-~H-COOH
+
НВг
Вг
Применение
МуравЬUfLая
кислота
-
в
медицине,
пчеловодстве,
органичес~ом
синтезе,
при
получении
растворителеи
и
консервантов;
I
в
качестве
сильного
восстановителя.
Ук
сус..ная
кислота
-
в
пищевой
и
химичес
I
КОИ
промышленноети.
I
I
I
I
I
I
~
~
г----~-----T-----------
57.
Азотсодержащие
оргаиичес"ие
соединения
Амины
Амины
-
органические
производные
аммиака
NН
з
,
в
молекуле
которого
один,
два
или
три
атома
водорода
замещены
на
углеводородные
радикалы:
RNH"
R,NН,
R,N.
Простейший
представитель
-
метил
амин
CH,NH,.
КлассИфикация
аминон.
По
количеству
ради:калов,
связанных
с
атомом
азота,
различают
первичные,
вторичные
и
тре
тичные
амины:
по
характеру
углеводород
ного
радикала
амины
подразделяются
на
алифатические
(жирные),
ароматические
и
смешанные
(или
жирноароматические).
Изомерия:
1.
Изомерия
углеродного
скеле
та
(начиная
с
бутиламина).
2.
Изомерия
I
положения
аl\ШНОГРУППЫ
(начиная
с
пропила
МlШа).
CH,-NH,
метиламин,
CH,-CH,-NH
2
I
зтиламин.
С,Н,-
NH,
фениламин.
I
Физические
свойства.
Метиламин,
ди
I
метиламин
и
триметиламин
-
газы;
сред
вие
члены
алифатического
ряда
-
жид
I
кости;
высшие
-
твердые
вещества.
Получение
I
1.
Нагревание
аммиака
с
алкилгалоге
видами
(реакция
Гофмана):
I
NН,
+
С,Н,Вг
~
[C,H,NH,]tBr
NНз)
I
~
C,H,NН
2
+ NH,Br
I
Смеси
аминов
разделяют
перегонкой
.
I
2.
Восстановление
нитросоедннений
обыч
I
но
использукrr
для
получения
первичных
ами
нов
ароматического
ряда
(реакция
3инина):
I
ON0
2
+
6[Н]
~
О
NH, +
2Н,О
I
Атомарный
водород
образуется
в
момент
выделения
в
результате
реакции
цинка
I
(или
алюминия)
с
кислотой
или
щелочью.
I
Химические
свойства
I
1.
Основность
аминов
обусловлена
спо
собностью
атома
азота
присоединять
про
I
тон
к
неподеленной
паре
электронов
с
об
разованием
катиона
а..'iмониевого
типа:
I
I
R-NH,
+
Н,О
Р
[RN+H,]OH
Р
I
р
[RN'H,]
+
ОН
Амины
реагируют
с
минеральными
кис
лотами,
образуя
соли
аммониевого
типа:
I
RNH, +
НС!
~
[RNH,]"Cl
RR'NH
+
НС!
~
[RR'NHo]'Cl
I
RR'RN
+
НС!
~
[RR'RNHTCl-
I
2.
А.!килирование
аминов:
CH,-NH,
+
С,Н,Вг
--)
rCH,-NН'-{;2Н']+ВГ
I
[СН
-NНо-СоН
]'Вг
+NaOH
~
I 58.
Гетероци"личес"ие
соединення
Гетероциклические
соединения
(гете
роциклы)
-
это
органические
вещества,
содержащие
в
своих
молекулах
циклы,
в
образовании
которых,
наряду
с
атомами
углерода,
участвуют
атомы
и
других
эле
ментов
(гетероатомы).
Наиболее
распрос
гранены
гетероциклы,
в
состав
которых
входят
атомы
азота,
кислорода
или
серы.
Пиридин
C,H,N
-
шестичленный
ге
тероцикл
с
одним
атомом
азота,
Атомы
углерода
и
азота
находятся
в
состоянии
sр'-гибридизации.
Все
а-связи
С-С,
С-Н
и
C-N
образованы
гибридными
орбиталя
ми,
углы
между
которыми
составдяют
примерно
120'.
Поэтому
цикл
имеет
плос
кое
строение.
Шесть
электронов,
находя
щихся
на
негибридных
1!-орбиталях,
обра
зуют
1!-электронную
ароматическую
сис
тему.
Из
трех
гибридных
орбиталей
атома
азота
две
образуют
а-связи
C-N,
а
третья
содержит
неиоделенную
пару
электронов,
которая
не
участвует
в
Jt-электронной
системе.
Поэтому
пиридин
проявляет
свой·
ства
основания.
Его
водный
раствор
ок
рашивает
лакмус
в
синий
цвет.
При
вза
имодействии
пиридина
с
сильными
кис
лотами
образуются
соли
пиридиния:
СГ
CN:
+
НС!
~
CW-H
пиридиний
хлорид
Наряду
с
основными
свойствами
пири
дин
проявляет
свойства
ароматического
~
соединенuя.
Однако
его
активность
в ре·
акциях
злектрофнльного
замещения
ниже,
чем
у
бензола.
Это объясняется
тем,
что
азот
-
как
более
электроотрицательный
элемент
-
оттягивает
электроны
на
себя
и
ПQнижает
плотность
электронного
об
лака
в
кольце,
в
особенности
в
положе
ниях
2, 4
и
6
(орто-
и
пара-положения).
Поэтому,
например,
реакция
нитрования
пиридина
проходит
при
300
'С
и
с
Низким
выходом.
Ориентирующее
влияние
атома
азота
на
вс'гупление
нового
заместителя
при
электрофильном
замещении
в
пири
дине
подобно
влиянию
нитрогруппы
в
нитробензоле;
реакция
идет
в
положение
3:
в
B+~N
+ HO-NO,
~
ON
+
Н,О
NO.
3-нитропиридин
I
Как
и
бензол,
пиридин
может
присое
~
_
~
_
:с,
ёН;-NН,-с,н,-=-
NaBr
-=-Н.о
-l
дин
ять
водород
-.:..
присутствии
~и~
_
67

г-----------T-----~----I
I
тора
с
образованием
насыщенного
соеди
I
нения
пиперидина:.
..
~N:
+
6[Н]
----'------.,
CN-H
I
C
-
ка,..
пиперидин
I
Пиперидин
проявляет
свойства
вторич
I
ного
амина
(сильное
основание).
Пиррол
C,H,NH ~
пятичленный
гетеро.
I
цикл
с
одним
атомом
азота.
Электроиное
строение
молекулы
пиррола
объясняет
его
I
свойства
как
слабой
кислоты
и
аромати
I
ческого
соединения.
Атомы
углерода и
азота
находятся
в
состоянии
sр'-гибриди
I
зации.
о-связи
С-С,
С-Ни
C-N
образо
ваны
гибридными
орбиталями.
Цикл
име
вт
плоское
строение.
На
негибридной
р-ор
битали
азота
находится
неподеленнаяпара
электронов,
которая
вступает
в
сопряже
ние
с
четырьмя
р-электронами
атомов
уг
лерода.
Таким
образом,
в
циклической
системе
сопряжения
находятся
шесть
элек
тронов,
что
определяет
аромаmичеСllие
свойства
пиррола.
Пиррол
значительно
активнее
бенэола
в
реакциях
электрофильного
замещения.
Пример
_
замещение
четырех
атомов
во
дорода
при
иодировании:
1 1
п
н
~.C}.>
+
41,
N.OH)
IZ.)-..I
+
4НI
N N
I I
Н
Н
пиррол
тетраиодпиррол
(иодол)
Связывание
неподеленной
электронной
пары
атома
азота
системой
сопряжения
приводит
к
резкому
ослаблению
основ
ных
и
проявлению
Ilислотных
свойств.
Как
слабая
кислота
пиррол
вступает
в
реакцию
с
металлическим
калием,
обра
зуя
соль
-
пиррол·калий:
20
+
2К
--.
20
+Н"
N5'
N-'
t 5' I •
Н
пирро:"калий
Пиррол
может
участвовать
в
реакциях
присоединения:
•
Гидрирование
приводит к
образова
нию
пирролидина:
~
+
2Н
--.
О
••
2..
O
~
~
Н
Н
пирролидин
(сильное
основание)
•
Под
действием
сильных
минеральных
кислот
пиррол
вступает
в
реакции
поли
меризации.
L_~
68
3.
Ацилирование
аминов
галогенангид-
I
рида~и:
СН.
NH, +
RCOOBr
--.
RCO-NH-CH.
11
О
4.
Горение:
4CH,NH, +
90,
--.
4СО,
+ lOH,O + 2N,
5_
Аминогруппа
оказывает
существен
ное
влияние
на
бензольное
кольцо,
вызы
вая
увеличение
подвижности
водородных
атомов
по
сравнению
с
бензолом,
причем,
вследствие
сопряжения
неподеленной
элек
тронн~й
пары
.с
1t-электронной
аромати
ческои
системои,
увеличивается
электрон
ная
плотность
в
орто-
и
пара-положени
ях.
При
нитровании
и
бромировании
анилин
(фениламин)
C,H,NН,
легко
обра
зует
2,
4,
6-тризамещенные
продукты
ре
акции:
* NH, NH,
Вг
Вг
6 +
3Вг,
--.
О
+ 3HBr
у
I 2 6
б
Br
I . ,4,
-три
романилин
По
тои
же
причине
анилин
легко
окис
I
ля:гся.
На
воздухе
анилин
буреет;
при
деиствии
других
окислителей
образует
вещества
разнообразной
окраски.
С
хлор
ной
известью
CaOCl,
дает
характерное
фиолетовое
окрашивание.
Это
одна
из
наиболее
чувствительных
качественных
реакций
на
анилин.
Практическое
значение
имеет
реакция
анилина
с
азотистой
:кислотой
или
ее
со
лями
при
пониженной
температуре
(око
ло
О
'С):
C,H,NH, + KNO, +
2НСI
~
анилин
--.
[С,Н,
-N=N]+CI- +
КСI
+
2Н,о
х~орид
фенилдиазония
При
более
высокой
температуре
реак
ция
идет
с
выделением
азота
и
анилин
превращается
в
фенол:
C,H,NH, + NaNO, +
Н
80.
--.
I
--.
С,Н,-ОН
+
N5
+ Na,SO. +
2Н,О
I
Так
.же,
как
~
анилин,
реагируют
с
азо
тистои
кислотои
И
другие
первичные
аро
I
матические
амины.
I
Прнменение
Амины
используют
для получения
ле
I
карственных
веществ,
красителей
и
ис
ходных
продуктов
для
органического
син
I
теза.
Гексаметилендиамин
при
ПОЛИКОИ
I
денсации
с
адипиновой
кислотой
дает
полиамидные
волокна.
~
~
г----~-----------------·
59.
Аминокислоты
Аминокислоты
-
это
карбоновые
кис
лоты,
в
углеводородном
радикале
кото
рых
один
или
несколько
атомов
водорода
замещены
аминогруппами.
В
зависимос
ти
от
взаимного
расположения
карбок
сильной
и
аминогрупп
различают
а,.,
~-,
у-
И
т.
д.
аминокислоты.
~
о.
СН.
-СН-СООН
о.-аминопропионовая
I
кислота
NН,
~
о.
СН,
-СН,
-СООН
~-аминопропионовая
I
кислота
NН,
Чаще
всего
термин
_аминокислота>
при
меняют
для
обозначения
карбоновых
кис
лот,
аминогруппа
которых
находится
в
а-положении,
т.
е.
для
а-аминокислот.
Общую
формулу
а-аминокислот
можно
представить
следующим
образом:
H N-CH-COOH
2
I
R
Важнейшие
а-аминокислоты,
входящие
в
состав
белков
Амянокислота
Строеиие
R
АлифатичеСllие
Глицин
Н
Аланин
СН,
Валии*
(СН,),СН
Лейцин*
(СН,),СН
-СН,
Изолейцин*
СН
-СН
-СН
з
,
I
СН.
Содержащие
ОН-
группу
Серин
НО-СН,
Треонин*
СН,
-СН(ОН)
Содержащие
СООН-
группу
Аспарагиновая
НООС-СН,-
Г
лутаминовая
НООС-СН,
-СН,
Содержащие
NH,CO-
группу
Аспарагин
NH,CO-CH,-
Глутамин
NH,CO-CH,-CH,-
Содержащие
NH,-
группу
Лизин*
NH,-(CH,),-CH,-
Аргинин
NН,-C-NH-(CH,),-CH,
11
NН
Серосодержащие
Цистеин
Н8-СН,
Метионин*
СН,-8-СН,-СН,
L
Аминокислота
Строение
R
АромаmичеСllие
Фенилаланин*
ОСН,
Тирозин
ho-Q-cН,
Гетероци/(лические
00
ен,
Триптофан*
N
I
Н
Гистидин
~l-ен,
t;'
Н
Имино/(ислота
Пролин
ИСООН
t;'
Н
*
Незаменимые
а-аминокислоты
Изомерия.
Наряду
с
изомерией,
обус
ловленной
строением
углеродного
скелета
и
положением
функциональных
групп,
для
а-аминокислот
характерна
оптическая
(зеркальная)
изомерия.
Все
о.·аминокис
лоты,
кроме
ГЛИЦИВ8,
DптичеСRИ
актив
ны.
Например,
аланин
имеет
один
асим
метрический
атом
углерода
(отмечен
звез
дочкой):
Н
I
H,N-C*-COOH
I
СН,
Аланин
существует
в
виде
оптически
ак
тивных
энантиомеров:
СООН
СООН
1 1
H-C-NH,
H,N-C-H
1 1
СН,
СН.
D-аланин
L-алании
Все
природиые
а-аминокислоты
ОТНО
сятся
к
L-ряду
.
Физические
свойства.
Аминокислоты
представляют
собой
кристаллические
ве
щества
с
высокими
(выше
250
'С)
темпе
ратурами
плавления,
которые
мало
отли
чаются
у
индивидуальных
аминокислот
и
поэтому
нехарактерны.
Плавление
со
провождается
разложением
вещества.
Аминокислоты
хорошо
растворимы
в
воде
и
нерастворимы
в
органических
раство
рителях
(зтим
они
похожи
на
неоргани
~-~
69

г-----------------~----,
I
ческие
соединения).
Многие
аминокисло
I
ты
обладают
сладким
вкусом.
Получение
1.
Важней:ший
ИСТDЧНИ:К
аминокис
I
лот
-
природные
белки,
при
гидролнзе
которых
образуются
смесн
а-аминокис
лот.
2.
Синтез
аминокислот
ИЗ
галогенозаме
щенных
кислот
действием
аМblиажа:
Cl-CH-COOH +
2NH,-+
1
R
-+
H,N-CH-COOH + NH,Cl
1
R
3.
Микробиологический
синтез.
Извест
ны
микроорганизмы,
которые
в
процессе
жизнедеятельности
продуцируют
а-ами
HoKиcлoTы
белков.
4.
Присоединение
аммиака
к
а,
~-непре
дельным
кислотам
с
образованием
р-ами
нокислот:
CH,~CH~COOH
+ NH, -+
-+
H,N-CH
2
-CH,-COOH
Химические
свойства
1.
Некоторые
свойства
аминокислот,
в
частности
высокая
температура
плавле
ния,
объясняются
своеобразием
их
строе
ния.
Кислотная
(-СООН)
и
основная
(-NH,)
группы
в
молекуле
аминокислоты
взаимодействуют
друг
с
другом,
образуя
внутренние
соли
(биполярные
ионы).
На
пример,
для
глицина
H,N-CH -COOH
р
H,N'-CH,-COO-
2
2.
Вследствие
наличия
в
молекулах
ами
нокислот
функциональных
грунп
кислот
ного
и
основного
характера
а-аминокис
лоты
являются
амфотерными
соединения
МИ,
Т. е.
ОНИ
образуют
соли
как
с
кисло·
тами,
так и
со
щелочами:
H N-CH-COOH +
HCl-+[Н,N--СН-СООН]Сl
2
1 I
R R
H,N-CH-COOH +
NaOH
-+
1
R
....
н
2
N-CH-COO-Na'
+ Н
,
О
~
3.
В
реакции
со
спиртами
образуются
сложные
эфиры:
"о
H,N-CH-c
7
+НОС,Н,....
~H,
'
ОН
""О
-+H,N-
?н-
С,
+
HP
сн,
ОС,Н,
этиловый
эфир
алаНIiна
4.
Ацилирование:
"о
СН,-С:
H,N-CH-COOH
+
/0-+
1
СН,-С"
сн,
"о
О
11
-+
CH,-C-NH-CH-COOH +
СН,СООН
1
сн,
N
-ацетилаланин
""О
H,N-CH-COOH
+
сн,-С
-+
I
'с!
сн,
О
11
-+
CH,-C-NH-CH-COOH +
НС!
1
сн,
5.
а-аминокислоты
вступают
друг
с
дру
ГОМ
В
реакцию
поликонденсации,
обра
зуя
амиды
кислот.
Продукты
такой
кон
денсации
называются
пептидами.
При
взаимодействии
двух
аминокислот
обра
зуется
дипептид:
Н
О
сн,О
1
11
I
11
Н
N-CH-C-OH
+
H-NH-CH-C-OH
-+
2
глицин
аланин
Н
О
сн,О
1
11
11
-+
H,N-CH-C~NH-CH~C-OH
+
Н,О
глицилаланин
При
коиденсации
трех
аминокислот
об
разуется
трипептид
и
т.
д.
О
11
Связь
-C-NH
называется
пептидной
связью.
6.
Практическое
значение
имеет
внут
римолекулярное
взаимодействие
функци
ональных
групп
Е-аминокапроновой
кис
лоты,
в
результате
которого
образуется
I
Е-капролактам
(полупродукт
для
получе
ния
капрона):
I
9H~_~_~~_~_~~~~~9H,
",~':;.I)
I
H-N-IH
но-:с-о
- I
'.---------------------,
Е-аминокапроновая
кислота
/СН,-сн
I
сн,
\'
I
-+
Ьн,
уН,
I
'--.
С
~--
"о
I
Н
Е-капролактам
I
L_~--------------------~
г----~-----------------
60.
Углеводы
I
I
УглеВОllЫ
-
общая
формула
С.(Н,О)m
-
I
I
входят
в
состав
клеток
и
тканей
расте
ний
и
животных
(80 %
сухого
вещества
растений
и
20 %
животных).
Растения
I
синтезируют
углеводы
из
СО, и
Н,О.
Функ
ции
углеводов:
поставляют
энергию
для
I
биологических
процессов,
являются
исход
ным
материалом
для
синтеза
промежуточ
I
Hыx
ИЛИ
конечных
метаболитов.
Углево
I
ды
делятся
на
простые
моносахариды
(мономеры)
олигосахаридов
(от
2
до
10
I
моносахаридных
остатков:
дисахариды
...
)
И
полисахариды
(полимеры).
Моносахари
I
ды
-
гетерофункциональные
соединения:
1
одновременно
содержат
карбонильную
и
I
несколько
гидроксильных
групп,
т.
е.
мо
I
носахариды
-
полигидроксиальдегиды
и
полигидроксикетоны.
В
зависимости
от
I
строения
моносахаридов
различают:
аль
дозы
(содержится
альдегидная
группа)
и
I
кетозы
(содержится
кетогруппа).
Напри
I
мер,
глюкоза
-
это
альдоза,
а
фрукто
за
-
это
кетоза.
I
СНО
<;ж,он
С=О
I
но
Н!ОН
Н
I
H0=t=H
Н
он
Н
он
Н
он
Н
ОН
I
СН,ОН
СН,ОН
I
глюкоза
фруктоза
I
в
зависимости
от
количес'гва
атомов
~'г
лерода
в
м~леку
ле
мо~осахарид
~азывает
I
си
тетрозои,
пентозои,
геКСО3QИ
и
т. д.
I
Большинство
при
родных
моносахари
дов
-
пентозы
и
гексозы.
Моносахариды
I
изображаются
в
виде
проекционных
фор·
I
мул
Фишера:
углеродная
цепь
записыва
ется
вертикально.
Для
природных
моно
I
сахарндов
характерно
явление
оптической
I
изомерии:
все
они
относятся
к
правовра
щающим
D-изомерам,
L-изомеры
исподьзу
I
ют
ТОЛЬКО
некоторые
бактерии,
Каждой
альдозе
D-
ряда
соответствует
стереоизо
I
мер
L-ряда.
молекулы
которых
ОТНОСЯ'гся
I
между
собой
как
предмет
инесовмести
мое
с
ним
зеркальное
изображение.
Такие
I
стереоизомеры
называются
энантиомера~
I~
Получение.
В
свободном
виде
в
природе
I
встречается
преимущественно
глюкоза.
I
Она
же
является
структурной
единицей
миогих
полисахаридов.
Другие
моносаха
I
риды
в
свободном состоянии
встречаются
I
редко
и
в
основном
известны
как
J<:ОМПО
L
ненты
олиго-
и
полисахаридов.
В
ПРИРОllе
глюкоза
получается
в
результате
реакции
фотосинтеза:
6СО,
+
6Н,О
....
С.Н
,О,
+
60,
1
(глюкоза)
Впервые
глюкозу
получил
в
1811
г.
рус
СКИЙ
химик
Г.
Э.
Кирхгоф
при
гидролизе
крахмала.
Позже
А.
М.
Бутлеров
предло
жил
синтез
моносахаридов
из
формальде
гида
в
щелочной
среде:
о
'1
6С-Н
(Са(ОН),)
-+
С.Н
12
О.
1
Н
В
промышленности
глюкозу
получают
гидролизом
крахмала
в
присутствии
сер
ной
кислоты:
(
С
Н
О)
+
Н
О
(H2
S0
4,t')
Б
10
::.
11
n 2
~
пС,Н
12
О,
(крахмал)
(глюкоза)
Физические
свойства.
Моносахариды
-
твердые
вещества,
легко
растворимые
в
воде,
плохо
-
в
спирте
и
совсем
нераство
римые
в
эфире.
Водные
растворы
имеют
нейтральную
реакцию
на
лакмус.
Боль
шинство
моносахаридов
обладают
слад
ким
вкусом,
однако
меньшим,
чем
свен
ловичный
сахар.
Химические
свойства.
Моносахариды
проявляют
свойства
спиртов
и
карбониль
ных
соединений.
1.
Реакции
по
карбонильной
группе
1.
Окисленне:
а)
как
и у
всех
альдегидов,
окисление
моносахаридов
приводит
к соответству
ющим
кислотам.
Так,
при
окислении
глю
козы
аммиачным
раствором
гидрата
окн
си
серебра
образуется
глюкововая
кисло
та
(реакция
.серебряного
зеркала.).
C
"о
ht
-
Нон
НО
н
н
он
+ 2[Ag(NH,),]OH-+
Н
ОН
СН,ОН
D-глюкоза
~Щ
Hg
!
gH
-+
Н
он
+ 2AgJ, + 3NH +
Н
О
Н
ОН
' 2
СН,ОН
аммониевая
соль
D~глюконовой
кислоты
I
~-~
70
71
килирующих
средств,
подобное
превраще
С,Н
12
О,
--i
СИ,
-си,
-си,
-СООИ
кислота
ние
затрагивает
все
гидроксильные
груп
му.
Позтому
мальтоза
способна
вступать
+
в)
более
сильные
окислительные
сред
н
реакции,
характерные
для
альдегидов,
(масляная
кислота)
пы
моносахарида:
и,
в
частности,
давать
реакцию
.серебряно
+
2Н,
+
2С0
2
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
ства
окисляют
в
карбоксильную
группу
н
ОН
",О
ОН
--i
ОСН,
Н
разных
моносахарида.
Для
установления
Н
ОН
Н
ОН
сн,о
ОСН,
строения
дисахаридов
необходимо
знать:
Н
гидролизе
образуют
два
одинаковых
или
ОН
О
~
СН,ОН
С-ОН
Н
ОН
(солодовый
сахар),
содержащаяся
а
соло
н
ОН
ОН
Н
~
н
ОН
относится
сахароза.
Она
содержится
в
са
СН,ОН
ОН
ОН
I
I
I
I
I
I
I
харном
тростнике,
сахарной
свекле
(до
де,
т. е.
проросших,
а
затем
высушенных
СН,ОН
28 %
сухого
вещества),
соках
растений
и
и
измельченных
зернах
хлебных
злаков.
Н
он
плодах.
Молекула
сахарозы
построена
из
О-глюкоза
О-сорбит
CH'OCOC~'
Н
a,O-глюкопиранозы
и
~,О-фруктофурано
Несмотря
на
схожесть
химических
зы:
~
Н
свойств
моносахаридов
с
альдегидами,
ОСОСП,Н
~
C
7Q'O
глюкоза
не
вступает
в
реакцию
с
гидро
СН,ОСО
ОН
мальтоза
г-----------------~----,
б)
реакция
моносахаридов
с
гидрокси
1.
Алкилирование
(образование
про
дом
меди
при
нагревании
также
приво
стых
зфиров).
ДИТ К
альдоиавым
кислотам.
CH'OHo
Н
",О
Н
+
СИ
ои
Hellr",)
C
-
Нон
ОН
Н
,---
НО
н
ОН ОН
ht
~
НО
н
+
2Сu(ОИj,--i
Н
он
Н
ОН
a,O-глюкопиранозз
СН,ОН
О-галактоза
CH'OHo
Н
",О
--i
~H
Н
+
ир
ОН
ОСН,
htC-~~
~
НО
н
Н
ОН
--i
НО
Н
+
Си,О'!'
+
2ИР
г----~-----------------
61.
Специфические
реакции
вании
ПрОСТDЙ
эфирной
связи
участвуют
yrnеводов
гликозидный
гндроксил
одной
молекулы
и
спиртовой
гидроксил
при
четвертом
Глюкоза
характеризуется
некоторыми
атоме
углерода
другой
молекулы
моноса
специфическими
свойствами
-
процесса
харида.
Аномерный
атом
углерода
(С,),
ми
брожения.
Брожением
называется
рас
участвующий
в
образовании
этой
связи,
щеплевие
молекул
сахаров
под
воздействи
имеет
а-конфигурацию,
а
аномерный
атом
ем
ферментов
(знзимов).
Брожению
под
со
свобоДНЫl\l
ГJIИКозидным
гидроксилом
мо
вергаются
сахара
с
числом
углеродных
жет
иметь
как
а-конфигурацию
(а-маль
атомов,
кратным
трем.
Различают:
тоза),
так
и
~-конфигурацию
(~-мальто
а)
спиртовое
брожение
за).
С.И
12
0.
--i
2СИ,
-си,ОН
+
2СО,
Мальтоза
представляет
собой
белые
кри
(этиловый
спирт)
сталлы,
хорошо
растворимые
в воде,
слад
кие
на
вкус,
одпано
значительно
меньше,
б)
молочнокислое
брожение
чем
у
сахара
(сахарозы).
C.H
I2
O,
--i
2СН,-СИ-СООН
Как
видно,
в
мальтозе имеется
свобод
I
Н
ОН
метил-а,О-ГЛЮf>опиранозид
СН,ОН
При
использовании
более
сильных
ал
О-галактоновая
ОН
ный
гликозидиый
гидроксил,
вследствие
(молочная
кислота)
чего
сохраняется
способиость
к
раскры
в)
маслянокислое
брожение
тию
цикла
и
переходу
в
альдегидную
фор
не
только
альдегидную,
но
и
первичную
спиртовую
группу,
приводя
К
двухоснов
ным
сахарным
(альдаровым)
кислотам.
",О
",О
C
-
Нон
H~C-~~
НО
Н
ht
но
н
Н
ОН
НNОз(конц.)
)
н ОН
Н
ОН
CH'OHo
Н
Н
~
NaOH
ОН
Н
ОН
ОН
~
Н
ОН
CH'OCHo
Н
Упомянутые
виды
брожения,
вызывае
мые
микроорганизмами,
имеют
широкое
практическое
значение.
Например,
спир
товое -
для
получения
этилового
спирта,
в
виноделии,
пивоварении
и
т.
Д.,
а
мо
лочнокислое
--
для
получения
молочной
кислоты
и
кисломолочных
продуктов.
Дисахариды.
Дисахариды
(биозы)
при
_
го
зеркала.,
поэтому
ее
называют
восста
навливающим
дисахаридом.
Кроме
того,
мальтоза
вступает
во
многие
реакции,
характерные
для
моносахаридов,
напри
мер, образует
простые
и
сложные
эфиры:
СН.ОН СП,ОН
Н
Н
H~OH
СН,!
ОН
Н
~
ОН
Н
NaOH
О-глюкоза
сахарная
н
ОСН,
(О-глюкаровая)
пентаметил-С(,
кислота
О-глюкопираноза
2.
Восстановление.
Приводит
к
много
2.
Ацилирование
(образование
сложных
атомным
спиртам.
эфиров).
C
",О
сн,_с"О
-
Нон
HtCH'~~
CH'OHo
Н
ht
НО
Н
CH-C~O
но
н
•
Н
ОН
Н
LiAlH4
)
мальтоза
из
каких
моносахаридов
он
построен,
ка
кова
конфигурация
аномерных
центров
у
этих
моносахаридов
(а-
или
~-),
каковы
CH'OC~'
Н
GCH'OC~'
Н
размеры
цикла
(фураноза
или
пираноза)
и
с
участием
каких
гидроксилов
образу
--i
~H,
Н
~н.
н
ется
связь
двух
молекул
моносахарида.
сн,о
О
ОСИ,
Дисахариды
подразделяются
на
две
груп
Н
осп,
н
ОСН,
~
пы:
восстанавливающие
и
невосстанавли
октвметилмалътоэа
вающие.
К
восстанавливающим
дисаха
К
невосстанавливающим
дисахаридам
ридам
относится,
в
частности,
мальтоза
<>0
ОН
н
H1
1~
ОН
2
О
Н
О
,
сульфитом
натрия
(NaНSO,).
Н
ОСОСН,
3.
Как
и
все
МВОГО8томные
спирты,
глю
11.
Реакции
по
гидроксиЛЬ1tЫ-М
груnnа-м
О
, •
.СН,ОН
коза
с
гидроксидом
меди
(11)
дает
интен
Эти
реакции
осуществляются,
как
пра
Мальтоза
составлена
из
двух
остатков
ОН
Н
вило,
в
полуацетальвой
(циклической)
сивное
синее
окрашивание
(качественная
D-глюкопиравозы,
которые
связаны
реакция).
I
(1-4)-гликозидной
связью,
т_ е.
в
образо
сахароза
форме.
L_~
~
L
~-~
73
72
I
г-----------------~----,
I
в
противоположность
мальтозе
глико
зидная
связь
(1-2)
между
моносахарида
I
мн
образуется
за
счет
гликозндных
гид
I
роксилов
обеих
молекул,
т. е.
свободиый
гликозидный
гидроксил
отсутствует.
Вслед
ствие
этого
отсутствует
восстанавливаю
щая
способность
сахарозы,
она
не
дает
реакции
.серебряного
зеркала.,
поэтому
ее
относят
к
невосстаиавливающим
диса
харидам.
Сахароза
-
белое
кристаллическое
ве
щество,
сладкое
на
вкус,
хорошо
раство·
римое
в
воде.
Для
сахарозы
характерны
реакции
по
гидроксильным
группам.
Как
и
все
диса
хариды,
сахароза
при
кислотном
нли
фер
ментативном
гидролизе
превращается
в
моносахариды,
из
которых
она
составлена.
Полисахариды.
Важнейшие
из
полиса
харидов
-
это
крахмал
и
целлюлоза
(клет
чатка).
Они
построены
из
остатков
глю
козы.
Общая
формула
этих
полисахари
дов
(С,Н,оО,),.
в
обраэовании
молекул
полисахаридов
обычно
принимает
учас
тие
гликозидный
(при
С,-атоме)
и
спир
товой
(при
С.-атоме)
гидроксилы,
т. е.
об
разуется
(1-4)-гликозидная
связь.
Крахмал
представляет
собой
смесь
двух
полисахаридов,
построенных
из
a,D-глю
копиранозных
звеньев:
амилозы
(10-20
%)
и
амилопектина
(80-90
%).
Крахмал
об
разуется
в
растениях
при
фотосинтезе
и
откладывается
в
виде
'резервного,
угле
вода
в
корнях,
клубнях
и
семенах.
Напри
мер,
зерна
риса,
пшеницы,
ржи
и
других
злаков
содержат
60-80
%
крахмала,
клубни
картофеля
-
15-20
%.
Родстаен
ную
роль
в
животнОм
мире
выполняет
по
лисахарид
гликоген,
«запасающиЙся.,
В
основном,
В
печени.
Крахмал
-
это
белый
порошок,
СОСТОЯЩИЙ
из
мелких
зерен,
не
растворимый
в
холодной
воде.
При
обра
ботке
крахмала
теплой
водой
удается
выделить
две
фракции:
фракцию,
раство
римую
в
теплой
воде
и
состоящую
из
по
лисахарида
амилозы,
и
фракцию,
лишь
набухающую
в
теплой
воде
с
образовани
ем
клейстера
и
состоящую
из
полисаха
рида
амилоnекmиnа.
Амилоза
имеет
линейное
строение;
ct,D-глюкопиранозные
остатки
связаны
(1-4)-гликозидными
связями.
Элементная
ячейка
амилозы
(и
крахмала
вообще)
по
строена
следующим
образом:
I
кtЩОН~
ОН
Н
о
Н
ОН
Молекула
амилопектина
построена
ана
логичным
образом,
однако
имеет
в
цепи
разветвления,
ЧТО
создает
пространствен
ную
структуру.
В
точках
разветвления
ос
татки
моносахаридов
связаны
(1-6)-гли
козидными
связями.
Между
точками
раз
ветвления
располагаются
обычно
20-25
ГЛЮRО3НЫХ
остатков.
_t1ЩОН~
:Н
Ь
О
-
СН
:н
,
СН,ОН
Н
ОННН
ОН
ОН
Н
ОН
Н
О
о-
I
О
Н
ОН
Н
ОН
I
амилопектин
I
Крахмал
легко.
подвергается
гидролизу;
I
при
нагревании
в
присутствии
сери ой
кислоты
образуется
глюкоза:
I
(С.Н
lО
О,),
+
nН,О
H:JS04.
\'
)
пС,Н"О.
:
(крахмал)
(глюкоза)
В
зависимости
от
условий
проведения
I
реакции
гидролиз
может
осуществляться
I
ступенчато
с
образованием
промежуточ-
I
ных
продуктов.
(С.н,.оо>,
-4
(С.Н
,0
О,)м
-4
I
(крахмал)
(декстрины
I
(т<п))
-4
хС"Н
22
О
I,
-4
пС.Н
,
,о.
I
(мальтоза)
(глюкоза)
Качественной
реакцией
на
крахмал
яв-
I
ляется
его
взаимодействие
с
ЙОДОМ
-
на-
I
блюдается
интенсивное
синее
окрашива-
I
ние.
Такое
окрашивание
появляется,
если
на
срез
картофеля
или
ломтик
белого
хле-
I
ба
поместить
каплю
раствора
йода.
Крах-
I
мал
не
вступает
в
реакцию
.серебряного
зеркала..
I
Целлюлоза
(клетчатка).
Это
-
наибо
лее
распространенный
растительный
по-
I
лисахарид.
Как
и
у
крахмала,
структур-
I
L_~--------------------~
г----~-----T-----------
I
ной
единицей
целлюлозы
явля~тся
D-глю-
I
62.
Пептиды.
Белки
копираноза,
звенья
котороя
связаны
I
(1-4)-гликозидными
связями.
Однако
от
I
Пептиды
и
белки
представляют
собой
I
крахмал~
целлюлоза
отлича:тся
~-конфи-
I
высокомолекулярные
органические
соеди
гурациеи
гликозндных
связеи
между
цик-
нения,
построенные
из
остатков а-амино
I
лами
и
строго
линейным
строением:
I
кислот,
соединенных
между
собой
пептид
I
ен
ОН
~
1
I
r
I,i
/
н
о"'"
~()
I
Н
Целлюлоза
не
растворяется
в
воде
и
обычных
органических
растворителях,
но
она
растворима
в
реактиве
Швейцера
(ра
створ
гидроксида
меди
в
аммиаке).
а
так
же
в
концентрированном
растворе
хлори
стого
цинка
и
в
концентрированной
сер
ной
кислоте.
Как
и
крахмал,
целлюлоза
при
кислотном
гидролизе
дает
глюкозу.
Целлюлоза
-
многоаroмный
спирт,
на
эле
ментную
ячейку
полимера
приходятся
три
гидроксильных
группы.
В
связи
с
этим,
для
целлюлозы
характерны
реакции
эте
рификации
(образование
сложных
эфи
ров).
Наибольшее
практическое
значение
имеют
реакции
с
уксусным
ангидридом
и
азотной КИСЛОтой:
+3nНNO,~
н
(целлюлоза)
-4
+3nНр
н
(тринитрат
целлюлозы)
Полностью
этерифицированная
клет
чатка
известна
под
названием
nupOl(cи~
лин,
который
после
соответствующей
об
работки
превращается
в
бездымный
по
рох.
При
взаимодействии
пеллюлозы
с
ук
сусным
ангидридом
в
присутствии
уксус
ной
и серной кислот
образуется
триаце
тнлцеллюлоза:
I
I
ными
свнзями.
Ни
один
из
известных
нам
I
живых
организмов
не
обходится
без
бел
I
ков.
Белки
входят
в
состав
мозга,
внут
ренних
органов,
костей,
кожи,
волосяного
покрова
и
т.
д.
Основным
источником
а-аминокислот
для
живого
организма
слу
жат
пищевые
белки,
которые
в
результате
ферментативного
гидролиза
в
желудочно
кишечном
тракте
дают
а-аминокислоты.
Многие
а-аминокислоты
синтезируются
в
организме,
а
некоторые
необходимые
для
синтеза
белков
а-аминокислоты
не
синте
зируются
в
организме и
должны
поступать
извне.
Такие
аминокислоты
называются
ltезамеnuмыи
•.
К
ним
относятся
валин,
лейцин,
треонин,
мети:онин.
триптофан
и
др.
При
некоторых
заболеваниях
человека
перечень
незаменимых
аминокислот
расши
ряется.
Пептиды
и белки
различают
в
за
висимости
от
их
молекулярной
массы.
Ус
ЛОВНО
считают,
что
пептиды
содержат
в
молекуле
до
100
(соответствует
молекуляр
ной
массе
до
10000),
а
белки
-
свыше
100
аминокислотных
остатков
(молекулярная
масса
от
10000
до
нескольких
миллионов).
При
ЭТОМ
в
пептидах
различают
олигопеn
тиды,
содержащие
в
цепи
не
более
10
ами
~
НОКИСЛОТНЫХ
остатков,
и
nодunеnтuды,
/{о
содержащие
до
100
аминокислотных
ос
I
татков.
КОнструкция
полипептидной
цепи
оди
накова
для
всего
многообразия
пептидов
и
белков.
Эта
цепь
имеет
неразветвленное
строение
и
состоит
из
чередующихся
ме
тиновых
(СН)
и
шштидных
(СОNН)
групп.
Различия
такой
цепи
заключаются:
в
бо
ковых
радикалах,
связанных
сметиновой
группой
и
характеризующих
ту
нли
иную
аминокислоту.
Один
конец
цепи
со
сво
бодной
аминогруппой
называется
N-
кон
цом,
другой,
на
котором
находится
ами
нокислота
со
свободной
карбоксильной
группой,
называется
С-
концом.
Пептид
ные
и
белковые цепи
записываются
с
N-
конца.
Иногда
пользуются
специаль
ными
обозначениями:
на
N-
конце
пишет
ся
NH~
группа
или
только
атом
водорода
~H,
а
на С-
конце
пишется
либо
карбок
I
сильная
СООН-
группа,
либо
только
гид
I
роксильная
ОН-
группа.
Для
полипепти
дов
И
белков
характерны
четыре
уровня
L
~
~-
74
75
г-----------T-----~----,
I
пространственной
организации,
которые
принято
называть
структурами.
I
Первuчнuя
структура
белка
-
специфи
I
ческа,я
аминокислотная
последователь
ность,
т.
е.
порядок
чередования
а-амино
I
кислотных
остатков
в
полиnеnтидной
цепи.
I
Вторuчная
CTpYKTy~a
белка
-
конфор
мация
полипептиднои
цепи,
т.
е.
способ
I
скручивания
цепи
в
пространстве
за
счет
I
водородных
связей
между
группами
NH
и
СО.
Одиа
из
моделей
вторичной
структу
I
ры
-
а-спираль.
I
Третuчная
структура
белка
-
трехмер
ная
конфигурация
закрученной
спирали
I
в
пространстве,
образоваsннsая
за
счет
ди
сульфидных
мостиков
- - -
между
цис
I
теиновыми
остатками
и
ионных
взаимо
.
1
действин,
Четвертuчная
структура
белка
-
I
структура,
образующаяся
за
счет
взаимо
I
действия
между
разными
полипептидны
ми
цепями.
Четвертичная
структура
ха
I
рактерна
лишь
для некоторых
белков,
на
I
пример
гемоглобина.
Химические
свойства
I 1.
Денатурация.
Утрата
белком
природ
I
ной
(нативной)
конформации,
сопровож
дающаяся
обычно
потерей
его
биологи
I
ческой
функции,
называется
денатура
I
циеЙ.
с
точки
зрении
структуры
белка
-
это
разрушение
вторичиой
и
третичной
I
структур
белка,
обусловленное
воздей
ствием
кислот,
щелочей,
нагревания,
ради
I
ации
и
т. д.
Первичная
структура
белка
I
при
денатурации
сохраняется.
Денатура
ция
может
быть
обратимой
(так
называ
емая
ренатурация)
инеобратимой.
При
мер
необратимой
денатурации
при
тепло
вом
воздействии
-
свертывание
яичного
альбумииа при
варке
яиц.
2.
Гидролиз
белков
-
разрушение
пер
СН
ОН}
I
•
О О
I
О
СН.-
с-9
+ 3n
~
О
-f
I
Н
СН.-С."о
I
Н
ОН
n
I
~
1
Н
+
зnен
саоН
I
ОСОСН.
Н
3 I
Н
Н
ОСОСН.
n I
(три
ацетил
целлюлоза)
Триацетилцеллюлоза
(или
ацетилцел-
I
I
*
люлоза)
является
ценным
продуктом
для
изготовления
негорючей
кинопленки
и
I
ацетатного
шелка.
I
вичной
структуры
белка
под
действием
кислот,
щелочей
или
ферментов,
приво
дящее
к
образованию
а-аминокислот,
из
которых
он
был
составлен.
3.
Качественные
реакции
на
белки:
•
Биуретовая
реакция
-
фиолетовое
ок
рашивание
при
действии
солей
меди
(П)
в
щелочном
растворе.
Такую
реакцию
дают
все
соединения,
содержащие
пептид
ную
связь;
•
Ксантопротеиновая
реакция
--
появ
ление
желтого
окрашивания
при
дей
ствии
концентрированной
азотной
кис
лоты
на
белки,
содержащие
остатки
аро
матических
аминокислот
(фенилалаНИНR
t
I
тирозина).
L_~
~
~
76
г----~-----------------,
63.
Нуклеиновые
кислоты
I
I
I
Состав.
Нуклеиновые
кислоты
представ
ляют
собой
бнополимеры,
макромолеку
лы
которых
СОСТОЯТ
ИЗ
многократно
по
I
вторяющихся
звеньев
-
нун:леотuдов.
В
состав
нуклеотида
ВХОДЯТ три составные
I
части:
1)
азотистое
основание
-
пирими
I
диновое
или
пурииовое.
В
иуклеиновых
I
кислотах содержатся
основания
чеырех
разных
видов:
два
из
них
ОТНОСЯТСЯ
к
I
классу
пуринов
и
два
-
к
классу
пири
ми
динов.
Азот,
содержащийся
в
кольцах,
I
придает
молекулам
основные
свойства;
2)
моносахарид
-
рибоза
или
2-дезокси
I
I
рибоза
(пентозы).
В
зависимости
от
вида
I
пентозы,
присутствующей
в
нуклеотиде,
различают
рибонуклеиновые
кислоты
I
(РНК
-
содержат
рибозу)
и
дезоксирибо
I
нуклеиновые кислоты
(ДНК
-
содержат
дезоксирибозу);
3)
остаток
фосфорной
КИСЛОТЫ.
I
бrроение
и
составные
части
I
нуклеотида
NR,
I
...........
~N
I
ОСIlOВlUlИе
L
А
NH,
I
i~:
О
(1
I
НО-СН
!он
НО-СН
N
О
:=:~)
Ld.J·"~
Lo-l
I
ИJПI
~
-2Н)О
\----{
"
••
'''''')1])''_
О
R
О
I
R
I
(К-Н)
гн
НО-Р-О-И
I
!он
11
'т""
О
I
_риая
НО-Р-О-Н
кук.пеоткд
"
..
,''''',.
11
О
Нуклеотид
-
это
фосфорный
эфир
НУН:
леозuда.
В
состав
нуклеозида
входят
два
компонента:
моносахарид
(рибоза
или
де
зоксирибоза)
и
азотистое
основание,
Состав и строение
нуклеознда
NН.
AN
ЦII'1'03-
Q.J.
NH,
~,
О
~~
н,
l!.
л
НО-СНОП:
НО-СН
N
О
~"""-~
ОПОН
-н,О
ОНОИ
р"
JI}'I<JIeOВIIД
L
Состав
ДНК
Правила
Чаргаффа:
1.
Все
ДИК
независимо
от
их
происхож
дения содержат
одинаковое
количество
пуриновых
и
пиримидинавых
оснований.
2.
Любая
ДНК
содержит
в
равных
ко
дичееТВ8Х
попарно
аденяв
и
ТИМКИ,
гуа
нин
и
цитозин.
3.
Количество
аденина
и
ЦИТ03ина
равно
количеству
гуанина
и
'гимина
(А+Ц=Г+Т)_
Для
каждого
типа
ДНК
суммарное
содер
жание
гуанина
и
цитозина
не
равно
сум
марному
содержанию
аденина
и
"'имина
(Г+Ц)!(А+Т)
и
отличается
от
единицы
(ко
эффициеитом
специфичности).
Состав
РНК
На
РНК
правила
Чаргаф
фа
не
распространяются.
В
состав
РНК
входит
не
тимин,
а
урацил.
Макромолекулярная
структура
ДНК.
В
1953
г.
Д.
Уотсон
и
Ф.
Крик
создали
модель
строения
ДНК,
согласно
которой
молекула
ДНК
представллет
собой
пра
вильную
спираль,
образованную
двумя
по
лидезоксирибонуклеотидными
цепями,
закрученными
относительно друг друга
и
вокруг
общей
оси.
Диаметр
спирали
прак
тически
постоянен
вдоль
всей
ее
ДЛИНЫ
и
равеи
1,8
нм.
Длина
витка
спирали,
ко
торый
соответствует
ее
периоду
идентич
ности,
составляет
3,37
им.
На
один
виток
спирали
приходится
10
остатков
основа
ний
в
одной
цепи.
Расстояиие
между
плос
костями
оснований
равно
0,34
нм.
Плос
кости
остатков
оснований
перпендикуляр
вы
ДЛИННОЙ
оси
спирали.
Плоскости
углеводных
остатков
отклоняются
от
этой
оси.
Спираль
-
правовращающая.
Поли
дезоксирибонуклеотидные
цепи
в
ней
ан
типараллельны:
ЭТО
означает,
ЧТО
если
двигаться
вдоль
ДЛИННОЙ
оси
спирали
от
одного
ее
конца
к
другому,
то
в
одной
цепи
будут
проходить
фосфодиэфирные
связи
в
направлении
3'
.....
5',
а
в
другой
-
в
направлении
5'
.....
3'.
Такая
простран
ственная
структура
удерживается
множе
ством
водородных
связей,
образуемых
азо
тистыми
основаниями,
направленными
внутрь
спирали.
Водородные
связи
возни
кают
между
пуриновым
основанием
од
ной
цепи
и
ПИрИМIIдинавым
основанием
другой
цепи.
Эти
основания
составляют
комплементарные
пары (А=Т
или
г",Ц).
Обрззование
водородных
связей
между
комплементарными
парами
оснований
обусловлено
их
пространственным
соответ
ствием:
~-~
77
