Шукаев И.Л. Лекции по неорганической химии. Часть 2. Химия металлов и анализ неорганических веществ
Подождите немного. Документ загружается.


21
Для этого образец руды растворяют в азотной кислоте и ведут электролиз с пла-
тиновым катодом. Раствор предварительно нейтрализуют до слабокислой реакции,
а катод – взвешивают. Обычно сопутствующие меди металлы (Fe, Co, Ni, Zn, Cd)
имеют отрицательный электродный потенциал и в этих условиях не осаждаются.
Катод после электролиза высушивают и взвешивают. Привес даёт содержание меди
в образце.
В газовом анализе измеряют объёмы газа и его составных частей.
Титриметрическим анализом называют определение точного объёма рас-
твора химического реактива, необходимого для полного протекания реакции с
раствором исследуемого вещества.
Концентрация приливаемого раствора (титранта) должна быть известна точно.
В аналитической химии часто концентрацию растворов выражают не в молях на
литр, а в эквивалентах на литр.
1. Эквивалентом называют количество вещества, вступающее в реакцию с одним
молем ионов водорода, ионов гидроксила или электронов, или отдающее один
моль этих частиц.
2. Эквивалентом называют количество вещества, вступающее в реакцию с 1 г
водорода или с 8 г кислорода, или с 96485 кулонами электричества.
Для кислот, оснований и металлов: Э=M/k, где Э – масса эквивалента, M – моляр-
ная масса, k – число ионов водорода в кислоте, ионов гидроксила в основании или
число электронов, отдаваемых металлом при окислении.
ПРИМЕР. В реакции нейтрализации
H
2
SO
4
+ 2NaOH → Na
2
SO
4
+ 2H
2
O
эквивалентная масса H
2
SO
4
: Э
1
= 98г/моль /2 экв/моль = 49 г/экв (k=2),
эквивалентная масса NaOH: Э
2
= 40г/моль /1 экв/моль = 40 г/экв (k=1).
Как видно, эквивалентная масса либо равна молярной, либо в несколько раз
меньше неё. Число эквивалентов считают сходно с числом молей: n
Э
=m/Э.
Выполняется важный закон эквивалентов:
вещества вступают в реакцию в эквивалентных количествах – один эквивалент
одного реагирует с одним эквивалентом другого.
Концентрацию раствора, выраженную в эквивалентах на литр, называют нор-
мальной концентрацией. В рассмотренном случае одномолярная (1 M) H
2
SO
4
явля-
ется двунормальной (2 N или 2 н.).

22
Нормальная концентрация:
С
N
=n
Э
/V (число эквивалентов растворённого вещества в 1 л раствора).
Различают несколько методов титриметрического анализа.
– КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ.
К кислому раствору по каплям приливают щёлочь известной концентрации (или,
наоборот, к щелочному приливают кислоту). В точке эквивалентности происходит
нейтрализация, смена окраски индикатора и резкий скачок pH. Если контролируют
потенциал электрода, зависящий от pH, титрование называют потенциометриче-
ским.
– ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ.
Обычно к раствору, содержащему восстановитель, приливают окислитель, например, рас-
твор KMnO
4
(перманганатометрия) или иода (иодометрия). Точку эквивалентности опре-
деляют по моменту, когда добавляемый раствор перестаёт изменять окраску или обесцвечи-
ваться.
– ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ.
Исследуемый ион осаждают в виде нерастворимого осадка. Например, хлорид осаждают
раствором AgNO
3
(аргентометрия) в нейтральной или слабощелочной среде:
Ag
+
+ Cl
–
→ AgCl ↓.
В раствор предварительно добавляют немного хромата натрия Na
2
CrO
4
. Он имеет лимон-
ный цвет. В точке эквивалентности на фоне творожистого белого осадка AgCl появляется
красный осадок хромата серебра:
2Ag
+
+ CrO
4
2–
→ Ag
2
CrO
4
↓.
– КОМПЛЕКСОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ.
Исследуемые ионы связывают в комплексы. Чаще всего используют связывание
катионов металла с анионом ЭДТА (этилендиаминтетраацетатом):
(OOCCH
2
HN)
2
CH
2
–CH
2
(NHCH
2
COO)
2
4–
(будем обозначать его T
4–
).
Для титрования берут соль Na
2
H
2
T (её называют "трилон Б"). Это – кислая соль,
свои два кислотных водорода анион легко замещает на металл:
H
2
T
2–
+ M
2+
→ MT
2–
+ 2H
+
.
ЭДТА связывается с M
2+
сразу двумя группами COO
–
в очень прочный комплекс.
Трилон Б используют для удаления накипи, предотвращения её образования, для
анализа жёсткости воды.
20. ЖЁСТКОСТЬ ВОДЫ
Жёсткостью воды называют содержание в ней многозарядных катионов ме-
таллов.
23
В природных водах это обычно Ca
2+
и Mg
2+
, в некоторых есть и железо (обычно
Fe
2+
). Выражают жёсткость (Ж), как и нормальную концентрацию, в экв/л.
Если Ж<4 миллиэквивалентов на литр (мэкв/л), вода считается мягкой, если Ж>8
мэкв/л – жёсткой, в промежутке – средней жёсткости.
Временная жёсткость связана с наличием ионов гидрокарбоната HCO
3
−
. При
нагревании он превращается в нерастворимые карбонаты (накипь):
Ca
2+
+ 2HCO
3
−
→ CaCO
3
↓ + H
2
O + CO
2
↑.
кальцит
В присутствии магния в осадок выпадает твёрдый раствор на основе кальцита:
(1–x)Ca
2+
+ xMg
2+
+ 2HCO
3
−
→ Ca
1–x
Mg
x
CO
3
↓ + H
2
O + CO
2
↑.
твёрдый раствор (обычно x≈0,1)
В отсутствие кальция с солями магния может также происходить частичный гид-
ролиз (с образованием осадка основных солей, например, гидромагнезита
Mg(OH)
2
⋅4MgCO
3
⋅4H
2
O), а при более сильном нагреве – полный гидролиз:
Mg
2+
+ 2HCO
3
−
→ Mg(OH)
2
↓ + 2CO
2
↑.
брусит
Помимо образования накипи, жёсткость снижает эффективность моющих средств,
особенно, мыла.
Мыла – это натриевые или калиевые соли жирных кислот: стеариновой C
17
H
35
COOH,
олеиновой C
17
H
33
COOH, пальмитиновой C
15
H
31
COOH и других. Кратко их обозначают
RCOOH, где R – углеводородный радикал, например, C
17
H
35
. Жирные кислоты – слабые и
легко вытесняются из мыла даже уксусной кислотой:
C
17
H
35
COO
–
+ CH
3
COOH → C
17
H
35
COOH↓ + CH
3
COO
–
.
стеариновая кислота (стеарин)
В жёсткой воде мыла дают нерастворимые соли кальция и магния:
2RCOONa + CaCl
2
→ (RCOO)
2
Ca↓ + 2 NaCl,
2RCOO
−
+ Ca
2+
→ (RCOO)
2
Ca↓.
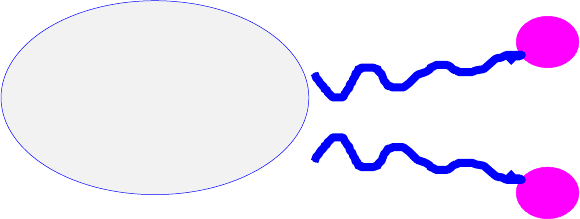
Вообще же действие моющих средств основано на том, что их молекулы или ионы имеют
полярный конец (группа COOH) и неполярный хвост (группа R). За счёт полярного конца
они растворимы в воде и способны растворять загрязнения с полярной связью. Но, главное,
за счёт неполярного органического радикала, в раствор уносятся нерастворимые в воде
за-
грязнения, например, жиры.
Основа стиральных порошков – органические производные серной кислоты сульфонаты
натрия NaSO
3
R. Сульфонаты кальция и магния хорошо растворимы в воде, поэтому такие
моющие средства применимы и в жёсткой воде.
24
COOH
Неполярное загрязнение
(жир)
R
R
COOH
Определяют временную жёсткость кислотно-основным титрованием. К исследуе-
мой воде приливают соляную кислоту в присутствии индикатора метилоранжа:
HCO
3
−
+ H
+
→ H
2
O + CO
2
↑.
В точке эквивалентности индикатор меняет окраску с жёлтой на красную.
ПРИМЕР. Определить временную жёсткость воды, если на титрование 200 мл
этой воды израсходовано 10 мл 0,1 н. раствора HCl.
РЕШЕНИЕ. По закону эквивалентов, число эквивалентов кальция и магния равно
числу эквивалентов кислоты:
V
HCl
⋅ N
HCl
= V
H
2
O
⋅ Ж
H
2
O
Отсюда Ж = 10 мл ⋅ 0,1 экв/л / 200 мл = 0,005 экв/л = 5 мэкв/л.
Постоянная жёсткость связана с содержанием всех других анионов, кроме
гидрокарбоната HCO
3
−
. В природной воде это обычно сульфаты и хлориды (конечно
же, это соли кальция или магния). Она не удаляется кипячением, не даёт накипи, но
может превращаться во временную благодаря поглощению CO
2
из атмосферы.
Общую жёсткость определяют титрованием трилоном Б в присутствии буферной
смеси (NH
4
OH+NH
4
Cl, для поддержания pH= 9–10). Индикатор – эриохром (E). С ио-
нами Mg
2+
он даёт розовое окрашивание, без них его водный раствор синий.
В точке эквивалентности, когда трилон Б связывает все ионы Ca
2+
и Mg
2+
, розовая
окраска переходит в синюю:
MgE + H
2
T
2–
→ H
2
E + MgT
2–
.
розовый
синий
В котельных воду предварительно умягчают содой Na
2
CO
3
или фосфатом натрия
Na
3
PO
4
:
Na
2
CO
3
+ CaCl
2
→ CaCO
3
↓ + 2NaCl,
CO
3
2−
+ Ca
2+
→ CaCO
3
↓.
25
ХАРАКТЕРИСТИКИ ОТДЕЛЬНЫХ
ЭЛЕМЕНТОВ-МЕТАЛЛОВ
21. ПРИМЕРЫ ХАРАКТЕРИСТИКИ ЭЛЕМЕНТОВ.
ХРОМ.
1) Хром (по-латински – Chromium, от греческого χρϖµα – цвет) – элемент 4 пе-
риода, побочной подгруппы 6 группы. Электронная формула – 3s
2
3p
6
3d
5
4s
1
. На
внешнем уровне у него всего 1 электрон, поэтому хром – металл. Валентными явля-
ются также 5 электронов предвнешего 3d-подуровня, поэтому максимальная воз-
можная степень окисления – +6.
2) Хром – средний по распространённости элемент. В земной коре он содержится
в основном в степени окисления +3, основной минерал – хромистый железняк
Fe
+2
Cr
+3
2
O
4
, хром(+3) также замещает в минералах железо и алюминий – так, при-
месь оксида хрома в корунде придаёт окраску рубину. Обычно хромистый железняк
восстанавливают углем в феррохром – сплав хрома с железом, который затем при-
меняют для получения нержавеющей стали. Отделить хром от железа можно сплав-
лением хромистого железняка с содой при окислительном действии кислорода воз-
духа: 4FeCr
2
O
4
+ 8Na
2
СO
3
+ 7O
2
= 2Fe
+3
2
O
3
+ 8Na
2
Сr
+6
O
4
+ 8CO
2
. Хорошо раствори-
мый Na
2
СrO
4
отделяют от нерастворимого оксида железа водой и используют для
получения других соединений хрома. Металлический хром восстанавливают из
Cr
2
O
3
алюминием (алюмотермия): 2Al + Cr
2
O
3
= 2Cr + Al
2
O
3
. Реакция идёт самопро-
извольно за счёт выделяющегося тепла, но реакционную смесь сначала поджигают
магнием.
3) Хром – серебристый тугоплавкий металл, твёрдый и царапает стекло. Метал-
лическая связь обусловлена 4s-электронами, прочность – ковалентной связью за
счёт 3d-электронов. С водой не реагирует, на воздухе устойчив за счёт образования
прочной плёнки оксида Cr
2
O
3
. Образование этой плёнки является причиной устойчи-
вости нержавеющей стали, в состав которой входит хром.
Хром растворяется в кислотах с выделением водорода: Cr + 2HCl = Cr
+2
Cl
2
+ H
2
.
Получаются голубые соли хрома(+2), которые на воздухе быстро окисляются в зелё-
ные соли хрома(+3): 4Cr
+2
Cl
2
+ O
2
+ 4HCl
=4Cr
+3
Cl
3
+ 2H
2
O. При диссоциации этих со-
лей хром получается в виде катионов, что типично для металла. В щелочах на воз-
духе хром растворяется с образованием лимонно-жёлтых хроматов – солей хро-

26
ма(+6): 2Cr
+ 4NaOH + 2O
2
= 2Na
2
Сr
+6
O
4
+ 2H
2
O. При этом хром попадает в состав
аниона СrO
4
2–
, то есть в высшей степени окисления он выступает в функции, анало-
гичной неметаллам.
4) Хрому отвечает множество оксидов, в том числе соединений переменного со-
става, содержащие несколько степеней окисления сразу. Наиболее простые и ти-
пичные – чёрный Cr
+2
O, зелёный Cr
+3
2
O
3
, красный Cr
+6
O
3
. Первые два имеют поли-
мерную структуру с D=3 и КЧ хрома =6, что типично для ионных оксидов. Они очень
прочные и тугоплавкие, не растворяются в воде и медленно реагируют с кислотами
и щелочами. Наиболее активен CrO
3
– это цепной полимер (D=1 и КЧ хрома =4),
сходный по строению с типичным ковалентным и кислотным оксидом SO
3
. При взаи-
модействии с водой растворяется, давая хромовые кислоты. При достаточном раз-
бавлении получается наиболее простая из них – H
2
CrO
4
, аналогичная серной. Ей
отвечают соли – хроматы. Распространены также соли дихромовой кислоты H
2
Cr
2
O
7
– бихроматы. Хромовые кислоты – сильные, так как ион Cr
+6
имеет высокий заряд и
малый размер, то есть обладает высоким поляризующим действием. Все соедине-
ния хрома(+6) – сильные окислители, бихромат калия для этой цели часто применя-
ют в лаборатории.
Низким степеням окисления отвечают гидроксиды – жёлтый Cr(OH)
2
(основный,
растворяется только в кислотах) и зелёный “Cr(OH)
3
“ (амфотерный – растворяется и
в кислотах, и в щелочах). Их получают действием недостатка щёлочи на растворы
солей. При нагревании гидроксидов получаются оксиды.
CrO
3
получают действием концентрированной серной кислоты на хромат натрия:
Na
2
CrO
4
+ 2H
2
SO
4
= CrO
3
+ Na
2
SO
4
+ H
2
SO
4
⋅H
2
O.
При изменении степени окисления хрома от +2 до +6 радиус иона уменьшается,
заряд увеличивается, поляризующее действие увеличивается, основные свойства
соединений ослабевают, кислотные усиливаются. В низких степенях окисления –
сильные восстановительные свойства (+2 переходит в +3), в высшей – окислитель-
ные (+6 переходит в +3).
5) В целом хром похож на соседние d-элементы (титан, ванадий, марганец, желе-
зо) – горизонтальная аналогия
в Периодической системе. Соединения хрома (+6) по
кислотным и окислительным свойствам превосходят соединения ванадия (+5) и мо-
либдена (+6), но уступают соединениям марганца (+7). Это можно объяснить изме-
нением степени окисления, снижением радиуса по периоду и увеличением его по
подгруппе.

27
ПРИЛОЖЕНИЕ
22. ДРОБНЫЕ РЕАКЦИИ КАТИОНОВ
Ионы калия К
+
1. К раствору, содержащему ионы калия, добавляют раствор гексакобальтонит-
рита натрия Na
3
[Co(NO
2
)
6
]. При этом образуется обильный жёлтый осадок:
2KCl + Na
3
[Co(NO
2
)
6
] = 2NaCl + K
2
Na[Co(NO
2
)
6
]↓,
2K
+
+ Na
+
+ [Co(NO
2
)
6
]
3–
= K
2
Na[Co(NO
2
)
6
]↓.
2. Платиновая проволока, смоченная раствором соли калия, окрашивает бесцветное пла-
мя газовой горелки в бледно-фиолетовый цвет.
Ионы натрия Na
+
1. К раствору, содержащему ионы натрия, добавляют раствор цинкуранилацетата
Zn(UO
2
)
3
(CH
3
COO)
8
, подкисленный уксусной кислотой. При этом образуется
кристаллический осадок светложёлтого цвета:
NaCl + Zn(UO
2
)
3
(CH
3
COO)
8
+ 9H
2
O
+CH
3
COOH = HCl +
NaZn(UO
2
)
3
(CH
3
COO)
9
⋅9H
2
O↓.
2. Проволока, смоченная раствором соли натрия, окрашивает пламя в жёлтый цвет.
Ионы аммония NH
4
+
1. К раствору, содержащему ионы аммония, реактив Несслера (щелочной рас-
твор тетраиодомеркурата калия K
2
[HgI
4
]). При этом образуется обильный бу-
ро-оранжевый осадок:
NH
4
Cl + 2K
2
[HgI
4
] + 4KOH = [Hg
2
N]I⋅H
2
O↓ + 7KI + KCl + 3H
2
O.
2. К раствору, содержащему ионы аммония, добавляют щёлочь и подогревают.
По запаху определяют образование аммиака:
NH
4
Cl + NaOH = NaCl + H
2
O + NH
3
↑,
NH
4
+
+ OH
–
= H
2
O + NH
3
↑.
Ионы магния Mg
2+
1. При добавлении к раствору солей магния аммиачного раствора гидрофосфата
натрия (pH=10) образуется белый кристаллический осадок:
MgCl
2
+ Na
2
HPO
4
+ NH
3
= MgNH
4
PO
4
↓ + 2NaCl,
Mg
2+
+ HPO
4
2–
+ NH
3
= MgNH
4
PO
4
↓.
2. Если к раствору соли магния добавить раствор щёлочи, образуется аморфный
осадок Mg(OH)
2
, хорошо растворимый в кислотах и растворах солей аммония:
MgCl
2
+ 2NaOH = Mg(OH)
2
↓ + 2NaCl
Mg
2+
+ 2OH
–
= Mg(OH)
2
↓
Mg(OH)
2
+ 2HCl = MgCl
2
+ 2H
2
O,
Mg(OH)
2
+ 2NH
4
Cl = MgCl
2
+ 2”NH
4
OH”
28
Ионы бария Ba
2+
1. При действии на соли бария раствором серной кислоты или её солей образу-
ется белый осадок, который не растворяется в HCl:
BaCl
2
+ H
2
SO
4
= BaSO
4
↓ + 2HCl,
Ba
2+
+ SO
4
2–
= BaSO
4
↓.
Сульфаты кальция и стронция в серной кислоте растворяются, поэтому не
осаждаются и определению бария не мешают.
2. При действии на соль бария раствором бихромата калия в присутствии уксус-
ной кислоты выпадают жёлтые кристаллы:
2BaCl
2
+ 2CH
3
COOH + K
2
Cr
2
O
7
= 2BaCrO
4
↓ + 2CH
3
COOK + H
2
O.
Ионы кальция и стронция определению не мешают.
3. При нанесении на фильтровальную бумагу капли соли бария и последующем
действии на неё раствора родизоната натрия Na
2
C
6
O
6
на бумаге появляется
красно-бурое пятно состава BaC
6
O
6
. При действии раствором HCl пятно стано-
вится розово-красным вследствие превращения в кислый родизонат бария.
4.
Проволока, смоченная раствором соли бария, окрашивает пламя горелки в зелёный
цвет.
Ионы стронция Sr
2+
1. При добавлении к раствору соли стронция насыщенного раствора сульфата
кальция CaSO
4
образуется белый осадок сульфата стронция:
Sr
2+
+ SO
4
2–
= SrSO
4
↓.
Ионы кальция определению не мешают.
2. При нанесении на фильтровальную бумагу капли соли стронция и последую-
щем действии на неё раствора родизоната натрия Na
2
C
6
O
6
на бумаге появля-
ется красно-бурое пятно осадка SrC
6
O
6
. При смачивании пятна раствором со-
ляной кислоты осадок растворяется и исчезает.
3. Проволока, смоченная раствором соли стронция, окрашивает пламя горелки в карми-
ново-красный цвет.
Ионы кальция Ca
2+
1. При добавлении к раствору соли кальция раствора оксалата аммония
(NH
4
)
2
C
2
O
4
образуется белый осадок CaC
2
O
4
, нерастворимый в CH
3
COOH, но
растворимый в HCl:
Ca
2+
+ C
2
O
4
2–
= CaC
2
O
4
↓,
CaC
2
O
4
+ 2H
+
= H
2
C
2
O
4
+ Ca
2+
.
Реакцию проводят при отсутствии в растворе солей ионов бария и стронция,
которые мешают определению.
2. Проволока, смоченная раствором соли кальция, окрашивает пламя горелки в кирпич-
но-красный цвет.

29
Ионы алюминия Al
3+
1. При взаимодействии соли алюминия с недостатком разбавленного раствора
щёлочи выпадает белый студенистый осадок Al(OH)
3
(точнее, Al
2
O
3
⋅xH
2
O):
AlCl
3
+ 3NaOH = Al(OH)
3
↓ + 3NaCl,
Al
3+
+ 3OH
–
= Al(OH)
3
↓.
Этот осадок растворяется в кислотах и щелочах, так как он является амфотер-
ным:
Al(OH)
3
↓ + 3HCl = AlCl
3
+ 3H
2
O,
Al(OH)
3
↓ + 3H
+
= Al
3+
+ 3H
2
O,
Al(OH)
3
↓ + NaOH + 2H
2
O = Na[Al(OH)
4
(OH
2
)
2
],
Al(OH)
3
↓ + OH
–
+ 2H
2
O = [Al(OH)
4
(OH
2
)
2
]
–
.
2. На фильтровальную бумагу наносят каплю раствора жёлтой кровяной соли
K
4
[Fe(CN)
6
], в центр пятна помещают каплю раствора соли алюминия, затем
обрабатывают бумагу газообразным аммиаком (следует подержать её над от-
крытой склянкой с концентрированным раствором аммиака). Затем пятно по
внешней окружности смачивают раствором ализарина и снова обрабатывают
газообразным аммиаком. В присутствии ионов алюминия появляется розовое
пятно на фиолетовом фоне.
Ионы хрома Cr
3+
1. Разбавленные растворы гидроксидов калия или натрия (взятые в недостатке),
а также водный раствор аммиака осаждают из растворов солей хрома(+3) се-
ро-зелёный осадок “Cr(OH)
3
“ (точнее, Cr
2
O
3
⋅xH
2
O):
CrCl
3
+ 3NaOH = “Cr(OH)
3
“↓ + 3NaCl,
CrCl
2+
+ 3OH
–
= “Cr(OH)
3
“↓ + Cl
–
.
Этот гидроксид является амфотерным, то есть, он растворяется в кислотах и
щелочах:
“Cr(OH)
3
“↓ + 3HCl = CrCl
3
+ 3H
2
O,
“Cr(OH)
3
“↓ + 3H
+
= Cr
3+
+ 3H
2
O,
“Cr(OH)
3
“↓ + NaOH + 2H
2
O = Na[Cr(OH)
4
(OH
2
)
2
],
“Cr(OH)
3
“↓ + OH
–
+ 2H
2
O = [Cr(OH)
4
(OH
2
)
2
]
–
.
2. Действием различных сильных окислителей соединения хрома(+3) переводят в
соединения хрома(+6). Если к раствору соли хрома(+3) добавить немного рас-
твора щёлочи и такое же количество 3%-ного раствора перекиси водорода
H
2
O
2
, то после осторожного нагревания смеси зелёная или темно-синяя окра-
ска, присущая соединениям хрома(+3), перейдёт в жёлтую, характерную для
образовавшегося хромата Na
2
CrO
4
:
2CrCl
3
+ 10NaOH + 3H
2
O
2
= 2Na
2
CrO
4
+ 6 NaCl + 8H
2
O.

30
Ионы железа Fe
3+
1. Разбавленные растворы гидроксидов калия или натрия, а также водный рас-
твор аммиака осаждают из растворов солей железа(+3) красно-бурый осадок
“Fe(OH)
3
“ (точнее, Fe
2
O
3
⋅xH
2
O):
FeCl
3
+ 3NaOH = “Fe(OH)
3
“↓ + 3NaCl,
FeCl
2+
+ 3OH
–
= “Fe(OH)
3
“↓ + Cl
–
.
Осадок растворяется в кислотах, но не растворяется в щелочах:
2“Fe(OH)
3
“↓ + 3H
2
SO
4
= Fe
2
(SO
4
)
3
+ 6H
2
O,
“Fe(OH)
3
“↓ + 3H
+
= Fe
3+
+ 3H
2
O.
2. Соли железа(+3) образуют с раствором роданида калия или аммония кроваво-
красное растворимое соединение. В разбавленных растворах преобладает
форма Fe(SCN)
2
+
:
FeCl
3
+ 2KSCN = [Fe(SCN)
2
]Cl + 2KCl,
FeCl
2+
+ 2SCN
–
= Fe(SCN)
2
+
+ Cl
–
.
3. При добавлении к раствору соли железа(+3) раствора жёлтой кровяной соли
K
4
[Fe
+2
(CN)
6
] образуется тёмно-синий раствор или осадок, называемый берлинской
лазурью (prussian blue), которому приписывают формулы K[Fe
+2
Fe
+3
(CN)
6
]⋅H
2
O или
Fe
+3
4
[Fe
+2
(CN)
6
]
3
⋅xH
2
O. Последние две реакции очень чувствительны и уникальны для
железа(+3), другие катионы 3 группы не мешают им.
Ионы железа Fe
2+
1. При добавлении к раствору соли железа(+2) раствора красной кровяной соли
K
3
[Fe
+3
(CN)
6
] образуется тёмно-синий раствор или осадок, называемый турнбулевой
синью. Его иногда отождествляют с берлинской лазурью и приписывают ему формулы
K[Fe
+2
Fe
+3
(CN)
6
]⋅H
2
O или Fe
+2
3
[Fe
+3
(CN)
6
]
2
⋅xH
2
O. Очевидно, что синее окрашивание
связано с сосуществованием в продукте двух разных степеней окисления железа, меж-
ду которыми происходит обмен электроном. Ион железа(+3) с красной кровяной солью
такой реакции не даёт.
2. При добавлении к раствору соли железа(+2) щёлочи выпадает светло-зелёный
осадок гидроксида железа Fe(OH)
2
:
FeSO
4
+ 2NaOH = Fe(OH)
2
↓ + Na
2
SO
4
,
Fe
2+
+ 2OH
–
= Fe(OH)
2
↓.
Даже малая примесь железа(+3), которая быстро возникает в присутствии кислорода
воздуха, способствует потемнению осадка. По мере окисления он становится тёмно-
зелёным, синим, чёрным, и, наконец, коричневым, что отвечает гидроксиду желе-
за(+3). Окисление ускоряется при интенсивном взбалтывании пробирки с осадком.
