Шпоры по химии для студента БГУИР (1 семестр)
Подождите немного. Документ загружается.

1. Предмет, задачи и основные понятия химической
кинетики: система, фаза, процесс, механизм реакции,
скорость реакции, средняя и истинная скорость химической
реакции.
Раздел химии, изучающий скорость и механизм протекания физико-
химических процессов, называется химической кинетикой.
Задачами химической кинетики являются: количественное
описание процесса, установление факторов, влияющих на скорость
реакций, установление механизма протекания реакций. Системой
называют тело или совокупность 2 взаимодействующих тел,
реально или мысленно выделенные в пространстве и способные
обмениваться с окружающей средой или между собой энергией и
(или) веществом. Часть системы, однородная во всех точках по
составу, физическим и химическим свойствам и отделенная от
других частей системы поверхностью, называется фазой. В
зависимости от числа фаз различают гомогенные системы,
состоящие из одной фазы, и гетерогенные — из двух или
нескольких фаз. Изменение хотя бы одного из параметров
состояния системы называется процессом. Механизм реакции –
совокупность всех стадий, через которые происходит превращение
исходных вещ-в в продукты реакции. Скорость реакции – число
элементарных взаимодействий в единицу времени в единице
реакционного пространства. Реакционным пространством в
гомогенной системе служит объем сосуда, в котором происходит
взаимодействие, в гетерогенной — поверхность раздела фаз.
Средняя скорость реакции – изменение кол-ва вещества в единицу
времени в единице реакционного пространства. Истинная
(=мгновенная) скорость реакции – производная концентрации по
времени.
1.2 Скорость гомогенных и гетерогенных процессов.
Многостадийность гетерогенных процессов. Факторы,
влияющие на скорость реакций. Основные кинетические
законы и правила.
Скорость гомогенных и гетерогенных процессов (по
выбранному компоненту) выражается формулами:
;,
гетгом
t
C
tS
n
v
t
C
tV
n
v
s
Скорость реакции зависит от: природы реаг. вещ-в, условий
протекания реакции (p,V,T), присутствия катализаторов, величины
реагирующей поверхности (для гетер. реакций). Реакции в
гетерогенных системах, как правило, отличаются сложностью и
протекают по стадиям:
1. процесс переноса исходных веществ к поверхности раздела фаз;
2. адсорбция исходных веществ на границе раздела фаз;
3. непосредственно сама химическая реакция;
4. десорбция продуктов реакции;
5. отвод продуктов реакции от поверхности раздела фаз.
Ввиду того, что эти стадии протекают последовательно,
скорость процесса определяется самой медленной стадией
(лимитирующей).
Основными кинетическими законами и правилами являются ЗДМ,
правило Вант-Гоффа, уравнение Аррениуса.
3. Зависимость скорости химических реакций от
концентраций (парциальных давлений) реагирующих
веществ. Закон действия масс для гомогенных и
гетерогенных реакций. Константа скорости.
Необходимым условием осуществления химического
взаимодействия является столкновение реагирующих частиц.
Столкновение их в некотором реакционном пространстве при
заданной температуре происходит тем чаще, чем больше этих
частиц. Эта зависимость выражается основным законом
химической кинетики — ЗДМ: скорость гомогенной химической
реакции при постоянной температуре прямо пропорциональна
произведению концентраций (парциальных давлений)
реагирующих веществ, взятых в степенях, равных
стехиометрическим коэффициентам в уравнении реакции.
;,
гомгом
b
B
a
A
b
B
a
A
PPkvCCkv
Константа
скорости – показывает, с какой скоростью идет реакция при
концентрациях вещ-в, равных 1 моль/л (физич. смысл). Также, k
является количественной мерой реакционной способности молекул
(хим. смысл). Зависит от природы вещ-в, T, катализаторов. ЗДМ
применим только для простых реакций. Но если в гетерогенной
реакции лимитирующей стадией является сама реакция, то ЗДМ
лим. стадии применим ко всей реакции, с учетом ограничения:
концентрации тв. вещ-в постоянны и включены в k , поэтому в ур-
ние ЗДМ входят только конц. газообразных и жидких вещ-в.
4. Влияние температуры на скорость процессов.
Правило Вант-Гоффа. Температурный коэффициент реакции
(γ). Уравнение Аррениуса.
Увеличение скорости химической реакции с повышением
температуры связано с возрастанием числа молекул,
обладающих избыточной энергией. Для того, чтобы произошла
реакция, т.е. чтобы образовались новые молекулы необходимо
вначале разорвать или ослабить связи между атомами исходных
веществ. На это необходимо затратить определенную энергию.
Если сталкивающиеся частицы будут обладать такой энергией, что
столкновение их может привести к перестройке атомов и к
образованию молекул нового вещества. Зависимость скорости
физико-химического процесса от температуры приближенно
выражается правилом Вант-Гоффа: при увеличении
температуры на каждые 10°С скорость химической реакции
возрастает примерно в 2 – 4 раза. Математически эта зависимость
выражается соотношением:
;
10
12
12
tt
vv
Темп. коэфф. показывает, во сколько раз
возр. скорость реакции при пов. темп. на 10 С (физич. смысл).
Зависит от прир. вещ-в и присутствия катализатора.
Точная зависимость скорости реакции от температуры задается ур-
нием Аррениуса:
,ln
12
12
1
2
TT
TT
R
E
k
k
eAk
a
T
T
RT
E
a
где k — константа скорости;
Е
a
— энергия активации, кДж/моль;
R — универсальная газовая постоянная, 8,314 Дж/моль⋅ К;
Т — абсолютная температура, К;
е — основание натурального логарифма;
А — предэкспоненциальный множитель (постоянная
величина для данной реакции).
5. Энергия активации процесса. Уравнение Аррениуса.
Анализ уравнения Аррениуса.
Избыточная энергия, которой должны обладать молекулы,
чтобы столкновение было эффективным, называется энергией
активации (E
a
), а частицы, обладающей такой энергией,
называются активными. С повышением температуры по
экспоненциальному закону возрастает доля активных частиц (
RT
E
a
e
). Числовое значение множителя
RT
E
a
e
определяет
отношение фактической скорости реакции при заданной темп. и ед.
конц. к макс. возможной (физический смысл). Чем больше E
a
, тем
меньше скорость реакции, но при этом, с увеличением T, в
большей степени возрастает скорость тех реакций, E
a
которых
больше. Величина E
a
определяет высоту энергетического барьера
реакции, а ее уменьшение с помощью катализатора является
одним из способов увеличения скорости реакции.
Ур-ние Аррениуса позволяет рассчитать:
как изменится v реакции при известном ΔT и E
a
;
E
a
, зная v и ΔT;
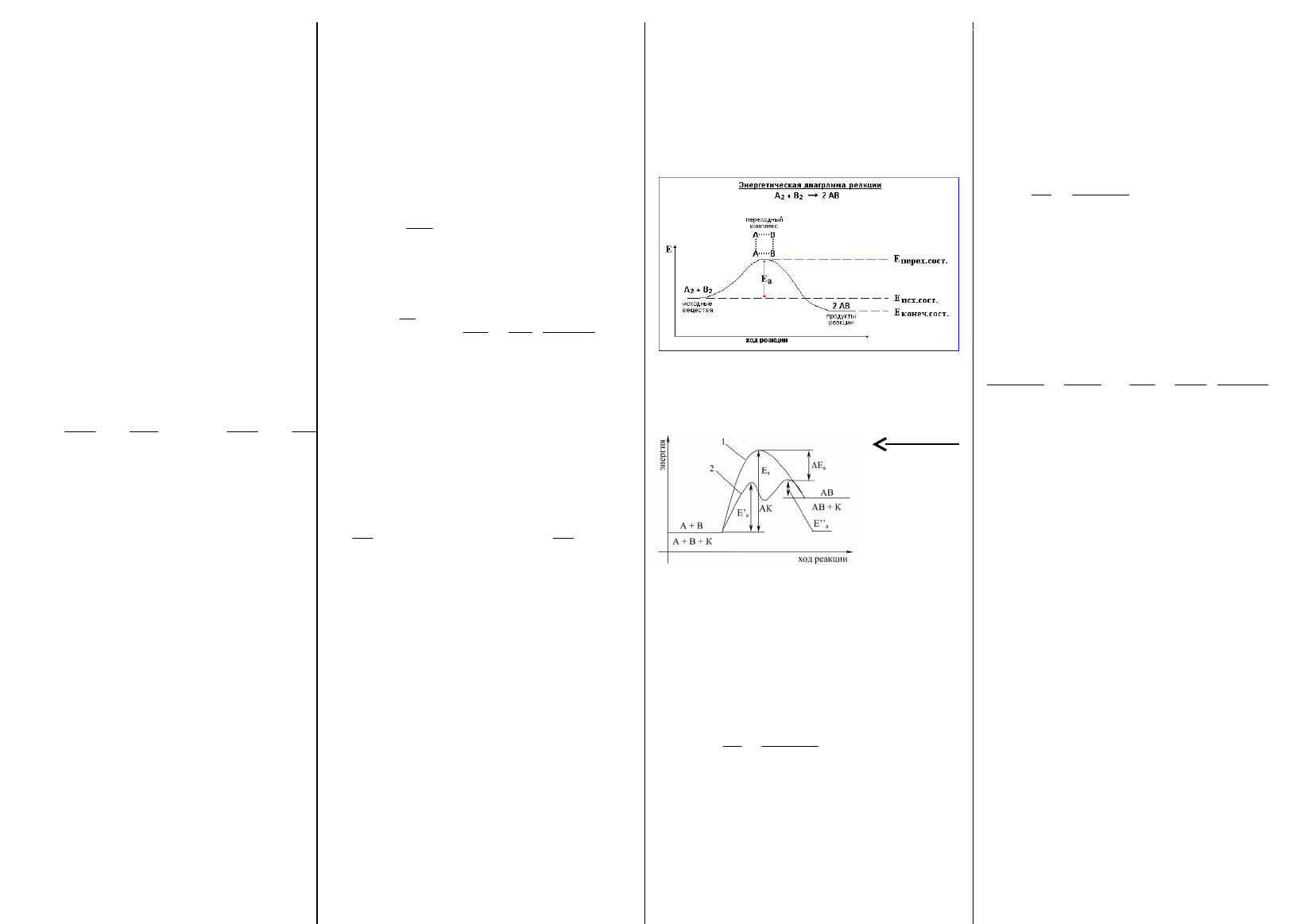
6. Энергетические диаграммы реакций, активированный
комплекс. Влияние катализаторов на скорость химических
реакций.
Величина E
a
определяет высоту энергетического барьера реакции.
Преодоление этого барьера частицами исходных вещ-в связано с
образованием акт. комплекса. Акт. комп. – группа взаимод. ч-ц в
момент соударения: старые связи ослабли, а новые еще не
образовались. Эн. диагр. реакции – опис. хода реакции через
изменение эн-гии исх. вещ-в. На рис. эн. диагр. экзотерм. реакции:
;,0,0
исхперисхкон
EEEQEEH
a
Катализаторы — вещества, которые, участвуя в реакции и влияя
на её скорость, сами к концу её остаются химически неизменными.
Могут как ускорять, так и замедлять реакцию (ингибиторы).
Введение в систему катализатора разбивает процесс на несколько
промежуточных стадий, E
a
которых меньше, чем E
a
всего процесса.
7. Обратимые процессы. Химическое равновесие
(кинетическое условие равновесия и факторы, влияющие
на его состояние). Вывод константы равновесия.
Обратимые процессы – процессы, протекающие при данных
условиях одновременно в двух противоположных направлениях,
при этом ни одно из реагирующих вещ-в не расходуется полностью.
В закрытых системах при T=p=const обратимые реакции протекают
до состояния равновесия. Хим. равновесие – состояние обр.
процесса, при котором v
пр
=v
обр
. Х.Р. нарушается при изменении p, T,
C. Вывод K
C
:
,
,,
2
1
C
обр2обр1пр
b
B
a
A
d
D
c
C
пр
d
D
c
C
b
B
a
A
CC
CC
k
k
K
vvCCkvCCkv
где - равновесная концентрация вещ-ва, моль/л.
8. Константа химического равновесия (К
C
и К
P
, их
взаимосвязь). Физический смысл. Факторы, влияющие на
численное значение. Зависимость К
C
и К
P
от температуры.
Для газообразных систем вместо концентраций можно
использовать равновесные парциальные давления газов:
;n где,)(, :но,
исхпрод
2
1
C
nnRTKKKK
PP
PP
k
k
K
n
CPPC
b
B
a
A
d
D
c
C
Физический смысл К
C
(К
P
) : константа равновесия определяет
предел (глубину) протекания процесса в выбранном
направлении, показывая, какие вещества (исходные или
продукты реакции) преобладают в равновесной системе. Если
К>1, равновесие смещено вправо, т. е. в равновесной системе
преобладают продукты реакции, и наоборот, при К<1 — равновесие
смещено влево, преобладают исходные вещества. Численное
значение К
C
(К
P
) зависит от природы реагирующих веществ,
температуры и не зависит от концентраций (парциальных
давлений) и присутствия катализатора. Зависимость константы
равновесия от температуры выражается уравнением изобары
(для Р, Т = const):
;ln,
T
ln
12
12
2
P
1
2
TT
TT
R
H
k
k
RT
HK
T
T
С повышением температуры константа равновесия увеличивается
в эндотермических реакциях и уменьшается в экзотермических
реакциях.
9. Кинетическое условие наступления равновесия в
системе, условия его сохранения и смещения. Принцип Ле-
Шателье.
Условие наст. равн.: v
пр
=v
обр
. Равновесие смещается при изменении
C, P, T, при которых система находилась в равновесии.
Принцип Ле Шателье: если на систему, находящуюся в состоянии
равновесия, оказывается воздействие (изменяются
концентрация, температура, давление), то оно благоприятствует
той из двух противоположных реакций, которая ослабляет это
воздействие. Например:
При увеличении концентрации исходных веществ
равновесие смещается в сторону продуктов реакции и
наоборот.
При повышении давления равновесие смещается в
сторону той реакции, которая сопровождается
уменьшением давления, т. е. в сторону образования
меньшего числа молей газообразных веществ. Если реакция
идет без изменения объема, то изменение давления не
вызывает смещения химического равновесия.
Повышение температуры смещает равновесие в сторону
протекания эндотермического процесса (∆Н>0), а понижение
— в сторону экзотермической реакции (∆Н<0).
10. Влияние изменения концентрации на положение
равновесия обратимой реакции. Обосновать на конкретных
примерах с использованием ЗДМ.
Увеличение концентрации веществ смещает равновесие в сторону
той реакции, которая уменьшает их концентрацию, а уменьшение
концентраций веществ смещает равновесие в сторону той
реакции, которая их пополняет, увеличивает концентрацию.
Например:
Увел. v
пр
приводит к наруш. кин. усл. равн., и оно смещается в напр.
реакции, идущей с большей скоростью. В данном случае, вправо:
Еще один пример:
x
X
C
Э
н
е
р
г
е
т
и
ч
е
с
к
а
я
д
и
а
г
р
а
м
м
а
в
л
и
я
н
и
я
к
а
т
а
л
и
з
а
т
о
р
а
н
а
с
к
о
р
о
с
т
ь
р
е
а
к
ц
и
и
:
1
—
и
з
м
е
н
е
н
и
е
э
н
е
р
г
и
и
р
е
а
к
ц
и
и
в
о
т
с
у
т
с
т
в
и
е
к
а
т
а
л
и
з
а
т
о
р
а
,
2
—
и
з
м
е
н
е
н
и
е
э
н
е
р
г
и
и
р
е
а
к
ц
и
и
в
п
р
и
с
у
т
с
т
в
и
и
к
а
т
а
л
и
з
а
т
о
р
а
.
3
прпр
3
KCNSFeCl
CCkv
;,22
пр224
4
vCHCOCOCH
CH
;,3)(3
пр33
3
vCKClCNSFeKCNSFeCl
FeCl
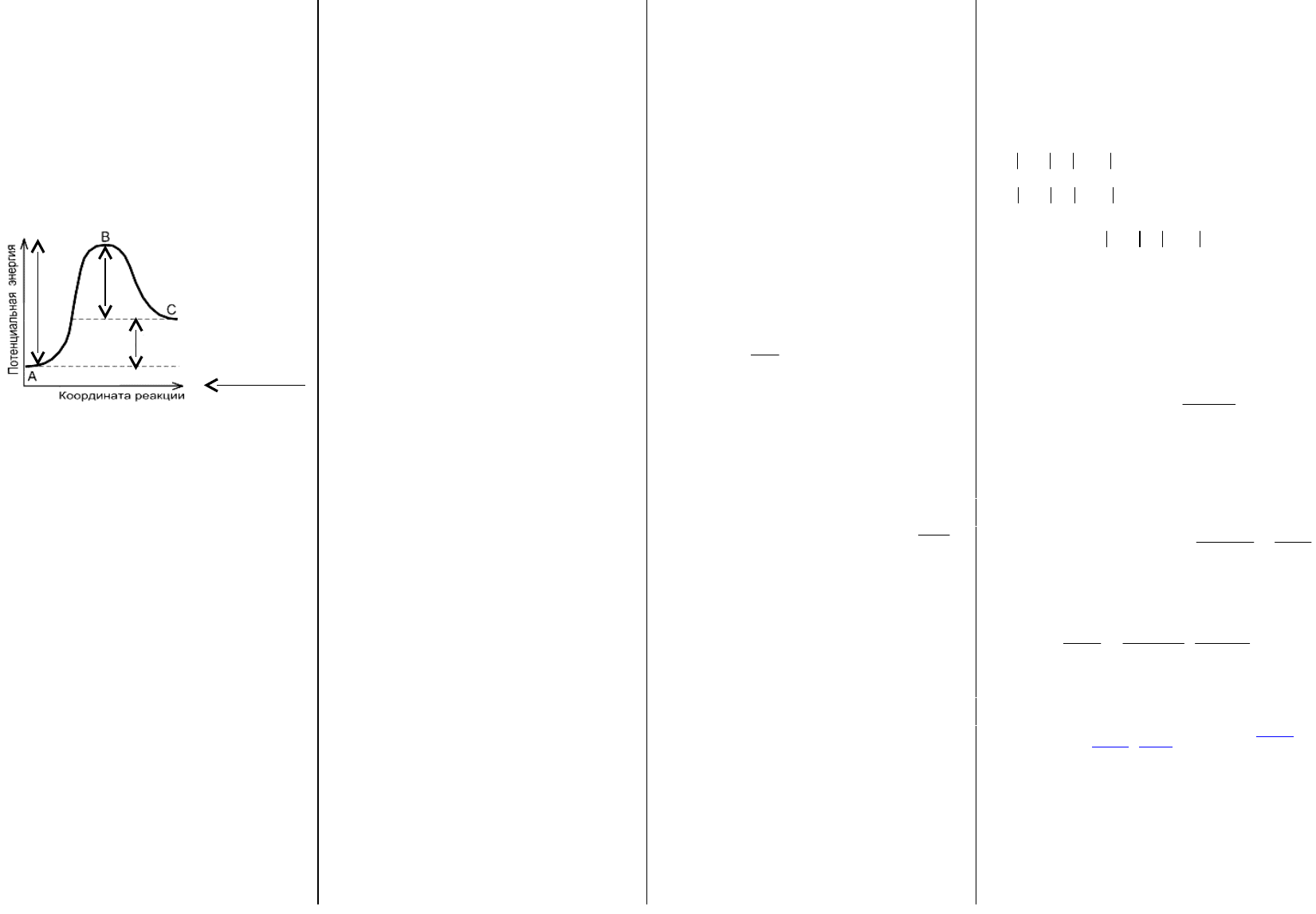
11. Влияние изменения температуры на положение
равновесия обратимой реакции. Обосновать на
конкретных примерах с использованием энергетической
диаграммы обратимой реакции.
При изм. T в разной степени изменяются скорость пр. и обр.
реакции. Для выяснения напрвления смещения необходимо знать
знак теплового эффекта реакции. При пов. T равновесие смещ. в
сторону эндотерм. реакции (ΔH>0, Q<0), и наоборот. Диаграмма:
Эндотерм. реакция:
вправо; смещ. при;0,0,22
22
TQHNOON
12. Основные понятия и определения химической
термодинамики (термодинамические системы, параметры,
функции).
Термодинамика – наука, изучающая связи между превращением
вещества и превращением энергии. Также изучает возможность и
невозможность самопроизвольного перехода системы из одного
состояния в другое, и энерг. эффекты этих переходов. Объект
изучения – макроскопические системы, состоящие из очень
большого числа частиц. Т/д рассматривает общие св-ва системы в
целом, и не интересуется поведением отдельных частиц.
Термодинамической системой называют тело или совокупность
взаимодействующих тел, реально или мысленно выделенные в
пространстве и способные обмениваться с окружающей средой или
между собой энергией и (или) веществом. Совокупность
физических и химических свойств, характеризующих данную
систему, называется состоянием системы. Каждое состояние
системы характеризуется термодинамическими параметрами,
которые можно разделить на две группы:
экстенсивные, пропорциональные количеству вещества или
массе системы (V, теплоемкость, U, S и др.);
интенсивные, не зависящие от массы, а определяемые только
природой системы (температура, давление, концентрация и
удельные величины — молярная теплоемкость, молярный
объем и др.).
Термодинамические параметры, изменение которых зависит
только от начального и конечного состояния системы и не зависит
от пути процесса, называются функциями состояния. Функции
состояния являются экстенсивными свойствами, поэтому их
значения обычно относят к единице количества вещества.
Параметры, значения которых зависят от пути перехода
системы из одного состояния в другое, называются
функциями процесса. Функции состояния: U (вн. эн), H (энтальпия),
S (энтропия), G (эн. Гиббса).
13. Первый закон т/д. Внутренняя энергия, энтальпия:
определение, физический смысл.
Любая система, состоящая из большого числа частиц,
находящихся в постоянном движении, характеризуется полным
запасом энергии. E
п
=Е
к
+E
п
+U. Внутренняя эн-гия системы – ее
полная эн-гия, сост. из кин. и пот. эн-гии всех частиц
системы.eВеличина экстенсивная. Изменение энергии может
происходить засчет обмена эн-гией между системами и системой и
средой в 2-ух формах: теплоты и работы. Теплотой называется
неупорядоченная форма передачи энергии засчет хаотического
столкновения молекул. Переноса вещества при этом не
происходит. Мера переданной таким образом энергии есть
количество теплоты. Работа является мерой упорядоченной
формы перехода энергии при перемещении масс, состоящих из
большого числа частиц, под действием каких-либо сил. В отличие
от внутренней энергии теплота и работа не являются
функциями состояния системы. В общем случае их величины
зависят от способа перехода системы из одного состояния в
другое, т. е. теплота и работа — функции процесса. Взаимосвязь
между внутренней энергией, теплотой и работой
устанавливается первым законом термодинамики: теплота,
подведенная к системе (Q), расходуется на увеличение ее
внутренней энергии (∆U) и на совершение системой работы (A):
где A
max
- максимальная полезная
работа, которую может совершить система, pΔV – работа
расширения. Энтальпия представляет собой сумму внутренней
энергии системы и работы, которую она производит против силы
внешнего давления. Не имеет абсолютного значения. Физич.
смысл: полная энергия системы в изобарно-изотермических
условиях: .
14. Тепловые эффекты реакций. Применение первого
закона т/д к изохорным и изобарным процессам.
Стандартные энтальпии образования веществ.
1. V=const, Q=ΔU. Подводимая теплота расходуется только на
изменение внутренней эн-гии системы.
2. p=const, Q=(U
2
-U
1
)+(pV
2
-pV
1
)=H
2
-H
1
=ΔH, H – энтальпия.
изменение энтальпии ΔH не зависит от пути процесса, т.е.
это функция состояния.
Тепл. эфф. реакции – изменение эн-
гии системы при протекании в ней
хим. реакции, при условии что
система не совершает никакой
работы, кроме раб. расширения.
эндотермические реакции
V = const, ∆U > 0;
P = const, ∆H > 0;
экзотермические реакции
V = const, ∆U < 0;
P = const, ∆H < 0.
Чтобы сравнивать тепл. эффекты разл. процессов, важно чтобы
они были отнесены к одним условиям, т.е. стандартизованны.
Стандартная энтальпия обр. соед-ия ( ) – энтальпия реак-
ции образования 1 моля этого соединения в стандартных условиях
из простых вещ-в, находящихся в стандартном состоянии
[кДж/моль]. Станд. усл.: p=1 атм.=101.3 кПа., T=298 K. Станд.
состояние вещ-ва – физич. сост., в кот. чистое вещ-во наиб.
стабильно в станд. условиях. Энтальпия обр. простого вещ-ва в
станд. сост. принята равной 0.
15. Законы термохимии (Лавуазье-Лапласа, Гесса). Расчет
тепловых эффектов химических процессов. Уравнение
Кирхгофа.
Закон Лавуазье-Лапласа: теплота, которая выделяется при
образовании химического соединения, равна теплоте,
поглощаемой при его разложении на исходные вещества
(тепловой эффект прямой реакции равен и противоположен по
знаку тепловому эффекту обратной реакции). Например:
Закон Гесса (основной закон термохимии): тепловой эффект
(изменение энтальпии) химической реакции не зависит от пути
процесса, а определяется только начальным и конечным
состоянием системы. Тепловой эффект любой химической
реакции можно рассчитать по известным теплотам образования
веществ, участвующих в реакции, используя следствие из закона
Гесса: тепловой эффект (изменение энтальпии) реакции равен
разности между суммой энтальпий образования продуктов реакции
и суммой энтальпий образования исходных веществ (с учетом
стехиометрических коэффициентов в уравнении реакции).
где n’ и n’’ - стехиометрические коэффициенты продуктов ре-
акции и исходных веществ соответственно. Для расчета тепл. эфф.
реакции при любой темп-ре используется ур-ние Кирхгофа:
где - молярная изобарная
теплоемкость (кол-во тепла, необ. для нагр. вещ-ва на 1 ºС).
Принято что теплоемкость не зависит от температуры, поэтому:
исх.
0
298,
прод.
0
298,
0
298
)()()реак.(
ff
СnСnС
16. Второй закон т/д. Энтропия системы, физический
смысл. Зависимость ее от различных факторов.
II закон т/д определяет напрвленность превращения эн-гии и имеет
несколько эквивалентных формулировок:
Теплота не может самопроизвольно переходить от
менее нагретого тела к более нагретому (Клаузиус).
Невозможно всю теплоту превратить в полную работу,
часть ее непременно теряется (Кельвин-планк).
где Q – связанная (рассеянная эн-гия) – та ее часть,
которая не может быть превращена в работу и определяет меру
беспорядка в системе (S). ΔS – изменение энтропии. Т/д смысл
энтропии: - мера связанной эн-гии, отнесенная к 1 K, т.е.
мера перехода эн-гии в такую форму, из которой онане может
самопроизвольно переходить в другие формы. Статистический
смысл: мера неупорядоченности системы, количественная мера
хаотического движения и взаимного расположения частиц системы.
Энтропия зависит от природы вещ-в, числа частиц и температуры.
17. Энтропия системы и ее изменение при протекании
физико-химических процессов. Расчет ∆S х.р. при
стандартных условиях и заданной температуре.
Любое вещ-во имеет некую положит. энтропию, но при темп. абсол.
нуля, энтропия чистого вещ-ва в виде идеального кристалла равна
0. Это состояние является точкой отсчета при определении
энтропии. Стандартная энтропия вещ-ва ( ) – это энтропия 1
моля вещ-ва в его станд. сост. при заданных условиях
[Дж/(моль*K)]. Расчет ΔS:
в станд. условиях:
при темп. T:
Энтропия особенно резко возрастает при темп. фазовых
переходов. В реакциях с участием газов, ΔS можно оценить
ориентировочно по изм. объема: при увел. V энтропия возрастает.
18. Уравнение, объединяющее первый и второй законы т/д.
Свободная энергия Гиббса или изобарно-изотермический
потенциал (G) и его изменение (∆G) в физико-химических
процессах при стандартных условиях и заданной
температуре Т.
Критерием направленности самопроизвольных процессов
при Р, Т = const, учитывающим эльтальпийную и энтропийную
составляющие движущей силы процесса, является изменение
свободной энергии Гиббса (ΔG). Ур-ние
объединяет математически первый и второй
законы термодинамики. Величина
GTSH
—
свободная энергия есть разность между полной энергией
расширенной системы и связанной энергией. Тогда,
При p,T=const химические реакции протекают самопроизвольно в
направлении, которому отвечает убыль свободной энергии Гиббса
системы: неравенства определяют
принципиальную возможность течения химической реакции.
Физич. смысл ΔG: это та часть энергетического эффекта реакции,
которую можно превратить в работу в обратимом процессе. Расчет
ΔG в стд. усл.: или
, при
заданной T: . простых вещ-в равен 0.
19. Взаимосвязь энтальпийного и энтропийного факторов в
определении т/д условий протекания самопроизвольных
процессов.
Процесс принципиально невозможен, если ∆G > 0. Чем более
отрицательно знач. ∆G, тем более система реакционноспособна.
Химические реакции можно классифицировать по возможности
и условиям протекания в зависимости от характера изменения ∆Н и
∆S (возможность хим. реакции опред. нер-вом ):
1. В изолированных системах ∆Н=0, тогда неравенство
принимает вид: -TΔS<0. Развитие любого самопроизвольного
процесса обусловлено только энтропийным фактором ∆S > 0.
2. В неизолированных системах:
если ∆Н < 0 и ∆S > 0, неравенства
выполняются при любых значениях Т; процесс возможен
при любой T;
если ∆Н > 0 и ∆S < 0, неравенства не
выполняются; процесс неосуществим в прямом, но возможен
в обратном направлении;
если ∆Н < 0 и ∆S < 0, неравенства
выполняются при условии , т.е. для течения
реакции благоприятен низкотемпературный режим;
если ∆Н > 0 и ∆S > 0, неравенства
выполняются при условии ,
благоприятным для протекания реакции является
высокотемпературный режим.
Для большинства реакций, идущих при обычной температуре и
атмосферном давлении ,поэтому в этих условиях
эндотермические реакции (∆Н > 0) редко протекают
самопроизвольно, в отличие от экзотермических (∆Н < 0).
20. Термодинамические условия наступления равновесия.
Расчет температуры наступления равновесия. Уравнение
изотермы химической реакции.
Пределом убыли свободной эн-гии Гиббса при самопроизвольном
протекании процесса является ее мин. значение, отвечающее
состоянию равновесия. Такое состояние системы наиболее
устойчиво, а всякое отклонение от него требует энергетических
затрат: В состоянии т/д равновесия
оба процесса в системе равновероятны. Пренебрегая
зависимостью ΔH и ΔS от темп-ры, можно приближенно
определить темп. наст. равн.:
0
298
0
298
равн
S
H
T
Взаимосвязь между константой равновесия и изобарным
потенциалом выражается уравнением изотермы:
)lg(3.2)ln(
0
PPT
KRTKRTG
Зная ΔG, по ур-нию изотермы можно рассчитать K
P
, а значит,
установить предел протекания процесса в данном направлении.
21. Уравнение изобары хим. реакции и использование его в
расчетах тепловых эффектов реакций (∆Н).
Взаимосвязь ΔH и K
P
устанавливает ур-ние изобары:
Ур-ние изобары является математическим выражением принципа
Ле-Шателье для темп. фактора. Очевидно, что знак производной
зависит только от знака ΔH, поэтому при ΔH>0 (эндотерм. реакция),
повышение T приводит к возрастанию значения K
P
, т.е. равновесие
смещается в сторону прямой реакции, подтверждая принцип Ле-
Шателье. Чтобы определить изменение K
P
при изменении темп. на
конечную вел-ну, ур-ние интегрируют в пределах от K
PT1
до K
PT2
, и
от T
1
до T
2
:
22. Определение понятий: электролиты,
электролитическая диссоциация, кислоты, основания,
соли. Степень диссоциации (α), классификация
электролитов по величине α.
Электролитами называются вещества, которые в растворе
(или в расплаве) полностью или частично состоят из ионов и
способны проводить электрический ток. Электролитическая
диссоциация - полный или частичный распад молекул
растворенного в-ва наeкатионыeиeанионы. С точки зрения теории
электролитической диссоциации кислотой называется вещество,
диссоциирующее в водном растворе на ионы Н
+
и кислотный
остаток; основанием — вещ-ва, диссоциируещие на ионы
металла и ОН-группу. Соли — вещества, образующие при
диссоциации ионы металлов и кислотных остатков (исключение
составляют соли аммония (NH
4
Cl, NH
4
NO
3
.и т.д.). Для
количественной оценки процесса электролитической
диссоциации введено понятие степени диссоциации. Отношение
числа молекул, распавшихся на ионы (N), к общему числу молекул
(N
0
) называется степенью диссоциации (α):
Численное значение (α) зависит от природы растворенного
вещества, температуры, концентрации раствора и принимает
значение, меньше или равное единице (α ≤ 1). По значению α все
электролиты условно делят на сильные (α → 1) и слабые (α << 1).
E
a пр.
E
a обр.
ΔH>0
ΔH=E
а. пр.
-E
а. обр.
Для реакции ΔH>0, Q<0:
E
а. пр.
>E
а. обр.
, и с пов. T, v
пр.
увел. больше, чем v
обр.
,
т.к. из ур-ния Аррениуса,
больше ускоряется та
реакция, E
a
которой
больше. В итоге,
равновесие смещается в
направлении реакции,
идущей с большей
скоростью. В данном
случае, вправо.
,,
max
AVpAAUQ
PVUH
0
298,f
H
;H ,SAs = 3S +2As
обрпр32
H
,)()()реак.(
исх.
0
298,
прод.
0
298,
0
298
ff
HnHnH
),298(
0
298,
0
298
0
TCHH
pT
0
p
C
,STQ
T
Q
S
0
298
S
исх.
0
298,
прод.
0
298,
0
298
)()()реак.(
ff
SnSnS
)
298
ln(
0
298,
0
298
0
T
CSS
pT
'
max
AVpUST
'
max
AH
.,
'
max
STHGGA
0,0 STHG
0
298
0
298
0
298
298 SHG
исх.
0
298,
прод.
0
298,
0
298
)()()реак.(
ff
GnGnG
000
TTT
STHG
0
298,f
G
0 STH
STH
STH
STH
0.ST-H или 0 G
2
ln
RT
H
T
K
P
.
10
ln
12
12
3
2
1
TT
TT
R
H
K
K
T
T
P
P
;/
0
NN

Cильными электролитами являются хорошо растворимые соли;
кислоты: галогеноводородные – (кроме HF), H
2
SO
4
и т.д.;
основания щелочных и щелочно-земельных металлов. Слабыми
электролитами – почти все карбоновые кислоты; некоторые
минеральные кислоты, многие основания, малорастворимые соли,
гидроксид аммония, вода.
23. Обратимость диссоциации слабых электролитов.
Константа диссоциации. Закон разбавления Оствальда.
Расчет концентраций ионов в слабом электролите.
В растворах слабых электролитов процесс диссоциации протекает
обратимо по формуле: . Константа равновесия
для процесса диссоциации слабого электролита называется
константой диссоциации (К
Д
). На основании закона действия масс
выражение для константы диссоциации имеет вид:
Константа диссоциации зависит от природы
диссоциирующего вещества, растворителя,
температуры и не зависит от концентрации раствора. Она
характеризует способность электролита распадаться на ионы.
Чем больше ее численное значение, тем в большей степени
диссоциирует электролит. Взаимосвязь между К
Д
и α устанавли-
вается законом разбавления Оствальда:
Концентрация ионов в растворе слабого
электролита определяется по формуле:
24. Электролитическая диссоциация воды. Ионное
произведение воды. Водородный и гидроксильный
показатели.
Вода является слабым электролитом, поэтому в любом водном
растворе существует равновесие:
К
Д
воды определен экспериментально и равен 1,86*10
-16
.
Равновесная концентрация недиссоциированных молекул воды
практически равна ее молярной концентрации, которая для воды
объемом 1 л составляет 55,56 моль/л и является постоянной
величиной. Произведение двух постоянных К
Д
и С
H20
дает новую
постоянную, называемую константой воды или ионным
произведением воды:
Величина ионного произведения воды остается постоянной при
неизменной температуре (298 К) не только в чистой воде, но и в
любом водном растворе электролита. В чистой воде:
;101К
7
Д
OHH
CC
Для практической оценки характера среды в водных растворах
используется водородный показатель рН. Водородный показатель
(рН) – отрицательный десятичный логарифм молярной
концентрации ионов водорода в растворе Гидроксильный
показатель (рОН) – отрицательный десятичный логарифм
молярной концентрации гидроксид-ионов в растворе. Тогда, при
298 К: pH+pOH=14.
25. Теория электродных потенциалов (механизм
возникновения, зависимость значений от природы
электродов). Электроды 1-го рода: металлические и
газовые.
Все металлы характеризуются свойством в большей или в
меньшей степени растворяться в воде. Под действием полярных
молекул воды ионы поверхностного слоя металла отрываются и
в гидратированном состоянии переходят в жидкость. При этом
пластина металла заряжается отрицательно (из-за появления в
ней избыточных электронов), а слой электролита у ее
поверхности – положительно (гидратированные катионы металла).
В результате электростатического притяжения противоположных
зарядов на границе металл – раствор возникает двойной
электрический слой и разность потенциалов в нем. С увеличением
концентрации катионов у поверхности металла становится
вероятным обратный процесс – восстановление ионов металла.
Когда скорости указанных процессов сравняются, в системе
устанавливается равновесие, которое можно выразить уравнением:
Состояние равновесия
зависит от активности металла, концентрации его ионов в
растворе и численно характеризуется константой равновесия,
которая для данной гетерогенной системы при P = const равна:
. Для активных металлов равновесие смещено
вправо. При погружении их в водный раствор собственной соли для
достижения равновесной концентрации ионы металла будут
переходить в раствор и поверхность металла зарядится
отрицательно, а раствор электролита – положительно. Для
малоактивных металлов равновесная концентрация ионов
металла в растворе очень мала и равновесие смещается
влево. При погружении их в водный раствор собственной соли для
достижения равновесной концентрации ионы металла из
раствора будут переходить на поверхность металла и она
зарядится положительно, а раствор электролита – отрицательно.
Потенциал, возникающий на металлическом электроде,
находящемся в равновесии с собственными ионами в растворе
электролита, называется электродным потенциалом (φ, В).
Значение электродного потенциала зависит от природы электрода,
темп., конц. потенциалоопред. ионов. Электроды, обратимые
относительно своих ионов в растворе электролита, называются
электродами 1-го рода. К ним относятся металлические и газовые
электроды: водородный, кислородный.
26. Стандартные электродные потенциалы. Электрод
сравнения – водородный электрод. Роль платины в
конструкции водородного электрода. Ряд напряжений.
Электрохимические условия протекания гетерогенных ОВР.
Cтандартный электродный потенциал
(φ
0
) — это потенциал, возникающий на
электроде при стандартных условиях
(Т = 298 К; Р = 1 атм; С
ионов
=1 моль/л)
относительно электрода сравнения –
водородного электрода. Потенциал
водородного электрода в стандартных
условиях равен нулю. Платина
используется в водородном электроде
потому что она инертна и не
корродирует в р-ре кислоты. Также, она
осуществляет избирательную абсорбцию водорода.
Располагая металлы в порядке возрастания их стандартных
электродных потенциалов, получают электрохимический ряд
металлов – ряд напряжений металлов. Чем меньше значение φ
0
,
тем ярче выражены восстановительные свойства (способность
окисляться). Чем больше значение φ
0
, тем ярче выражены
окислительные свойства (способность восстанавливаться).
Условием протекания окислительно-восстановительных реакций
в водных растворах электролитов является неравенство: φ
ок
> φ
вос
.
Ряд напряжений применим только к водным растворам. Из
нескольких возможных реакций возможна та, для которой в
большей степени выполняется условие φ
ок
> φ
вос
.
27. Электроды 1 рода (металлические и газовые).
Схематическая запись, уравнения электродных реакций.
Уравнение Нернста и расчет φ
p
.
Электроды, обратимые относительно собственных ионов в
растворе электролита, называются электродами 1-го рода.
Схематически эл-ды записываются в молекулярной или ионной
формах. Схем. зап. и электродные реакции газ. и Me-эл-дов:
Me-электрод:
;2;Zn| Znили|
22
4
ZneZnZnSOZn
H
2
-электрод:
О
2
:
Численные значения равновесных электродных потенциалов (φ
р
)
рассчитываются по уравнению Нернста:
где C
ок
, C
вос
– конц. ок. и восст. форм
эл-дов в степени стехиометр. коэфф., стоящих в ур-ниях соотв.
электродных реакций. В стд. усл. ур-ние имеет вид:
Me-электрод:
H
2
-электрод:
O
2
-электрод:
28. Частные случаи уравнения Нернста для расчета
равновесных потенциалов газовых электродов (вывод,
анализ: зависимость значений равновесных потенциалов
от рН растворов).
Численные значения равновесных электродных потенциалов (φ
р
)
рассчитываются по уравнению Нернста:
где C
ок
, C
вос
– конц. ок. и восст. форм
эл-дов в степени стехиометр. коэфф. (a,b), стоящих в ур-ниях
соотв. электродных реакций. Переходя от натурального
логарифма к десятичному (коэфф. перевода 2,3), и подставляя
численные значения постоянных R и F, при Т=298 К получим:
H
2
-электрод:
O
2
-электрод:
Принимая P
газов
за нормальные и равные 1 атм (101 кПа), n=2,
-lg(C
H+
)=pH, -lg(C
OH-
)=pOH, pH+pOH=14, и подставив стандардные
потенциалы H
2
-электрода (0В) и O
2
-электрода (0.4В), имеем:
H
2
-электрод:
O
2
-электрод:
Таким образом, в стандартных условиях потенциалы газовых
электродов зависят только от значения pH р-ра. Их потенциалы с
увел. pH уменьшаются, растут их восст. способности.
29. Водородный и кислородный электроды, зависимость их
значений от величины рН. Топливные водород-кислородные
элементы.
см. бил. 28.
Топливные водород-кислородные элементы:
Топливные элементы — химические источники тока
непрерывного действия, в которых окислитель и восстановитель не
заложены заранее в рабочую зону, как в первичных элементах и
аккумуляторах, а подаются непрерывно к электродам, которые во
время работы топливного элемента не расходуются. Окислитель —
чистый кислород, или кислород воздуха, иногда Cl
2
, HNO
3
и др.
Восстановитель — водород, полученный химической конверсией
различных водородсодержащих веществ: аммиака, метанола,
гидридов металлов и др. Электролит — чаще всего 30%-й раствор
KOH. Электроды — графитовые или пористые никелевые с
добавками других металлов, катализирующих процессы. Схема
кислород-водородного топливного элемента с графитовыми
электродами и уравнения электродных реакций:
В результате этой реакции в цепи генерируется постоянный
ток и химическая энергия непосредственно превращается в
электрическую. ЭДС можно рассчитать по формуле:
Реальная ЭДС элемента меньше расчетной, что обусловлено в
большей степени поляризацией электродов и снижением
скорости электрохимических процессов. Снижение поляризации
достигается применением катализаторов, увеличением
поверхности электродов (пористые), повышением температуры и
давления. В высокотемпературных элементах используются
твердые электролиты или расплавы солей. Для увеличения
напряжения и тока элементы соединяют в батареи.
30. Гальванические элементы: химические и
концентрационные: принцип работы, основные
характеристики (на конкретных примерах).
Хим. гальван. эл-т – замкнутая э/х система, состоящая из эл-дов
различной хим. природы. Электрод с меньшим значением φ
называется анодом, на нем идут процессы окисления, с большим
значением φ - катодом, на нем идут процессы восстановления.
Хим. Г.Э. бывают двух типов: Даниэля Якоби и Вольта. Эл-т
Даниэля-Якоби состоит из 2-ух эл-дов I-го рода (обратимых по
собственному иону). Эл-т Вольта состоит из 2-ух эл-дов различной
природы в одном р-ре электролита. Концентрационный Г.Э. состоит
из двух эл-дов I-го рода в растворах эл-та с различной конц.
потенциалоопред. ионов. Эл-д в р-ре с мен. конц. – анод. Примеры:
Эл-т Даниэля-Якоби Эл-т Вольта
Концентрационный Г.Э.
Эл-ды в хим. Г.Э. соединяются посредством проводника второго
рода (электролитического мостика). Во внешней цепи электроды
соединены металлическим проводником первого рода. При
соединении электродов равновесие нарушается вследствие
перехода электронов по внешней цепи от цинкового электрода
(анода) к медному (катоду), а анионов SO
4
− по внутренней
цепи в обратном направлении. Концентрационный Г.Э. работает
за счет выравнивания концентрации ионов в растворах
электролитов. Критерий работающего
Г.Э.: E>0, т.е. φ
к
>φ
а
. ЭДС
рассчитывается по формуле E= φ
к
>φ
а
.
Г.Э. совершает макс. пол. электр.
работу: A
m
=nFE, где n – число
электронов, F – пост. Фарадея (96500 Кл). По изв. знач. E можно
определить ΔG=-nFE, lgK
p
=(nE)/0.059. В условиях, отличных от
стандартных, знач. пот. рассчитываются по ур-нию Нернста. ЭДС
концентрационного Г.Э.:
31. Химические гальванические элементы: Даниэля-Якоби и
Вольта: принцип работы, основные характеристики.
см. билет 30.
Дан.-Якоби:
токообр. реак.
Вольта:
токообр. реак.
Принцип работы медно-цинкового Г.Э.: При соединении
электродов металлическим проводником, вследствие разности
потенциалов между электродами, часть электронов с цинковой
пластинки перейдет на медную. Это нарушит равновесие в
двойном электрическом слое у цинка (потенциал его повышается) и
у меди (потенциал ее понижается). Обе системы стремятся
вернуть равновесие за счет окисления цинка и восстановления
ионов меди. Этими процессами сохраняется разность
потенциалов, обеспечивающая постоянный переход электронов по
внешней цепи от цинка к меди – электрический ток в цепи. Во
внутреннем участке цепи анионы SO
4
перемещаются в растворе от
медного электрода к цинковому. Хар-ки в б. 30.
32. Концентрационные гальванические элементы на
конкретных примерах элементов, составленных из 2-х
металлических электродов: принцип работы, основные
характеристики.
см. б. 30
Конц. Г.Э. из 2-ух металлических эл-дов:
Электрод в растворе с меньшей концентрацией ионов, имеющий
меньшее значение потенциала, является анодом. Электрод в
растворе с большей концентрацией, имеющий большее значение
потенциала – катодом. Уравнения электродных процессов:
nBmABA
nm
;
Д
nm
BA
n
B
m
A
C
CC
K
;
1
2
Д
м
С
K
;К
Д МM
СCC
;
2
OHHOH
;101
14
Д
22
OHH
OHOH
CCCKK
.
22
enOmHMeOHmMe
n
n
Me
C
CKK
P
;22;2H|H Pt, или|,
22422
HeHSOHHPt
;222/1;2OH|H Pt, или2|,
22
-
22
OHeOHOKOHOPt
),
C
ln(
b
вос
a
ок
0
C
nF
RT
эл
р
эл
nnn
MeMeMe
р
MeMe
Cn lg)/059.0(
0
//
pH
р
HH
059.0
2
/2
pH
р
OHO
059.023.1
2/
2
),
C
ln(
b
вос
a
ок
0
C
nF
RT
эл
р
эл
)/lg()/059.0(
20
2/2/
2
22
OH
O
OHO
р
OHO
CPn
)/lg()/059.0(
2
22
20
/2/2
H
HHH
р
HH
PCn
pH
р
OHO
059.023.1
2/
2
pH
р
HH
059.0
2
/2
;/
0
298
nFG
Концентрационный Г.Э. работает за
счет выравнивания концентрации
ионов в растворах электролитов. ЭДС
эл-та определяется соотношением
концентраций ионов и рассчитывается по уравнению:
где где С
1
и С
2
– молярные конц.
ионов у анода и катода (C
1
< C
2
);
33. Концентрационные гальванические элементы на
конкретных примерах элементов, составленных из 2-х
газовых электродов: принцип работы, основные
характеристики.
Конц. Г.Э. работает засчет выравнивания конц. ионов в р-ре эл-тов.
Конц. Г.Э. из 2-ух газовых (H
2
) эл-дов:
Поскольку величина потенциала водородного электрода зависит от
концентрации ионов H
+
в растворе, анодом будет являться тот
электрод, pH р-ра которого выше. Также, значение потенциала
зависитот давления H
2
. ЭДС H
2
эл-да рассчитывается по формуле:
+см. б. 30.
34. Явление поляризации и деполяризации в
гальванических элементах (на примере элемента Вольта и
Даниэля-Якоби).
Поляризация – смещение величин эл-дных потенциалов от их
равновесных значений. Поляр. бывает конценрационной и
химической. Конц. поляр. вызвана изменением конц.
потенциалоопред. ионов в р-ре. Химич. поляр. вызвана измен. хим.
прир. эл-да. при выделении на них продуктов электрохимической
реакции. Напр., в Cu-Zn эл-те Вольта потенциал катода (медного
электрода) уменьшается за счет выделения на нем молекулярного
водорода (Н
2
) и фактического изменения химической природы
электрода. При этом потенциал катода в пределе становится
равным потенциалу водородного электрода, т.е. φ
к
=-0.059 pH.
Концентрационная поляризация обусловлена изменением
концентрации потенциалопределяющих ионов в приэлектродных
слоях при прохождении тока. При этом потенциал анода
увеличивается за счет возрастания концентрации положительных
ионов при окислении анода (например, ионов Zn
2+
в элементе
Вольта). Таким образом, в Cu-Zn эл-те Вольта анод поляризуется
концентрационно, а катод — химически. В химических элементах
типа Даниэля-Якоби имеет место концентрационная
поляризация. При этом потенциал анода растет за счет увеличения
концентрации положительных ионов при окислении анода, а
потенциал катода уменьшается за счет снижения концентрации
положительных ионов при их восстановлении на катоде.
Поляризация является причиной уменьшения ЭДС хим. Г.Э.
Явление уменьшения поляризации называется деполяризацией.
Механическое удаление пузырьков газа с поверхности электрода
или перемешивание электролита, снижающее концентрацию
потенциалопределяющих ионов в приэлектродных слоях —
физическая деполяризация, введение химических соединений —
сильных окислителей (K
2
Cr
2
O
7
) и веществ, связывающих
избыточные ионы в труднорастворимые или малодиссоциируемые
соединения или комплексы — химическая деполяризация.
Например, для уменьшения химической поляризации катода в
элементе Вольта в катодное пространство добавляется несколько
капель K
2
Cr
2
O
7
. При этом протекает окислительно-
восстановительная реакция, приводящая к окислению
восстановленного на катоде водорода.
35. Требования, предъявляемые к современным э/х
источникам тока. Первичные (необратимые) химические
источники тока: сухой элемент Ле Кланше. Обратимые
ХИТ или аккумуляторы: кислотные (свинцовые).
Схемы, уравнения электродных процессов при их разрядке
и зарядке, основные характеристики.
Химические источники тока (ХИТ) предназначены для
преобразования химической энергии в электрическую. К ним
относятся гальванические элементы (первичные, одноразовые),
аккумуляторы (многократного действия) и топливные элементы.
Они характеризуются величиной ЭДС, напряжением, мощностью,
емкостью и энергией, величиной КПД, сроком службы,
способностью поляризоваться. В первичных Г.Э. окислитель и
восстановитель заложены непосредственно в состав Г.Э. и
расходуются в процессе его работы. Чаще всего используются
сухие элементы (Ле Кланше), в которых анодом служит Zn,
катодом — диоксид марганца с графитом. Схема эл-та Ле-Кланше:
Эл-ты Ле-
Кланше дешевы,
однако напряжение
(1,1 – 1,3 В)
заметно падает во
времени с увел.
нагрузки и особенно
резко при низких температурах.
Аккумуляторы — химические источники тока обратимого
многоразового действия, в которых химическая энергия
превращается в электрическую (разряд) и электрическая (под
действием внешнего поля) — в химическую (заряд). При разряде
аккумулятор работает как гальванический элемент, при заряде —
как электролизер. В простейшем виде аккумулятор имеет два
электрода (катод и анод) и ионный проводник между ними. На
аноде как при заряде, так и при разряде идут процессы окисления,
на катоде — восстановления. В свинцовых (кислотных)
аккумуляторах анодом является система перфорированных
свинцовых пластин, заполненных губчатым свинцом (для
увеличения поверхности), катодом служит диоксид свинца PbO
2
,
впрессованный в свинцовые решетки. Электролит — раствор
серной кислоты. Схема свинцового аккумулятора и уравнения
процессов разряда и заряда:
Требования: 1) возможно большая величина ЭДС; 2) возможно
меньшее отклонение ∆φ между электродами от ЭДС. Снижение
поляризации достигается макс уменьшение внутреннего
сопротивления ХИТ за счет применения электродов высокой
проводимости. 3) большая удельная емкость – большой запас
электричества в расчете на ед.массы или объема источника. 4)
макс высокая удельная мощность. Макс большое количество
энергии, отдаваемой в ед.времени единицей массы или объема. 5)
макс низкий самозаряд. 6) сохраняемость – срок хранения, в
течение которого характеристики остаются в заданных пределах.
36. Электролиз водных растворов электролитов на
инертных электродах. Факторы, влияющие на
последовательность и скорость разряда частиц на катоде и
аноде ( на конкретных примерах).
При электролизе растворов в процессах на электродах учувствуют
помимо частиц самого вещества молекулы или ионы газа. Характер
электродных процессов зависит от состава электролита, от рН
раствора, концентрации ионов, материала электродов, режима
электролиза.
Простейшая электролизная система состоит из
электролизера, электродов, электролита, источника постоянного
тока. Эл-д, подключенный к отрицательному полюсу источника
тока, называется катодом, к положительному — анодом. В
качестве примера рассмотрим электролиз ZnSO
4
на граф. эл-дах:
На катоде:
В случае инертного анода на нем идут процессы окисления
частиц электролита в следующей последовательности:
37. Особенности электролиза водных растворов
электролитов на активных электродах и использование в
технике: электрорафинирование.
пр. эл-за см. в б. 36.
Практическое применение эл-за – электрорафинирование –
электролизная очистка металлов от примесей. Схема:
38. Электролиз расплавов и использование в технике:
получение щелочных металлов.
Поскольку активные металлы из водных р-ров не
восстанавливаются, вместо них используются расплавы. В случае
электролиза расплавов электролитов реакции, связанные с
разложением воды, исключаются. Последовательность разряда
ионов зависит от их активности и концентрации.
39. Формулировки и математические выражения
законов Фарадея. Электрохимический эквивалент.
Следствия из II-го закона Фарадея. Выход по току.

40. Перенапряжение при электролизе. Факторы,
влияющие на величину перенапряжения (уравнение
Тафеля). Двойственная роль перенапряжения при
электролизе, гальваностегия (конкретные примеры).
Перенапряжение – сдвиг реального потенциала выделения вещ-ва,
по сравнению с его равновесным значением, вызванный
медленной кинетикой процесса. Величина перенапряжения зависит
от: 1) плотности тока по ур-нию Тафеля (η=a+b*lg(i), a,b –
табличные вел-ны), 2) природы выделеляющихся вещ-в,
3) материала электрода.
Перенапряжение играет двойственную роль,т.к. их отриц. действие
это дополнительные затраты электроэнергии при промышленном
получении Н2 и О2 электролитическим способом.Но в некоторых
случаях перенапряжение оказывается полезным,поскольку
проводит такие электрохимические процессы,которые без него
были бы невозможны.Пример:с помощью перенапряжения удается
осаждать из водных растворов Pb,Sn,NI. Гальваностегия — полу-
чение на поверхности изделий тонких металлических покрытий
декоративного и специального назначения.
41. Явление поляризации и перенапряжение при
электролизе. Потенциал (ЭДС) разложения. Расчет Е поляр. и
Е разл. электролита.
Поляризация – смещение величин эл-дных потенциалов от их
равновесных значений. Перенапряжение – сдвиг реального
потенциала выделения вещ-ва, по сравнению с его равновесным
значением, вызванный медленной кинетикой процесса. Накопление
продуктов электролиза на электродах изменяет их природу и
величину электродных потенциалов (химическая поляризация).
При этом в электролизере возникает внутренний
гальванический элемент, ЭДС которого направлена встречно
внешней ЭДС и называется ЭДС поляризации. E
разл
=E
поляр
+η
к
+η
а
.
ЭДС разложения – мин. необходимая разность потенциалов, при
которой эл-з становится возможен. ЭДС поляризации – ЭДС
внутреннего Г.Э., возникающего в результате поляризации эл-дов,
и направленная встречно внешней ЭДС.
Пример решения задачи на расчет Е поляр. и Е разл. (это пример,
при ответе его писать не надо!):
42. Химическая и электрохимическая коррозия металлов.
Коррозия – ф/х или хим. взаимод. между Ме (сплавом) и средой,
приводящее к ухудшению функциональных св-в Ме, среды или
включающей их техн. системы. По механизму протекания бывает:
1) Химическая (окисл. Ме, не сопров. возн. эл. тока в системе),
2) Э/Х коррозия (процесс самопроизвольного анодного окисления
Ме и кат. восст. окислит. среды в рез-те образ. на пов-ти Ме
короткозамкнутого Г.Э. (гальванопары)). Э/Х условие
самопроизвольного протек. коррозии: E>0 (φ
к
>φ
а
), термодин.: ΔG<0.
причины см. в б. 43.
43. Причины и механизм электрохимической коррозии.
Коррозия с водородной и кислородной деполяризацией.
Факторы, влияющие на ее скорость.
Причины Э/Х коррозии: 1) контакт 2-ух Ме в пров. среде (приводит к
образ. макрогальванопары), 2) контакт с прим. другого Ме
(приводит к образ. локальных микрогальванопар), 3) наличие на
пов-ти нарушенных оксидных или солевых пленок, облад. электр.
проводимостью, 4) неодинаковая мех. обработка разл. участков
одного и того же Ме (обраб. часть детали в сравнении с необраб.
частью обладает повыш. запасом эн-гии и большей хим. акт.,
поэтому служит анодом), 5) неравномерная аэрация (насыщ.
кислородом) различ. участков Ме (более окисл. участок Ме
(больший доступ кисл.) явл. катодом. (напр. ржавление мет. тросов
изнутри)). Анодом всегда является металл с меньшим
значением ϕ; катодные участки — это металл или примесные
центры с большим значением ϕ. Таким образом,
электрохимическая коррозия — это анодное окисление металла с
катодным восстановлением окислителя окружающей среды. В
результате окисления анода электроны перемещаются к катодным
участкам и поляризуют их, т.е. уменьшают их потенциалы.
Окислитель среды, связывающий эти электроны, называется
деполяризатором. Если окислителем являются ионы Н + , то
коррозия протекает с водородной деполяризацией:
Если окислителем является О
2
, то коррозия протекает с
кислородной деполяризацией и выражается уравнениями:
Скорость электрохимической коррозии зависит от активности
металла, величины рН электролита, присутствия активаторов
коррозии (О
2
, ионов Cl), температуры, природы катодных участков
и др. Так, например, скорость коррозии с водородной
деполяризацией может быть замедлена снижением
температуры, увеличением рН, очисткой металлов от примесей,
катализирующих выделение Н
2
(Со, Ni, Pt и др.). При кислородной
деполяризации скорость коррозии замедляется при уменьшении
концентрации О
2
(деаэрация), снижении его парциального
давления, введения в электролит восстановителя. Активирующее
действие ионов Сl объясняется их высокой адсорбируемостью
на поверхности металлов, разрушением пассивирующих
оксидных пленок или предотвращением их образования. И
наоборот, вторичные реакции, приводящие к образованию,
например, основных гидроксидов Fe(ОН)
2
или Fe(OH)
3
,
труднорастворимых в нейтральной или щелочной средах, тормозят
коррозионные процессы. Гидроксиды же амфотерных металлов
(Zn, Cr, Sn, Al и др.) нерастворимы только в нейтральных средах,
поэтому для таких металлов опасна не только кислая, но и
щелочная среда.
44. Химические и электрохимические методы защиты от
коррозии.

45. Принципиальные отличия в организации схемы и в работе
г.э.–источника тока и короткозамкнутого г.э. коррозии (на
конкретных примерах).
1) Кат. процессы: на предпол. катоде коррозийной пары восстан. ок-
тель среды.
2) Отсутствие внешней цепи: в рез-те окисл. анода, эл-ны не
покидают Ме, а перемещаются внутри него к катодным участкам.
с примерами туго(
46. Основные положения квантово-механической модели
строения атома.
Основные положения:
1.в-ва состоят из молекул. Молекула наименьшая частица в-ва
определяющая его свойтсва. Состоит из одинаковых или разных
атомов.
2.Атом-наименьшая хим частица являющаяся пределом хим
разложения любого в-ва.
3.молекулы и атомы непрерывно движуться.
4.молекулы сохраняются при физических явлениях и разрушаются
при хим реакциях.
5.хим р-ции особый вид движения атомов заключающийся в их
перегруппировке.
Развитие совр. теории строения атома начиналось с модели
Резерфорда:
1. центре атома находится положительно заряженное ядро, оно
занимает ничтожную часть пр-ва внутри атома.
2.Вокруг ядра вращаются по стационарн. круговым орбиталям
электроны, их число опр. положительным зарядом ядра атома.
Недостатки модели: электрон, двигаясь вокруг ядра с ускороением,
согласно электромагнитной теории, должен непрерывно излучать
энергию и упасть на ядро.
Непрерывное излучение энергии должно давать сплошные линии в
спектре, полученные к тому времени спектры испускания атома Н2
имели 3 серии линий,т.е. были дискретны.
Модель строения атома Нильса Бора(1913) объеденяет
устойчивость планетарной модели атома, спектральн. данные для
атома Н2 с позиции квантовой теории(теории квантования Макса
Планка)
Согласно постулатам Бора:
1.В атоме сущ. стационарные орбиты, вращаясь по кот. электрон
не излучает энергию.
2.При переходе электрона с одной орбиты на другую излучается
квант энергии.Энергия всегда излуч. целым числом порций 2hν, 3hν
3.Момент кол-ва движ. вращ-ся электрона пропорционален
квантовому числу, т.е. номеру орбитали. mvR=nh/2π,где n=1,2,3
Рассч. на основе спектр. данных показал радиусы электр. орбит.
относятся как 1/1,1/4,1/9 и т.д.
Немецк. физик Заммерфельд предложил: кроме круговых, электрон
может двигаться и по эллиптич. орбиталям, при этом, почти
одинаковому уровню энергии соотв. число типов, орбит равное n.
Дополнил модель побочным (орбитальным) квантовым числом и
зависимость массы электрона от скорости.
Недостатки модели:нельзя описать строение атомов, более
сложных, чем водород.
В основе совр. квантово механич. модели строени атома, лежат сл.
полож:
1.Электр. имеет двойственную корпускулярно-волновую
природу:как частица обладает массой m и зарядом; в своем диж.
вокруг ядра проявл. волновы
св-ва, характ длиной волны, кот. можно оценивать с помощью
уравн де Бройля
λ=h/mV {E=m*c^2;E=hv;v=c/λ}
Урав. де Бройля объеденяет характ. волнового проц.(λ) и
корпускулярного движения(mv-импульс)
2.Неопред. в пов. электрона.Поскольку электр. обладает
волновыми св-ами, тоего движ. не может быть описано четкой
траект. она «размывается» возникает область неопределенности, в
пределах кот находится электрон.Для электрона применим принцип
неопр-ти Гейзенберга(1927): невозможно одновр. точно определить
и положение эл. в пр-ве и его импульс, минимальн возможн.
неточность равна h.
Δx Δp
͌
=h; Δр-неопр. в величине импульса, Δх-неопр.в полож.
частицы пр-ва.Область пр-ва атома, внутри кот. сущ. наибольшая
веротность нахожд. электрона, назыв. орбиталью.
3.Формы атомной орбитали т.е. формы пов. огранич-ей область с
наиб. веротн. нахожд. электрона, а так же их кол-ва в пределах
электр Уровня опр. квантовыми числами кот. получ. при решении
волн. уравн Шрёдингера.
47. Квантовые числа и уравнение Шредингера. Что
означает термин «волновая функция»? Каков физический
смысл квадрата волновой функции?
Волновая ф-ия Ψ-это характ. электр. она им. опред. знач. в любой
точке пр-ва и формально явл. трехмерным аналогом аплитуды
плоской волны. уравн Шрёдингера:
0)(
8
2
2
2
2
2
2
2
2
UE
h
m
zyx
где E,U – полная и потенциальная эн-гия в данном состоянии; x, y,
z – координаты трехмерного пространства.
Физ. смысл волновой ф-ии закл. в том, что её квант Ψ^2
пропорционален веротности нахождения электрона в
элементарном объеме атома ΔV с координатами x,y,z уравн
Шрёдингера.
49. Многоэлектронные атомы. Основные квантово-
механические законы. Принцип минимальной энергии.
Принцип Паули. Правило Гунда. Правило Клечковского.
Электронные конфигурации атомов.
В многоэлектронных(МЭ) атомах электр. движется не только в поле
собств. ядра, но и в поле других электронов.Внутр. электронные
уровни экранируют электр. внешних уровней от действия ядра,
притяжение внешн. уровней к ядру меньше приятяжения электр.
внутр. уровней.
Принцип мин. энергии:
В невозб. атоме электроны располог. таким образом, чтобы
обеспечивались их наиболее прочная связь с ядром и энергия
атома была мин. Низшие по энергии орбитали заполн первыми, все
послед. энергет уровни будут заполн в строгой посл-ти от 1 до
7,подуровни s->p->d->f
Принцип минимальной энергии справедли только для основн. сост
атома. Если атом наход. в возб. сост. электр. могут быть на любых
его орбиталях.
Принцип запрета Паули:
В атоме не может быть двух электр. с одинаковым набором всех
четырех квантовых чисел. В соотв с принципом Паули, каждая
орбиталь не может содержать более 2-х электронов.
Следствие из принципа Паули:
Емкость уровня равна 2n^2
Емкость подуровн равна 2(2l+1)
Правило Хунда объясняет порядок заполнения электронами
квантового подуровня.
В данном подуровне электроны стремятся занять энергетич. сост.
таким образом, чтобы суммарный спин был максимальным(сначала
по одному электрону на орбиталь, а затем спаривание)
Правило Клечковского
При увеличени заряда ядра атома последовательное заполнение
электронами орбиталей происходит в порядке возрастания
суммы(n+l). При равенстве этих сумм сначала заполняется
орбиталь с меньшим значением n
В соотв с правилом Клечковского, после заполнения электронами
3p подуровней (n+l)=(3+1)=4 заполняется не 3d подуровни,
(n+l)=(3+2)=5, а 4S подуровни (n+l)=(4+0)=4
На подуровне 3p, 3d u 5s сумма (n+l)=5 В этом случае сначала
происходит заполнение подуровня с наим. знач т.е. 3d->4p->5s
Порядок заполн энерг уровней и подуровней без учета возможного
проскока электронов след(фото
Проскоки электронов набл. у тех атомов, кот. имеют на d-орбитали
по 4 и 9 электронов. Это обусловлено более низкой энергетической
конфигурацией d5 u d10 по сравнению с d4 u d9
В тех случаях,когда до таких конфигураций не хватает одного
электрона наблюдается проскок электрона с внешего s-подуровня
на предыдущий d-подуровень
50. Периодический закон Д.И. Менделеева. Периодический
закон, периодическая система элементов Д.И. Менделеева и
электронная конфигурация атомов. Структура
периодической таблицы. Классификация
конструкционных материалов по периодической таблице
элементов: металлы, неметаллы, полупроводники.
Периодич. закон – св-ва элементов и их соед. наход. в периодич.
зависимости от заряда ядра атома или порядкового номера
элемента. Физ. смысл: монотонное измен. зарядов ядер хим.
элементов приводит к повторению электронного строения
последних энерг. уровней элементов, что в свою очередь
определяет переодичность повторений(сходства) свойств хим.
элементов и веществ образованных ими. Электронная
конфигурация атома-это запись распред электронов в атоме по
уровням, подуровням, орбиталям. В первую очередь заполняються
наиболее низкие по энергииуровни и подуровни в соответствии с их
емкостью и квантово-механическими законами.
Для упрощения записи электроно графич. схемы чаще изображают
без учета различия энергет. уровней. Запись электр. конфигурации
атома может быть полной или сокращенной -> указывает
распределение электронов только внешнего уровня: так
электронная конфигурация атома мышьяка As записывается
1S22S22P63S23P64S23D104P3
Сокращенная 4S24P3
Из записи следует: элем находится в 4 периоде(арабская цифра) в
5-й группе(5 электронов на вннешн. энергет уровне), в главной
подгруппе, так как внешний электронный слой содержит только s и
р электроны.
Квантовое сост. атома с наим. энергией называется
нормальным(основным). Квантовое сост. с более высокими
энергиями наз. возбужденным. Возбужденное сост. атома
возникает при переходе электронов с уровней(подуровней) с
меньшей энергией на уровни(подуроовни) с большей энергией.
Атом характ. 3 фундаментальные элементарные частицы: протон, нейтрон, электрон. Ядро заряжено положительно и в нем соср. основная масса атома. Массовое число А-соотв. относит. атомной массе элемента, кот. приведена в периодич. сист., число нейтронов и электронов равно
порядковому номеру.
Электрон имеет 4 степени свободы и для хар. его пов в атоме требуется 4 квантовые числа. Главное квантовое число опр. осн. хар. элект. в атоме, его полн. энерг. т.е. его энерг.уровень.
--n имеет знач. ряда целых чисел
-энергия электр.зависит от расст. электр. до ядра, чем ближе к ядру, тем мешьше энерг.
-при n=1 электр. наход. на 1 энергоуровне и характ наим. велич. энерг.
-чем больше n тем слабее електр. связан я ядром и более емким станов. квантовый уровень
-число знач n опр. емкостью квантового уровня-ко-во подуровней на данном квантовом уровне.
Электр., кот нах. на одинаков. расст. от одинаков. расст. от ядра,образ. 1 электр. слой.
n 1 2 3 4 5 6 7
энерг. уров. K L M N O P Q
Знач. гл. квантового числа n соотв. номеру периода в периодич. сист. Менделеева
Орбитальное квантовое число l характ. форму электр. облака и приним значение от 0 до n-1 .
Орбитальн. квантовое число l опр. структ. слоя(число подуровней), характ. форму электр. облака
L 1 2 3 4 5 6
Подуровни s p d f q h
У реальн. атомов макс. знач. l=3
-s при l=0 (s-подуровень) электронное облако имеет форму шара и не обл. направл в пр-ве
-р-подуровни им. форму гантели, кот. может быть ориент.в напр. осей x,y,z
-d u f подуровни им. более сл. форму
Магнитное квантовое число m, опред простр. направл. электр. облаков под влиянием внешнего магнитн. поля
Приним. любое целочисленн. знач. от –l до +l, через 0
Число возм. квант. знач. магнитн. квант. числа равно 2l+1 и оно равно кол-ву орбиталей на данном подуровне. У подуровня шарообр. формы может быть только 1 проекция имеющ знач 0. Вне зав-ти от формы орбиталь всегда симметр. относит. ядра. Энерг. подуровни возраст. сл. обр.:
Es<Ep<Ed<Ef
Форма орбиталей и направл. играют сущ. роль при образов. хим. связей. Эти два фактора опред. хар. и степень перекрыв. электр. облаков соед. атомов. Спиновое квантовое число m-это число хар. собств. момент кол-ва движен. электр-на-направление вращения электрона вокруг
своей оси-спин. Спин может приним. знач. +1/2 и -1/2 кот. связаны с напр. вращ. Электр. имеющ. одинаков. напр. спинов, наз. параллельными, при противоположном направлении-антипараллельными.
