Шпоры по химии (5/6) (Муллаянов)
Подождите немного. Документ загружается.

1.Строение атома. Модель Резерфорда-Бора.
Строение атома. Модели атомы (Морозова, Резерфорда, Бора)
Атом – это наименьшее кол-во вещества, обладающее хим. св-вами. Атом –исходное состояние
для хим. превращений.
1790-1815 гг. – открыты осн. законы химии 1882 г. – Морозов предложил след. модель строения
атома: атом он представлял в форме куба, внутри кот. находится + q, в узлах – отриц. 1897 г. –
Дж. Томсон открыл
e
. 1909 г. – Р. Малликен определил заряд
e
. 1904 г. – Дж. Томсон
предложил модель строения атома, согласно кот атом можно представить в виде + заряженной
сферы с вкрапленными
e
(«булочка с изюмом»)
1910 г. – в лаборатории Э. Резерфорда в опытах по бомбардировке металлического фольги
-
частицами было установлено, что некоторые
-частицы рассеиваются фольгой. Исходя из
этого Резерфорд заключил, что в центре атома существует + заряженное ядро малого размера,
окруженное е. Такая модель наз-cя «ядерной планетарной моделью». 1900 г. – М. Планк
предположил, что энергия выделяется порциями
h
. 1910 г. – Н. Бор, используя модель
Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой
e
двигаются вокруг ядра не по любым орбитам, а лишь по разрешенным, на кот
e
обладает опред энергиями (квантовая модель Бора)
Постулаты Бора, радиус, энергия, уравнение Бора
Постулаты Бора:
1. Движение
e
ограничено индивидуальной устойчивой орбитой (
e
вращается по
стационарной орбите, при этом
e
не поглощает и не излучает энергию)
2. При переходе
e
с дальней орбиты на нижнюю выделяется энергия. При переходе
e
с
нижней орбиты на верхнюю энергия поглощается
3. Энергия выделяется порциями (квантами), кот. можно рассчитать по уравнению Планка:
22
222
2
22
222
2
2
4
2
nh
em
e
nh
me
e
r
e
E
rm
e
v
r
e
r
mv
FF
центробежнмитцентростре
2
2
2
22
.
2
222
2
22
2
2
222
44
2
n
rm
h
vn
h
rvmn
h
mvr
22
22
2
222
22
44 me
nh
rn
rm
h
rm
e
2
0
nrr
n
[r]=Ангстрем
2
2
2
1
2
422
21
112
nnh
em
EEE
2.Уравнение Шредингера. Следствие из решения уравнения Шредингера.
Принцип неопределенности Гейзенберга. Волновая функция. Волновое ур-е Шредингера
Принцип неопределенности Гейзенберга (1927 г.): невозможно утверждать, что e, имеющий
определенную скорость, находится в той или иной точке пространства. Вероятность нахождения
электрона в определенной области пространства описывается волновой функцией
, которая
характеризует амплитуду волны, как функцию координат электрона. В наиболее простом случае
эта функция зависит от трех пространственных координат и называется орбиталью. Орбиталь –
область вокруг ядра, где нахождение e наиболее вероятно. В 1926 г. Шредингер предложил
уравнение математического описания электронного строения атома в трехмерном пространстве:
0)(
8
2
2
2
2
2
2
2
2
UE
h
m
dzdydx
, где
x, y, z – координаты электрона
m – масса электрона
Е – полная энергия
U – потенциальная энергия
- волновая функция
3.Периодическая таблица Д.И. Менделеева в свете строения атома.
ПСХЭ Д.И.Менделеева.
Свойства химических элементов, а также формы и свойства соединений элементов находятся в
периодической зависимости от q ядер их атомов. Период-последовательный ряд элементов,
размещённых в порядке ↑q атомов, электронная конфигурация кот изменяется от ns
1
до ns
2
np
6
(или до ns
2
у первого периода). Периоды начинаются с s-элемента и заканчиваются р-элементом
(у 1-го периода-s-элементом). Малые периоды содержат по 2 и 8 элементов, большие-18 и 32, 7
период не завершён. Каждый период, кроме 1, начинается щелочным металлом и заканчивается
благородным газом. В ПСХЭ имеется 8 групп, что соответствует max числу е во внешних
подоболочках. Номер группы связан со степенью окисления элементов, проявляемой ими в
соединениях. Группы делятся на главные и побочные. Подгруппы включают в себя элементы с
аналогичными электронными структурами. К главным подгруппам (А) относятся подгруппы
элементов второго периода: Li,Be,B,C,N,O,F и подгруппа благородных газов. К побочным (В)
принадлежат d- и f-элементы. Первые шесть d-элементов (от Sc до Fe) начинают
соответствующие подгруппы от подгр. III (Sc) до подгр.VIII (Fe). В подгр. VIII также
включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги-платиновые металлы. Медь
и ее аналоги, имеющие во внешней s-оболочке по 1е, образуют первую побочную подгруппу.
Лантаноиды и актиноиды (f-элементы) называют семейством и не относят к какой-л группе.
Хим свойства элементов главных и побочных групп значительно различаются. Н-р, в VII группе
главную подгруппу составляют неметаллы F,Cl,Br,I,At, побочную-металлы Мn,Tc,Re. Т.о.,
подгруппы объединяют наиболее сходные м/у собой элементы. Свойства элементов в
подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и
ослабевают неметаллические.
4.Изменение радиуса атомов в пределах одного периода и в пределах одной группы по мере
роста порядкового номера элементов. Объяснение на основе строения атома. 5.Изменение
потенциала ионизации в пределах одного периода и в пределах одной по мере роста
порядкового номера элементов.
Периодичность изменения свойств элементов, радиусов, потенциалов ионизации,
восстановительная способность окислителей, сродство к электрону,
электроотрицательность
В периодах атомные R по мере ↑ заряда , т.к. при одинаковом числе электронных слоев
возрастает q ядра, а следовательно, притяжение им e. Т.е. в периодах R ↑ слева направо. В
пределах каждой подгруппы элементов радиусы атомов ↑ сверху вниз, т.к. возрастает число
электронных уровней. Потенциал ионизации – энергия, кот необходимо применить к атому,
чтобы оторвать 1-ый, 2-ой и т.д.
e
. Пот. ионизации ↑ слева направо и снизу вверх (т.к. с
увеличением порядкового № элемента увел. расстояние внешнего электронного уровня от ядра).
Восстановительная способность характеризуется потенциалом ионизации. Растет слева направо
и снизу вверх. Сродство к электрону - энергия, которая выделяется при присоединении
e
к
атому. Увел. слева направо по периоду и снизу вверх по группе. –среднее арифметическое
суммы потенциала ионизации и сродства к e. По периоду растет слева направо, по группе – снизу
вверх.
ЭО по периоду -> увел, в группе умен.
7.Химическая связь. Типы связи. Краткая характеристика.
Параметры химической связи.
Энергия связи-кол-во энергии, выделяющейся при образовании ХС.[кДж/моль] С ↑кратности
связи Е
св
↑, а её длина . Для многоатомных соединений с однотипными связями за Е
св
принимают её ср значение, рассчитанное делением Е образ соединения из атомов на число
связей. Чем Е
св
↑, тем молекулы устойчивее. Длина связи-межъядерное расстояние. Зависит от
размеров эл оболочек и степени их перекрывания. С l
св
↑Е
св
и ↑ устойчивость молекул.
Прочность связи хар-ся l
св
и Е
св
. Гибридизация эл орбиталей (валентные углы). Идея Полинга:
Если у атома, вступающего в ХС имеются разные атомные орбитали, то в процессе образования
ХС происходит смешение АО, т.е. из разных АО образуются одинаковые АО. Гибридные АО
образуются у 1 атома, имеющего разные орбитали. Гибридизация происходит у орбиталей,
имеющих близкие значения Е. Форма гибридной АО отлич от формы исходной АО. В гибридной
АО Электронная смещена в 1 сторону от ядра при её взаим с АО др атомов происходит мах
перекрывание , кот й приводит к ↑Е
св
. Это повышение компенсирует Е, требуемую на
образование гибр орбитали.
8.Ковалентная связь. Условия ее образования.
Свойства ковалентной связи: насыщаемость, направленность, гибридизация, кратность
Особенностями ковалентной химической связи являются ее направленность и насыщаемость.
Т.к. атомные орбитали пространственно ориентированы, то перекрывание электронных облаков
происходит по определенным направлениям, что и обусловливает направленность ковалентной
связи. Количественно направленность выражается в виде валентных углов между направлениями
химической связи в молекулах и твердых веществах. Насыщаемость ковалентной связи
называется ограничением числа e, находящихся на внешних оболочках, которые могут
участвовать в образовании ковалентной связи. Число связей между атомами в методе валентных
связей называется кратностью связи. Молекула с кратными связями имеет 2 или 3 общие
электронные пары. Если у атома, вступающего в хим связь, имеются разные атомные орбитали
(s, p, d или f), то в процессе образования химической связи происходит гибридизация (смещение)
атомных орбиталей, т.е. из разных атомных орбиталей образуются одинаковые (эквивалентные)
атомные орбитали. Гибридные атомные орбитали образуются у одного атома, имеющего разные
орбитали.
Неполярная связь, полярная связь
Если ковалентная связь образована одинаковыми атомами, например H–H, O=O, Cl–Cl, N
N,
то обобществленные электроны равномерно распределены между ними. Такая связь называется
ковалентной неполярной связью. Если же один из атомов сильнее притягивает электроны, то
электронная пара смещается в сторону этого атома. В этом случае возникает полярная
ковалентная связь. Критерием способности атома притягивать электрон может служить . Чем ↑
у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома.
Поэтому разность характеризует полярность связи. Вследствие смещения электронной пары к
одному из ядер повышается плотность электрического q у данного атома и соответственно атом
получает заряд, называемый эффективным зарядом
. Полярную ковалентную связь с
,
приближающемуся к 1, можно считать ионной связью.
Ковалентная связь. Механизм образования по Льюису.
Хим. связь, образованная путем обобществления пары электронов двумя атомами., наз-ся
ковалентной связью.(КС)
В 1916г Г. Льюис предложил, что устойчивые внешние электронные конфигурации у молекул
могут возникнуть в результате обобществления электронов. Связь, образованная за счет
обобществленной пары электронов, поставляемых по одному от каждого атома,получила
название КС.
Св-ва КС: насыщ-ть, направленность, гибридизация, кратность.
Т.к. атомные орбитали пространственно ориентированы, то перекрывание электронных облаков
происходит по определенным направлениям, что и обуславливает направленность КС.
Насыщаемость КС вызывается ограничением числа электронов, находящихся на внешних
оболочках, кот-е могут учавствовать в образовании КС.
Гибридизация – под этим понятием понимают смещение s- и p- орбиталей, кот-е приводит к
образованию гибридной орбитали.
Тип молекулы Тип гиб-ции Геометр. форма
AB2
AB3
AB4
sp
sp2
sp3
Линейная
Пирамидальная
Тетраэдрическая
9.Ионная связь. Условия ее образования и характеристика.
Ионная связь. ИС-связь м/у ионами, осуществляемая электростатическим притяжением. ИС
возникает при большой разности атомов, н-р м/у катионами s-металлов 1 и 2 групп и анионами
неметаллов 6 и 7 групп(К
2
О,LiF,CsCl). NaCl: атомы с незавершёнными внешними электронными
уровнями. Для заверения вн уровня Na легче отдать 1е, чем присоединить 7, а Cl легче
присоединить 1е, чем отдать 7: Na-e=Na
+
, Cl+e=Cl
-
.Между Na
+
и Cl
-
возникают силы
электростатического притяжения, в результате чего образуется NaCl. Молекулы тлк в
парообразном состоянии. в твёрдом состоянии ионные соединения состоят из закономерно
расположенных + и – ионов. Молекулы в этом случае отсутствуют. Т.к. электрическое поле иона
имеет сферический характер, то не свойственна направленность. Ненасыщаемость, т.к. ион
способен взаимодействовать со многими соседними ионами противоположного знака, число кот
зависит от зарядов ионов и соотношений геом размеров. Т.к. I
иониз
>Е
сродства к е
, то полного перехода
е не бываетчисто ионной связи не существует. Доля ионоости.=2-связь ионная.
10.Координационная и водородная связь. Условия их образования.
Донорно-акцепторная связь. Комплексообразователь, его заряд, заряд комплексного иона.
Электролитическая диссоциация. Комплексные соединения.
Если одна из двух молекул(акцептор) имеет атом со свободными орбиталями, а другая(донор)-
атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное
взаимодействие, которое приводит к образованию ковалентной связи, например:
ClNHHClNH
43
где N в соединении
3
NH
-донор, H в соединении
HCl
-акцептор.
Донорно-акцепторная связь имеет место в комплексных соединениях.
Комплексные соединения - сложные соединения, у которых имеются ковалентные связи,
образованные по донорно-акцепторному механизму. Н-р:
2
4
4
2
3
2
SONHCu
КС состоят из внутренней (в квадратных скобках) и внешней (за скобками) сфер. Внутренняя
сфера наз-ся комплексным ионом. Центральное место в комплексном ионе занимает
комплексообразователь(в данном примере это
2
Cu
). Комп-ями служат атомы или ионы,
имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением
заряда иона и уменьшением его размера. К наиболее распространенным к-ям отн-ся ионы d-элем-
ов VII, VIII, I и II групп периодической табл. эл-ов.Заряд комп-ля = сумме зарядов всех
входящих в него ионов с противополпжным знаком.Заряд комплексного иона = заряду иона
внешней сферы с противоположным знаком.
Электролитическая диссоциация. Пример:
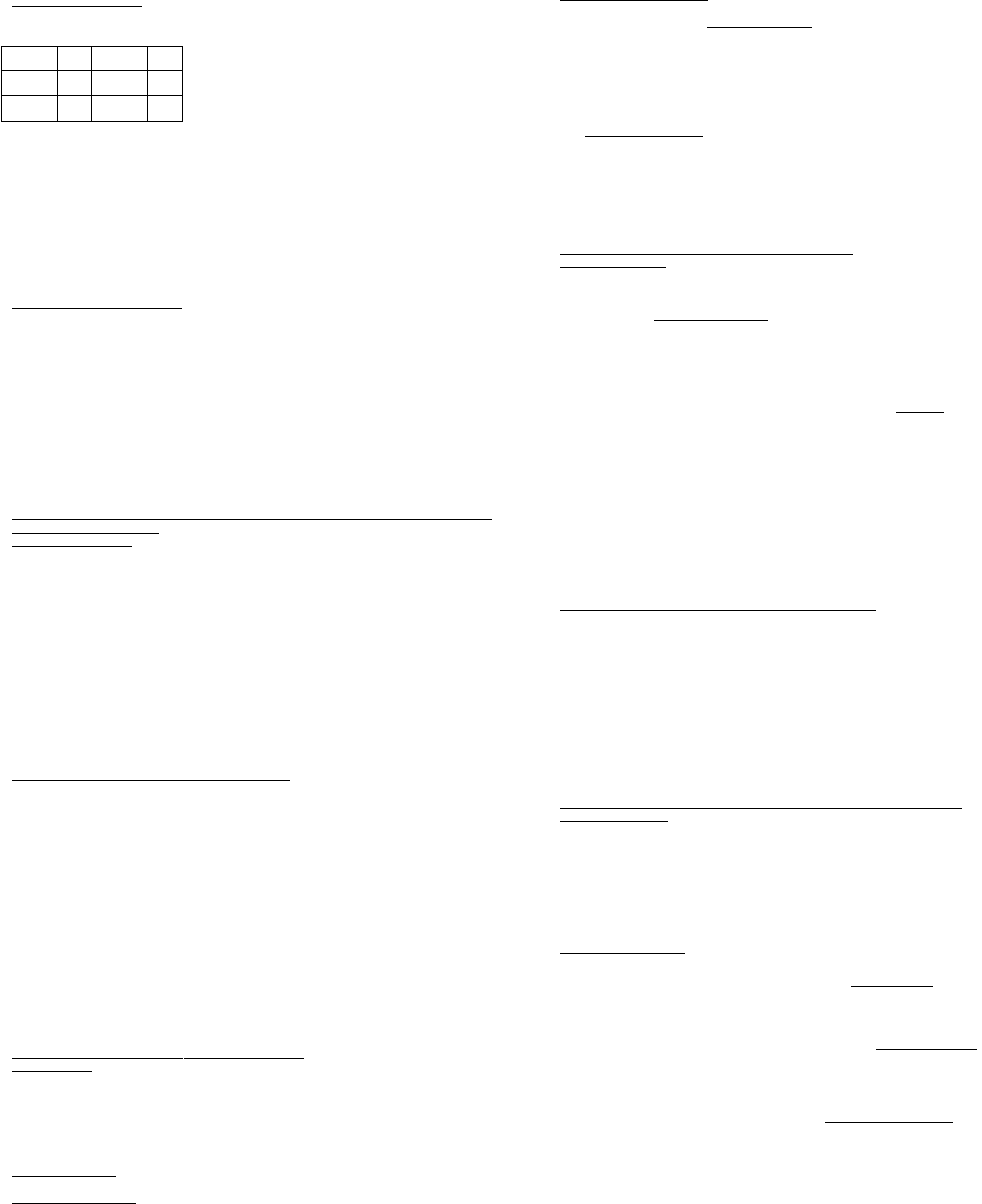
ClOClHNHCr
ClOClHNHCr
2
2
4
3
2
2
2
0
4
3
3
11.Описание ковалентной связи методом валентной связи (ВС).
Метод валентных связей
Метод ВС впервые был использован в 1927 г. В.vГейтлером и Ф.vЛондономв методе ВС
предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара
заселяет орбиталь то одного, то другого атома. Гейтлер и
Лондон показали, что при сближении 2 атомов водорода с
антипараллельными спинами происходит энергии
системы, что обусловлено ↑ электронной плотности в
пространстве между ядрами взаимодействующих атомов.
При сближении атомов с параллельными спинами энергия
системы ↑ и молекула не образуется.
Основные положения метода ВС:
1. Хим. связь между двумя атомами возникает в результате перекрывания атомных орбиталей с
образованием электронных пар
2. Атомы, вступающие в хим. связь, обмениваются между собой электронами, которые образуют
связывающие пары.
3. В соответствии с принципом Паули хим. связь образуется лишь при взаимодействии
электронов с антипараллельными спинами
4. Характеристики хим. связи (энергия, длина, полярность и др.) определяются типом
перекрывания атомных орбиталей
Согласно теории ВС, ковалентная связь направлена в сторону максимального перекрывания
атомных орбиталей реагирующих атомов. Следует отметить, что электронная структура
молекулы значительно отличается от электронной структуры образующих ее атомов.
12.Описание ковалентной связи методом молекулярной орбитали (МО).
Метод молекулярных орбиталей
Согласно методу МО электроны в молекулах распределены по молекулярным орбиталям, кот
подобно атомным орбиталям (АО) характеризуются определенной энергией (энергетическим
уровнем) и формой. В отличие от АО молекулярные орбитали охватывают не 1 атом, а всю
молекулу, т.е. являются двух- или многоцентровыми. В методе МО молекула рассматривается
как единая система.
Правила метода МО:
1. Число МО равно общему числу АО, из которых комбинируются МО
2. Энергия одних МО оказывается выше, другихv– ниже энергии исходных АО. Средняя энергия
МО, полученных из набора АО, приблизительно совпадает со средней энергией этих АО.
3. Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается
принцип запрета Паули и правило Гунда
4. Наиболее эффективно комбинируются АО с теми ОА, которые характеризуются
сопоставимыми энергиями и соответствующей симметрией.
5. Прочность связи пропорциональна степени перекрывания атомных орбиталей.
14.I закон термодинамики. Энтальпия образования химических соединений.
Первый закон термодинамики в применении к изобарному, изохорному, изотермическому,
адиабатическому процессам
I закон термодинамики : теплота, подведенная к системе, тратится на изменение внутренней
энергии и на работу расширения газа
VpUQ
1) изобарный процесс: Р=const
VpUQ
p
2) изохорный процесс: V=const
v
QUV 0
3) изотермический процесс: T=const
VpQTRU
T
0
4) адиабатический процесс:
0Q
Изменение внутренней энергии происходит за счет работы расширения газа
16.II закон термодинамики. Энергия Гиббса. Энтропия.
Энтропия. Самопроизвольное протекание процессов.
Энтропия-ТД ф-я, определяющая меру беспорядка в системе. Логарифмическая ф-я вероятности
существования системы.S
1
=k•lnW
1
S
2
=k•lnW
2
. S=k•ln(W
2
/W
1
). W-число микросостояний, в кот осуществляется
данное макросостояние; вероятность упорядоченной системы. k-const
Больцмана.[S=Дж/(моль•К)] S
г
>S
ж
>S
тв.
Чем
S, тем вещество твёрже. Чем ↑молярная масса, тем ↑беспорядок, тем ↑S.
аА+вВlL+dD+S
298 хр
S
298 хр
=(lS
298 обр L
+ dS
298 обр D
)-(aS
298 обр A
+ bS
298 обр B
)
Самопроизвольные процессы-процессы, протекающие без подвода Е от вн источника. СП в
обратном направлении не могут протекать самопроизвольно. Многие ХР протекают
самопроизвольно(образование ржавчины, растворение соли в Н
2
О, диффузия). Большинство
экзотермических р-й (Н<0) протекают самопроизвольно. Но условие Н<0 не явл критерием
самопроизвольного течения ХР, т.к. самопроизвольные эндотермич ХР, у кот
Н>0(растворение некоторых солей в Н
2
О). Движущей силой самопроизвольного течения
процесса явл стремление частиц к хаотичному движению, а системы- к переходу от более
упорядоченного состояния к менее упорядоченному. Н-р, если 2 сосуда с индивидуальными
жидкостями соединить друг с другом через отверстие, то через некоторое время произойдёт
смешение жидкостей, система из более упорядоченного состояния перейдёт в менее
упорядоченное(смесь жидкостей). Процесс идёт самопроизвольно, если S>0, G<0. Самопр
идут проц в сторону ↑ беспор в системе.
Энергия Гиббса, Гельмгольца. II закон термодинамики.
Энергия Гиббса - критерий самопроизвольного протекания ХР. G=Н-ТS, где Н-теплота,
подведённая к системе; ТS- (энтропийный фактор) бесполезное тепло, тепло, кот переходит к
холодильнику. ХР возможна, если G<0. G>0-р-я не может протекать самопроизвольного.
G=0-р-я обратима. G зависит от хар-ра р-ии(Н и S), от Т. Изменение эн Гиббса системы при
образовании 1 моль вещ-ва В из простых в-в, устойчивых при 298К, наз-ся энерг Гиббса
образования вещ-ва В. G
обр
прост вещ-ва=0. Энергия Гиббса ХР:
aA
(тв)
+bB
(тв)
lL
(ж)
+dD
(г)
+G
298 хр
G
298хр
=(lG
298обрL(ж)
+dG
298обрD(г)
)- (aG
298обрa(тв)
+bG
298обрB(тв)
)
Энергия Гельмгольца: F=Н-TS. Хар-ет направление и предел самопроизвольного течения ХР
при изохорно-изотермических условиях, кот возможно при F<0.
II закон термодинамики : Томсон: невозможно Q какого-л тела превратить в А, не произведя
никакого др действия кроме охлаждения этого тела. В изолированных системах самопроизвольно
идут только такие процессы, еот сопровождаются ↑энтропии: S>0.
19.Скорость химических реакций (гомогенные и гетерогенные).
Влияние cat на скорость ХР.
Cat-вещ-ва, участвующие в хим процессе, изменяя V процесса, но в ре-те выходят в неизменном
виде. "Cat" ввёл Берцелиус. Гомогенный катализ-катализ, при кот реагирующие вещ-ва и cat
находятся в 1 фазе, м/у cat и реагирующими вещ-ми нет поверхности раздела. V
2
+V
3
>V
1
SO
2(г)
+O
2(г)
SO
3(г)
V
1
NO
(г)
+O
2(г)
NO
2(г)
V
2
SO
2(г)
+NO
2(г)
SO
3
+NO V
3
CO+O
2
(H
2
O) CO
2
V
1
CO+O
2
(K
2
SO
4
) CO2 V
2
;V
2
>V
1
При гетерогенном катализе-реагирующие вещ-ва и cat образуют систему из разных фаз. Есть
поверхность раздела. Особенность ГК - протекает на границе раздела сред.
Н
2
О
2(ж)
(Fe
2+
(тв)
) Н
2
О
(ж)
+О
2(г)
Суммарная V химич превращения зависит от S поверхности cat.Все каталитические
гетерогенные реакции включают в себя стадии адсорбции и десорбции. Адсорбция - поглощение
или концентрирование вещ-ва на границе раздела 2 фаз, происходящее самопроизвольно из-за
стремления системы к свободной Е. Рисунок!!!!!!!
24.Классификация дисперсных систем по степени дисперсности и по агрегатному
состоянию.
Дисперсные системы. Коллоидные растворы. Свойства.
Дисперсные системы-системы, в кот 1 вещ-во равномерно распределено в виде частиц в др вещ-
ве. Дисперсная фаза-вещ-во, кот рассеяно в среде. Дисперсная среда-вещ-во, кот образует
сплошную фазу. 3 вида ДС в зависимости от размеров частиц ДФ: истинные р-ры (R<10
-9
м, р-ры
кислот, щелочей, солей), коллоидные р-ры (10
-9
<R<10
-7
), грубодисперсные р-ры (R=10
-7
,
эмульсии, взвеси). Коллоидные растворы - высокодисперсные двухфазные системы, состоящие
из ДС и ДФ, причём линейные размеры частиц ДФ[1…100]нм. Коллоидные частицы состоят из
большого числа молекул или ионов. Коллоидное состояние хар-но для многих веществ, если их
частицы имеют размер [1…500] нм. Суммарная поверхность этих частиц огромна. Характерной
особенностью коллоидных частиц явл наличие на их поверхности q, обусловленного
избирательной адсорбцией ионов. КЧ имеет сложное строение: ядро, адсорбированные ионы,
противоионы, растворитель. Гидрофильные коллоиды - растворитель взаимод с ядрами частиц,
гидрофобные коллоиды- растворитель не взаимод с ядрами частиц. Свойства: Оптические. Если
рассм путь светового луча, проходящего через КР, сбоку на тёмном фоне, то он становится
видимым (конус Тиндаля). Он вызван рассеянием света частицами ДФ и явл следствием
коллоидной степени дисперсности этих частиц. При сильном увеличении каждая частица
кажется светящейся точкой. Частицы ДФ золей по своим размерам< волн лучей видимого
светаони рассеивают свет, но не отражают его. Частицы в грубодисперсных системах
отражают свет. Кинетические свойства КР близки кин св-ам истинных р-в. Для КР хар-но
движение частиц ДФ, вызываемое беспорядочными ударами со стороны молекул среды,
находящихся в тепловом движении. Электрические. 1909 Рейсс набл воздействие const эл тока на
диспергированную в Н
2
О глину: частицы ДФ(глины) перемещались к аноду (электрофорез), где
из-за их большого скопления наблюдалось помутнение р-ра. Частицы ДС(Н
2
О) перемещались к
катоду (электроосмос), где наблюдалось повышение уровня прозрачности жидкости.
Направленное движение частиц к электродам говорило об их q, причём q(ДФ)=-q(ДС).
27.Растворы электролитов. Теория электролитической диссоциации. Степень и константа
диссоциации.
Растворы электролитов. Электролитическая диссоциация.
Сольватация - взаим м/у молекулами и ионами растворяемого вещ-ва и молекулами
растворителя. 1-я стадия: молекулярная диссоциация растворённого вещ-ва. Процесс
молекулярной диссоциации: АВ+(n+m)SAB(n+m)S (1)
AB(n+m)SА
p+
nS+B
q-
mS (2)
Если процесс сольватации протекает до (1), то система представляет собой р-р неэлектролита.
Она характеризуется отсутствием ионов в р-ре и не обладает ионной электрической
проводимостью. Разб р-ры неэлектролитов подчин законам Рауля, Вант-Гоффа. (Н-р, р-р О,
сахара в Н
2
О). Если процесс протекает до (2), то система является р-ом электролита, т.е. имеет
место ЭД с образованием ионов (идея Аррениуса). Уравнение ЭД: АВ+(n+m)SА
p+
nS+B
q-
mS.
Процесс ЭД уксусной кислоты в Н
2
О: СН
3
СООН+(n+m)Н
2
ОСН
3
СОО
-
•nН
2
О+Н
+
•mН
2
О.
Особенностью сольватов как хим соед явл то, что n и m меняются с изменением параметров р-ра.
Пример растворов неэлектролитов-р-ры щелочей, солей в воде. Р-ры электролитов явл ионными
проводниками. В них набл отклонения от законов Рауля, Вант-Гоффа. Диссоциация-химич
процесс распада молекул на ионы.
Степень диссоциации, константа диссоциации, изотонический коэффициент.
Степень диссоциации -отношение числа молекул, диссоциированных на ионы, к общему числу
молекул растворённого электролита. В р-ах некоторых электролитов диссоциирует тлк часть
молекул. Для количественной хар-ки ЭД введено понятие степени диссоциации. По в
растворах электролиты : на 2 группы: =1 и почти не зависит от конц раствора - сильные
электролиты (кислоты HCl, HNO
3
, H
2
SO
4
; щелочи NaOH, Ca(OH)
2
, Ba(OH)
2
, LiOH, большинство
солей); <1 и с ростом концентрации - слабые электролиты (H
2
CO
3
, H
2
S, NH
4
OH, Н
2
О;
основания p-,d-, f-элементов). Одно и то же вещ-во в 1 растворителе может проявлять св-ва
сильного, а в др - слабого электролита. Н-р, хлорид Li и йодит Na при растворении в Н
2
О ведут
себя как сильные электролиты, а при растворении в ацетоне или в уксусной кислоте эти вещ-ва
явл слабыми электролитами. зависит от концентрации и от t. С концентрации ↑, с ↑t ↑.
Константа диссоциации К
д
-константа равновесия для процесса диссоциации. Для процесса
диссоциации кислоты НАН
+
+А
-
HА
АН
дс
(*). Для процесса
диссоциации слабого основания ROHR
+
+OH
ROH
OHR
д
. Н-р, для
гидроксида аммония NH
4
OHNH
+
4
+OH
-
OHNH
OHNH
д
4
4
. К
д
зависит от
природы диссоциирующего вещ-ва и растворителя и не зависит от концентрации р-ра. К
д
указывает на прочность молекул в р-ре. Чем К
д
в данном растворителе, тем слабее
диссоциирует электролит, тем его молекулы устойчивее. Многоосновные слабые кислоты и
основания диссоциируют ступенчато, причём К
д
по каждой следующей ступени всегда на
несколько порядков ниже, чем по предыдущей. В Ур-е =сRT Вант-Гофф ввёл поправочный
А+В
АВ V
1
А+К
АК V
2
АК+В
АВ+К V
3

коэф i, называемый изотоническим коэффициентом и позволяющий использовать это ур-е для
разб р-в:
осм
= iсRT. i хар-ет отклонение от законов идеальных р-в вследствие электролитической
диссоциации электролитов.
Рассм зависимость от концентрации слабого электролита на примере уксусной кислоты:
СН
3
СООНСН
3
СОО
-
+Н
+
. Принимая исх концентрацию кислоты равной с, и степень
диссоциации =, получаем, что концентрация части кислоты, кот диссоциирована, будет
=с. Т.к. при диссоциации 1 молекулы кислоты образуется по 1 иону Н
+
и СН
3
СОО
-
, то их
концентрации будут =с. Концентрация кислоты, оставшейся в недиссоц состоянии, будет
равна с-с=с(1-). Подставим значения равновесных концентраций ионов и кислоты в (*):
V
с
с
с
д
)1(1)1(
2222
, где V=1/с.
28.Электролитическая диссоциация воды. Водородный показатель, pH. Кислотно-основные
индикаторы.
Ионное произведение Н
2
О. Водородный показатель рН.
Процесс диссоциации Н
2
О: Н
2
ОН
+
+ОН
-
, 2Н
2
ОН
+
•Н
2
О +ОН
-
. Н
2
О
+
-ион гидроксония.
К
дис
=[Н
+
][ОН
-
]/[Н
2
О], [Н
+
][ОН
-
] ={К
дис
[Н
2
О]}-ионное произведениеН
2
О.
[Н
+
]=[ОН
-
]=С
Н2О
.
[Н
+
]=[ОН
-
]=1,8*10
-10
*55,5=10
-7
(г*ион/л). С
Н2О
=1000/18=55,5 моль/л.[Н
+
]=[ОН
-
]=10
-7
. Ионное
произведение Н
2
О ↑ с ↑t. рН-взятый с обратным знаком десятичный логарифм активности ионов
Н в растворе. рН=-lg[H
+
]=-lg
H
+
. рОН= -lg
ОH
-
.
Шкала рН:
кислые р-ры [Н
+
]>[ОН
-
]>10
-7
; рН<7;
щелочная среда [ОН
-
]>[Н
+
]>10
-7
; рН>7;
нейтр среда [ОН
-
]=[Н
+
]=10
-7
.
Для определения рН:
индикаторы-вещ-ва, меняющие свою окраску в определённой области рН раствора; слабые
органические кислоты НInd и основания IndOH. НIndH
+
+Ind (равновесие сместится слева
направо);
IndOHInd
+
+ОН
-
.
рН служит критерием силы кислоты и основания. рН имеет важное значение для
жизнедеятельности организма. Отклонение рН от нормальных значений приводит к расстройству
деятельности организма.
29.Малорастворимые электролиты. Произведение растворимости.
Произведение растворимости.
Большинство в-в обл ограниченной растворимостью в воде. ВаSO
4
Ba
2+
+SO
2-
4
. К
дис
=[Ba
2+
][SO
2-
4
]/
[ ВаSO
4
];
К
дис
*[ВаSO
4
]=[Ba
2+
][SO
2-
4
]-произведение растворимости. ПР малорастворимого электролита
равно произведению концентраций ионов данного вещества при стандартной температуре.
30.Гидролиз солей; факторы, влияющие на процесс гидролиза. pH – гидратообразования.
Гидролиз солей.
Солями называются электролиты, при диссоциации кот образуются катионы металлов и анионы
кислотных остатков. Гидролиз солей - разложение солей водой. В результате гидролиза соли в
растворе появляется избыточное количество ионов Н
+
или ОН
-
. Гидролизу не подвергается соли,
образованные сильными кислотами и сильными основаниями. Гидролиз протекает в 3 случаях:
1). Соль сильного основания и слабой кислоты. Сильные электролиты: кислоты HCl, HNO
3
,
H
2
SO
4
; щелочи NaOH, Ca(OH)
2
, Ba(OH)
2
. Слабые электролиты: H
2
CO
3
, H
2
S, NH
4
OH, все
основания d-металлов Fe(OH)
3
, Cu(OH)
2
. (Na
+
NaOH, CO
3
2-
H
2
CO
3
, рН>7)
Na
+
2
CO
2-
3
+HOHNaOH+NaHCO
3
I-я стадия гидролиза,
2Na
2+
+CO
2-
3
+HOH2Na
+
+OH
-
+HCO
-
3
,
CO
3
+HOHOH
-
+HCO
-
3
,
NaHCO
3
+HOHNaOH+H
2
CO
3
II-я стадия гидролиза (H
2
O и CO
2
);
Na
+
+HCO
-
3
+HOHNa
+
+OH
-
+H
2
CO
3
;
HCO
-
3
+HOHH
2
CO
3
+OH
-
(H
2
O и CO
2
). Сильное основание+сильная кислотанет гидролиза. KCl
гидролизу не подвергается. Т.к. процесс гидролиза обратимый, то он не приводит к выводу
продукта.
2). Соль слабого основания и сильной кислоты: (Fe
3+
Fe(OH)
3
, Cl
-
3
HCl, pH<7):
FeCl
3
+3HOHFe(OH)
3
+3HCl,
Fe
3+
+3Cl
-
+3HOHFe(OH)
3
+3H
+
+3Cl
-
,
Fe
3+
+3HOHFe(OH)
3
+3H
+
.
3). Соль слабого основания и слабой кислоты: (Fe
3+
2
Fe(OH)
3
, S
2+
3
H
2
S):
Fe
2
S
3
+3HOH2Fe(OH)
3
+3H
2
S↑.
Полный необратимый гидролиз. Соли слабого основания и сильной кислоты в растворе не
существуют, т.к. происходит полное гидратическое разложение.
31.Коллоиды: отличительные свойства коллоидных систем.
Золи, гели, лиофильные, лиофобные коллоиды.
Коллоидное состояние характерно для многих вещ-в, если их частицы имеют размер от 1 до 500
нм. Суммарная поверхность этих частиц огромна. Поверхностный слой хар-ся поверхностной
энергией и способностью адсорбировать те или иные частицы, в том числе ионы из раствора.
Характерной особенностью коллоидных частиц яв-ся наличие на их поверхности заряда,
обусловленного избирательной адсорбцией ионов. Коллоидная частица имеет сложное строение.
Она включает в себя ядро, адсорбированные ионы, противоионы и растворитель. Существуют
лиофильные (гидрофильные) коллоиды,в кот-ых растворитель взаимодействует с ядрами частиц,
и лиофобные (гидрофобные) коллоиды, в кот-ых растворитель не взаимодействует с ядром
частиц. Лиофильные коллоидные растворы приближаются по св-ам к истинным растворам. Это,
как правило, золи органического происхождения. Коллоидные растворы большинства
неорганических вещ-в имеют лиофобный хар-р. Коллоидный раствор наз-ся золем. При
длительном хранении гидрофильные золи переходят в особое «студнеобразное» коллоидное
состояние. В таком виде их называют гелями. Структура геля такова, что мицеллы не
разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, впутри кот
сохраняетя среда
OH
2
. Гель можно высушить, превратив его в твердый коллоид.
Примером гидрофильного золя может служить золь желатина. При набухании в воде твердого
золя желатина образуется гель. При нагревании геля образуется золь. Все процессы обратимы:
Золь
Гель
Твердый коллоид
Процесс перехода геля в золь наз-ся пиктизацией. Пиктизация присуща только лиофильным
коллоидам.
32.Мицелла. Двойной электрический слой.
Строение мицеллы коллоидов. Оптические и электрические св-ва.
Ядро ч-цы состоит из электронейтрального агрегата ч-ц с адсорбированными ионами элементов,
входящих в состав ядра. Кол-ая ч-ца кроме ядра имеет противоионы и молекулы растворителя.
Адсорбированные ионы и противоионы с растворителем образуют адсорбированный слой.
Суммарно q частицы = разности q адсорбированных ионов и противоионов. Вокруг частиц
находится диф-ый слой ионов,q кот = заряду коллоидной частицы. Кол-ая ч-ца и диф-ый слой
образуют электронейтральную мицеллу. Оптические св-ва. Если рассматривать путь светового
луча, проходящего ч/з прозрачный кол-ый раствор, то он становится видимым. Этот опт-ий
эффект наз-ся конусом Тиндаля. Он вызывается рассеянием света частицами дисперсной фазы
коллоидного раствора и яв-ся следствием коллоидной степени дисперсности этих частиц. При
сильном увеличении каждая частица в конусе Тиндаля кажется светящейся точкой. Размеры и
форму частиц нельзя установить, можно лишь подсчитать их число. Частицы дисперсной фазы
золей по своим размерам меньше волн лучей видимого светаони интенсивно рассеивают
свет, но не отражают его. Частицы в грубодисперсных системах отражают свет, их величину и
форму часто можно установить без оптического увеличения. Эффект Тиндаля можно наблюдать
в темноте при прохождении луча света ч/з запыленное и накуренное помещение. Электрические
св-ва .В 1909 г. Рейсс наблюдал воздействие постоянного эл. тока на диспергированную в воде
глину и на этом основании описал эл. св-ва коллоидных растворов. Частицы дисперсной фазы
(глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение
раствора. Частицы дисперсной среды (воды) перемещались к катоду, где наблюдалось ↑уровня
прозрачной жидкости. Направленное движение частиц к электродам говорило об их q, причем
стало ясным, что дисперсная фаза несет на себе q, противоположный по знаку q среды.
Движение частиц дисперсной фазы к одному из электродов при пропускании ч/з золь const эл.
тока получило название электрофореза, а движение частиц дисперсной среды-электроосмоса.
Электрофорез и электроосмос обусловлены наличием разноименного q у частиц дисперсной
фазы и дисп-ой среды. На границе раздела фаз возникает двойной эл-ий слой, состоящий из
тонкой (адсорбционной) части и протяженной диффузной части. М/у фазами возникает разность
потенциалов (электротермодинамический потенциал).Часть скачка потенциала,обусловленная
диф-ым слоем, наз-ся электрокинетическим или дзета-пот-ом. Эл-кин-ий пот-ал определяется
толщиной и зарядом диффузного слоя, кот зависят от концентрации и q противоионов и t.
