Шпаргалки по биоорганической химии (на укр. яз.) Шпаргалки з біоорганічної хімії
Подождите немного. Документ загружается.

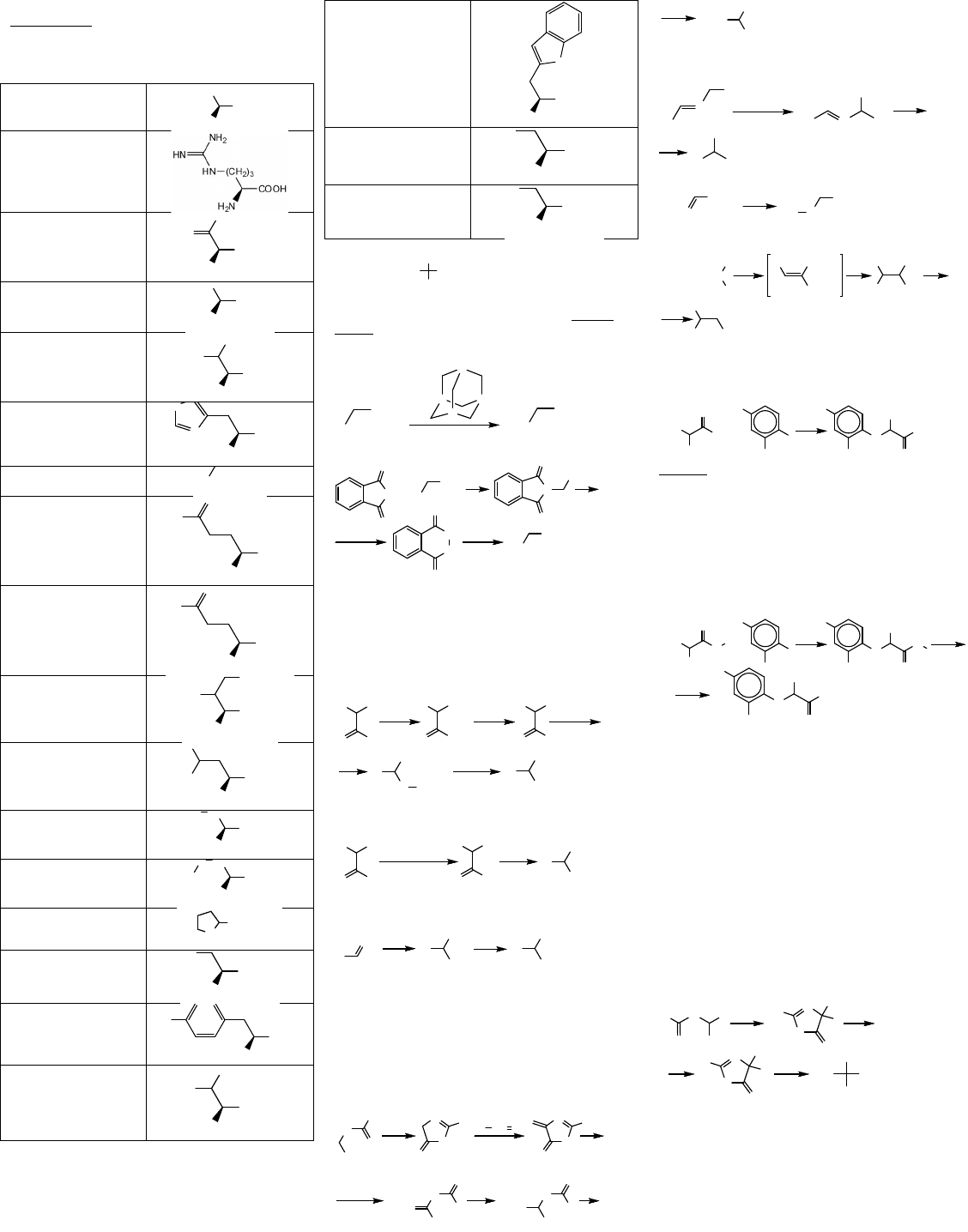
60%
Амінокислоти. Номенклатура Практично всі
природні амінокислоти належать до L-ряду. В
таблиці наведені назви генетично кодованих
(протеїногенних) амінокислот. Назви незамінних
амінокислот виділені жирним шрифтом.
Аланін Ala
COOH
H
2
N
H
3
C
Аргінін Arg
Аспараґін Asn
COOH
H
2
N
NH
2
O
Аспарагінова кислота
Asp
COOH
H
2
N
HOOC
Валін Val
COOH
H
2
N
CH
3
H
3
C
Гістидин His
COOH
H
2
N
HN
N
Гліцин Gly
COOH
H
2
N
Глютамін Gln
COOH
H
2
N
H
2
N
O
Глютамінова кислота
Glu
COOH
H
2
N
HO
O
Ізолейцин Ile
COOH
H
2
N
H
3
C
CH
3
Лейцин Leu
COOH
H
2
N
H
3
C
H
3
C
Лізин Lys
COOH
H
2
N
(CH
2
)
4
H
2
N
Метіонін Met
COOH
H
2
N
(CH
3
)
2
S
H
3
C
Пролін Pro
COOH
N
H
Серин Ser
COOH
H
2
N
HO
Тирозин Tyr
COOH
H
2
N
HO
Треонін Thr
COOH
H
2
N
CH
3
HO
Триптофан Trp
COOH
H
2
N
NH
Фенілаланін Phe
COOH
H
2
N
Ph
Цистеїн Cys
COOH
H
2
N
HS
Для визначення конфігурації використовують L-серин
як стандарт:
COOH
H
2
N H
CH
2
OH
Якщо конфігурація верхнього
тетраедра амінокислоти збігається із конфігурацією L-
серину, то амінокислоту відносять до L-ряду. Хімічн.
синтез α-амінокислоти Амінування за Гофманом α-
галогензаміщених кислот препаративно краще
проводити дією уротропіну з наступним гідролізом:
COOH
Cl
COOH
H
2
N
N N
N
N
1.
2. H
3
O
+
Амінування за методом Габріеля зручніше:
COOH
Cl
COOH
H
2
N
NK
O
O
N
O
O
COOH
NH
NH
O
O
+
NH
2
NH
2
Синтези із алкілацетооцтового та алкілмалонового
естеру: Алкілмалоновий естер амінують хлораміном.
Бромомалоновий естер можна використовувати як
галогензаміщений карбоновий компонент у взаємодії з
Калій фталімідом. Перегрупування Курціуса
Ціанідооцтовий естер переводять у ацилазид, який
перегруповується у етоксикарбоніламін, який легко
гідролізується до амінокислоти:
R CN
O OEt
R CN
O NHNH
2
R CN
O N
3
R
CN
HN COOEt
R
COOH
NH
2
N
2
H
4
HNO
2
C
2
H
5
OH
H
3
O
+
Перегрупування Гофмана. Нітрильну функцію в α-
ціанідкарбоновій кислоті спочатку гідролізують до
амідної, яку перегруповують в аміногрупу за Гофманом:
R CN
O OEt
R CN
O NH
2
R
COOH
NH
2
H
2
SO
4
(конц.)
Br
2
OH
-
Синтез Штреккера Приєднання ціанідної кислоти до
альдімінів, що утворюються із альдегідів та амоніаку,
дає можливість синтезувати цільові амінокислоти:
R
NH
R
NH
2
CN
R
NH
2
COOH
HCN
H
3
O
+
Практично на карбонільні сполуки діють сумішшю
амоній хлориду і Натрій ціаніду, які в реакційному
середовищі утворюють необхідні реагенти. Окиснення
аміноспиртів проводять із попереднім захистом
аміногрупи Калій перманганатом чи біхроматом або
кип’ятінням із КОН в присутності CdO. Азлактоновий
синтез дозволяє одержати α-ароїлалмінокислоти.
Гіпюрова кислота (N-бензоїлгліцин) під дією оцтового
ангідриду зазнає циклізування в азлактон, який легко
конденсується із ароматичними альдегідами:
HN
COOH
O
Ph
O
N
Ph
O
O
N
Ph
O
Ar
ArCH
HN
COOH
O
Ph ArCH
2
HN
COOH
O
Ph
Ac
2
O
-H
2
O
Ar CH O
H
2
O, OH
-
[H]
ArCH
2
NH
2
COOH
H
3
O
+
Алкілування основ Шиффа
гліцину. Під дією дуже сильних основ (t-ButOK)
утворюється карбаніон, що реагує з різними
алкілгалогенідами. Виходи амінокислот – до 90%.
COOH
N
Ph
COOHNPh
R
1. (CH
3
)
3
COK
2. RHal
H
3
O
+
COOHH
2
N
R
H
3
O
+
β-амінокислоти β-аланін
синтезують із акрилової кислоти:
COOH
H
2
C
COOH
CH
2
H
2
N
NH
3
Синтез
Родіонова проводять із малоновою кислотою в
присутності амоніаку:
COOH
COOHR
COOH
COOHR
H
2
C
COOH
COOH
H
2
N
RCHO
+
NH
3
COOH
R
H
2
N
-CO
2
Власт. α-амінокислот Реакції
арилуваня відбуваються із реактивом Сангера (2,4-
динітрофлуоробензеном) із утворенням забарвлених
продуктів, що використовуються для ідентифікації
амінокислот.
R
H
2
N
O
OH
N
H
R
OH
ONO
2
O
2
N
F
O
2
N
NO
2
+
Пептиди Аналіз Визначення амінокислотного складу
проводять, гідролізуючи пептид при рН = 5,7 за
допомогою HCl при 110 °С. При цьому повністю
руйнується Trp, частково Ser, Thr, Cys, a Gln i Asn
перетворюються відповідно у Glu i Asp. Гідролізат
обробляють нінгідрином і хроматографують. Аналіз N-
амінокислотних залишків дозволяє визначити кількість
поліпептидних ланцюгів у молекулі білка. N-кінцеву
амінокислоту визначають за Сангером при реакції
кінцевої α-аміногрупи з 2,4-ДНФ. Пептид гідролізують і
відділяють ДНФ-похідне хроматографічно.
R
1
H
2
N
O
N
H
X
N
H
R
1
H
N
O
X
NO
2
O
2
N
F
O
2
N
NO
2
N
H
R
1
ONO
2
O
2
N
OH
+
H
3
O
+
H
3
O
+
+ other aminoacids
Кращим є дансилхлоридний метод, що передбачає
взаємодію непротонованого N-кінця із дансилхлоридом
(1-диметиламінонафталін-5-сульфохлоридом). При
гідролізі виділяється α-ДНС-амінокислота. Крім того
можуть утворюватися ε-ДНС-Lys та O-ДНС-Tyr. C-
кінцеві амінокислоти визначаються гідразинолізом або
оксазалоновим методом. В першому методі при
нагріванні пептиду чи білку з безводним гідразином при
100-120 °С пептидні зв’язки рвуться із утворенням
гідразидів, коли С-кінцева кислота лишається
незмінною. При гідразинолізі руйнуються Gln, Asn, Cys.
Arg втрачає гуанідинову групу з утворенням орнітину.
Гідразиди Ser, Trh, Gly лабільні і перетворюються у
вільні кислоти, що утруднює інтерпретацію результатів.
Оксазалоновий метод заснований на циклізації С-
кінцевого амінокислотного залишку під дією Ас
2
О. В
лужному середовищі 4-й протон міняється на тритій.
Гідроліз, хроматографія і визначення радіоактивності
дозволяють визначити С-кінець.
H
N R
COOHO
O
N
O
R
H
O
N
O
R
T
H
2
N
R
COOH
T
4
Ac
2
O
T
2
O
OH
-
HCl
H
2
O
X
X
X
Пролін
оксазалону не утворює. Визначення амінокислотної
послідовності за Едманом передбачає послідовне
відділення амінокислот у вигляді фенілтіогідантоїнів,
які утворюються при реакції N-кінця із
фенілтіоізоціанатом:
NH
2
R
1
O
N
H
R
2
O
X
HN
R
1
O
NH
R
2
O
X
NHPh
S
N
H
R
2
O
X
N
S
OH
R
1
PhHN
N
S
R
1
PhHN
O
H
2
N
R
2
O
X
HN N
S
O
Ph
R
PhNCS
pH 9.0-9.5
H
+
CF
3
COOH
H
+
+
H
3
O
+
phenylthiohydantoin derivative
Для підвищення полярності продуктів зараз
використовують п-ізоціанатфенілсульфокислоту.
Пептидний синтез
NH
2
-захисні групи Зняття
Трифтораце-
тильна Tfa
CF
3
CO–
0.2 н. NaOH;
NH
3
·H
2
O
Фталільна Pht
O
O
N
2
H
4
Тозильна Tos
H
3
C SO
2
Na/NH
3
Бензилокси-
карбонільна Z
O
O
H
2
/Pd; HF;
HBr/
CF
3
COOH
трет-
бутилокси-
карбонільна
Boc
O
O
CH
3
H
3
C
CH
3
HF;
CF
3
COOH;
BF
3
·Et
2
O
9-флуореніл-
метилокси-
карбонільна
Fmoc
O
O
Морфолін
або
піперидин в
ДМФА
Фталільну і тозильну групу використовують нечасто
через жорсткі умови зняття. Фталільний захисть
вводять, ацилюючи у водно-лужному розчині
карбетоксифталімідом. Tfa використовують для захисту
лізину. Три останніх групи – уретанового типу. Їх
вводять через хлориди, азиди чи карбонати. Z i Boc
видаляються або каталітичним гідруванням (у випадку
сульфурвмісних пептидів в рідкому амоніаку), або
ацидолізом. Fmoc-група знімається м’яким лужним
гідролізом і широко застосовується у твердофазному
синтезі.
СООН-захисні групи. Естер Зняття
Бензильний
OBzl
PhCH
2
–O– H
2
/Pd, OH
–
трет-
бутильний OBu
t
(CH
3
)
3
С–O–
CF
3
COOH, 0°;
BF
3
·Et
2
O
4-піколільний
OPic
N
O
OH
–
; H
2
/Pd; Na/
NH
3
9-флуореніл-
метильний OFm
O
10% піперидин,
вторинні і
третинні аміни
в ДМФА
Бензильні (і їх похідні) естери утворюються або прямою
естерифікацією захищених амінокислот, або обробкою
бензилбромідом захищених амінокислот в лужному
середовищі. Якщо неможливо застосувати
естерифікацію, використовують каталізатори утворення
естерних зв’язків – DCC і N,N`-карбонілдиімідазол:
COOH
NHX
R
O
NN
N N
R
NHX N
O
N
R
NHX OR
1
O
NHN
+
R
1
OH
+
OBu
t
-естери одержують приєднанням ізобутилену при
кислому каталізі:
COOH
NHX
R
H
2
C
CH
3
CH
3
NHX
R O
OBu
t
+
ОН-захисні групи Зняття
Бензильна Bzl
(Ser, Thr, Tyr)
PhCH
2
– H
2
/Pd;
HF/анізол
трет-бутильна (CH
3
)
3
С– CF
3
COOH, 0°
Bu
t
(Ser, Thr,
Tyr)
2,6-дихлорбен-
зильна Cl
2
Bzl
(Tyr)
CH
2
Cl
Cl
HF/анізол
Цикло-
гексильна cHex
HF/анізол
SН-захисні групи (Cys) Зняття
п-
метоксибензиль
на МBzl
H
3
CO CH
2
HF/анізол;
CF
3
COOH/
Hg
2+
; Na/NH
3
Тритильна Tr Ph
3
C– Солі Hg
2+
,
Ag
+
; I
2
;
CF
3
COOH –
EtSH (1:1)
Ацетамідо-
метанольна
Acm
CH
2
HN
O
CH
3
Солі Hg
2+
, pH
4; I
2
;
Захист імідазольного фрагменту (His) Зняття
Тозильна Tos
H
3
C SO
2
HF/ButOH
(π)-бензокси-
метильна Bom
CH
2
O CH
2
Ph
H
2
/Pd
Гідроксигрупу Ser захищають прямим алкілуванням у
присутності Na/NH
3
або NaH в ДМФА. О-трет-
бутилові етери гідроксиамінокислот утворюються при
обробці вільних амінокислот або їх метилових естерів
ізобутиленом в присутності Η
2
SO
4
, TosOH, BF
3
·Et
2
O. Ο-
Bzl-Tyr одержують алкілуванням Cu-комплексу Tyr
бензилбромідом. При ацидолітичному видаленні
бензольної групи тирозину відбувається побічна реакція
алкілування по кільцю. Для зменшення впливу цього
явища в якості розчинника використовують пастку –
анізол. Значно менш схильні до алкілування 2,6-
дихлорбензильна та циклогексильна групи.
Циклогексильну групу вводять дією циклогексену із
BF
3
·Et
2
O.
Меркаптогрупу цистеїну захищають дією
метоксибензилхлориду чи тритилхлориду в лужному
середовищі. Бензильний захист тут використовують
рідко через жорсткі умови зняття. Ацетамідометильна
група вводиться обробкою цистеїну в кислому
середовищі ацетамідометанолом. Формування
пептидного зв’язку. Азидний метод – метод Курціуса.
NH
R
1
X
HN
O
NH
2
H
2
N
R
2
Y
O
NH
R
1
X
N
3
O
HNO
2
+
pH 7.8
0
o
H
+
N
H
R
1
X
H
N
O R
2
Y
O
Азиди також одержують
дією ізоамілнітриту чи трет-бутилнітриту на гідразиди
в середовищі мало полярного розчинника. Головний
недолік методу – протікання перегрупування Курціуса.
Метод ангідридів (карбодіімідний та ін.). Ангідриди N-
ациламінокислот утворюються при обробці останніх
дициклогексилкарбодиімідом або
ізобутилхлоркарбонатом. Ці ангідриди ацилюють вільні
NH
2
-групи з утворенням пептидного зв’язку:
H
2
N
R
2
Y
O
NH
R
1
X
OH
O
NH
R
1
X
OH
O
2
DCC
-H
2
O
+
DMAP
N
H
R
1
X
H
N
O R
2
Y
O
H
2
N
R
2
Y
O
NH
R
1
X
OH
O
+
N-methylmorpholine
NH
R
1
X
O
O
O
i-BuO
i-BuO COCl
N
H
R
1
X
H
N
O R
2
Y
O
Нуклеїнові основи Синтез Синтез можна починати з
формування піримідинового кільця. Урацил (Ura)
(зустрічається тільки в РНК):
Синтез Ura з яблучної кислоти:
O
OH
OHO
NH
2
OH
2
N
N
H
NH
O
O
+
H
2
SO
4
90
Цитозин (Cyt)
NH
2
NH
2
O
C
O
EtO
N
HN
N
H
O NH
2
O
+
NaOBu
Ці синтези
проводять при кип’ятінні в етанолі. Замість сечовини в
подібних реакціях можуть використовуватись також
іміноестери, амідини і гуанідини. Їх реакційна здатність
по відношенню до карбонільних груп залежить від
нуклеофільності аміногруп. У приведеному ряду вона
зростає:
Синтез Гуаніну (Gua) за Траубе:
Така циклізація із сечовиною приводить до 8-
оксопуринів – похідних сечової кислоти.
Використовуючи замість мурашиної кислоти інші
ацилуючі агенти можна одержувати 8-заміщені пурини.
N
N
NH
2
NH
2
N
N
H
N
NH
2
CH
3
O
N
N
N
H
N
CH
3
Ac
2
O
Сечову кислоту одержують також із урамілу –
амінобарбітурової кислоти, конденсуючи її з
ізоціанатами.
N
N
NH
2
OHHO
OH
N
N
H
N
OHHO
OH
NH
2
O
HNCO
H
+
N
NHO
OH
N
H
N
OH
Піримідинове кільце можна
використати для синтезу аденозину:
NH
2
SH
2
N
CN
CN
N
H
N
H
2
N
NH
2
S
N
N
HN
NH
2
SMe
N
N
N
NH
2
SMe
(CHOAc)
3
CH
2
OBz
O
OBz
OH OH
+
MeONa
MeOH
N
N
H
2
N
NH
2
SCH
3
CH
3
I
CH
3
I
OHC
AcO
H
O
H
OAc
H
CH
2
OBz
Ac
NH
3
N
N
HN
NH
2
R
1
N
N
Ar
N
N
HN
NH
2
O
OBz
OAc OAc
H
2
N
N
2
Cl
Cl
1. Ac
2
O
2. Zn/AcOH
Na
+
HCS
2
-
N
N
HN
NH
2
R
2
H
NH
2
N
S
N
N
NH
2
N
N
R
2
MeONa
MeOH
N
N
NH
2
SMe
N
N
O
OH
OH OH
H
2
/ Reney's Ni
Інший варіант синтезу пуринової системи – від
тимідазолів, наприклад, 5-аміноімідазол-4-карбоксаміду,
з якого одержують гіпоксантин
HN
N
N
H
N
O
H
2
N
O
NH
N
H
2
N
HCONH
2
180
Синтез
заміщеного аденіну (Ade)
Синтез аденіну може бути проведений із HCN:
Нуклеозиди Аденозин, гуанозин, уридин, цитидин,
тимідин. Синтез
NH
2
-захисні групи Зняття
Ацетильна Ас
CН
3
CO–
Конц.
NH
3
·H
2
O
Бензоїльна Bz
(Cyt, Ade)
PhCΟ–
Анізольна An
(Cyt)
H
3
CO
O
Ізобутирильна
Ib (Gua)
OH
3
C
H
3
C
5’-OH-захисні групи Зняття
Тритильна Tr Ph
3
C– Бензенсульф
окислота;
CCl
3
COOH;
CF
3
COOH;
Монометокси-
тритильна
MeOTr
H
3
CO
Ph
Ph
3’-OH-захисні групи Зняття
Ацетильна Ас
CН
3
CO–
Конц.
NH
3
·H
2
O
Бензоїльна Bz PhCΟ–
