Шпаргалка по органической химии
Подождите немного. Документ загружается.

Ароматические УВ Арены.
Ароматические соединения (арены) —
органические соединения с плоской
циклической структурой, в которой все
углеродные атомы создают единую
делокализованную n-электронную систему,
содержащую (4л+2) п-электронов.К АС
относятся прежде всего бензол С
6
Н
6
и его
многочисленные гомологи и
производные.АСмогут содержать в молекуле
одно или несколько бензольных ядер
(многоядерные ароматические соединения).
Строение молекулы бензола С
6
Н
6
.
«ароматичност
и»
В органической химии хорошо известно и
широко используется такое понятие, как
ароматичность некоторых органических
соединений. Термин «ароматичность» связан
прежде всего с бензолом, его гомологами и
многочисленными производными. Этот
термин относится исключительно к структуре
молекул этих веществ, их свойствам, но не
имеет никакого отношения к их запаху.
Ароматичность — общий признак некоторых
циклических органических соединений,
обладающих совокупностью особых свойств.
Наличие единой замкнутой системы п-
элеюпронов в молекуле — основной признак
ароматичности. Ароматические соединения
подчиняются правилу Э. Хюккеля плоские
моноциклические соединения, имеющие
сопряженную систему я-электронов, могут
быть ароматическими, если число этих
электронов равно 4п+2 (где л = 0,1,2,3, 4 и т.д.,
т.е. число я-электронов в молекуле может
быть 2, 6,10,14,18 )Гомологи бензола
получают при его взаимодействии с
алкилгалогенидами в присутствии
галогенидов алюминия.
Номенклатура.
Систематическо
е название всех ароматических углеводородов
— арены, а бензола — бензен. Гомологи
бензола рассматривают как замещенные
бензола и цифрами указывают положение
заместителей:
Однако систематическая номенклатура
допускает название «бензол», а для некоторых
гомологов бензола—тривиальные названия:
винилбензол (I) называют стиролом,
метилбензол (II) — толуолом, ди-метилбензол
(III) — ксилолом, изопропилбензол (IV) —
кумолом, метоксибензол (V) — анизолом.
Ароматические радикалы имеют общее
название — арилы (Аг). Радикал С
6
Н
5
-
называют фенилом (от старого названия
бензола —«фен»), С6Н4 — фениленом, С6Н5-
СН
2
-- бензилом, бензилиденом.
Получение Основными природными
источниками ароматических углеводородов
являются каменный уголь и нефть. Гомологи
бензола можно получать синтетическим
путем.
Галогенопроизводные.
Г. наз. орг.соед-ния, в мол-лах кот-х один или
неск-ко атомов водорода замещены на
галогены. В зав-сти от числа водородных
атомов в УВ, замещенных на галогены,
различают моно- и
полигалогенопроизводные1(ди-).Хар-р
радикала, связанного с галогеном, определяют
предельность или непредельность
галогенопроизводных.
Моногалогенопроизводные предельных УВ
(моногалогеналкилы). Номенклатура. По
систем. номен-ре название
галогенопроизводных составляют из названия
углеводорода и галогена с добавлением
цифры, обозначающей его место в цепи. При
этом цепь нумеруют так, чтобы атом углерода,
связанный с галогеном, получил наименьший
номер. Если имеются и другие заместители, то
их перечисляют в алфавитном порядке.Для
названия простых моногалогенопроизводных
используют номенклатуру радикалов, с
которыми связан атом углерода. Например:
Химические свойства Хим. связь С-Х в
галогеналкилах отл-ся повышенной
полярностью. Это связано со значит.
электроотрицательностью атома галогена,
связанного с углеродным радикалом. Поэтому
в мол-ле галогеналкилов электронная
плотность смещается в сторону атома
галогена, проявляющего индуктивный эффект:
Этим объясняется выс.
реакционная сп-сть галогеналкилов в хим. р-
циях.Галогеналкилы вступают в реакции
нуклеофильного замещения, реакции
отщепления.
1. Реакции нуклеофильного замещения (S
n
).
Поляризованность связи С-Х способствует
замещению галогена X на нукдеофильные реа-
генты.
2 Реакции отщипления.отщепление 2-ух
атомов от одного и того же вещ-ва без
замещения их на другие атомы.
3. Реакции восстановления. При
восстановлении галогеналкилов в присутствии
катализаторов образуются алканы
4. Реакции образования магнийорганических
соединений. Эти соединения получают
взаимодействием магния с галогеналкилами в
среде абсолютного диэтилового эфира.
Дисахариды.
Строение. Олигосахариды (от греч. oligos —
немногочисленный, незначительный) —
сложные углеводы, имеющие сравнительно
невысокую молекулярную массу и схожие с
моносахаридами свойства. Они состоят из
остатков моносахаридов, связанных между
собой гликозид-ными связями. При гидролизе
из олигосахарида образуется несколько
молекул моносахаридов (от 2 до 10). В
зависимости от их числа различают
дисахариды (биозы), гидролизующиеся на две
молекулы монозы, трисахариды (триозы),
гидролизующиеся на три молекулы монозы и
т.д. Если Дисахарид способен из циклической
формы переходить в таутомерную ей альде-
гидную (цепную) форму, которая обладает
восстанавливающими свойствами. Эти
дисахариды называют восстанавливающими.
Если же дисахарид образуется за счет двух
полуацетальных гидро-ксилов (по одному от
каждой молекулы монозы), то он обладает
устойчивым циклическим строением и не
проявляет восстанавливающих свойств. Такие
дисахариды называют
невосстанавливающими.
Дисахариды — твердые или сиропообразные
вещества, хорошо растворимые в воде.
Обладают сладким вкусом.
Химические свойства. Химические свойства
невосстанавливающих дисахаридов
определяют гидроксильные группы, а
восстанавливающих — еще и альдегидная или
кетонная группа. Дисахариды легко
гидролизуются при нагревании с водными
растворами минеральных кислот или при
действии ферментов.
Диеновые углеводороды (Алкадиены)
CnH2n-2
Диеновые УВ (алкадиены) – это УВ, в
молекулах которых между атомами углерода
имеются две двойные связи.
CH2 = CH – CH = CH2 1,3
бутадиен
2-метил-1,3
бутадиен или изопрен
Химические свойства
Реакция присоединения галогенов
CH2 = CH – CH = CH2 + 2Br2
CH2Br – CHBr – CHBr – CH2Br
1,2,3,4-тетрабромбутан
Диены применяются в
производстве каучуков.
Природный каучук
Каучуки – природные или
синтетические продукты полимеризации
некоторых диеновых углеводородов с
сопряженными связями.
Его получают из млечного сока
дерева гевея.(C5H8)n– природный
изопреновый каучук. В основе природного
каучука находится изопрен. Каучук – это
природный полимер. Макромолекулы
натурального каучука состоят из остатков
молекул изопрена. Полимеризацию изопрена
можно отобразить следующим образом
Природный каучук –
стереорегулярное строение (цисизомерия).
Химические
свойства
Вулканизация каучука
При нагревании каучука с серой
происходит образование дисульфидных
связей между макромолекулами каучука по
месту разрыва некоторых двойных связей, при
этом образуется резина («сшивание»
линейных молекул).
Применение Шины, обувь,
ткани, ленты, ремни, трубки,
строительные материалы,
электротехника.
Жиры.
жиры – смеси сложных эфиров, образованных
трехатомным спиртом – глицерином и
высшими к-тами. В образовании сложных
эфиров, входящих в состав жира, могут
принимать участие разные высшие
карбоновые к-ты, но из спиртов только один –
глицерин. Поэтому эти эфиры наз-ют
глицеридами (ацилглицеринами). Общ.ф-ла
жиров имеет вид
Н
2
С –О – СО – R
\
НС – О – СО – R
\\
Н
2
C – О – СО – R
\\\
,
Где R
\
, R
\\
,R
\\\
- радикалы высших карбоновых
к-т, входящих в состав жира. В состав жиров в
основном входят триглицериды –
производные глицерина, остаток к-рого связан
с тремя остатками высших к-т (ацилами), но в
жирах могут присутствовать и ди- и даже
моноглицериды
Называя глицериды, вначале нумеруют
углеродные атомы в остатке глицерина, а
затем указывают положение и название
заместителей с добавлением слова
«глицерин».
Основные источники жиров и масел –
животные и растительные организмы. Из них
жиры и масла выделяют вытапливанием
(нагреванием животных тканей), отжимом
(прессованием нагретых семян) и
экстрагированием (растворением жиров в
хим.растворителях с последующим
извлечением).
Жиры имеют маслянистую консистенцию
(твердую или жидкую). Жиры не
растворяются в воде, но растворимы во
многих органических растворителях.
Химич.св-ва.1)гидролиз (омыление жиров).
Под действием воды при высокой темп-ре и
давлении или в присутствии минеральных к-т,
а также щелочей или ферментов (липазы)
происходит процесс расщепления жиров, в
рез-те к-рого образуются глицерин и высшие
карбоновые к-ты. Если омыление жира
проводят водным р-ром щелочи, то вместо
свободных к-т получают их соли – мыла.
2)окисление жиров. Растительные масла,
содержащие глицериды непредельных к-т (с
двумя или более двойными связями), легко
окисляются кислородом воздуха, образую
тонкую прозрачную пленку – линоксин. Такие
масла стали называть высыхающими и широко
использовать в лакокрасочной пром-ти.
3)гидрогенизация жиров (гидрирование).
Жидкие масла можно перевести в твердые –
жиры. Процесс насыщения водородом
двойных связей проводят в присутствии
катализатора – мелкораздробленного никеля.
Полученные твердые жиры (саломас, или
комбижир) используют для произв-ва
пищевого продукта – маргарина и для
техничесих целей. Маргарин получают в
основном отверждением растительных масел –
их гидрогенизацией.

Кл-ция орган. соед-й
классификация орг. соединений по
углеродному скелету:
1.Ациклические соединения – соединения с
открытой цепью углеродных атомов. Она м.б.
прямой или разветвленной.2.Циклические
соединения – соединения, в кот-х углеродные
атомы образуют циклы.1)карбоциклические
(алициклические и ароматические),
2)гетороциклические – циклы содержат
гетороатомы.
По функциональным группам . классы
орг.соед:спирты, кетоны, альдегиды, фенолы,
карбоновые к-ты, нитросоед,амины, галогены
Карбоновые к-ты.
Высшие жирные кислоты. К ним относятся
предельные и непредельные карбоновые
кислоты с открытой цепью атомов углерода,
содержащие 16, 18 и более С-атомов; такого
рода кислоты входят в состав природных
жиров. Важнейшими являются предельные
кислоты пальмитиновая С15Н31СООН, или
CH
3
(CH
2
)
14
COOH, и стеариновая
C
17
H
35
COOH, ИЛИ CH
3
(CH
2
)
16
COOH, а также
непредельная С
17
Н
33
СООН, или
СН
3
(СН
2
)
7
СН=СH(СН
2
)
7
СООН — олеиновая
кислота. Высшие предельные кислоты —
воскообразные вещества, непредельные —
жидкости (напоминающие растительное
масло). Натриевые и калиевые соли высших
жирных кислот называются мылами
(например, C
17
H
35
COONa — стеарат натрия,
C
15
H
31
COOK — пальмитат калия и т. д.).
Натриевые мыла — твердые, калиевые —
жидкие.
Бензойная кислота
простейшая одноосновная кислота
ароматического ряда. Бесцветные кристаллы
(пластинки) (темп, плавл. 121,5°С).
Антисептик. Применяется для
консервирования пищевых продуктов, а также
во многих органических синтезах.
Щавелевая кислота НООС—СООН —
простейшая двухосновная карбоновая кислота.
Кристаллическое вещество (безводная —
темп, плавл. 189 °С; дигидрат С
2
Н
2
О
4
.
2Н
2
О—
темп, плавл. 101,5°С); растворяется в воде;
ядовита. В виде кислой калиевой соли со-
держится во многих растениях. Применяется
при крашении тканей.
Органическая химия-химия соед-й
углерода. Состав орган. соед-й. элементы
органогены. Многообр-ие соед-й углерода.
Все вещества химики делят на два больших
класса — на орган и неорганические.
Органические вещества, в отличие от
неорганических, всегда содержат в молекулах
один или несколько (часто — очень много)
атомов углерода. Т.о., основным и
обязательным элементом, входящим в состав
органических веществ, является углерод.
Поэтому такие вещества изучает особая наука
— органическая химия, Кроме углерода
органические вещества почти всегда содержат
водород, довольно часто — кислород, азот и
галогены, несколько реже — серу, фосфор и
некоторые металлы. Если в углеводородах
один или нескольк атомов водорода заместить
на другие атомы или группы атомов, то можно
получить разнообразные производные
углеводородов. Следовательно, органическую
химию можно определить как химию
углеводородов и их производных, в состав
которых могут входить почти все элементы
Периодической системы.
сырьеве ист-ки получ орг-их соед
Для получения органических соединений
используют как природные источники, так и
методы синтеза. К первым относятся нефть,
природный и попутные газы, каменный уголь,
торф, сланцы, древесина, продукты лесного и
сельского хозяйства, к вторым —
органический и микробиологический синтезы.
Полисахариды. Крахмал
Аморфный порошок белого цвета,
без вкуса и запаха, плохо растворим в воде, в
горячей воде образует коллоидный раствор
(клейстер). Макромолекулы крахмала
построены из большого числа остатков α-
глюкозы. Крахмал состоит из двух фракций:
амилозы и амилопектина. Соотношение между
амилозой и амилопектином в крахмалах
разных растений различно. В среднем
содержание амилозы – 20-30%, амилопектина
– 70-80%.
Применение крахмала
Крахмал применяется в
кондитерском производстве (получение
глюкозы и патоки), является сырьём для
производства этилового, н-бутилового
спиртов, ацетона, лимонной кислоты,
глицерина и так далее. Он используется в
медицине в качестве наполнителей (в мазях и
присыпках), как клеящее вещество.
Крахмал сравнительно легко
подвергается гидролизу:
(C6H10O)n + nH2O nC6H12O6
(при t и в присутствии H2SO4)
крахмал глюкоза
В зависимости от условий
гидролиз крахмала может протекать
ступенчато, с образованием различных
промежуточных продуктов:
(С6H10O5)n (C6H1005)m
xC12H22O11 C6H12O6
крахмал декстрины
мальтоза (изомер глюкоза
сахарозы)
Происходит постепенное расщепление
макромолекул
Простые и сложные белки.
Белки – сложные высокомолекулярные
орг.соединения, молекулы кот-х построены из
остатков α-аминокислот. По хим. составу
белки делятся на простые – при гидролизе
распадаются на аминокислоты, и сложные –
образуются при гидролизе аминокислоты и
вещ-в не белковой природы(углеводы, нукл.
кислоты);это соед. белкового вещ-ва с
небелковыми. состав их молекул входят:
углерод, кислород, азот, водород, сера. Кроме
того белки могут содержать небольшое кол-во
фосфора, галогенов, металлов. Остатки α-
аминокислот связанных м/у собой
пептидными связями-CO-NH-. Соединения,
построенные из небольшого числа молекул α-
аминокислот, наз-я пептидными.1,2,3.4-
структ. белка. Определенны набор
аминокислотных остатков, их число и
последовательность соединения в
полипептидной цепи определяет основу
строения белков-их первичную структуру.
Устойчивость отдельных витков
цилиндрической спирали обеспечивает
множественными водородными связями, кот-е
возникают м/у атомом карбонильной группы и
водородом аминогруппы. Такое
пространственное расположение
полипептидной цепи наз-ют вторичной.
Спирали сворачиваются в клубки подобно
гибкой спирали электрической плитки. В рез-
те происходит пространственная упаковка
частицы-глобулы. Такое образование относят
к третичной структуре. Пространственное
объединение нескольких полипептидных
макромолекул м/у собой с образованием
единой, большой субмолекулы наз-ся
четвертичная структура. Значение белков.
Белки играют важную биологическую роль,
являясь основным веществом, из которого
построены клетки животных и растительных
организмов. Белки участвуют в важнейших
процессах жизнедеятельности организма –
строительных, каталитических,
энергетических, обменных, защитных. Белки
входят в состав ферментов, гормонов,
нуклеотидов. Хим св-ва. Белки обладают
амфотерными св-ми. В щелочной среде они
проявляют кислотные св-вс, а в кислой –
основные. Многие белки растворяются в воде,
в кислотах и щелочах. Качест.реакции При
обработке белка концентрированным
раствором щелочи и насыщенным раствором
сульфата меди появляется фиолетовое окраш-
ние. Ксантопротеиновая р-ция. действии на
белки конц-ой азотной к-ты появляется желтая
окраска. Она связана с образованием пр-тов
нитрования ароматических ядер,
содержащихся в молекуле белка.
Сульфгидрильная реакция. При нагревании
белков с рас-ом плюмбита натрия выпадает
черный осадок сульфида свинца.
Способы получения карбоновых кислот
j Некоторые К. к. получают из природных
продуктов. Так, щелочным гидролизом
(омылением) жиров получают соли высших
жирных кислот (мыла) и глицерин. Лимонную
кислоту получают из ботвы хлопчатника и из
стеблей махорки (после выделения из них
никотина). Многие К. к. получают
сбраживанием углеводов в присутствии
бактерий определённого вида (маслянокислое,
молочнокислое, лимоннокислое и др. виды
брожения).
Теория хим. строен. орг. соед. Бутлерова
Осн. положения теории А.М. Бутлерова были
опубликованы в 1861 г. в статье «О
химическом строении веществ» 1.Атомы,
входящие в состав молекулы органического
вещества, не находятся в беспорядочном
состоянии, а соединены между собой в
определенной последовательности
химическими связями. назвал химическим
строением.
2.Соединение атомов в молекуле происходит в
соответствии с их валентностью. Свободных
валентностей у атомов в молекуле нет.
3.Свойства вещества зависят от того, в какой
последовательности они соединены между
собой в молекуле (т.е. от
химического строения). является причиной
изомерии.
4.Атомы и группы атомов, входящие в
молекулу, оказывают влияние на химическое
поведение друг друга.
5.Зная свойства вещества, можно установить
его строение и наоборот: химическое строение
органического соединения может многое
сказать о его свойствах.
6.Атомы углерода способны соединяться друг
с другом с образованием углерод-углеродных
цепей различных видов. Эти цепи могут быть
открытыми (прямыми или разветвленными)
или
замкнутыми (циклическими). Цепи могут
содержать одинарные, двойные и тройные
связи.
7.Строение молекулы можно выразить при
помощи структурной формулы, которая для
данного органического вещества является
единственной.
Углеводы.
Углеводы, или сахара – ОС, сод-ие в молекуле
одновременно альдегидную или кетонную
группу и несколько спиртовых групп. Т.е.
углеводы явл-ся многоатомными
альдегидоспиртами или кетоноспиртами.
Нахождение в природе У-в – довольно
обширная группа прир.орг.в-в, кот. играют
большую роль в жизни чел, жив,растений. Они
широко распространены в природе, особенно
в раст. мире, и сост. осн. массу орг. в-ва. У-в
входят в состав нуклеотидов. У-в – один из
основных видов продуктов питания. Все у-в
делят на две группы: 1.Простые у-
в(моносахариды, монозы). В зав. от числа
углеродных атомов в молекуле моносахаридов
различают тетрозы, пентозы, гексозы. Если
моносахариды сод-т альдегидную группу, то
они относ-ся к классу альдоз, если кетонную –
к классу кетоз. 2.Сложные
(полисахариды).Подвергаются гидролизу с
образованием простых у-в. Они дел-ся: 1)
низкомол-ые, сахароподобные у-
в(олигосахариды), растворимы в воде и
сладкие на вкус; 2) высокомол-ые,
несахароподопные у-в, несладкие на вкус и
нерастворимы в воде. В зав. от состава: 1)
гомополисахариды(из остатков одн.
моносахарида); 2) гетерополисахариды.
Монохы С
n
H
2n
O
n
: гексозы С
6
Н
12
О
6
,
пентозыС
5
Н
10
О
5.
Из гексоз наиб. значения
имеют глюкоза(альдегидная группа), и
фруктоза(кетонная гр.). Они имеют одну и ту
же общую формулу, но различное строение,
они изомеры. Моносахариды – тв.
кристаллические в-ва, обычно сладкого
вкуса. Гигроскопичны, хорошо растворяются в
воде, оптически активны. Моносахариды
проявляют св-ва спиртов.
Фенолы.
Фенолы –производные ароматическихУВ,
кислородсодержащие орг.соед, в молекулах
которых ОН-группы связаны непосредственно
с бензольным ядром.
В зависимости от числа ОН-групп
различают одноатомные фенолы (например,
вышеприведенные фенол) и многоатомные.
Среди многоатомных фенолов наиболее
распространены двухатомные:
фенолам свойственна структурная изомерия
(изомерия положения гидроксогруппы).
Физические свойства. Многие фенолы при
комнатной температуре кристаллические
вещества (мета-крезол - жидкость). Они плохо
растворимы в воде, хорошо р-ряются в водных
р-рах щелочей.
Химические свойства. 1. Кислотные св-еа
фенола проявляются в р-циях с щелочными
металлами и щелочами: C
6
H5OH + Na =>
C6H
5
ONa + 1/2Н
2
Т,
С6Н
5
ОН + NaOH => C
6
H
5
ONa + H
2
O. Фенол -
слабая кислота Он выделяется из растворов
фенолятов под действием углекислого газов:
C6H5ONa + СО
2
+ Н2О=> C6H
5
OH + NaHCO
3
.
Кислотные свойства фенолов ослабляются при
введении в кольцо заместителей I рода и
усиливаются при введении заместителя II
рода.
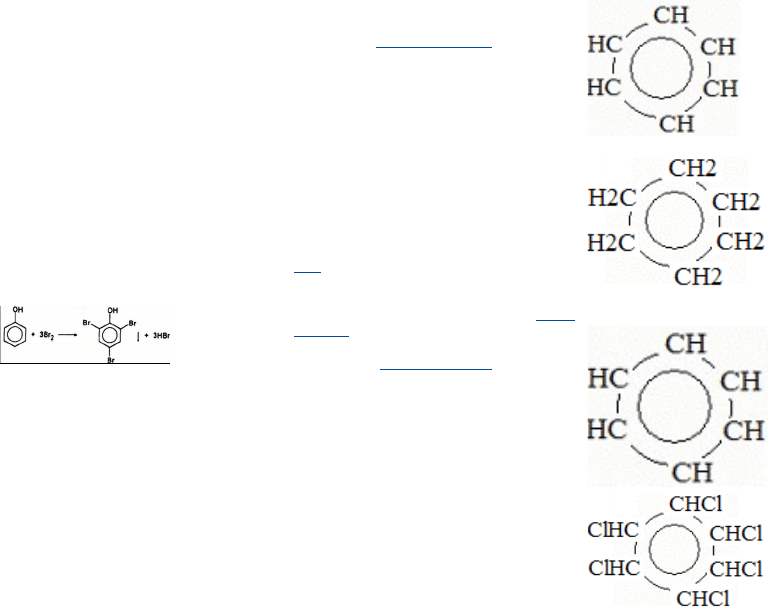
а) Галогвнирование. При действии бромной
воды образуется осадок 2.4,6-трибромфенола:
Это качественная
реакция на фенол.
Применение
Фенол применяется при производстве
фенолформальдегидных смол, в
фармацевтической промышленности и как
антисептик (карболовая кислота). Гидрохинон
(1,4-диоксибензол) – проявитель в
фотографии.
Химические свойства карбоновых кислот
Как правило, К. к. слабее минеральных.
Константы диссоциации одноосновных
насыщенных кислот жирного ряда при 25°С
изменяются от 1,7×10
-4
(муравьиная кислота)
до 1,3
.
10
-5
(высшие гомологи). Сила К. к.
существенно зависит также от
электрофильности радикала, связанного с
карбоксилом. Введение электроотрицательных
заместителей (например, NO
2
, CN, Cl) в
положение, соседнее с карбоксильной
группой, резко повышает кислотность,
например циануксусная кислота CNCH
2
COOH
примерно в 200 раз сильнее уксусной кислоты
CH
3
COOH. По мере удаления от карбоксила
влияние заместителей ослабевает.
Дикарбоновые кислоты сильнее
монокарбоновых, причём влияние одного
карбоксила на другой тем больше, чем они
ближе расположены друг к другу. Так, в ряду
кислот щавелевая кислота HOOC—COOH
сильнее малоновой кислоты HOOCCH
2
COOH,
которая, в свою очередь, сильнее янтарной
HOOC (CH
2
)
2
COOH, и т.д. Кислотность
непредельных кислот выше, чем предельных;
влияние двойной связи тем сильнее, чем она
ближе расположена к карбоксилу. Так,
акриловая кислота CH
2
=CH—СООН в 4 раза
сильнее пропионовой CH
3
—CH
2
—COOH.
Ароматические кислоты сильнее предельных
алифатических (например, константа
диссоциации бензойной кислоты 6,5
.
10
-5
).
j К. к. — жидкие (например, низшие жирные
кислоты) или твёрдые (например, высшие
жирные и ароматические кислоты) вещества.
Низшие члены насыщенных К. к. жирного
ряда хорошо растворимы в воде, средние
члены (C
4
— C
10
), а также ароматические
кислоты — ограниченно, высшие жирные
кислоты в воде не растворимы; как и
ароматические кислоты, они хорошо
растворяются в спирте, эфире, бензоле.
j Наиболее важные химические свойства К. к.
— способность превращаться в производные.
При взаимодействии с основаниями К. к. дают
соли:
RCOOH + NaOH ® RCOONa + H
2
O.
При действии на К. к. спиртов в присутствии
минеральных кислот легко образуются эфиры
сложные:
RCOOH + R'OH ® RCOOR' + H
2
O;
при действии галогенангидридов минеральных
кислот (например, PCl
3
, POCl
3
, SOCl
2
)—
галогенангидриды К. к. RCOX (X — атом
галогена). При нагревании кислот с
водоотнимающими средствами получаются
ангидриды К. к. (RCO)
2
O.
Химические свойства ароматических УВ
Химические свойства
I. Реакции замещения
1. Взаимодействие с галогенами
C6H6 + Br2 C6H5Br + HBr (в присутствии
FeCl3)
2. Взаимодействие с HNO3
C6H6 + HONO2 C6H5NO2 + H2O (в
присутствии H2SO4)
нитробензол
II. Реакции присоединения
1. Гидрирование (присоединение Н2)
+3H2
2. Присоединение
галогенов
+3Cl2
III. Реакции окисления
1. Горение
2C6H6 + 15O2 12CO2 + 6H2O
2. Бензол стоек к действию окислителей.
Окисляются только гомологи по боковой
цепи.
C6H5 – CH3 + 3O C6H5 – COOH + H2O (в
присутствии KMnO4)
бензойная кислота
Из циклогексана
C6H12 3H2 + C6H6 (при t и катализаторе)
циклогексан бензол
1) Из гексана
C6H14 C6H6 + 4H2 (при t и катализаторе)
2) Из ацетилена
3C2H2 C6H6 (при t и катализаторе)
Применение бензола: получение пластмасс,
красителей,растворителей, бутадиенового
каучука, волокна лавсана, сахарина, анилина,
лекарств, средств для борьбы с вредными
насекомыми и болезнями.
Циклоалканы.
Номенклатура, получение, свойства
Циклоалканы(СnH2n)-насыщенные УВ,
содержащие цикл из 3-ех,4-ех,5-ти и более
атомов С.циклы связаны между собой сигма-
связями.т.е.эти соединения изомерны
этиленовым углеводородам.
циклоалканы,содержащие пяти-и
шестичленные
циклы(циклопентан),составляют основную
массу некоторых сортов
нефти(бакинской)входят в состав эфирных
масел и др.природных соедин.Получение:
циклоалканы выделяют из нефти, некоторых
природных в-в или получают синтетическим
путем.
Действием цинковой пыли в спиртовом
растворе на 1,3-дихлорпропан получают
циклопропан
CH2C CH2
H2C +Zn= H2C / +ZnCI
CH2CI CH2
1,3-дихлорпропан
циклопропан
Циклоалканы в химическом отношении во
многом напоминают алканы. они
сравнительно малоактивны и склонны к
реакциям замещения. но низшие алканы
вступают в реакцию присоединения, которые
связаны с разрывом кольца.
