Попова Н.А., Юшкова А.А., Баймак Т.Ю. Основы молекулярной генетики. Часть 1
Подождите немного. Документ загружается.

11
При образовании молекул белков аминокислоты соединяются
друг с другом прочной ковалентной связью. В химическую реак-
цию вступают карбоксильная группа одной аминокислоты и ами-
ногруппа другой аминокислоты. Связь, образующаяся при этом,
носит название пептидной связи, а аминокислоты становятся
аминокислотными остатками. При соединении двух и более ами-
нокислот в цепочку образуется молекула пептида; пептиды, со-
стоящие из более чем 10 аминокислотных остатков называются
полипептидами.
Пептиды имеют очень важное биомедицинское значение. Мно-
гие гормоны человека являются пептидами; также к этой группе
относятся различные антибиотики и противоопухолевые препара-
ты. Многие природные токсины – яды змей, скорпионов, пчел –
также являются пептидами. Например, яд пчелы содержит пептид
апомин, состоящий из 18 аминокислотных остатков.
Все белки являются высокомолекулярными полипептидами.
Условную границу между крупными полипептидами и белками
обычно проводят в области молекулярной массы 10 000 (или при-
мерно 100 аминокислотных остатков). Средний по размеру белок
содержит около 500 аминокислотных остатков.
В любом живом организме содержатся тысячи белков, выпол-
няющих разнообразные функции. В организме животных белки
составляют около 20 % сырой массы или 80 % сухой массы клет-
ки. Простые белки содержат только аминокислоты (соединенные
пептидными связями), а сложные – еще и неаминокислотные
компоненты (например, ионы металлов и др.).
Белки играют центральную роль в процессах жизнедеятельно-
сти клеток и в формировании клеточных структур. Выполнение
белками их функций возможно только при определенной про-
странственной конфигурации молекул. Поэтому полипептидные
12
цепи подвергаются укладке, приобретая нужную пространствен-
ную структуру. Образование компактной структуры возможно
благодаря возникновению множества внутримолекулярных свя-
зей. Выделяют четыре уровня пространственной организации
белков. Под первичной (I) структурой белка (пептида) понима-
ют последовательность расположения аминокислотных остатков
в белке (или пептиде). Именно первичная структура молекулы
определяет свойства белка и его дальнейшую пространственную
конфигурацию.
Замена всего лишь одной аминокислоты на другую в полипеп-
тидной цепочке может привести к изменению свойств и функции
белка. Классический пример – заболевание, называющееся сер-
повидноклеточная анемия. Заболевание развивается если у содер-
жащегося в клетках крови и отвечающего за перенос кислорода и
углекислого газа белка гемоглобина одна аминокислота (глутами-
новая кислота) заменена на другую (валин). Измененная первич-
ная структура приводит к значительным нарушениям в дальней-
шей укладке полипептидной цепи и, как следствие, белок плохо
справляется со своей функцией, а клетки даже изменяют форму.
В длинной полипептидной цепи возможно свободное вращение
атомов вокруг ряда связей, что делает остов белковой молекулы
очень гибким. Поэтому любая белковая молекула не находится «в
растянутом» состоянии, а моментально принимает более компакт-
ную форму – вторичную (II) структуру, наиболее устойчивую в
водной среде. Её формирование происходит благодаря образова-
нию множества внутримолекулярных водородных связей.
В первую очередь они возникают между близкорасположенны-
ми аминокислотными остатками (между атомами атомом водорода
из аминогруппы и атомом кислорода из карбонильной группы). В
этом случае формируется наиболее распространенная вторичная

13
структура – α-спираль. Типичный белок, образующий α-спираль –
кератин. На один виток его спирали приходится примерно четыре
аминокислотных остатка, шаг спирали составляет 0,54 нм. Боко-
вые цепи аминокислотных остатков располагаются на наружной
стороне спирали. На рисунке 2 изображен схематический вид
α-спирали сверху.
Некоторые белки образуют не спиральную, а складчатую вто-
ричную структуру. В складчатом слое полипептидные цепи почти
полностью вытянуты, а водородные связи формируются между
аминогруппами и карбоксильными группами далеко отстоящих
друг от друга аминокислотных остатков. В формировании склад-
чатых структур может участвовать от двух до пяти соседних по-
липептидных цепей.
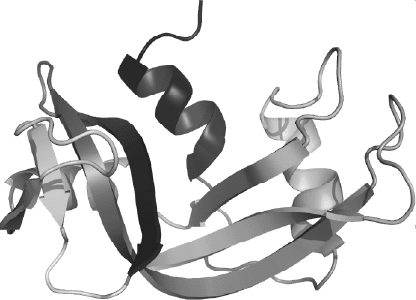
Довольно часто бывает так, что одни участки белковой моле-
кулы принимают форму спирали, другие – складчатую структуру
(рис.3). Кроме того, могут встречаться и участки с нерегулярной
Рис. 2. Схематическое изображение спиральной струк-
туры белка (вид сверху).
Незакрашенные кружки – остов спирали; радикалы амино-
кислотных остатков выступают из спирали, они изображе-
ны закрашенными кружками (масштаб не соблюден).
14
структурой, порой довольно значительные. С точки зрения био-
логической функции неупорядоченные участки столь же важны,
как и упорядоченные.
Третичной (III) структурой называется приобретаемая по-
липептидной цепью конфигурация в результате её свертывания в
пространстве. Формирование третичной структуры обусловлено
возникновением химических связей между различными участка-
ми полипептидной цепи, обычно далеко отстоящими друг от дру-
га в первичной структуре.
Одним из важнейших факторов, определяющих свертывание
полипептидной цепи в третичную структуру, является взаимо-
действие боковых радикалов аминокислот. Гидрофобные стре-
мятся «уйти» от окружающей их воды, а гидрофильные, наобо-
рот, стремятся в водную среду. Такие гидрофобно-гидрофильные
взаимодействия являются одними из основных сил, определяю-
щих третичную структуру белковой молекулы. Иногда третичная
структура «укрепляется» дополнительными ковалентными связя-
ми между радикалами аминокислот. Ковалентные связи наиболее
Рис. 3. Белковая молекула, имеющая участки со спи-
ральной, складчатой и нерегулярной структурой.
15
часто возникают между радикалами аминокислот, содержащих
серу. Кроме того, в молекуле формируются водородные и/или
электростатические связи между радикалами аминокислотных
остатков.
Иногда при формировании третичной структуры возмож-
на утрата части полипептидной цепочки. Например, первичная
структура белка инсулина – одна полипептидная цепь из 109 ами-
нокислотных остатков. К моменту образования третичной струк-
туры из молекулы вырезается большой кусок и остаются только
два участка из первоначальной цепи, длиной в 21 и 30 аминокис-
лотных остатков, удерживаемые друг около друга прочными ди-
сульфидными связями.
Общий результат всех индивидуальных взаимодействий ами-
нокислот состоит в том, что молекула белка принимает характер-
ную для нее третичную структуру (а изначально все это определя-
ется первичной структурой белка.)
Многие белки выполняют свои функции в форме третичной
структуры. Но ряд белков представляет собой объединение не-
скольких одинаковых или разных полипептидных цепей, свя-
занных между собой нековалентными связями. Про такие белки
говорят, что они обладают четвертичной (IV) структурой. От-
дельные полипептидные цепи в таких белках называют субъеди-
ницами. Они удерживаются друг около друга нековалентными
связями, аналогичными тем, что поддерживают третичную струк-
туру. Примером такого сложного комплекса может служить моле-
кула гемоглобина: его четвертичная структура представляет собой
устойчивое образование из четырех субъединиц (2α × 2β).
Иногда в состав четвертичной структуры включаются небел-
ковые компоненты: молекулы углеводной или липидной природы,
ионы металлов. Так, гемоглобин содержит ион железа (Fe
2+
), гор-
16
мон инсулин – ион цинка (Zn
2+
).
Молекулы белка не всегда могут укладываться в спирали, слои
и клубки самостоятельно. Тогда им помогают специальные бел-
ковые молекулы, которые называются шапероны. Этот процесс
происходит в эндоплазматической сети – внутриклеточной систе-
ме мембран и канальцев. Шапероны как бы окружают вновь син-
тезированную молекулу белка, сжимая её то сильнее, то слабее,
способствуя упаковке. Ошибки в укладке молекулы белка очень
опасны для организма, так как могут привести к образованию
прионов, особых инфекционных агентов белковой природы.
Прионы – это белки, отличающиеся от нормальных белков
только третичной структурой. Первичная структура у них может
быть одинакова. Например, прионный белок, вызывающий ко-
ровье бешенство, отличается от нормального тем, что имеет два
спиральных участка вместо четырех, т.е.только третичной струк-
турой. Найдены мутации, приводящие к прионизации белков.
При взаимодействии прионного белка с нормальным структура
последнего тоже искажается и становится прионной. Таким об-
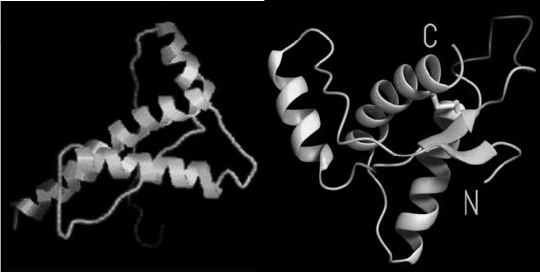
Рис. 4. Схематическое изображение прионного белка,
вызывающего коровье бешенство (1) и нормальной бел-
ковой молекулы (2).
1 2
17
разом, происходит «заражение» всех белков в клетке, в соседних
клетках и далее.
Прионы обладают повышенной способностью вступать в реак-
ции между собой и с другими белками. В результате растворимые
белки переходят в нерастворимое состояние и клетка перестает
нормально работать. Прионы очень устойчивы. Эти белки вы-
держивают кипячение в течение двух часов, не утрачивают своих
свойств и при попадании в органы пищеварения, тогда как обыч-
ные белки утрачивают свою структуру после таких воздействий.
Феномен прионизации белков лежит в основе таких нейродегене-
ративных заболеваний как скрепи овец, коровье бешенство, бо-
лезнь Крейцфельда-Якоба и фатальная семейная бессонница че-
ловека.
Утрата белковой молекулой своей структуры называется де-
натурацией. Связи, поддерживающие пространственную (вто-
ричную, третичную) структуру многих белков, достаточно легко
разрушаются. Это приводит к потере белком биологической ак-
тивности. Денатурация может происходить по разным причинам.
Большинство белков утрачивают свою структуру при нагревании,
обработке кислотами или щелочами, интенсивном ультрафиоле-
товом облучении и так далее. Примерами денатурации являются:
свертывание белка куриного яйца при варке яиц или молочных
белков – при скисании молока; процессы, происходящие при ду-
блении кожи.
Денатурация обратима до тех пор, пока не произошло наруше-
ние первичной структуры белка. Как только условия среды вос-
становятся, молекула вернется к прежнему состоянию. Но раз-
рушение пептидных связей (нарушение первичной структуры)
приводит к необратимой денатурации. Примером последней как
раз является свертывание белка куриного яйца при варке
18
Белки исключительно многообразны. Эта группа молекул за-
нимает неоспоримое первенство, как по разнообразию структу-
ры, так и по выполняемым функциям. Классифицировать белки
можно по различным принципам, мы остановимся на некоторых
из них.
По растворимости белки делят на растворимые в воде (напри-
мер, белки крови: гемоглобин, альбумин) и нерастворимые в воде
(белки покровных и соединительных тканей: кератин, коллаген).
По форме молекулы белки делят на фибриллярные и глобуляр-
ные. Если рассмотреть соотношение продольных и поперечных
осей в молекуле белка, то в том случае, когда оно больше 10, белки
относятся к фибриллярным («нитевидным») белкам. Вторичной
структурой фибриллярных белков обычно служит спираль, как,
например, у кератина или коллагена. Но есть и исключения. На-
пример, вторичная структура фиброина шелка – складчатая. Бла-
годаря этому шелковые нити очень гибкие, а материал гладок на
ощупь.
Если в молекуле соотношение продольной оси к поперечной
меньше 10, то такие белки относятся к глобулярным («сфериче-
ским») – например: гемоглобин, инсулин. Роль каркаса в глобу-
лярных белках часто играет складчатая структура. Глобулярные
белки как правило растворимы в воде.
По составу белки подразделяют на простые и сложные. Про-
стые белки состоят только из аминокислот (например, альбумин),
а сложные наряду с полипептидными цепями содержат и компо-
ненты небелковой природы (например, гемоглобин, содержащий
в своем составе гем – комплексное соединение двухвалентного
железа с порфирином ).
Классификация белков по функциям – одна из основных клас-
сификаций белков. Остановимся на ней подробнее.
19
Структурные белки участвуют в формировании всех клеточ-
ных компонентов (мембраны, внутриклеточный скелет и т.д.), а
так же придают механическую прочность внеклеточным структу-
рам.
В организме млекопитающих преобладающим структурным
белком является коллаген: он составляет 25 % общего белка. Пре-
жде всего, этот белок присутствует в соединительной ткани. Мо-
лекула коллагена представляет собой нить, построенную из трех
спиральных полипептидных цепей. Длина одной молекулы колла-
гена – около 300 нм (300×10
-9
м).
Другой распространенный структурный белок, кератин, яв-
ляется компонентом внутриклеточного скелета, так же из него
построены волосы (шерсть), перья, иглы, когти, рога и копыта
животных. В кератине большая часть полипептидной цепи свер-
нута в спираль, две цепи объединяются в одну двойную. Даль-
нейшее объединение двойных спиралей приводит к формирова-
нию микрофибрилл диаметром 10 нм. Отдельные цепи кератина
скреплены поперечными ковалентными связями, что придает им
дополнительную прочность. Микрофибриллы собираются в ма-
крофибриллы, а сочетание макрофибрилл дает основу волоса.
Эластичность шерсти и волос – результат способности такой вы-
сокоспирализованной структуры раскручиваться.
Белок шелка, фиброин, содержит аминокислотные остатки с
минимальными по размеру радикалами (глицин, аланин, серин).
Вторичная структура фиброина складчатая, полипептидные цепи
почти полностью растянуты, поэтому шелк менее эластичен, чем
шерсть, но очень гибок.
И шерсть, и шелк давно используются человеком. Интересное
применение может получить еще один белковый продукт: паути-
на. Паутинная нить не только очень прочная на разрыв, но и эла-
20
стичная. Эти качества подходят для создания специальных тканей,
из которых можно производить парашюты, бронежилеты и т.п.
Но требуемое количество паутины не поставит ни одна «паучья
ферма», требуется искусственное производство белка паутинной
нити с помощью микроорганизмов. Аналог шелковидной паутины
– материал под названием кевлар – появился благодаря совмест-
ной работе биологов-генетиков и инженеров, специалистов по ма-
териалам.
Белки выполняют роль катализаторов (ферментов). Катали-
заторы – это вещества, ускоряющие протекание химических ре-
акций; они могут претерпевать физические изменения в ходе ре-
акции, но по её завершении возвращаются в исходное состояние.
Ферментами называют катализаторы белковой природы. Большая
часть биохимических реакций в отсутствии ферментов протека-
ла бы крайне медленно. Каждый фермент специфичен – спосо-
бен катализировать только одну биохимическую реакцию (только
очень редко несколько). Около четверти всех известных фермен-
тов содержат ионы металлов, чаще всего это ионы магния (Mg
2+
),
марганца (Mn
2+
) и кальция (Ca
2+
). Иногда ферментам для работы
требуются низкомолекулярные органические соединения – ко-
ферменты. Активность ферментов зависит от таких факторов, как
концентрация фермента и субстрата, температура, кислотность
среды. Практически все биохимические реакции катализируются
ферментами.
Примерами белков-ферментов могут служить разнообразные
пищеварительные ферменты желудочного и кишечного соков.
Другой пример – один из самых распространенных и быстродей-
ствующих ферментов – каталаза. Этот белок присутствует во всех
живых клетках и осуществляет реакцию разложения перекиси
водорода (Н
2
О
2
) до молекул воды и кислорода со скоростью до
