Основы электрохимии
Подождите немного. Документ загружается.


2.03.2010. Лабораторная работа №6. Основы электрохимии.
Цель:
Исследовать окислительно – восстановительные свойства веществ, в состав которых
входят элементы с промежуточной степенью окисления. Ознакомиться с методами
измерения Е гальванического элемента. Определить зависимость Е от концентрации
электролита.
Опыт 1. Окислительно – восстановительные реакции
А) Перекись водорода (H
2
O
2
) как окислитель.
Ход работы.
В пробирку налили 2 мл раствора йодида калия (KJ), добавили 2 – 3 капли раствора
уксусной кислоты (CH
3
COOH), затем прилили 1 мл раствора перекиси водорода (H
2
O
2
).
Схема окислительно – восстановительной реакции:
KJ + H
2
O
2
+ CH
3
COOH → J
2
↓ + CH
3
COOK + H
2
O
Жид жид жид тв жид жид
Наблюдение: выпал осадок коричневого цвета.
2 KJ + H
2
O
2
+ 2CH
3
COOH → J
2
↓ + 2 CH
3
COOK + 2 H
2
O
K + J + H
2
O
2
+
CH
3
COO +
H
→2 J ↓ + CH
3
COO + K + H
2
O
рН<7
щелочная среда
2J – 2e→J
2
1 в-ль, ок-ие
H
2
O
2
+ 2Н + 2e → H
2
O + H
2
O 1 ок-ль, вос-ие
2J + H
2
O
2
+ 2Н → 2H
2
O + J
2
E
0
= φ
0
(окислитель)
- φ
0
(восстановитель)
E
0
= 1,776 В - 0,536 В = 1,24 В
∆G
0
= - nE
0
F
∆G
0
= - 2 * 1.24 B * 96500 А*с * 10
-3
= -239,32 кДж/моль
Б) Перекись водорода (H
2
O
2
) как восстановитель.
Ход работы.
В пробирку налили 2 мл раствора перманганата калия (KMnO
4
), добавили 2 – 3
капли раствора серной кислоты (H
2
SO
4
), затем прилили 1 мл раствора перекиси
водорода (H
2
O
2
).
Схема окислительно – восстановительной реакции:
KMnO
4
+ H
2
O
2
+ H
2
SO
4
→ MnSO
4
+ O
2
↑ + K
2
SO
4
+ H
2
O
Наблюдение: сначала раствор становится разового цвета. Затем KMnO
4
обесцвечивается, выделяется газ.

2KMnO
4
+ 5 H
2
O
2
+ 3H
2
SO
4
→ 2 MnSO
4
+ 5O
2
↑ + K
2
SO
4
+ 8H
2
O
Жид жид жид жид газ жид жид
K
+
+ MnO
4
-
+ H
2
O
2
+
2H
+
+ SO
4
2-
Mn
2+
+ SO
4
2-
+2К + SO
4
2-
+ H
2
O
рН<7
щелочная среда
MnO
4
-
+
8H
+
+ 5е
→
Mn
2+
+ 4 H
2
O 2 ок-ль, в-ие
H
2
O
2
-
2е
→
O
2
+
2H
+
5 в-ль, ок-ие
2MnO
4
-
+
16H
+
+ 5
H
2
O
2
→ 2 Mn
2+
+ 8H
2
O +5 O
2
+
10H
+
E
0
= φ
0
(окислитель)
- φ
0
(восстановитель)
E
0
= 1,510 В -0,630 В = 0,88В
∆G
0
= - nE
0
F
∆G
0
= - 10 * 0,88В * 96500 А*с * 10
-3
= - 849,2кДж/моль
Вывод: мы исследовали окислительно – восстановительные свойства веществ, в
состав которых входят элементы с промежуточной степенью окисления. Атом элемента,
имеющий промежуточную степень окисления, может проявлять как окислительные, так и
восстановительные свойства.
Опыт 6.2. Измерение ЭДС (Е) гальванического элемента
Ход работы.
Собрали гальванический элемент из двух металлических электродов и растворов
электролитов: зачистили наждачной бумагой две металлические пластинки, промыли их
дистиллированной водой, просушили фильтровальной бумагой, опустили электроды в
стаканы с соответствующими растворами солей; соединили электролиты
электролитическим ключом (полоска фильтровальной бумаги, пропитанная насыщенным
раствором KCl); подсоединили электроды с помощью проводов к вольтметру.
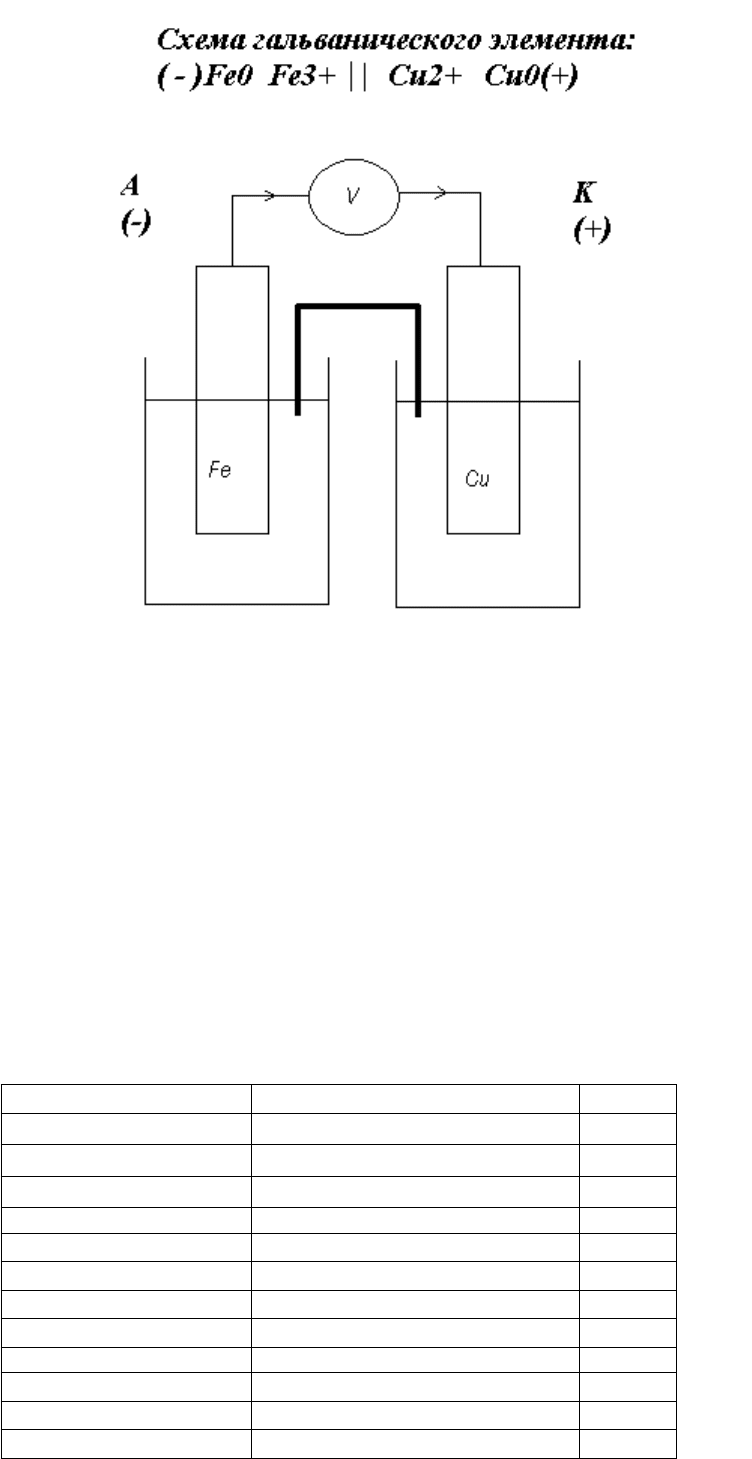
Электродные потенциалы металлов:
φ
0
(Cu
2+
/Cu
0
) =0,337 (В) , φ
0
(Fe
3+
/Fe
0
) =-0,037 (В)
Электродные реакции, протекающие на аноде и на катоде:
n
На аноде: Fe
0
– 3e̅ Fe
3+
, ок-е 6 2
На катоде: Cu
2+
+ 2e̅ Cu
0
, в-е 3
φ (Cu
2+
/Cu
0
) 0,337+0,059/6*lg [Cu
2+
]
φ
1
(Cu
2+
/Cu
0
) 0,337+0,059/6*lg 5*10
-3
0,287
φ
2
(Cu
2+
/Cu
0
) 0,337+0,059/6*lg 5*10
-2
0,304
φ
3
(Cu
2+
/Cu
0
) 0,337+0,059/6*lg 5*10
-1
0,32
Е
теор
= φ (катод)
- φ (анод); Епрак
Е
теор1
0,33383 0,8
Е
теор2
0,35083 0,85
Е
теор3
0,36683 0,85
ΔG
теор.
- n Е
теор
F;
ΔG
теор.1
-193287,57
ΔG
теор.2
-203130,57
ΔG
теор.3
-212394,57
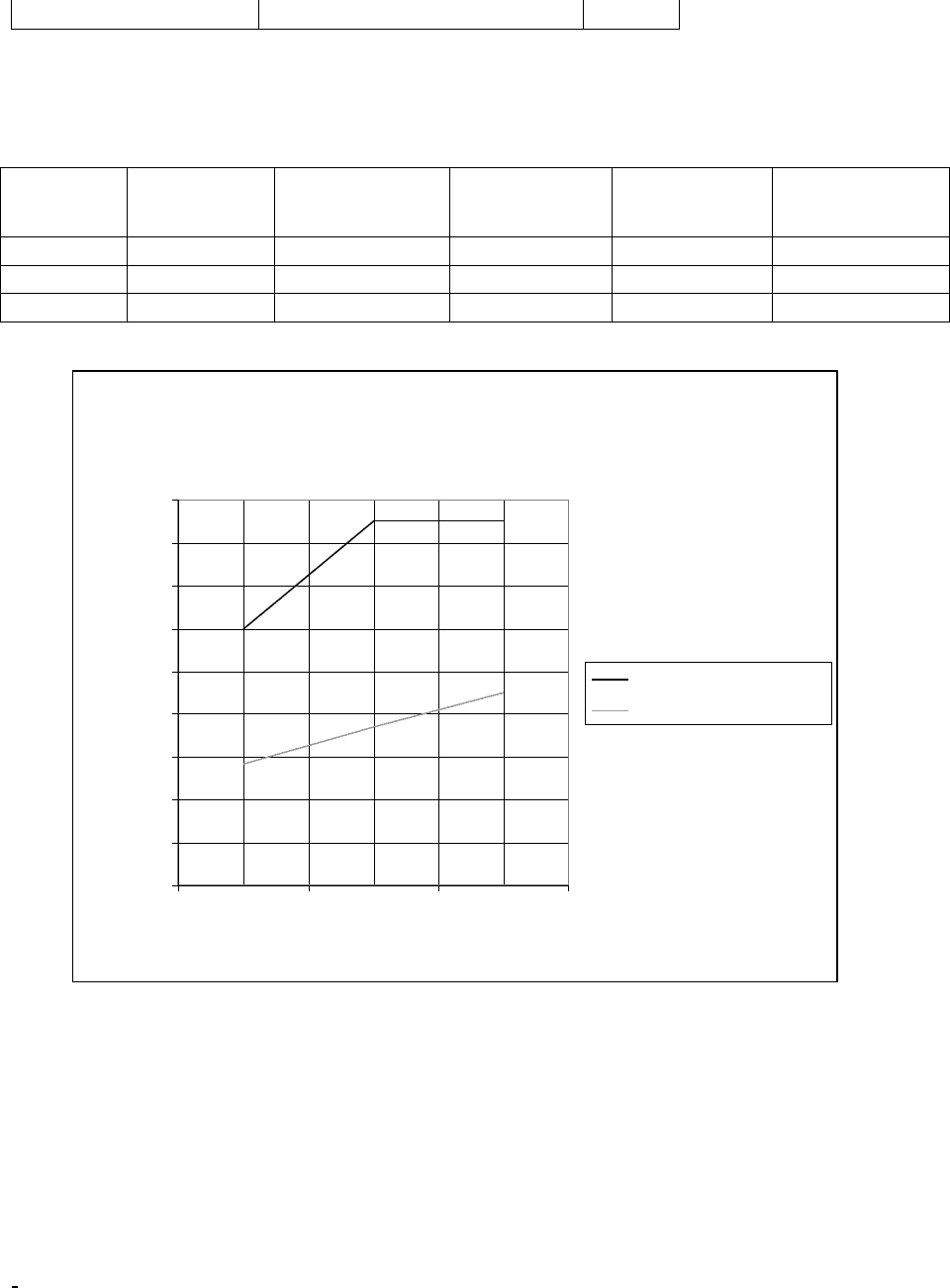
Результаты эксперимента приведены в таблице
№ [Cu
2+
], моль/
л
φ катода, В Е
теор.
, В Е
эксп.
, В ΔG
теор.
,
кДж/моль
1 5*10
-3
0,287 0,3383 0,8 -193,3
2 5*10
-2
0,304 0,35083 0,85 - 203,1
3 5*10
-1
0,32 0,36683 0,85 -212,4
График зависимости ЭДС теоретического от
экспериментального
0,8
0,85
0,85
0,737
0,754
0,77
0,68
0,7
0,72
0,74
0,76
0,78
0,8
0,82
0,84
0,86
0,005 0,05 0,5
концентрация
ЭДС
экспериментальное Е
теоретический
Рисунок
Вывод: ознакомились с методами измерения Е гальванического элемента.
Определили зависимость Е от концентрации электролита.
