Лекции - Термодинамика
Подождите немного. Документ загружается.


МОЛЕКУЛЯРНАЯ ФИЗИКА И ОСНОВЫ ТЕРМОДИНАМИКИ
Электронный учебник по физике
КГТУ-КХТИ. Кафедра физики. Поливанов-М.А.,-Старостина-И.А.,-Кондратьева-О.И.
Для перемещения по тексту электронного учебника можно использовать:
1- нажатие клавиш PgDn, PgUp,, для перемещения по страницам и строкам;
2- нажатие левой клавиши «мыши» по выделенному тексту для перехода в требуемый раздел;
3- нажатие левой клавиши «мыши» по выделенному значку @ для перехода в оглавление.
ОГЛАВЛЕНИЕ
Введение
1. - Молекулярно-кинетическая теория идеальных газов
1.1 Термодинамические параметры
1.2. Уравнение состояния идеального газа
1.3. Основное уравнение молекулярно-кинетической теории идеальных газов и его следствия
1.4. Барометрическая формула
1.5. Закон Больцмана о распределении частиц во внешнем потенциальном поле.
1.6. Распределение Максвелла молекул идеального газа по скоростям
2. Основы термодинамики
2.1. Внутренняя энергия
2.2. Первое начало термодинамики
2.3. Теплоемкость
2.4. Применение первого начала термодинамики к изопроцессам
2.5. Второе начало термодинамики
2.6. Энтропия
3. Явления переноса
3.1. Теплопроводность
3.2. Внутреннее трение (вязкость)
3.3. Диффузия
4. Реальные газы
4.1. Понятие фазы и фазовых переходов
4.2. Уравнение Ван-дер-Ваальса
4.3. Изотермы реальных газов
5. - Жидкости
5.1. Свойства и строение жидкостей
5.2. Поверхностное натяжение жидкостей
5.3. Смачивание. Краевой угол
5.4. Поверхностное испарение и кипение жидкостей
5.5. Жидкие растворы
6. Особенности твердого состояния вещества
6.1. Структура твердых тел
6.2. Физические типы кристаллических решеток
6.3. Теплоемкость кристаллов
6.4. Плавление и кристаллизация
ВВЕДЕНИЕ. @
Молекулярная физика – раздел физики, в котором изучаются свойства тел в различных агрегатных состояниях на
основе рассмотрения их молекулярного строения. Физические свойства макроскопических систем (т.е. систем, состоящих из
очень большого числа частиц) изучаются двумя разными, но взаимно дополняющими друг друга методами – статистическим
и термодинамическим.
Статистический метод основан на использовании теории вероятностей. В этом методе свойства макроскопической
системы определяются усредненными значениями скорости частиц, их энергии и других динамических характеристик.
Например, температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент
времени различные молекулы имеют разные скорости, то температура может быть выражена только через среднее значение
скорости движения. Нельзя говорить о температуре одной молекулы.
Термодинамический метод основан на анализе законов и условий, характеризующих, происходящие в системе
изменения макропараметров типа давления, энергии, энтропии и др. В этом методе не рассматривается внутреннее
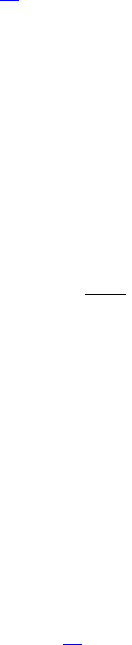
микроскопическое строение изучаемых тел и их изменения. Раздел теоретической физики, в котором изучаются свойства
макроскопических систем и энергетика различных физических и химических процессов, называется термодинамикой. В
основе термодинамики лежит несколько фундаментальных законов (начал), которые являются обобщением многочисленных
наблюдений.
1. -МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
1.1. -Термодинамические параметры. @
Мысленно выделенная макроскопическая система, рассматриваемая методами термодинамики, называется
термодинамической системой. Все тела, не включенные в состав исследуемой системы, называются внешней средой.
Состояние системы задается термодинамическими параметрами (или, по-другому, параметрами состояния) – совокупностью
физических величин, характеризующих свойства системы. Обычно в качестве основных параметров выбирают давление р,
температуру Т и удельный объем v. Различают два типа термодинамических параметров: экстенсивные и интенсивные.
Экстенсивные параметры пропорциональны количеству вещества в системе, а интенсивные не зависят от количества
вещества и массы системы. Интенсивными параметрами являются давление, температура, удельный объем и др., а
экстенсивными – объем, энергия, энтропия.
Объем пропорционален количеству вещества в системе. При расчетах удобнее оперировать с удельным объемом v –
это величина, равная отношению объема к массе системы, то есть объем единицы массы v = V/m = 1/ρ, где ρ – плотность
вещества.
Давлением называется физическая величина
dS
dF
P
n
где dF
n
- проекция силы на нормаль к поверхности площадью
dS.
Температура – это физическая величина, характеризующая энергию макроскопической системы, находящейся в
состоянии термодинамического равновесия. Температура системы является мерой интенсивности теплового движения и
взаимодействия частиц, образующих систему. В этом состоит молекулярно-кинетический смысл температуры. В настоящее
время существует две температурных шкалы – термодинамическая (градуированная в Кельвинах (К)) и Международная
практическая (градуированная в градусах Цельсия (˚С)). 1˚С = 1К. Связь между термодинамической температурой Т и
температурой по Международной практической шкале имеет вид: Т = t + 273,15˚С.
Всякое изменение состояния термодинамической системы, характеризующееся изменением ее параметров, называется
термодинамическим процессом. Термодинамический процесс называется равновесным, если при этом система проходит ряд
бесконечно близких равновесных состояний. Равновесное состояние – это такое состояние, в которое система приходит в
конце концов при неизменных внешних условиях и дальше остается в этом состоянии сколь угодно долго. Реальный процесс
изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается.
1.-2. Уравнение состояния идеального газа. @
В молекулярно-кинетической теории широко используется физическая модель идеального газа. Это вещество,
находящееся в газообразном состоянии, для которого выполняются следующие условия:
1. Собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда.
2. Между молекулами газа отсутствуют взаимодействия, кроме случайных столкновений.
3. Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, т.к. они при условиях, близких к
нормальным (давление р
0
= 1,013∙10
5
Па, температура Т
0
=273,15К) ведут себя аналогично идеальному газу. Например, воздух
при Т=230К и р= р
0
/50 по всем трем критериям подобен модели идеального газа.
Поведение идеальных газов описывается рядом законов.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При
нормальных условиях этот объем равен V
M
=22,4∙10
-3
м
3
/моль. В одном моле различных веществ содержится одно и то же
число молекул, называемое числом Авогадро N
A
=6,022∙10
23
моль
-1
.
Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем
есть величина постоянная pV = const при Т = const и m = const.
Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой р=р
0
(1+αt) при
V = const и m = const.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется линейно с температурой V =
V
0
(1+αt) при р = const и m = const. В этих уравнениях t – температура по шкале Цельсия, р
0
и
V
0
-давление и объем при
0°С, коэффициент α=1/273,15 К
-1
.
Французский физик и инженер Б.Клапейрон и русский ученый Д.И.Менделеев, объединив закон Авогадро и законы
идеальных газов Бойля – Мариотта, Шарля и Гей – Люссака, вывели уравнение состояния идеального газа – уравнение,
связывающее вместе все три термодинамических параметра системы: для одного моля газа рV
М
= RT и для произвольной
массы газа
где V
М –
молярный объем, т.е. объем одного моля газа, R – молярная газовая постоянная, равная 8,31Дж/(моль·К), М –
молярная масса, V= V
М
· m/M – объем всей массы газа, = m/M – количество вещества в молях. Это уравнение называется
уравнением Менделеева– Клапейрона.
Существует еще одна форма записи данного уравнения:
Ее можно получить, если учесть, что k =R/N
A
= 1,38∙10
-23
Дж/К –это постоянная Больцмана, а n =N
A
/V
М
– это концентрация
молекул газа.
Для расчета давления в смеси разных газов применяется закон Дальтона: давление смеси идеальных газов равно
сумме парциальных давлений входящих в нее газов: р =р
1
+ р
2
+ … +p
n
. Парциальное давление – это такое давление,
которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той
же температуре. Для расчета парциального давления идеального газа используют уравнение Менделеева– Клапейрона.
1.-3. Основное уравнение молекулярно – кинетической теории идеальных газов и его следствия. @
Рассмотрим одноатомный идеальный газ, занимающий некоторый объем V (рис.1.1.) Пусть число столкновений между
молекулами пренебрежимо мало по сравнению с числом столкновений со стенками сосуда. Выделим на стенке сосуда
некоторую элементарную площадку ΔS и вычислим давление, оказываемое на эту площадку. При каждом соударении
молекула, массой m
0
, движущаяся перпендикулярно площадке со скоростью υ, передает ей импульс, который представляет
собой разницу импульсов молекулы до и после соударения:
m
0
υ -(-m
0
υ) = 2m
0
υ.
За время Δt площадки ΔS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием ΔS и длиной
υΔt. Это число молекул будет nυΔSΔt, где n – концентрация молекул. Необходимо, однако, учитывать, что реально молекулы
движутся к площадке под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении
меняется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно
перпендикулярных координатных осей, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем
половина – 1/6 – движется в одну сторону, половина – в противоположную. Тогда число ударов молекул, движущихся в
заданном направлении, о площадку ΔS будет nυΔSΔt /6. При столкновении с площадкой
эти молекулы передадут ей импульс
tSυnm
3
1
6
t
Sυnυ2mP
2
0
вчислоударо
молекулы
одной от
импульс
0
.
В данном случае, когда сила, действующая на единицу площади, постоянна, для давления газа на стенку сосуда мы можем
записать р = F/ΔS = ΔP/ΔSΔt = = nm
0
υ
2
/3. Молекулы в сосуде движутся с самыми различными скоростями υ
1,
υ
2….
υ
n,
общее
число их – N. Поэтому необходимо рассматривать среднюю квадратичную скорость, которая характеризует всю совокупность
молекул:
Таким образом, давление газа, оказываемое им на стенку сосуда, будет равно
Приведенное выше уравнение и есть основное уравнение молекулярно-кинетической теории идеальных газов. Поскольку
m
0
‹υ
кв
›
2
/2 – это средняя энергия поступательного движения молекулы ‹ ε
пост
›, уравнение можно переписать в виде:
N
1i
2
iкв
υ
N
1
υ
TνRRT
M
m
рV
2
кв0
υnm
3
1
р
nkTр
Рис.1.1. К выводу основного
уравнения молекулярно-кине-
тической теории.
Следствия:
1. Учитывая, что концентрация n = N/V, получаем
где E – суммарная кинетическая энергия поступательного движения всех молекул газа. Таким образом, давление равно двум
третям энергии поступательного движения молекул, содержащихся в единице объема газа.
2. Для вывода второго следствия воспользуемся первым следствием и уравнением Менделеева-Клапейрона:
Энергия молекул Е в веществе пропорциональна количеству вещества в системе и температуре.
4. Найдем еще кинетическую энергию поступательного движения одной молекулы ‹ ε
пост
›, учитывая
k =R/N
A
получим:
Отсюда следует, что средняя кинетическая энергия хаотического поступательного движения молекул идеального газа
пропорциональна его абсолютной температуре и зависит только от нее, т.е. температура есть количественная мера энергии
теплового движения молекул. При одинаковой температуре средние кинетические энергии молекул любого газа одинаковы.
При Т=0К ‹ε
пост
› = 0 и поступательное движение молекул газа прекращается, однако анализ различных процессов показывает,
что Т = 0К – недостижимая температура.
4.Учитывая, что ‹ε
пост
› = 3kT/2, р = 2n‹ ε
пост
›/3, получим отсюда: р = nkT.
Мы получили уже знакомый нам вариант уравнения Менделеева-Клапейрона, выведенный в данном случае из понятий
молекулярно-кинетической теории статистическим методом. Последнее уравнение означает, что при одинаковых температуре
и давлении все газы содержат в единице объема одинаковое число молекул.
1.-4.-Барометрическая формула. @
При выводе основного уравнения молекулярно-кинетической теории предполагалось, что если на молекулы газа не
действуют внешние силы, то молекулы равномерно распределены по объему. Однако
молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с
одной стороны, и тепловое движение молекул, с другой, приводят к некоторому
стационарному состоянию газа, при котором концентрация молекул газа и его давление с
высотой убывают. Выведем закон изменения давления газа с высотой, предполагая при
этом, что поле тяготения однородно, температура постоянна и масса всех молекул
одинакова. Если атмосферное давление на высоте h равно р, то на высоте h+dh оно равно
р + dp (рис.1.2). При dh > 0, dр < 0, т.к. давление с высотой убывает. Разность давлений р
и (р + dр) равна гидростатическому давлению столба газа авсd, заключенного в объеме
цилиндра высотой dh и площадью с основанием равным единице. Это запишется в
следующем виде: p- (p+dp) = gρdh, - dp = gρdh или dp=-gρdh, где ρ – плотность газа на
высоте h. Воспользуемся уравнением состояния идеального газа рV = mRT/M и выразим
плотность ρ=m/V=pM/RT. Подставим это выражение в формулу для dр:
dp = - pMgdh/RT или dp/p = - Mgdh/RT
Интегрирование данного уравнения дает следующий результат:
lnC
RT
Mgh
lnp откуда ,
RT
Mgh
p
dp
Здесь С – константа и в
данном случае удобно обозначить постоянную интегрирования через lnC.
Потенцируя полученное выражение, находим, что
При условии h=0 получим, что С=р
0
, где р
0
-давление на высоте h=0.
Е
3
2
εN
3
2
pV
пост
RT
M2
m3
E
отсюда E;
3
2
RT
M
m
,εN
3
2
pV
пост
kT
2
3
ε
пост
пост
εn
3
2
p
c
a
p+dp
p
d
в
dh
h
Рис.1.2. Изменение
давления газа с высотой.
Рис.1.3. Зависимость давления газа от
высоты.
р
o
р
o
2
р
o
4
.
.
6
12
h
RT
Мgh
еСр
A
пост
N
M
m
N
;εN
3
2
pV
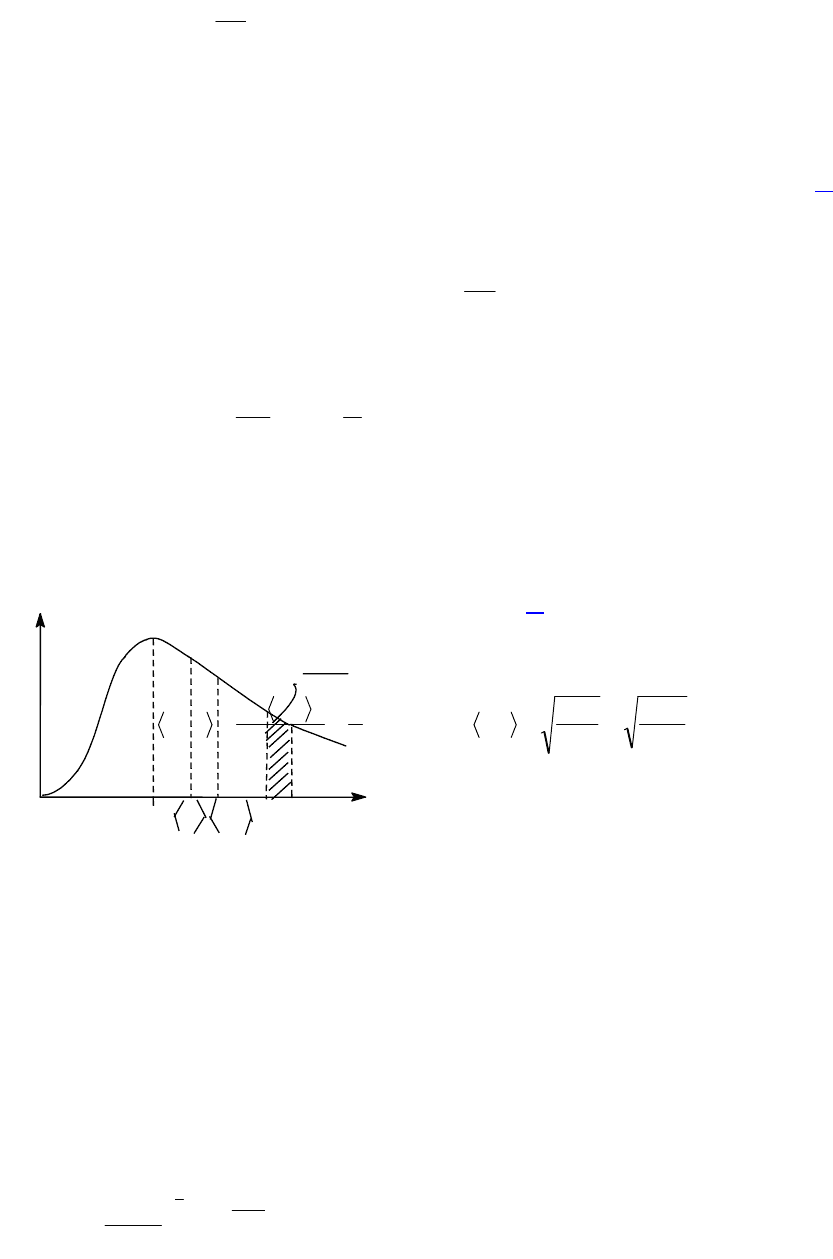
Данное выражение называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от
высоты, или высоту, если известно давление.
Зависимость давления от высоты демонстрирует рисунок 1.3. Прибор для определения высоты над уровнем моря
называется высотомером или альтиметром. Он представляет собой барометр, проградуированный в значениях высоты.
1.-5. Закон Больцмана о распределении частиц во внешнем потенциальном поле. @
Если воспользоваться выражением р = nkT, то можно привести барометрическую формулу к виду:
здесь n – концентрация молекул на высоте h, n
0
– то же у поверхности Земли. Так как М = m
0
N
A
, где m
0
– масса одной
молекулы, а R = k N
A
, то мы получим П = m
0
gh – это потенциальная энергия одной молекулы в поле тяготения. Поскольку
kT~‹ε
пост
›, то концентрация молекул на определенной высоте зависит от соотношения П и ‹ε
пост
›
Полученное выражение называется распределением Больцмана для внешнего потенциального поля. Из него следует,
что при постоянной температуре плотность газа (с которой связана концентрация) больше там, где меньше потенциальная
энергия его молекул.
1.-6.-Распределение Максвелла молекул идеального газа по
скоростям. @
При выводе основного уравнения молекулярно-кинетической теории
отмечалось, что молекулы имеют различные скорости. В результате
многократных соударений скорость каждой молекулы меняется со временем
по модулю и по направлению. Из-за хаотичности теплового движения
молекул все направления являются равновероятными, а средняя
квадратичная скорость остается постоянной. Мы можем записать
Постоянство ‹υ
кв
› объясняется тем, что в газе устанавливается стационарное,
не меняющееся со временем распределение молекул по скоростям, которое
подчиняется определенному статистическому закону. Этот закон
теоретически был выведен Д.К.Максвеллом. Он рассчитал функцию f(),
называемую функцией распределения молекул по скоростям. Если разбить
диапазон всех возможных скоростей молекул на малые интервалы, равные
d, то на каждый интервал скорости будет приходиться некоторое число молекул dN(), имеющих скорость, заключенную в
этом интервале (Рис.1.4.).
Функция f(v) определяет относительное число молекул, скорости которых лежат в интервале от до + d. Это число - dN()/
N=f()d. Применяя методы теории вероятностей, Максвелл нашел вид для функции f()
RT
Mgh
0
enn
M
RT3
m
kT3
υ откуда kT,
2
3
2
υm
ε
0
кв
2
кв0
пост
kT2
υm
2
2
3
0
2
0
eυ
πkT2
m
π4υf
RT
Мgh
0
ерр
kT
П
0
kT
ghm
0
enenn
0
f(
)
dN
N
(
)
в
кв
Рис.1.4. Вид функции распределения по
скоростям.
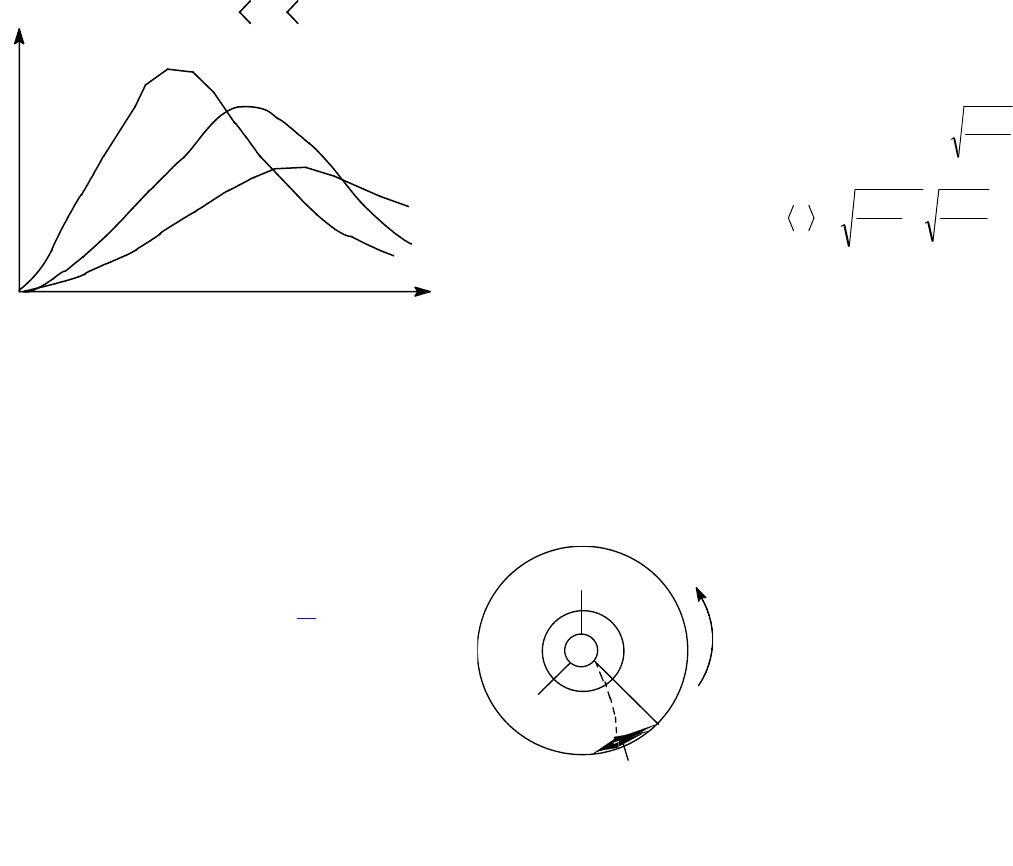
Данное выражение - это закон о распределении молекул идеального газа по скоростям. Конкретный вид функции
зависит от рода газа, массы его молекул и температуры (рис.1.5). Функция f()=0 при =0 и достигает максимума при
некотором значении
в
, а затем асимптотически стремится к нулю. Кривая несимметрична относительно максимума.
Относительное число молекул dN()/N, скорости которых лежат в интервале d и равное f()d, находится как площадь
заштрихованной полоски основанием dv и высотой f(), показанной на рис.1.4. Вся площадь, ограниченная кривой f() и
осью абсцисс равна единице, потому что, если просуммировать все доли молекул, имеющих всевозможные значения
скорости, то получается единица. Как показано на рис.1.5, с ростом температуры кривая распределения смещается вправо, т.е.
растет число быстрых молекул, но площадь под кривой остается
постоянной, т.к. N = const.
Скорость
в
, при которой функция f() достигает максимума,
называется наиболее вероятной скоростью. Из условия равенства
нулю первой производной функции f(v) ′ = 0 следует, что
На рисунке 1.4. отмечена еще одна характеристика – средняя
арифметическая скорость молекулы. Она определяется по формуле:
Опыт, проведенный немецким физиком О.Штерном,
экспериментально подтвердил справедливость распределения
Максвелла (рисунок 1.5.). Прибор Штерна состоит из двух
коаксиальных цилиндров. Вдоль оси внутреннего цилиндра со щелью
проходит платиновая проволока, покрытая слоем серебра. Если пропустить по проволоке ток,она нагревается и серебро
испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра. Если прибор будет
вращаться, то атомы серебра осядут не против щели, а сместятся от точки О на некоторое расстояние. Исследование
количество осадка позволяет оценить распределение молекул по скоростям. Оказалось, что распределение соответствует
максвелловскому.
2.-ОСНОВЫ ТЕРМОДИНАМИКИ
2.1.-Внутренняя энергия. @
Важной характеристикой любой термодинамической системы
является ее внутренняя энергия – энергия хаотического теплового движения
частиц системы-молекул, атомов и энергия их взаимодействия. К внутренней
энергии не относится кинетическая энергия движения системы как целого и
потенциальная энергия системы во внешних полях. Внутренняя энергия системы в
определенном состоянии не зависит от того, как система пришла в это состояние
(т.е. от пути перехода), а определяется только значениями термодинамических
параметров в этих состояниях. В термодинамике имеются и другие функции,
удовлетворяющие этим условиям, их называют функциями состояния системы.
Таким образом, внутренняя энергия – это функция состояния.
Для дальнейших рассуждений нам понадобится понятие числа
степеней свободы – это число независимых переменных (координат), полностью определяющих положение системы в
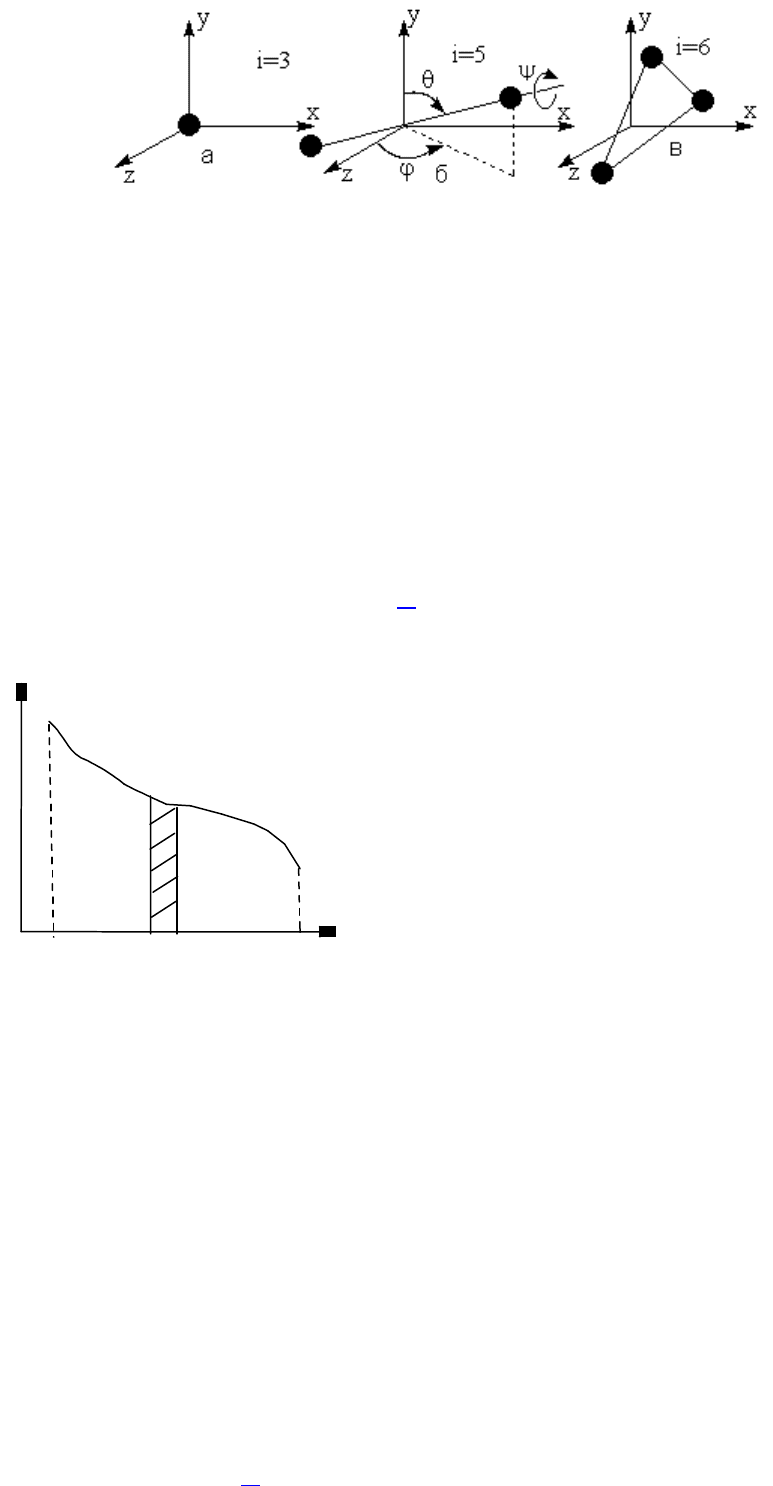
пространстве. Например, молекулу одноатомного газа можно рассматривать как материальную точку, обладающую тремя
степенями свободы поступательного движения (координаты x,y,z) (рис.2.1.а). Молекула двухатомного газа, рассматриваемая
в классической механике как совокупность двух материальных точек, жестко связанных между собой, имеет уже 5 степеней
свободы. У нее имеется 3 степени свободы поступательного движения центра масс и 2 степени вращательного, связанного с
поворотами на углы и (рис. 2.1.б). Эти углы - полярный угол θ и азимутальный угол φ, определяют ориентацию оси
молекулы. В данном случае, на первый взгляд кажется, что необходимо также задавать угол поворота ψ молекулы
относительно собственной оси. Но вращение двухатомной молекулы вокруг своей собственной оси ничего не меняет в
положении молекулы, так как структуры у материальных точек-атомов нет и, поэтому, этот угол не нужен для задания
положения такой молекулы в пространстве. Трехатомные молекулы (рис. 2.1.в), в которых атомы связаны жестко между
собой, имеют 6 степеней свободы, так как здесь уже необходим дополнительный угол ψ.
Если расстояния между атомами меняются, т.е. атомы в молекуле колеблются, то для задания этих расстояний
необходимы дополнительные координаты-колебательные степени свободы и общее число степеней свободы будет больше 6.
Для много-атомных молекул число степеней может быть намного больше 6.
M
RT2
υ
в
.
Ag
Pt
O
S
Рис.1.5. Опыт Штерна.
f(
))
T
1
T
2
T
3
T
1
T
2
T
3
Рис.1.5. Зависимость f(
) от температуры.
πM
RT8
πm
kT8
υ
0
Ранее мы получили формулу для средней кинетической энергии поступательного движения одно-атомной молекулы
идеального газа следующее выражение: ‹ε
0
› = 3kT/2. Но у одно-атомной молекулы имеется 3 степени свободы
поступательного движения и ни одна не имеет преимущества перед другими. Поэтому на каждую степень в среднем должна
приходиться одинаковая энергия, равная 1/3 общей: ‹ε
1
› = kT/2. Так как, очевидно, что все степени свободы равноценны, то в
классической статистической физике существует закон Больцмана о равномерном распределении энергии по степеням
свободы. Он формулируется так: для статистической системы, находящейся в состоянии термодинамического равновесия, на
каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная кТ/2, а на
каждую колебательную степень свободы – кТ. Колебательная степень свободы обладает вдвое большей энергией, так как на
нее приходится не только кинетическая, но и потенциальная энергия взаимодействия. Таким образом, средняя энергия любой
молекулы ‹ε› = ikT/2, где i - это сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы.
Из этого закона получаем, что внутренняя энергия U
М
одного моля идеального газа равна U
М
=ikTN
A
/2 = iRT/2, а
внутренняя энергия U газа массы m равна U = ikTN/2 = iRTm/2M (здесь мы учитываем, что потенциальная энергия
взаимодействия молекул равна 0, общее число молекул в одном моле равно N
A
, N= mN
A
/M и kN
A
=R).
2.2.- Первое начало термодинамики. @
Обмен энергией между термодинамической системой и внешней средой может осуществляться двумя качественно
различными способами: путем совершения работы и путем теплообмена.
Изменение энергии системы, происходящее под действием сил
измеряется работой. Если термодинамическая система совершает работу против
внешних сил, то работа считается положительной (А>0). Если работу над
системой совершают внешние силы, то она считается отрицательной (А< 0).
Изменение энергии системы, происходящее в результате теплообмена,
определяется количеством переданной или отнятой теплоты Q. При
теплообмене тела систем должны находится в тепловом контакте, т.е. молекулы
этих систем должны иметь возможность сталкиваться при своем движении и
обмениваться своей кинетической энергией. Если энергия (теплота) передается
системе, то Q>0, если она от системы отнимается, то Q<0. Итак, работа и
теплота – это две формы передачи энергии от одних тел другим. Поскольку
внутренняя энергия - это механическая энергия всех молекул, то при всех ее
изменениях должен соблюдаться закон сохранения энергии. Применительно к
термодинамическим процессам этим законом является первое начало
термодинамики, установленное в результате обобщения опытных данных. Опыт
показал, что при любом способе перехода системы из состояния 1 в состояние 2
изменение внутренней энергии системы ΔU = U
1
- U
2
определяется количеством
теплоты Q, полученной системой, и работой А, совершенной системой против
внешних сил (получаемое тепло увеличивает энергию системы, а работа
системы над внешней средой уменьшает ее) :
ΔU = Q – A или Q = ΔU + A
В дифференциальной форме (для малых изменений величин) это запишется следующим образом:
δQ = dU + δA ,
где δQ - бесконечно малое количество теплоты, dU – бесконечно малое изменение внутренней энергии, δA – элементарная
работа. Это уравнение выражает первое начало термодинамики: теплота, подводимая к системе, расходуется на изменение ее
внутренней энергии и на совершение работы против внешних сил. Знак δ в δQ и δА означают, что данные элементарные
приращения не являются полными дифференциалами и, следовательно, А и Q не являются функциями состояния.
Пусть газ заключен в цилиндрический сосуд, закрытый легко скользящим поршнем площадью S. Найдем работу газа
при расширении его объема δA = Fdl = pSdl =pdV, где F – сила, с которой газ действует на поршень, dl – перемещение
поршня. Если зависимость р(V) изобразить графически, то общая работа при изменении объема от V
1
доV
2
равна площади
фигуры, ограниченной кривой р(V), осью абсцисс и прямыми V= V
1
и V= V
2
(рис.2.2.). Графически можно изображать лишь
равновесные процессы, и все количественные выводы термодинамики строго применимы только к равновесным процессам.
При достаточно медленном протекании реальные процессы можно приближенно считать равновесными. Первое начало
термодинамики выполняется во всех процессах, связанных с обменом энергией и совершением работы.
2. 3.-Теплоемкость. @
Одним из основных свойств тел, которое широко используется в термодинамике, является теплоемкость.
Теплоемкостью тела называется физическая величина, численно равная отношению теплоты δQ, сообщаемой телу, к
Рис.2.1. Степени свободы: а) одноатомной молекулы;б) двухатомной
молекулы;в) трех- и многоатомной молекулы.
Рис.2.2. Графическое изображение
работы газа при расширении.
V
V
1
2
dV
V
р
изменению температуры тела в рассматриваемом термодинамическом процессе. Теплоемкость тела зависит от его
химического состава, массы и термодинамического состояния, а также от вида процесса, в котором поступает теплота.
Тепловые свойства однородных тел характеризуются понятиями удельной и молярной теплоемкостей.
Удельная теплоемкость вещества – величина, численно равная количеству теплоты, необходимому для нагревания
единицы массы вещества на 1 Кельвин при данном процессе, единица измерения – Дж/(кг∙К)
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания одного моля вещества на 1К ,
т.е. С =сМ, где М – молярная масса вещества. Теплоемкости одного и того же вещества при разных термодинамических
процессах нагревания различаются.
Найдем молярную теплоемкость системы в изобарном процессе, для этого возьмем один моль газа и сообщим ему
количество теплоты δQ
М
. Согласно определению молярной теплоемкости и первому началу термодинамики можем
записать (здесь δА
М
- работа одного моля газа)
Если газ нагревается при постоянном объеме, то dV=0 и δА
М
=0. Сообщаемая газу теплота идет только на увеличение его
внутренней энергии и теплоемкость для изохорного процесса
Откуда следует, что
Из уравнения Менделеева – Клапейрона для изобарного процесса можно получить pdV
М
= RdT. Таким образом, pdV
М
/dT =
R. Из этой формулы следует физический смысл газовой постоянной: она численно равна работе (δА
М
= pdV
М
), совершаемой
одним молем идеального газа, при его изобарном нагревании на 1 К. После замены получаем:
Это выражение называется уравнением Майера, оно показывает, что молярная теплоемкость при постоянном давлении С
р
всегда больше, чем теплоемкость при постоянном объеме C
v
на величину, равную молярной газовой постоянной. Это
объясняется тем, что при постоянном объеме все подводимое тепло идет только на увеличение внутренней энергии, т.е.
повышение Т, а при постоянном давлении кроме этого требуется еще дополнительное количество теплоты на совершение
работы газом против внешних сил при его расширении.
2.-4.-Применение первого начала термодинамики к изопроцессам.
@
Различают следующие виды термодинамических процессов:
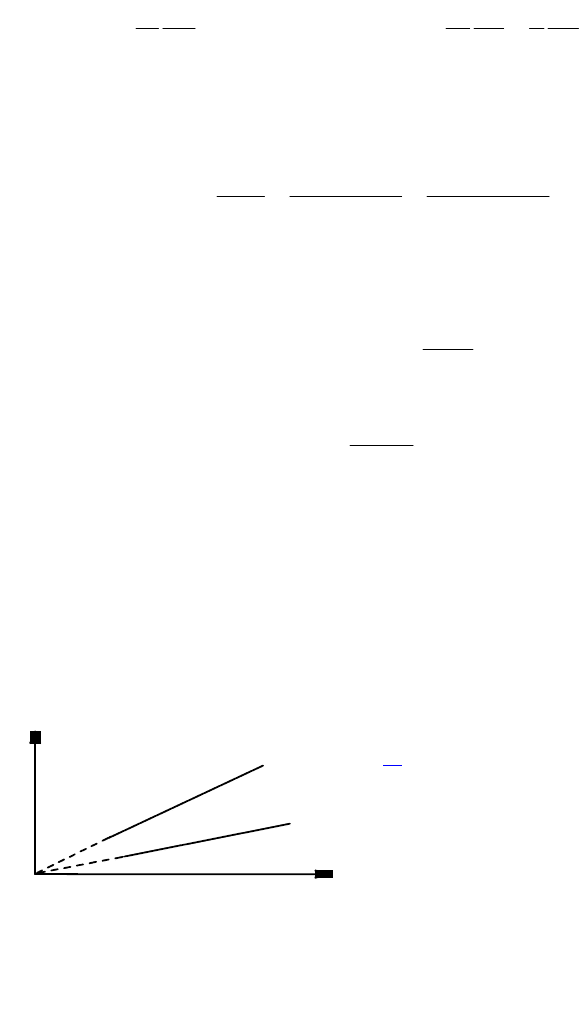
1.Изохорный - это процесс, протекающий при постоянном объеме.
V=const. На диаграмме в координатах (р, Т) он изображается прямой,
называемой изохорой (рис.2.3.). При изохорном процессе газ не
совершает работы над внешними телами, так как dV=0. Вся теплота,
сообщаемая газу, идет на увеличение его внутренней энергии и отсюда
I начало термодинамики для изохорного процесса δQ = dU. Для
одного моля δQ
м
=dU
м
, где dU
м
=С
V
dT. Изохорным является
процесс сгорания топлива в карбюраторном двигателе.
2.Изобарный – это процесс, протекающий при постоянном давлении. Прямая, изображающая этот процесс в координатах
(V,T), называется изобарой (рис.2.4.). Первое начало термодинамики для
изобарного процесса δQ = dU + δA. Так давление не меняется, то работа газа при увеличении объема от V
1
до V
2
равна
Теплота, сообщаемая газу массой m в изобарном процессе
dT
δQ
m
1
с
dT
dQ
ν
1
dT
δQ
m
M
C
dT
pdV
CC
M
Vp
Рис.2.3. Диаграмма изохорного
процесса (изохора).
р
T
V
1
2
V
=
=const
const
1
2
>
V
V
dT
pdVdU
dT
δAdU
dT
δQ
С
MMMMM
p
dT
dU
С
M
V
RCС
Vp
2
1
V
V
12
VVppdVA
при этом его внутренняя энергия возрастает на величину
так как внутренняя энергия идеального газа не зависит от давления и объема, а определяется лишь температурой. При
изобарном нагревании к системе подводится тепло δQ >0 и δA >0, так как газ расширяется. При изобарном сжатии
направление процесса меняется на противоположное и теперь тепло отводится от системы, т.е. δQ <0 и δA <0, так как работу
над газом совершают внешние силы. dU также будет меньше нуля. Примером изобарного процесса может служить процесс
образования пара в паровых котлах или сгорания топлива в воздушно-реактивных двигателях.
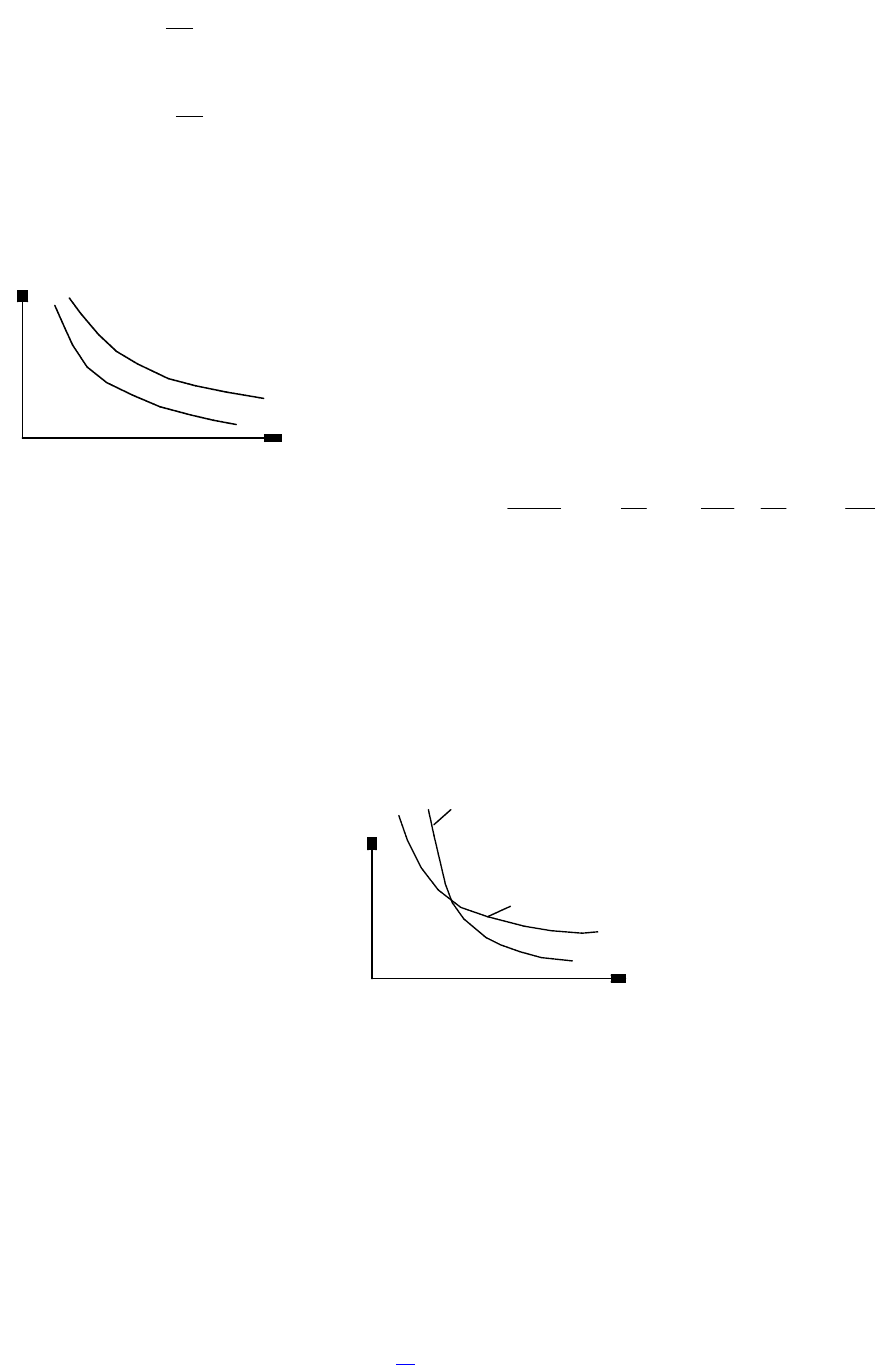
3.Изотермический – это процесс, протекающий при постоянной температуре.
Кривая, построенная в координатах (р, V), называется изотермой. Она представляет
собой гиперболу (рис.2.5.), расположенную на диаграмме тем выше, чем выше
температура, при которой происходит процесс. Так как при Т = const внутренняя
энергия идеального газа не изменяется, то dU = 0 и первое начало термодинамики для
изотермического процесса примет вид: δQ = δА. Теплоемкость при изотермическом
процессе С
Т
=δQ/dT=δQ/0 = ∞ и не имеет смысла. Изотермический процесс
осуществляется при наличии термостата (внешней среды или тела с большим запасом
внутренней энергии, находящемся при той же температуре).
Найдем работу изотермического расширения газа, учитывая, что все
количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил и не изменяет его
температуру. Учитывая формулу для работы и уравнение Менделеева-Клайперона, получаем
Примерами изотермических процессов являются закалка и отжиг сталей в процессе их изготовления. Существуют
автомобили и вагоны – рефрижераторы, служащие для перевозки скоропортящихся продуктов. Они имеют
теплоизолированный кузов и холодильники для поддержания внутри постоянной температуры и поэтому процесс перевозки
продуктов в таких условиях можно назвать изотермическим..
4.Адиабатическийпроцесс. Адиабатическим называется процесс, при котором отсутствует теплообмен между системой
и окружающей средой, т.е. δQ = 0, Q = const. Так как δQ = 0, первое начало термодинамики имеет вид: δА=-dU т.е. работа
совершается за счет внутренней энергии газа. Если газ расширяется, то δА>0,
dU<0 и температура газа уменьшается. Если происходит сжатие газа, то δА<0 и dU>0.
Работу над газом совершают внешние силы, внутренняя энергия (а, значит, и
температура) газа повышается. Реализовать адибатический процесс можно,
если проводить его либо при хорошей теплоизоляции от окружающей среды, либо
быстро за короткое время, при котором теплообмен будет мал.
Пуассона или показатель адиабаты. Уравнение адиабатического
процесса (уравнение Пуассона) имеет вид: рV
γ
= const, где γ = С
р
/C
v
–
коэффициент (показатель адиабаты).
Диаграмма адиабатического процесса (адиабата) в координатах (р,V)
изображается гиперболой, более крутой, чем изотерма (рис.2.6.). Объясняется
это тем, что при адиабатном сжатии увеличение давления происходит не только за
счет уменьшения объема, как при изотермическом сжатии, но также связано с
возрастанием температуры. Согласно уравнению р = nkT =NkT/V давление
пропорционально T/V и в случае адиабатического сжатия его возрастание определяется одновременно и возрастанием
температуры, и уменьшением объема. При адиабатном расширении газа его температура уменьшается и давление падает
быстрее, чем при соответствующем изотермическом расширении, поскольку давление уменьшается пропорционально T/V и
его падение определяется одновременно и понижением температуры, и увеличением объема. Теплоемкость при
адиабатическом процессе С
Q
= Q/ΔT=0/ΔT=0, не имеет большого смысла. Адиабатические процессы широко распространены
в технике, например, в двигателях внутреннего сгорания. Истечение газов через сопла реактивных двигателей также может
считаться адиабатическим процессом, поскольку происходит очень быстро. Отчетливо выражен адиабатический характер
процесса сжатия в дизеле, который не имеет зажигания: адиабатическое нагревание смеси при сжатии приводит к ее
самовоспламенению. И, наконец, самый простой бытовой пример: сифон для газирования воды – в момент прокола газового
баллончика, когда газ мгновенно его покидает, сам баллончик резко охлаждается (покрывается инеем).
2.5. Второе начало термодинамики. @
dTC
M
m
δQ
p
Рис.2.6. Адиабата и изотерма.
р
T
=const
V
Q=0
dTC
M
m
dU
V
р
V
T
T
T
T
1
1
2
2
>
Рис.2.5. Диаграмма
изотермического процесса
(изотерма).
2
1
2
1
V
V
1
2
V
V
V
V
RTln
M
m
V
dV
RT
M
m
dV
MV
mRT
pdVА
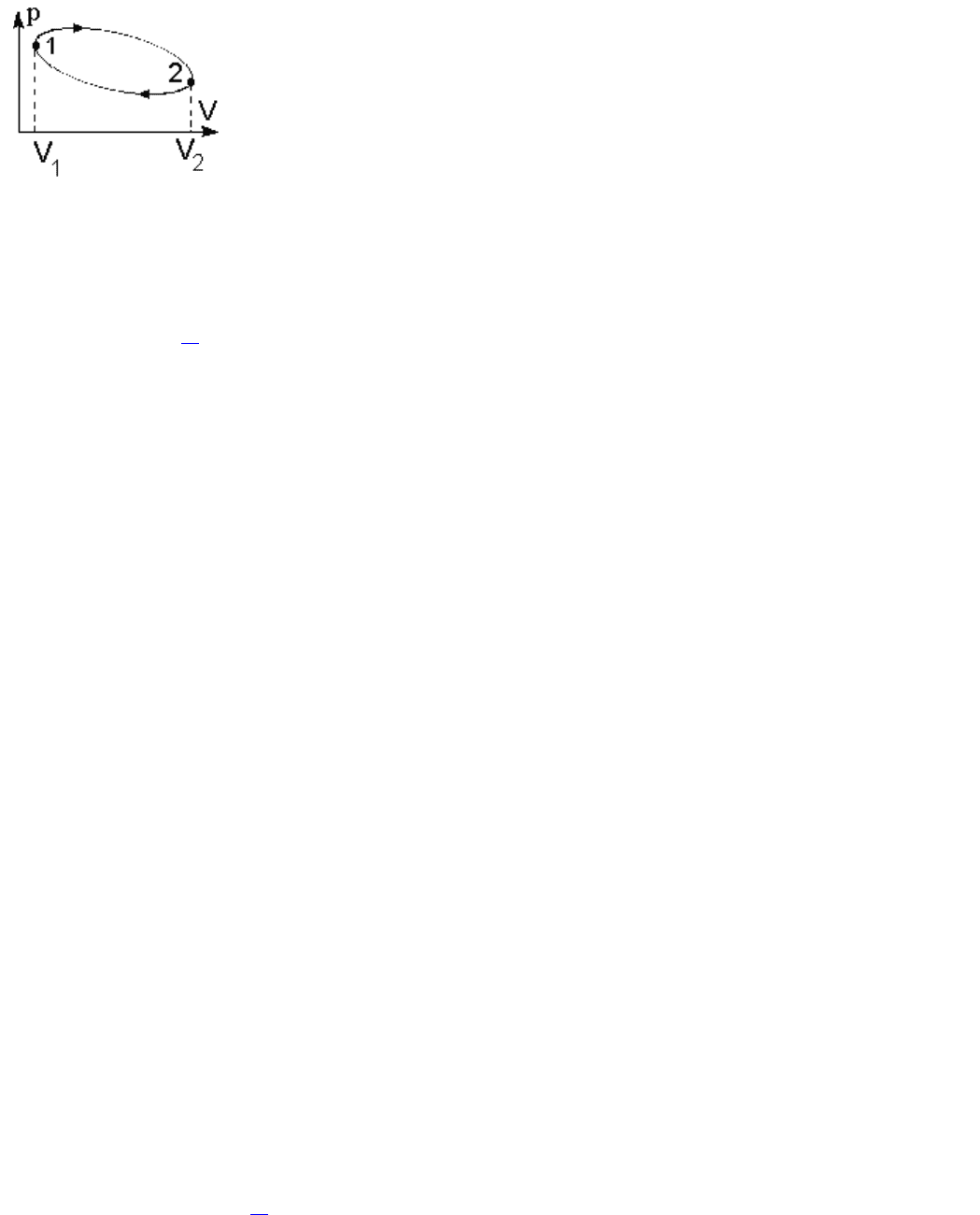
Термодинамический процесс называется обратимым, если он может
происходить как в прямом, так и в обратном направлении, а в окружающей среде и в
системе при этом не происходит никаких изменений. Всякий процесс, не
удовлетворяющий этим условиям, является необратимым.
Если система, пройдя через ряд состояний, возвращается в исходное, то такой
процесс называется круговым процессом, или циклом. Циклы лежат в основе работы
всех тепловых машин – двигателей внутреннего сгорания, паровых и газовых турбин,
холодильников. На диаграмме процессов в координатах (р,V) цикл изображается
замкнутой кривой, где процесс 1-2 –процесс расширения газа, а 2-1 – процесс сжатия
(рис. 2.7.). В результате кругового процесса система может теплоту как получать, так и
отдавать. Обозначим полученное количество теплоты Q
1
, а отданное - Q
2
. Работа,
совершаемая газом за цикл, определяется площадью фигуры, ограниченной кривой 1-2-
1. В результате цикла система возвращается в исходное состояние и, следовательно,
полное изменение внутренней энергии газа равно нулю, а работа, совершаемая за цикл, равна полученной теплоте
Q=Q
1
-Q
2
=А.
2. 6. Энтропия. @
Для описания термодинамических процессов одного первого начала термодинамики недостаточно, потому что оно не
позволяет определять направление протекания процессов. Например, процесс самопроизвольной передачи теплоты от
холодного тела горячему первым началом не запрещен, однако опыты показывают, что он не происходит. Итак, необходимо
определить условия, при которых возможны превращения энергии из одного вида в другой, что позволило бы узнать
направления протекания процессов.
В термодинамике, кроме внутренней энергии, существует еще несколько функций состояния системы. Особое место
среди них занимает энтропия S. Энтропия как раз и является той величиной, которая позволяет прогнозировать возможность
и направление протекания процессов. Энтропия (от греч.entropia–поворот, превращение)- понятие, впервые введенное в
термодинамике для определения меры необратимого рассеяния энергии немецким физиком Р.Клаузиусом в 1865г.
Пусть δQ – элементарное количество теплоты, сообщаемое системе каким-либо нагревателем с постоянной
температурой Т. Если процесс равновесный (обратимый), то температура системы тоже равна Т. Отношение δQ/Т называется
приведенным количеством теплоты и равно изменению энтропии при обратимом процессе: δQ/Т = dS. Поскольку Т всегда
> 0, из 2-ого начала видно, что δQ и dS имеют один и тот же знак. Это позволяет по характеру изменения энтропии судить о
направлении процесса теплообмена и прогнозировать его возможность. При нагревании тела δQ > 0 и его энтропия возрастает
(dS > 0), при охлаждении энтропия убывает. Если δQ=0 (обратимый адиабатический процесс), то dS = 0 и S = const, то есть
энтропия остается постоянной.
Энтропия, подобно внутренней энергии, является функцией состояния системы. Энтропия системы равна сумме
энтропий всех тел, входящих в систему. Для изолированной системы энтропия в любом обратимом процессе не изменяется и
S = const. В термодинамике доказывается, что в необратимом процессе энтропия системы может только возрастать: dS
0.
Объединяя два последних условия, мы получаем, что энтропия замкнутой системы может либо возрастать, либо оставаться
постоянной: dS ≥ 0. Это неравенство Клаузиуса также является формулировкой второго начала термодинамики.
С точки зрения молекулярной физики, энтропия является мерой разупорядоченности системы, т.е. чем система
более хаотична, тем ее энтропия выше. С этой точки зрения второе начало термодинамики утверждает, что в замкнутой
системе, при отсутствии внешних воздействий любая система стремится перейти в состоянии максимальной
разупорядоченности. Такое состояние является наиболее вероятным, поэтому энтропию S можно связать с вероятностью W
состояния системы соотношением Больцмана S=k lnW, а второе начало объяснять стремлением системы находиться в
наиболее вероятном состоянии. Явление увеличения беспорядка можно легко наблюдать при добавлении в воду капли туши.
Если не воздействовать на такую систему извне, то через небольшое время тушь полностью перемешается с водой, обратный
процесс – процесс собирания частичек туши в каплю, хотя в принципе он и возможен, никогда не наблюдается.
3. ЯВЛЕНИЯ ПЕРЕНОСА
Беспорядочность теплового движения молекул газа или жидкости, непрерывные столкновения между ними приводят
к постоянному перемешиванию частиц и к изменению их скоростей и энергий. Если в веществе имеется пространственная
неоднородность плотности или температуры, то со временем, согласно второму началу термодинамики, происходит
обязательное выравнивание этих неоднородностей. В среде возникают потоки энергии, вещества, а также импульса
упорядоченного движения частиц. Эти потоки являются физической основой особых процессов, объединенных под общим
названием явления переноса. К этим явлениям относится теплопроводность (обусловлена переносом энергии), диффузия
(обусловлена переносом массы) и внутреннее трение (обусловлено переносом импульса).
3.1.-Теплопроводность. @
Теплопроводность – это явление переноса внутренней энергии (теплоты) при наличии неоднородности в
распределении температуры. Теплопроводность возникает, например, при наличии разности температур, вызванной какими-
либо внешними причинами. При этом молекулы газа в разных местах его объема имеют разные средние кинетические
энергии. В результате хаотического теплового движения молекулы, попавшие из нагретых частей газа в более холодные,
Рис.2.7. Круговой процесс
(цикл).
