Лекции по радиобиологии
Подождите немного. Документ загружается.

Производное триптамина, 5-окситриптамин (серотонин) является эффективным
радипротектором. При ведении этого соединения животным до облучения, в дозе 10 – 60
мг на кг массы, LD
50
увеличивается в 2-3 раза.
Другое производное триптамина, 5-метоокситриптамин, также является эффективным
радиопротектором и широко используется на практике. Тривиальное название этого
препарата – мексамин.
Защитный эффект мексамина показан на мышах, собаках, обезьянах. ФИД этого препарат
больше 3, при введении его в расчете 10 – 60 мг на кг массы тела.
Меркаптоэтаноламины
Наиболее простое соединение из класса серосодержащих аминов –
меркаптоэтаноламин.
Внутриутробное введение этого соединения мышам в расчете 150 мг/кг за 5-10 минут до
облучения позволяет предотвращать гибель летально облученных животных. ФИД этого
препарата для различных животных колеблется от 2 до 3. На многочисленных
экспериментах с различными животными показано, что большинство соединений,
относящихся к меркаптоэтаноламинам, обладают, в той или иной степени, радиозащитным
эффектом. Наиболее эффективны и используются для научных и практических целей
следующие соединения: дисулфидмеркаптоэтаноламин (тривиальное название препарата -
цистамин), аминоэтилазотиуроний (АЭТ), натривая соль аминоэтилфосфорной кислоты
(цистафос), имдазолэтиламин (гистамин).
Нужно отметить, что защитный эффект протектора проявляется только в том случае,
если протектор вводится в организм незадолго до облучения. Эффективность действия
протектора снижается по мере увеличения интервала времени между введением препарата и
облучением объекта. Наиболее эффективное время составляет у разных животных 5-15
минут до облучения. Таким образом, молекулы протектора должны присутствовать в тканях
животных во время облучения. В связи с этим, можно предположить, что механизмы
действия протекторов в организме связаны с первичными реакциями лучевого поражения и
что действие протекторов направлено на уменьшение продуктов радиолиза. Существует
несколько гипотез, объясняющих механизмы проявления защитного эффекта протекторов в
организме. Рассмотрим эти гипотезы.
91
Перехват и инактивация образующихся свободных радикалов. Эта гипотеза говорит о
том, что химические соединения введенные в ткани и клетки, снижают количество
свободных радикалов, образующихся в облучаемой среде. Следовательно, они снижают
косвенное действие ионизирующей радиации. В первую очередь, защитный эффект
протекторов обусловлен инактивацией свободных радикалов и других активных продуктов
радиолиза воды. На первый взгляд, эта гипотеза кажется логичной и объясняющей
защитный эффект протекторов. Однако, существует ряд экспериментальных данных,
противоречащих этой гипотезе.Вор-первых, в соответствии с этой гипотезой, различные
соединения должны проявлять одинаковую эффективность при одинаковых концентрациях,
по крайней мере, при равных молярных концентрациях. Однако известно, что эффективные
дозы протекторов различаются в несколько раз и даже на несколько порядков. Например,
серотонин и мексамин действуют эффективно при дозе 10 –60 мг на кг массы, а
концентрация цистеина для достижения такого же эффекта, должна составлять не менее 1
г/кг массы. Во-вторых, даже незначительные изменения структуры защитного соединения,
которое не влияет на его антиокислительные свойства, может привести к полной утрате его
протекторных свойств in vivo. В третьих, хорошие перехватчики и инактиваторы свободных
радикалов в химических растворах, не обязательно являются эффективными
радипротекторами. Так, например, триптофан, гистидин, тирозин являются очень хорошими
перехватчиками свободных радикалов, однако в живых тканях их радиозащитный эффект
равен нулю. Кроме того, внутриклеточные концентрации протекторов очень низки, а их
способность реагировать со свободными радикалами не намного выше, чем некоторых
внутриклеточных соединений. Все эти факты и соображения свидетельствуют о том, что в
проявлении радиозащитного действия протекторов, перехват и инактивация свободных
радикалов имеет место, но не может являться основной причиной проявления
протекторного эффекта.
Повышение биологического фона радиорезистентности. В соответствии с этой
гипотезой, введение в организм эффективных доз радипротекторов, приводит к
изменению интенсивности биохимических процессов. В частности, предполагается, что эти
соединения стимулируют синтез различных соединений, которые повышают устойчивость
клеток, тканей и, в конечном счете, целого организма. Показано, что введение протектора
сопровождается повышением концентрации в крови сульфигидрильных соединений на 10-
15 %. При этом повышается и содержание эндогенных аминов, обладающих защитным
эффектом (серотонин, дофамин, гистамин).
Биохимический шок. Эта гипотеза предполагает, что введение протекторов в
организм приводит к разнообразным нарушениям в структуре и функционировании клеток.
Показано, что инкубация клеток в растворах с протектором приводит к повышению
проницаемости мембран, размыванию крист митохондрий, ингибированию некоторых
биохимических реакций. Различные нарушения структуры и функций клеток и тканей
называют общим термином «биохимический шок». Предполагают, что эти нарушения
приводят к повышению радиорезистентности клеток и организма в целом. Как считают
многие авторы, повышение радирезистентности – это частный случай неспецифической
реакции клеток на действие любых повреждающих факторов. Радиопротекторы как бы
имитируют действие ионизирующей радиации и индуцируют те защитные реакции,
которые проявляются при облучении, например, процессы репарации макромолекул. Как
известно, радиоустойчивость организмов повышается при фракционированном
( многократном и малыми дозами) облучении, при длительном облучении малыми дозами.
Повышение радиоустойчивости наблюдается и при предварительном облучении
ультрафиолетовым излучением ( эффект фотозащиты). О важной роли репарационной
системы клеток в реализации действия протекторов убедительно свидетельствуют
эксперименты С.Е. Бреслера, Л.А. Носкина. Ими показано, что меркаптоэтаноламины
эффективно защищают от действия излучения только те штаммы бактерий, у которых не
92

повреждены системы репарации. У клеток-мутантов, у которых системы репарации ДНК
ингибированы, радиопротекторы не работают.
Снижение концентрации кислорода. Показано, что радиопротекторные соединения
вызывают в тканях снижение напряжения (концентрации) кислорода. Это свойство
протекторов коррелирует с их сосудосуживающим эффектом у животных, что также связано
со снижением концентрации кислорода в крови. Интересно отметить, что защитный эффект
некоторых протекторов (серотонин, гистамин) снижается или даже отсутствует при
действии их антиметаболитов и при повышении давления кислорода в тканях. Поэтому
многие авторы связывают механизм действия радиопротекторов, в первую очередь
индолилалкиламинов, со снижением кислородного эффекта.
Кислородный эффект. Радисенсибилизаторы.
Под кислородным эффектом в радиобиологии понимают явление усиления лучевого
поражения при повышенной концентрации кислорода по сравнению с облучением в
анаэробных условиях. Кислородный эффект – универсальное явление, которое проявляется
исключительно по всем показателям лучевого поражения на всех уровнях организации
живых систем. Проявление кислородного эффекта обнаружено как в модельных системах с
макромолекулами, так в экспериментах с клеточными культурами, изолированными
тканями, организмами, популяциями. Впервые это явление было описано К. Шварцем 1909
году. Однако, детальные исследования роли кислорода в проявлении радиобиологических
эффектов начались с 50 гг. 20 века. А. Дауди и сотр. (1950) показали, что в условиях
гипоксии имеет место увеличение выживаемости летально облученных рентгеновскими
лучами крыс (табл.1). Как видно, снижение в воздухе концентрации кислорода до 5 %
приводит к уменьшению количества погибших животных при облучении их высокими
дозами рентгеновского излучения.
Таблица 1
Влияние гипоксии на выживаемость облученных крыс
Доза облучения, Гр Количество выживших животных , %
Воздух (20 % О
2
) Гипоксия (5 % О
2
)
6 63 100
8 0 100
10 0 91
12 0 81
14 0 29
Как видно, кислород является эффективным радиомодификатором, он обладает
радиосенсибилизирующим эффектом. Количественным выражением повышения
радиочувствительности в присутствии кислорода является коэффициент кислородного
усиления (ККУ). Значение этого коэффициента показывает, во сколько раз происходит
увеличение радиочувствительности (снижение радиоустойчивости) живых обьектов в
кислородной среде по сравнению с облучением их бескислородных условиях. Например,
при облучении в анаэробных условиях суспензии бактерий значение LD
50
= 1000 Гр. При
облучении этого вида бактерий в среде с содержанием кислорода LD
50
для них составила
всего 500 Гр. Коэффициент кисородного усиления в этом случае будет равен двум.
В 1953 году Г.Грей сделал вывод об универсальном проявлении кислородного
эффекта и о зависимости радиочувствительности облучаемых объектов от концентрации
кислорода в облучаемой среде. На рис.1 представлена кривая зависимости кислородного
эффекта от концентрации кислорода. Как видно, при высокой концентрациях кислорода
93
в облучаемой среде, значение ККУ = 3. Как известно, в атмосферном воздухе содержится
около 20 % кислорода, что соответствует его парциальному давлению равному примерно
160 мм.рт.ст.
Рис.1. Зависимость радиочувствительности живых систем от содержания кислорода в среде
облучения
Видно, что при таких значениях давления и концентрации кислорода ККУ имеет
максимальное значение и, соответственно, живые организмы характеризуются
наибольшей радиочувствительностью. Уменьшение значения ККУ от 3 до 2 происходит
при снижении парциального давления кислорода от 50 до 5 мм.рт.ст. (7 – 0,5 %
содержание кислорода в воздухе). При парциальном давлении кислорода ниже 5 мм.рт. ст.
значение ККУ снижается от 2 до единицы в бескислородной среде.
Экспериментально показано, что участие кислорода в реализации в реализации
возникающих потенциальных повреждений происходит во время облучения. Так, введение
кислорода в суспензию бактерий, культивируемых в условиях аноксии за 20 мс до
облучения, усиливает их поражение. Добавление кислорода через 10 мс после облучения не
изменяет поражающее действие ионизирующего излучения. Таким образом,
сенсибилизирующее действие кислорода при облучении клеток проявляется только тогда,
когда он присутствует в тканях в момент облучения.
В настоящее время нет четких представлений о механизме сенсибилизирующего
действия кислорода при облучении. Наиболее общепринятой считается точка зрения о том,
что молекулы кислорода, обладая электронноакцепторными свойствами, активно
взаимодействуют с образующимися свободными радикалами, в т. ч. и с радикалами
биологических молекул. Вследствие этого, происходит появление новых активных
свободных радикалов и фиксация возникших в результате облучения потенциальных
повреждений молекул. Фиксация повреждений заключается в стабилизации поврежденной
структуры молекулы, что делает их недоступными или труднодоступными для системы
репарации. Время жизни таких кислородозависимых повреждений может быть длительным.
Например, в макромолекулах такие повреждения сохраняются в течение нескольких часов.
Представления о возникновении скрытых (потенциальных) повреждений в структурах
живых систем при облучении сформировались в 60 –ых годах в результате исследований Т.
Альпера, Л.Эйдуса, П. Александера. В соответствии с этими представлениями, при
облучении молекул определенная часть возникших повреждений в отсутствии кислорода
не проявляются, т.е. не приводят к потере их активности.
Как известно, все процессы репарации молекул требуют затраты энергии, в первую
очередь, энергии АТФ. Синтез большей части молекул АТФ непосредственно зависит от
присутствия свободного кислорода в клетках. Поэтому, присутствие кислорода в тканях
после облучения способствует эффективности репарационных процессов. Показано, что
эффективность восстановления потенциально летальных и сублетальных повреждений
прямо пропорционально концентрации кислорода в клетках.
94
Таким образом, кислород при лучевом поражении живых систем играет
двойственную роль. С одной стороны, он усиливает первичное поражение молекул, с другой
- способствует пострадиационному восстановлению этих повреждений.
Радиосенсибилизаторы - соединения, снижающие радиоустойчивость живых
организмов
Возможность повышения поражающего действия ионизирующих излучений
привлекает внимание ученых и врачей-практиков. Поэтому велись и проводятся
интенсивные поиски соединений, усиливающих поражающее действие радиационного
излучения. Такие соединения могут принести большую пользу при лучевой терапии
онкологических больных.
По своей химической природе сенсибилизаторы могут относиться к различным
классам соединений. Так, радисенсибилизирующим эффектом обладают иодацетамид,
йодуксусная кислота, хлормеркурийбензоат, кетоальдегиды, фторурацил, актиномицин Д.
По механизму действия на живые системы их можно подразделить на 2 группы: а)
усиливающие первичные радиационные повреждения макромолекул б) ингибирующие
процессы пострадиационного восстановления.
По первому механизму действуют соединения с ярко выраженными окислительными
свойствами, которые спосбны отбирать электроны у атомов и молекул и способствовать,
таким образом, образованию ионов и свободных радикалов. К таким соединениям можно
отнести искусственно синтезированные свободные радикалы, такие как тиацетомин –N-
оксин, n-нитроацетофенон, нитраимдазолы, нитрофураны.
По второму механизму действуют различные аналоги азотистых оснований и
антибиотики. В частности, аналоги азотиситых оснований, повышают количество
поврежденых молекул ДНК при облучении за счет ингибирования процессов репарации
макромолекул. Например, 5-фторурацил ингибирует активность тимидилат-синтазы,
фермента, участвующего в синтезе тимина Антибиотик актиномицин Д связывается с
гуаниновым нуклеотидом ДНК и ингибирует синтез и-РНК, и соответственно, белков-
ферментов, участвующих в пострадиационной репарации, например, РНК-полимеразы.
Таким образом, все ингибиторы синтеза нуклеиновых кислот и синтеза белка, являются
эффективными радиосенсибилизаторами.
Радиомимметики – соединения имитирующие действие ионизирующих
излучений.
В 40–ых годах 20 века было обнаружено, что отравляющий газ нервно-
паралитического действия иприт вызывает реакции, сходные с реакциями возникающими в
организме при облучении. В частности, было показано, что иприт подавляет рост
опухолевых клеток, вызывает хромосомные аберрации, задерживает деление клеток. В
последующем такие же эффекты были обнаружены и при действии на живые системы
структурных аналогов иприта.
CH
2
- CH
2
Cl
S иприт
CH
2
- CH
2
Cl
Предполагается, что радиомимметики, как и ионизирующие лучи, повреждают
макромолекулы и снижают эффективность работы репарационных систем. Естественно,
радиомимметики, полностью не могут воспроизводить эффекты, проявляющиеся на
тканевом и организменном уровне при облучении. Это связано с тем, что химическое
вещество не может проникать одновременно во все клетки, ткани и органы, как в случае
ионизирующего излучения.
95
Радиомимметическая способность обнаружена у различных соединений,
содержащих следующие функциональные группировки: ипритную (SCH
2
- CH
2
Cl ),
эпоксидную ( -CH –CH- ), этиламинную (CH
2
- CH
2
), перекисную (-CH –CH- ),
гидроксиперекисную (-CH –CH- ).
добавить
Контрольные вопросы и задания.
1. Какие вещества являются радиомодификаторами?
2. Предложите схему эксперимента для определения модифицирующей активности
химического соединения.
3. Какие химические соединения можно отнести к радипротекторам? Приведите примеры .
4. Объясните физиологические и биохимические механизмы повышения устойчивости
живых организмов при действии радипротекторов.
5. Как Вы понимаете термин «кислородный эффект»? Что означает коэффициент
кислородного усиления?
6. Проявится ли кислородный эффект у анаэробных бактерий при облучении их на
воздухе? Ответ обоснуйте.
7. Увеличится ли ( если увеличится - насколько) поражаемость клеток радиацией при
повышении концентрации кислорода в воздухе:
а) на 5 % б) на 10 % в) на 20 %
8. LD
50
для дрожевых клеток равняется 10 Зв. После обработки их актиномицином Д эта
доза уменьшается до 5 Гр. К какому классу радиомодификаторов относится этот
антибиотик.
9. При облучении бактерий в анаэробных условиях в дозе 50 Гр погибло 50 % клеток.
Какая доза радиации необходима для достижения такого же эффекта при облучении этих
бактерий на воздухе, если ККУ = 3 ?
10. После введения мышам лекарственного препарата, ЛД
50
для них увеличилась с 12 Гр до
15 Гр. Явлется ли этот препарат радиопротектором?
11. Каккие способы Вы можете предложить для повышения эффективности лечения при
радиотерапии злокачественных опухолей?
12. Введение этилового спирта в организм человека и млекопитающих повышает их
устойчивость к облучению. Однако, это соединение не относится к радипротекторам.
Почему?
13. Бригада ремонтников на атомной электростанции работала в течение 2 часов при
экспозиционной мощности дозы гамма-излучения Р
экс
= 0,05 мГр/с. До облучения в
организм рабочих был введен радипротектор с ФИД = 3. Какую эквивалентную дозу
облучения получил каждый работник, и каковы прогнозируемые последствия для его
здоровья?
14. Человек облучался тотально - лучами с Р
экс
= 1 мГр/с в течение часа. Какой диагноз
относительно здоровья этого человека? Какие способы лечения этого облученного Вы
можете предложить?
15. Как можно уменьшить вредное действие ионизирующего излучения на нормальные
ткани при лечении опухолей?
96
Лекция 12 . Природный радиационный фон и источники формирования
радиационного фона
Все организмы, живущие на Земле, подвергаются непрерывному облучению за счет
излучения естественных и искусственных источников ионизирующих излучений, т.е.
радиационного фона. Радиационный фон биосферы формируется за счет излучения
естественных радионуклидов, искусственных источников излучения, находящихся в
окружающей среде и космического излучения.
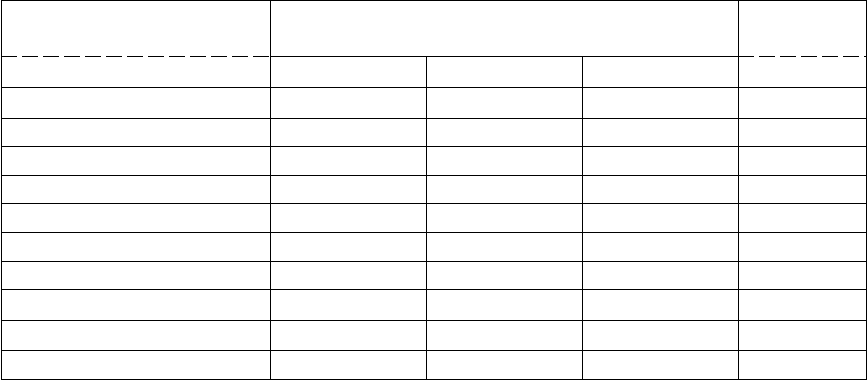
Распространение естественных радионуклидов в природе. В настоящее время
известно более 60 естественных радионуклидов, участвующих в формировании
радиоактивности биосферы. По происхождению они делятся на две группы.
Космогенные радионуклиды— нуклиды, образующиеся в результате взаимодействия
космического излучения с атомами азота, водорода и др. Наибольший вклад в формирование
радиационного фона Земли вносят
3
H,
7
Be,
22
Na,
14
C.
Естественные радионуклиды - нуклиды (продукты деления) радиоактивных семейств
(рядов)
235
U,
238
U и
232
Th, а также
40
К и
87
Rb. Эти нуклиды входят в состав земной коры с
момента образования нашей планеты.
Содержание естественных радионуклидов в окружающей среде варьирует в широких
пределах. В земной коре, например, из всех радиоактивных веществ больше всего
содержится
40
К ( 2,5 %), тогда как содержание урана и тория в десятки и сотни, а радия - в
миллионы раз меньше по сравнению с содержанием радиоактивного калия. Весьма
существенные различия в концентрации радионуклидов отмечаются в почвах разных типов
(таблица 1.).
Естественные радионуклиды обнаруживаются во всех типах природных вод.
Особенно высока их концентрация в подземных водах. Например, в сильно
минерализованных водах, концентрация урана в среднем составляет 5 10
-5
г/л (0,5 мкг/л),
тогда как мягких водах эта величина составляет лишь 2,8 10
-8
г/л.
Таблица 1
Концентрация
40
К,
235
U и
232
Th в почвах различных типов и соответствующие мощности
поглощенной дозы (Р
погл
, мкрад/ч) в воздухе на высоте 1 м от поверхности земли
Типы почв Концентрация элементов, пКи/г Р
погл
мкрад/ч
40
К
235
U
233
Th
Серозем
18 0,85
1,3 7,4
Серо-коричневая 19 0,75 1,1 6,9
Каштановая 15 0,72 1,0 6,0
Чернозем 11 0,58 0,97 5,1
Серая лесная 190 0,48 0,72 4,1
Дерново-подзолистая 8 0,41 0.60 3,4
Подзолистая 4 0,24 0,33 1.8
Торфянистая
2,5 0,17
0,17 1,1
Среднее для планеты
10 0,7
0,7 4,6
Пределы колебаний 3-20 0,3 – 1,4 0,2-1,3 1,4- 9
97
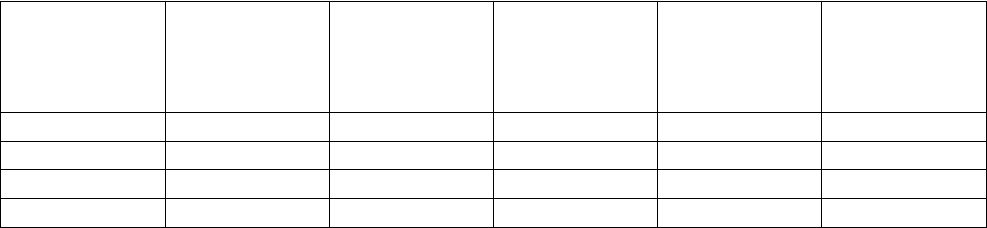
Таблица 2.
Активность естественных радионуклидов, поступающих в организм человека с пищей и
водой (пКи/сут)
Радионуклид Среднее
значение
активности
Пределы
колебания
активности
Радионуклид Среднее
значение
активности
Пределы
колебания
активности
40
К 1000 100-3550
226
Ra 13 0,5-285
87
Rb 125 100-150
228
Ra 11 1,25- 162
210
Pb 23 2-44
238
U 0,3 0,15-2
210
Po 78 2-344
Из естественных долгоживущих радионуклидов в природных водах больше всего
40
К- до
330 пКи/л (в морской воде). Содержание радионуклидов в дождевой воде невелико,
исключение составляют нуклиды
3
Н и
7
Be, концентрация которых может достигать до 40
пКи/л. В составе живых организмов содержание радионуклидов, как правило, ниже, чем в
окружающей среде. Это объясняется тем, что большинство естественных радионуклидов
плохо усваиваются растениями и животными. Интенсивно усваиваются живыми
организмами и включаются в метаболизм
40
К,
14
С и
З
Н. Расчетные данные о возможных
уровнях поступления основных радионуклидов в организм человека приведены в таблице 2.
В атмосферу радионуклиды поступают различными путями. Некоторое количество
радионуклидов попадает в воздух в результате выветривания земных пород и разложения
органических веществ. Определенная доля радиоактивности атмосферы обусловлена
наличием в воздухе космогенных радионуклидов. Существенную роль в радиоактивности
воздушной среды играет диффузия из почвы в приземные слои атмосферы газов радона
(
226
Rn) и торона (
220
Th
), являющихся продуктами радиоактивного распада, соответственно
226
Ra и
224
Ra.
Радиоактивность атмосферного воздуха варьирует в широких пределах и зависит от
местоположения (в атмосферном воздухе над сушей концентрация радионуклидов выше,
чем над океаном), концентрации радионуклидов в земных материнских породах, времени
года, состояния атмосферы и т. д. Средние значения активности радиоактивных аэрозолей в
нижних слоях атмосферного воздуха составляют: -активных аэрозолей - 410
-13
Ки/л,
-активных аэрозолей - 3,1 10
-13
Ки/л. Среднее значенияе концентрации радона и торона в
приземных слоях воздуха составлет около 710
-14
Ки/л. Величина радиоактивнсти воздуха
в жилых домах и рабочих помещениях определяется, в первую очередь, концентрацией газа
радона. Его концентрация внутри помещений зависит, главным образом, от типа
строительных материалов, использованнхы для постройки зданий. Так, в домах,
построенных из дерева, кирпича и бетона, активность радона в воздухе составляет
соответственно 0,41; 1,08 и 3,13 пКи/л. Причина таких различий - неодинаковое
содержание
226
Ra, предшественника радона в строительных материалах. На концентрацию
радона в воздухе помещений влияет интенсивность воздухообмена. При плохой
вентиляции концентрация радона внутри помещений может повышатся в десятки раз.
Космическое излучение. Космическое излучение имеет 3 источника
происхождения: галактическая радиация из дальних районов космоса; радиация в виде
заряженных частиц, образующих циркулирующие слои вокруг Земли; радиоактивное
излучение, сопровождающее вспышки на Солнце.
Галактическое излучение является одним из самых загадочных явлений природы. Оно
состоит главным образом из протонов и -частиц, движущихся со скоростями, близкими к
скорости света. Однако в состав этого излучения входят и более тяжелые ионизирующие
99
частицы, например, ядра атомов железа. Некоторые частицы обладают очень высокой
энергией, которая значительно превышает энергию частиц, ускоряемых в современных
синхротронах. Эти высокоэнергетические частицы ( HZE - частицы) не представляют
какой-либо опасности для живых организмов на Земле, так как большая их часть
отклоняется магнитным полем Земли, а остальная часть задерживается в атмосфере.
Однако, для людей находящихся в Космосе, они представляют реальную опасность. Эти
частицы легко проходят через обшивку космических аппаратов и могут ионизировать
клетки космонавтов. Так, в течение 2-х недель во время экспедиции землян на Луну,
через голову каждого астронавта прошло не менее 100 HZE – частиц, которые разрушили
значительное количество нейронов. Американские ученые предполагают, что долгое
пребывание человека в космосе ( более 1 месяца) может привести к нарушению работы
нервной системы вследствие облучения HZE -частицами.
Радиационные пояса Земли. Вокруг нашей планеты существуют области, в которых
магнитное поле задержало огромное число заряженных частиц, которые по силовым
линиям магнитного поля циркулируют вокруг Земли по замкнутым траекториям. Эти
области с повышенной радиацией получили название радиационных поясов.
Радиационные пояса в основном состоят из электронов и протонов, обладающих
невысокими энергиями. При подъеме на летательных аппаратах, мощность дозы
излучения радиационного пояса возрастает по мере увеличения высоты, начиная с 5 –6
км и до 100 км. Хотя значительная часть излучения радиационных поясов задерживается
обшивкой космического корабля или самолета, мощность дозы внутри корабля при
прохождении этих поясов может достигать 0,1 Гр/ч. К счастью, космические корабли
преодолевают радиационный пояс в течение нескольких минут. Длительные
космические полеты проходят на высоте 200 –300 км. При многократном прохождении
таких поясов при оборотах вокруг Земли, суммарная поглощенная доза радиации может
быть значительной. В силу этих причин, некоторые исследователи полагают, что
длительность пребывания человека в космосе не должна превышать 4-х месяцев.
Солнечное корпускулярное излучение. Большую радиационную опасность для
космонавтов представляют вспышки, периодически возникающие на Солнце. Как
известно, средняя температура солнечной поверхности составляет около 6000 °С.
Периодически часть поверхности Солнца нагревается до нескольких миллионов
градусов. Нагревание поверхности обуславливает появление так называемых солнечных
пятен, которые превращаются во вспышки. Вспышки на Солнце могут продолжаться от
нескольких минут до нескольких часов. Время появления, продолжительность солнечных
пятен и вспышек пока астрономы не могут точно предсказать. Примерная тенденция их
появления имеет 10 –11 летний период. Предполагается , что в 11 летнем цикле
солнечной активности, продолжительность повышенной радиационной опасности может
составлять 10 – 20 часов. По некоторым подсчетам, мощность дозы при солнечной
вспышке на высоте 20 км от поверхности Земли может доходить 3,5 мЗв/ч. Поэтому,
полеты в сверхзвуковых авиалайнерах и космические полеты в период высокой
солнечной активности связаны вероятностью поражения космонавтов в результате
получения дополнительной дозы от солнечных вспышек.
Дозы ионизирующих излучений от естественных источников. Микроорганизмы,
растительные и животные организмы подвергаются непрерывному облучению в
результате воздействия внешнего ионизирующего излучения и излучения от естественных
радионуклидов, находящихся непосредственно в клетках, органах и тканях организмов
(внутреннее облучение).
Доза от внешнего ионизирующего излучения формируется за счет космического
излучения и излучения от естественных радионуклидов, находящихся в среде обитания
растений и животных.
100
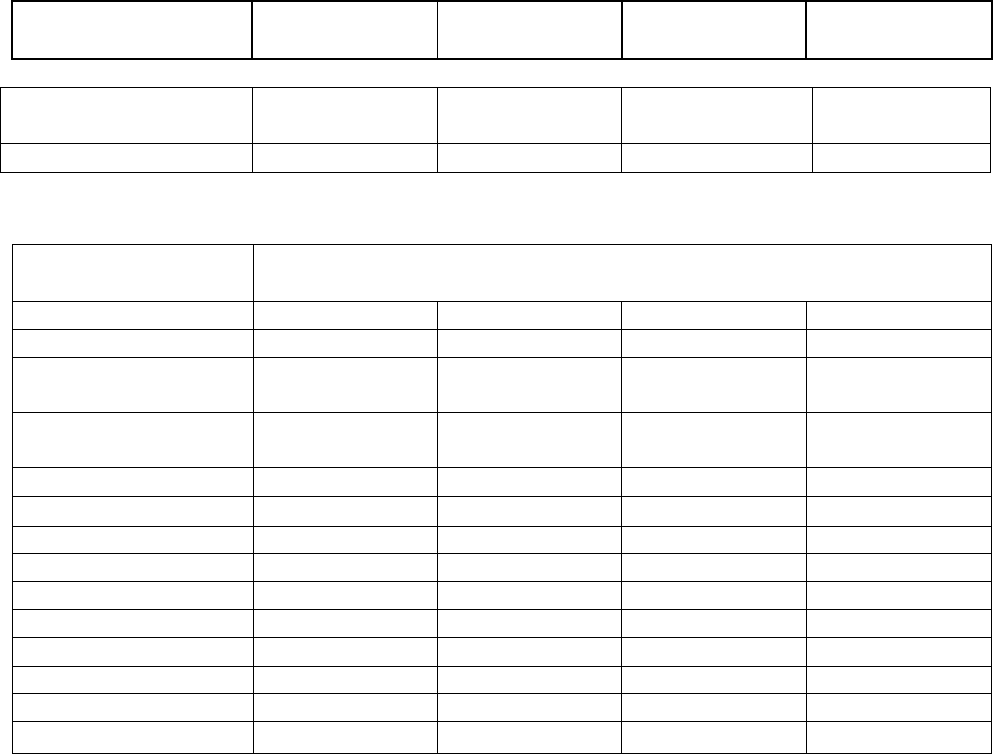
Подсчитано, что средняя поглощенная мощность дозы космического излучения на
высоте уровня моря составляет 3,2 мкрад/ч, а поглощенная доза этого вида излучения в
течение года - 28 мрад (табл. 4). Как отмечалось, интенсивность космического излучения
по мере увеличения высоты над уровнем моря возрастает, и соответственно увеличивается
мощность поглощенной дозы. Например, на высоте 2 км над уровнем моря мощность
экспозиционной дозы 3- 4 раза, а на высоте 3 км - повышается в 5-6 раз выше, чем на
уровне моря.
Доза внешнего излучения от естественных радионуклидов колеблется в широких
пределах. В качестве средней мощности поглощенной дозы в воздухе на высоте 1 м над
поверхностью Земли принимают значение 4,5 мкрад/ч (32 мрад/год), а внутри помещений
- 5,3 мкрад/ч.
Таблица 3.
Поглощенные дозы радиации от природных источников в расчете за год на одного
человека (мрад/год)
Источники облучения Половые железы Легкие Надкостница Красный
костный мозг
Внешнее облучение
Космическое
излучение
28 28 28 28
Земное излучение 32 32 32 32
Внутреннее облучение
Космогенные
радионуклиды:
3
H ()
0,001
0,001
0,001
0,00
7
Be ()
—
0,002
—
—
14
C () 0,5 0,6 2,0 2,2
22
Na ( +)
0,02
0,02
0,02
0,02
Земные радионуклиды
40
К ( +)
15
17
15
27
87
Rb () 0,8 0,4 0,9 0,4
238
U –
234
U () 0,04 0,04 0,3 0,07
230
Th ()
0,004
0,04
0,8
0,05
226
Ra -
210
Po() 0,03 0,03 0,7 0,1
210
Pb -
214
Po ( + )
0,6
0,3
3,4
0,9
222
Rn -
214
Po ()
0,2
30
0,3
0,3
232
Th () 0,004 0,04 0,7 0,04
228
Ra -
208
Tl ()
0,06
0,06
1,1
0,2
220
Rn -
208
Tl ()
0,008
4
0,1
0,1
Всего 78 110 86 92
В районах с повышенным радиационным фоном дозы облучения значительно выше.
Например, в г. Гуарапари (Бразилия), мощность поглощенной дозы варьирует в пределах
100-200 мкрад/ч. В штате Керала (Индия) средняя мощность поглощенной дозы
101
