Лекции - Фізична і колоїдна хімія. Конспект лекцій. Тема 6
Подождите немного. Документ загружается.


Міністерство охорони здоров'я України
Вінницький національний медичний університет ім.М.І.Пирогова
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ
Конспект лекцій
для студентів 2-го курсу денного відділення
фармацевтичного факультету
6. РОЗЧИНИ ЕЛЕКТРОЛІТІВ – ТЕРМОДИНАМІКА ТА
ЕЛЕКТРОПРОВІДНІСТЬ
м. Вінниця, 2004 р.

Лекция 6. Розчини електролітів - термодинаміка та електропровідність
1
Закони Рауля і принцип Вант-Гоффа не виконуються для розчинів, навіть
нескінченно розведених, які проводять електричний струм – розчинів
електролітів. Ці розчини поводять себе так, нібито вони містять більше
частинок розчиненої речовини, ніж це витікає з їх концентрації: підвищення
температури кипіння, зниження температури замерзання, осмотичний тиск
для них завжди більші, ніж розраховані теоретично. Для урахування цих
відхилень у відповідні рівняння було введено поправку - ізотонічний
коефіцієнт:
теор
експ
теорпл
експпл
теоркип
експкип
T
T
T
T
i
π
π
=
∆
∆
=
∆
∆
=
.
.
.
.
З урахуванням цього коефіцієнту відповідні рівняння мають вигляд
TRci
⋅
⋅
⋅
=
π
mEiT
кип
⋅⋅=∆
mКiT
кр
⋅⋅=∆
Ізотонічний коефіцієнт для розчинів електролітів завжди більше одиниці,
причому з розведенням розчину цей коефіцієнт зростає до певного
цілочисельного значення.
Ці факти можна пояснити за допомогою теорії електролітичної
дисоціації, яка базується на постулатах:
1. Електроліти в розчинах розпадаються на іони - дисоціюють;
2. Дисоціація є зворотнім рівноважним процесом;
3. Сили взаємодії йонів з молекулами розчинника і одного з іншим є
слабкими (тобто розчини є ідеальними).
Дисоціація електролітів в розчині відбувається під впливом полярних
молекул розчинника; наявність іонів в розчині веде до його
електропровідності. Для визначення повноти дисоціації в вводиться поняття
ступеню дисоціації
α
αα
α
- відношення числа молекул, що розпались на іони, до
загального числа розчинених молекул.
Ступінь дисоціації виражається в долях одиниці або процентах. Ступінь
дисоціації можна розрахувати за величиною ізотонічного коефіцієнта,
знайденого експериментально при вимірюванні колігативних властивостей
розчинів електролітів.
Величина ступеню дисоціації залежить від природи розчинника та
розчиненої речовини, концентрації розчину та температури. За величиною
ступеня дисоціації електроліти відносять до сильних (α > 0.7), середніх (0.3 <
α < 0.7) та слабких (α < 0.3). До сильних електролітів належать майже всі
солі, більшість неорганічних кислот та лугів, до слабких – всі органічні
кислоти, вода, водневі розчини аміаку, сірководню і т.і. Електролітами
середньої сили є певні неорганічні кислоти – плавікова, ортофосфорна.
Тепер дуже легко визначити зв’язок між ізотонічним коефіцієнтом та
ступенем дисоціації. Якщо в 1 л розчинити C моль електроліту, кожна
молекула якого розпадається на ν
іонів, то при ступені дисоціації, що
дорівнює α розпадеться (продисоциює) (α ⋅ C) моль електроліту, при цьому
утвориться (ν ⋅ α ⋅ C) моль іонів і залишиться не дисоційованим кількість
молекул, що дорівнює (C - α ⋅ C) моль. Загальне число частинок
дорівнюватиме:
C - α ⋅ C + ν ⋅ α ⋅ C = i ⋅ C.

Лекция 6. Розчини електролітів - термодинаміка та електропровідність
2
Звідси (дуже важлива формула):
i = 1 +
α
(ν- 1)
Слабкі електроліти. Константа дисоціації.
Процес дисоціації слабких електролітів є зворотнім і в системі існує
динамічна рівновага, яку можна описати константою рівноваги. Для певного
електроліту, який розпадається у розчині на іони у відповідності до рівняння:
МА ⇔ M
z+
+ А
z-
константу дисоціації можна виразити таким рівнянням:
][
]][[
MA
AM
K
ZZ
Д
−+
=
Оскільки концентрація кожного іона для бінарного електроліту дорівнює
добутку ступеня дисоціації α на загальну концентрацію електроліту С
о
C
mz+
= C
Az-
= C ⋅ α
то
C
MA
= C – C ⋅ α = C ⋅ (1-α)
цей вираз можна надати у вигляді:
V
C
C
CC
K
д
⋅−
=
−
⋅
=
⋅−
⋅⋅
=
)1(1)1(
]][[
22
α
α
α
α
α
αα
де V =
C
1
— розведення, тобто об'єм, в якому міститься 1 моль
електроліту.
Це рівняння має назву закону розведення Оствальда
Експериментальні дослідження показали, що, по-першу, константа
дисоціації сильного електроліту залежить від концентрації (тобто до розчинів
сильних електролітів не можна застосовувати закон діючих мас) і, по-друге,
ніякими методами не було виявлено в розчинах сильних електролітів
непродисоційованих молекул. З цього зроблено висновок, що сильні
електроліти в розчинах будь-яких концентрацій повністю дисоциюють на іони
та, відповідно, закономірності, яки було одержано для розчинів слабких
електролітів, не можна застосовувати до сильних електролітів без
відповідних поправок.
Для сильних електролітів, які повністю дисоціюють на іони, навітіь при
малих концентраціях розчинів енергія електростатичної взаємодії між іонами
достатньо велика, і знехтувати цією взаємодією не можна. Взаємодія іонів з
різними та однаковими знаками заряду веде до того, що поблизу кожного
іона знаходяться переважно іони з протилежним зарядом, які утворюють так
звану іонну атмосферу. Радіус іонної атмосфери порівняно великий, тому
іонні атмосфери сусідніх іонів перекриваються; крім того, кожний іон
оточений дипольними молекулами розчинника - сольватною оболонкою. Т.о.,
в розчині сильного електроліта виникає певна просторова структура, що
обмежує свободу пересування іонів і веде до змін властивостей розчина,
немов би ступінь дисоциації зменшувалась. Тому, при визначенні ступеня
дисоціації розчину сильного електроліта одержують т.з. уявну ступінь
дисоціації, тобто величину з похибкою на міжіонну взаємодію. Чим вище
Лекция 6. Розчини електролітів - термодинаміка та електропровідність
3
концентрація розчину, тим сильніше взаємодія іонів, тим менше і уявна
ступінь дисоциації сильного електроліту.
Але термодинамічні властивості розчинів сильних електролітів можна
описувати за допомогою тих же рівнянь, які використовуються для слабких
електролітів, якщо концентрацію в них замінити активністю.
Активність – це величина, підстановка якої замість концентрації
в термодинамічні рівняння робить їх справедливими для реальних
систем.
Активність дорівнює добутку концентрації на коефіцієнт активності
a
i
= c
i
⋅ y
i
a
i
= m
i
⋅ γ
i
a
mz+
= c
mz+
⋅ y
mz+
де y
i
i γ
i
- відповідно молярний та моляльний коефіцієнти активності.
Активність та коефіцієнт активності можуть бути знайдені кріоскопічним,
ебуліоскопічним, осмометричним, потенціометричним та іншими методами.
Було встановлено, що середні коефіцієнти активності дуже розбавлених
розчинів електролітів залежать від загальної концентрації всіх іонів,
присутніх у розчині, та їх валентностей. В зв'язку з цим ними було введене
поняття «іонної сили» розчину, яка дорівнює півсумі добутків концентрацій
іонів на квадрати їх зарядів:
∑
=
2
2
1
ii
zcI
Коефіцієнт активності одно-одновалентного електроліту та іонна сила
розчину пов’язані рівнянням:
lg y
±
= - A ⋅
I
де y
±
— моляльний коефіцієнт активності; А — константа, що включає
температуру та діелектричну проникність розчинника. Зокрема, для води при
/ = 25 °С А = 0,51.
Для будь-якого електроліту:
lg y
±
= - 0.51 ⋅ |z
K
∗ z
A
| ⋅
I
Цей вираз вірний для граничне розбавлених розчинів і називається
граничним законом Дебая. З цього рівняння випливає, що коефіцієнт
активності зменшується із збільшенням іонної сили і має однакові значення
для будь-яких електролітів однакового зарядного типу при I = const. Все це
має неабиякий вплив на процеси проходження електричного струму через
розчини електролітів.
Електропровідність.
Електричний струм є упорядкованим рухом заряджених частинок.
Розчини електролітів мають іонну провідність, тобто вони є провідниками
другого роду (на відміну від електронної провідності провідників першого
роду). Будь-який провідник, по которому тече струм, характеризується
певним опором R, який є пропорційним до довжини провідника I і обернено
пропорційним площі перерізу S; коефіцієнтом пропорційності є питомий опір
матеріалу ρ - опір проводника довжиною 1 м і пллощу перерізу 1 м
2
:
S
l
R ⋅=
ρ

Лекция 6. Розчини електролітів - термодинаміка та електропровідність
4
Основною характеристикою здатності розчинів проводити електричний
струм використовують електропровідність L, величину, зворотню до опору:
l
S
R
L ⋅==
κ
1
(6.1)
де κ = величина, обернена питомому опору, що називається питомою
електричною провідністю. Звідси
S
lL
⋅
=
κ
Електричну провідність вимірюють в Oм
-1
(См - Сіменс), l - у м, S - у м
2
.
Отже, розмірність питомої електричної провідності:
[κ
κκ
κ] = Ом
-1
• м
-1
= См • м
-1
Питома електропровідність електроліту залежить від низки факторів:
природи електролиту, температури, концентрації розчину. Питома
електропровідність розчинів електролітів (на відміну від електропровідності
проводників першого роду) із
збільшенням температури зростає,
що викликано збільшенням швидкості
руху іонів за рахунок зниження
в’язкості розчину та зменшення
сольватних оболонок. Залежність
питомої електропровідності від
концентрації розчину наведена на
малюнку
(1 - H
2
SO
4
;
2 - KOH; 3 – СН
3
СООН).
При збільшенні концентрації
питома електропровідність спочатку
зростає, а після досягнення певного
максимуму починає зменшуватися. В
найбільшій мірі ця залежність
виражена для сильних електролітів і
набагато гірше - для слабких. Наявність максимуму на кривих пояснюється
тим, що в розведених розчинах сильних електролітів швидкість руху іонів
мало залежить від концентрації, і к спочатку зростає пропорційно числу іонів;
при збільшенні концентрації посилюється взаємодія іонів, що зменшує
швидкість їх пересування. Для слабких електролітів наявність максимуму на
кривої обумовлена тим, що зі збільшенням концентрації зменшується ступінь
дисоціації, а при досягненні певної концентрації кількість іонів в розчині
починає збільшуватися повільніше, ніж концентрація.
Залежність питомої електричної провідності від вищеперелічених
факторів виражається рівнянням:
κ = (u
+
+ u
-
) ⋅ F ⋅ C ⋅ α
де u
+
та u
-
- рухливості катіона і аніона (швидкості при одиничному
градієнті потенціалу). Розмірність рухливості [u] =
⋅
в
м
сек
м
с - молярна концентрація (моль/м
3
),
α - ступінь дисоціації,
Лекция 6. Розчини електролітів - термодинаміка та електропровідність
5
Р - число Фарадея (96500 кл/моль).
На практиці при визначенні питомої електропровідності розчин
електроліту вміщують у кондуктометричну комірку, вимірюють опір і
розраховують к. Для розрахунку к необхідно знати відстань між електродами
l та площу електродів S. Відношення
S
l
, яке називають константою
кондуктометричної комірки, розраховують за допомогою наведених вище
рівнянь, вимірявши опір розчину з точно відомим к (звичайно розчин КСl з
певною концентрацією).
Оскільки залежність питомої електричної провідності від концентрації
має екстремуми, вона не може бути однозначною характеристикою
електричних властивостей розчинів (різним концентраціям відповідають рівні
значення κ), та для урахування впливу на електричн провідність розчинів
електролітів їх концентрації та взаємодії між іонами введено поняття
молярної електропровідності розчину.
Молярна електропровідність розчина λ є величина, оборотна до опору
розчина, який містить 1 моль розчиненої речовини і розташованого між
електродами, відстань між якими складає 1 м. З питомою електропровідністю
к і молярною концентрацією розчина С молярна електропровідність
пов’язана наступним співвідношенням:
C
κ
λ
=
= (u
+
+ u
-
) ⋅ F ⋅ α (6.2)
Розмірність [λ] = Cм∗м
2
/моль
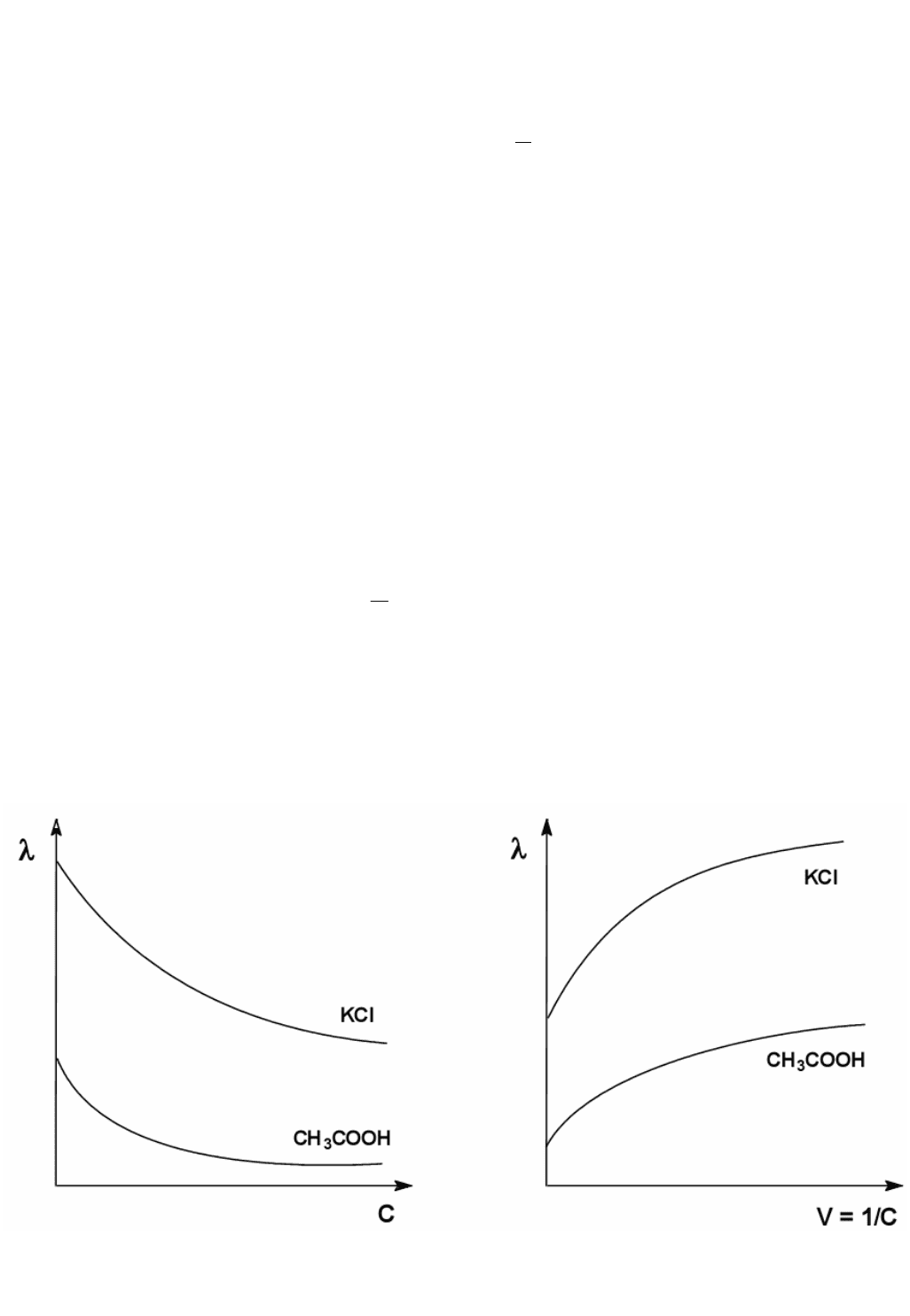
Молярна електропровідность будь-яких (і сильних, і слабких)
електролітів збільшується зі зменшенням концентрації, досягаючи при
нескінченному розведенні певної межі λ
∞
, яку називають молярною
електропровідністю при нескінченному розведенні, або граничною
молярною провідністю (рисунок).
Залежність молярної електро-
провідності від концентрації
Залежність молярної електро-
провідності від розведення

Лекция 6. Розчини електролітів - термодинаміка та електропровідність
6
Для слабкого електроліта така залежність молярної електропровідності
від концентрації обумовлена переважно збільшенням ступеню дисоціації при
розведенні розчину. У сильних електролітів при зменшенні концентрації
послаблюється взаємодія іонів між собою, що збільшує швидкість їх руху і,
відповідно, молярну елекропровідність розчину.
Для слабкого електроліту молярна електрична провідність повільно
зростає із розведенням, але межу практично встановити неможливо, тому що
повна дисоціація слабкого електроліту настає при дуже великих
розведеннях, недоступних для експериментального дослідження. λ
∞
для
слабких електролітів визначається розрахунковим шляхом.
Було показано, що в молярну електропровідність нескінченно
розведених розчинів електролітів кожний з іонів вносить свій незалежний
внесок, тобто, молярна електрична провідність електроліту при
нескінченному розведенні дорівнює сумі іонних електричних провідностей
при нескінченному розведенні.
λ
∞
= (u
+
∞
+ u
-
∞
)
⋅
F =λ
∞
+
+ λ
∞
-
Це положення називається законом Кольрауша, або законом
адитивності електричної провідності при нескінченному розведенні,
або законом незалежності руху іонів.
За допомогою закону Кольрауша можна розрахувати λ
∞
слабких
електролітів, експериментально визначивши λ
∞
для сильних електролітів.
Наприклад, безпосередніми вимірюваннями неможливо визначити граничну
молярну провідність оцтової кислоти, але можно експериментально
визначити граничні молярні провідності сильних електролітів: НСl, NаСl і
СН
3
СОONa. Для цих величин є вірним
λ
∞
HCl
= λ
∞
H+
+ λ
∞
Cl-
λ
∞
CH3COONa
= λ
∞
Na+
+ λ
∞
CH3COO-
λ
∞
NaCl
= λ
∞
Na+
+ λ
∞
Cl-
Склавши перше та друге і віднявши третє, одержуємо вираз для
граничної молярної провідності оцтової кислоти:
λ
∞
HCl
+ λ
∞
CH3COONa
- λ
∞
NaCl
= λ
∞
H+
+ λ
∞
CH3COO-
= λ
∞
CH3COOH
На розглянутих закономірностях базується метод фізико-хімічного
дослідження розчинів – кондуктометрія, який полягає у вимірюванні їх
електричної провідності.
ВИЗНАЧЕННЯ СТУПЕНЯ І КОНСТАНТИ ДИСОЦІАЦІЇ.
Молярна електрична провідність при певному розведенні
λ = (u
+
+ u
-
)
⋅
F
⋅
α
а при нескінченному розведенні
λ
∞
= (u
∞
+
+u
∞
-
)
⋅
F
В розведених розчинах значення рухливостей u
+
i u
-
незначно
відрізняються від граничних значень рухливостей u
∞
+
та u
∞
-
. Отже, маємо
відношення

Лекция 6. Розчини електролітів - термодинаміка та електропровідність
7
∞
=
λ
λ
α
(6.3)
Підставивши значення
α
в закон розведення Оствальда, одержуємо
)(
1
22
λλλ
λ
α
α
−
=
−
=
∞∞
cc
K
(6.4)
Тому, після вимірювання опору розчину спочатку обчислюють величину
питомої електричної провідності за рівнянням (6.1), потім обчислюють
молярну електричну провідність за рівнянням (6.2). Значення λ
∞
розраховують за законом Кольрауша, використовуючи табличні значення
граничних електричних провідностей іонів. Залишається лише підставити
обчислені величини до рівнянь (6.3) та (6.4).
ВИЗНАЧЕННЯ РОЗЧИННОСТІ ВАЖКОРОЗЧИННОГО ЕЛЕКТРОЛІТУ.
Оскільки насичений розчин малорозчинного електроліту практично
нескінченно розбавлений, то молярну електричну провідність такого розчину
можна визначити за законом Кольрауша, використавши табличні дані.
Питому електричну провідність насиченого розчину визначають
експериментально і потім розраховують концентрацію за рівнянням:
∞
−
∞
+
+
−
=
λλ
κκ
OH
с
2
(При вимірюванні к сильно розбавлених розчинів треба враховувати
провідність води).
Визначення концентрації розчину сильного електроліту. Будують
калібрувальний графік залежності κ від С і, вимірявши κ, за графіком
находять значення концентрації розчину. Метод використовується в
автоматичному контролі хімічних виробництв.
КОНДУКТОМЕТРИЧНЕ ТИТРУВАННЯ
Велике практичне значення має кондуктометричне титрування, в якому
точку еквівалентності знаходять за зміною електичної провідності розчину.
Зміна провідності повязана з тим, що в процесі
титрування одні іони замінюються іншими, які мають іншу
рухливість.
При титруванні сильної кислоти лугом електрична
провідність змінюється, як на малюнку. Спочатку велика
(іони Н
+
мають аномально високу рухливість),
зменшується (замість Н
+
з'являються менш рухливі
катіони металу). Мінімальне значення - в точці
еквівалентності. По досягненні точки еквівалентності
провідність зростає (внаслідок високої рухливості іона гідроксилу). Точку
еквівалентності визначають дуже точно графічною екстраполяцією.
Кондуктометричне титрування на відміну від індикаторного є більш
об'єктивним і точним, дозволяє аналізувати мутні і забарвлені розчини,
Лекция 6. Розчини електролітів - термодинаміка та електропровідність
8
визначати дуже слабкі основи і кислоти, аналізувати багатокомпонентні
системи. Кондуктометрія є фармакопейним методом аналізу.
