Лабораторная работа
Подождите немного. Документ загружается.


Федеральное агентство по образованию Российской Федерации
САНКТ- ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ГОРНЫЙ ИНСТИТУТ ИМ. Г.В. ПЛЕХАНОВА
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
Кафедра общей и физической химии
Неорганическая химия
ЛАБОРАТОРНАЯ РАБОТА №6
По дисциплине:неорганическая химия
ИССЛЕДОВАНИЕ ГИДРОЛИЗА СОЛЕЙ
Выполнил: студент ГМ-09-1 ______________
Хромин О.В. (подпись)
Проверил: ассистент _____________
Джевага Н.В. (подпись)
САНКТ-ПЕТЕРБУРГ
2009 г.
Цель работы: ознакомиться с процессом гидролиза солей и его следствиями,
научиться составлять уравнения гидролиза.
Общие сведения
Гидролизом называют процесс химического взаимодействия солей с водой.
Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда
осадки или газы. Соответственно соли, образованные сильной кислотой и сильным
основанием, не гидролизуются. К ним относятся, например, хлориды, нитраты и сульфаты
щелочных металлов, стронция и бария. Различают три типа гидролизующихся солей:
1. Соли, образованные сильной кислотой и слабым основанием, гидролизуются по
катиону. Продуктами реакции являются либо слабое основание, либо растворимый
гидроксокомплекс. Согласно ионным уравнениям, в растворе накапливаются ионы Н
+
,
следовательно, растворы этих солей имеют кислую реакцию, рН<7.
2. Соли, образованные слабой кислотой и сильным основанием, гидролизуются по
аниону с образованием слабой кислоты или иона кислой соли. В растворах солей этой
группы накапливаются ионы гидроксида ОН
-
, в результате чего они имеют щелочную
реакцию, рН>7.
Степень гидролиза солей этих двух групп невелика, не превышает нескольких процентов.
Поэтому гидролиз многозарядных ионов протекает не далее первой ступени, то есть
ограничивается взаимодействием иона только с одной молекулой воды.
3. Соли, образованные слабой кислотой и слабым основанием, гидролизуются по
обоим составляющим их ионам с образованием сразу двух слабых электролитов. Среда в
растворах таких солей зависит от относительной силы образующихся в результате
гидролиза кислоты и основания, но в целом близка к нейтральной. Степень гидролиза
многократно выше, чем у солей первых двух групп, гидролизующихся только по одному
иону, если продуктами гидролиза являются труднорастворимыми соединения или газы, то
гидролиз протекает полностью.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-
Шателье.
1. Чем слабее кислота или основание, образующиеся в результате гидролиза, тем
выше глубина протекания процесса.
2. С увеличением количества воды, то есть с разбавлением раствора, степень
гидролиза возрастает.
3. Поскольку гидролиз всегда протекает с поглощением тепла, является
эндотермической реакцией, степень гидролиза повышается при нагревании
раствора.
4. Гидролиз солей первой группы может быть подавлен добавлением кислоты, а
во второй группе солей – добавлением щелочи.
5. При смешивании растворов солей первой и второй групп происходит взаимное
усиление гидролиза.
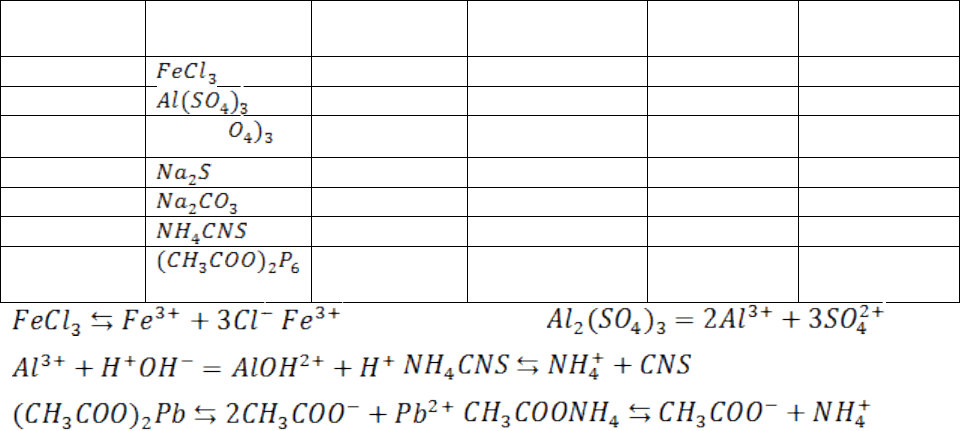
Ход выполнения работы:
Опыт 1. Гидролиз солей.
В отдельные пробирки наливаю по 3-4 капли растворов хлорида железа (III),
сульфата цинка, сульфата алюминия, карбоната натрия и сульфида натрия. Добавляю по
1-2 капли лакмуса и записываю в таблицу окраску каждого из растворов этих солей.
Выливаю содержимое пробирок, промываю их дистилированной водой и вновь наливаю
указанные выше растворы. Добавляю по 1-2 капли фенолфталеина и записываю окраску
растворов.
Номер
опыта
Формула
соли
Окраска
лакмуса
Окраска
фенолфталеина
Характер
раствора
Окраска
метиллоранж
1 красный бесцветный Рн=2 красный
2 красный бесцветный Рн=3 красный
3
Cr(S
красный бесцветный Рн=2 красный
4 синий фиалетовый Рн=11 оранжевый
5 синий прозрачный Рн=12 оранжевый
6 бесцветный прозрачный Рн=7 красный
7
8
бесцветный бесцветный Рн=7 красный
, +HOH=FeOH+H, ,
, ,
,
Опыт 4. Взаимное усиление гидролиза при взаимодействии растворов
двух солей.
2FeCl
3
+3Na
2
CO
3
+3H
2
O=2Fe(OH)
3
+6NaCl+3Cl
2
2Fe
3+
+3CO
3
2-
+3H
2
O=2Fe(OH)
3
+3CO
2
Al
2
(SO
4
)
3
+3Na
2
CO
3
+3H
2
O=2Al(OH)
3
+3Na
2
(SO)
4
+3CO
2
2Al
3+
+3CO
3
2-
+3H
2
O=2Al(OH)
3
+3CO
2
Cr
2
(SO
4
)
3
+3Na
2
S+6H
2
O=2Cr(OH)
3
+3Na
2
SO
4
+3H
2
S
2Cr
3+
+3S
2-
+6H
2
O=2Cr(OH)
3
+3H
2
S
Вывод: Я ознакомился с процессом гидролиза солей и его следствиями,
научился составлять уравнения гидролиза. Также я повторил теорию по
гидролизу солей.
