Лабораторная работа №3 (Муллаянов)
Подождите немного. Документ загружается.


Федеральное агентство по образованию Российской Федерации
Уфимский Государственный Авиационный Технический Университет
Кумертауский филиал
Кафедра ЕН и ОТД
Отчёт
по лабораторной работе №3
«Химическая термодинамика»
Выполнил:
студент гр. ТМ-108
Тимербаев Рафаэль
Проверил:
преподаватель
Муллаянов Р.Х.
2008 г.

ЛАБОРАТОРНАЯ РАБОТА № 3.
«Химическая термодинамика»
Цель работы: определение тепловых эффектов и направления
химических процессов.
Краткая теория
Химическая термодинамика изучает превращение энергии химических
реакций в другие виды – тепловую, электрическую, лучевую.
Химические вещества и системы могут характеризоваться
термодинамическими функциями, которые имеют такое же значение, как
понятие молекулярная и атомная масса, плотность. В химической
термодинамике рассматриваются начальные и конечные состояния
химических систем, их превращения, предсказывается изменение энергий
этих превращений независимо от характера изменений, скорости реакций и
природы промежуточных продуктов, образовавшихся в результате реакции.
Химические процессы, протекающие с выделением тепла, называются
экзотермическими.
Химические процессы, протекающие с поглощением тепла, называются
эндотермическими.
Первый закон термодинамики:
Q= ΔU+A
Для изобарных систем (p-const) тепловой эффект проявляется как
изменение энтальпии (ΔН)
ΔН=ΔU+pΔV
Химические уравнения с приведенными тепловыми эффектами Q и ΔН
называются термохимическими.
Тепловой эффект химической реакции не зависит от промежуточных
стадий процесса.
Закон Гесса
aA+bB=cC+dD+ΔН
0
298 к.р.
ΔН
0
298 к.р.
=d ΔН
0
298 обр.D
+ c ΔН
0
298 к.р.C
- aΔН
0
298 обр.А
- b ΔН
0
298 обр.В
ΔН
0
298 к.р.
=Σ
1
U
1
ΔН
0
298 обр.пр.
- Σ
2
U
2
ΔН
0
298 обр.исх.в.
По закону Гесса можно определить теплоту образования неустойчивых
соединений, теплоту фазовых и агрегатных переходов.
Энтропия – логарифмическая функция вероятности существования
системы, определяющая меру беспорядка в системе.
ΔS=R * ln
беспорядок системы в конечном состоянии
беспорядок системы в исходном состоянии
ΔS=R *2,303*lg V
2
/V
1
Для измерения тепловых эффектов используют калориметры. Теплота,
выделяемая или поглощаемая в калориметре:
Q=(c
1
m
1
+c
2
m
2
+k)*(T
2
-T
1
)
с
1
,с
2
– удельные теплоемкости веществ
m
1
, m2
- массы веществ
k – постоянная калориметра
T
1
, T
2
– начальная и конечная температура
Экспериментальная часть
Оценка энтропии растворения соли.
Опыт проводится в упрощенном калориметре. Нальем 50 мл
дистиллированной воды в реакционный сосуд. Измерим температуру воды
через равные промежутки времени. Занесем эти данные в таблицу 1.
Введем капсулу с солью KCl, массой 0,5 г.
Помешаем и измерим температуру полученного раствора. Занесем
данные в таблицу.
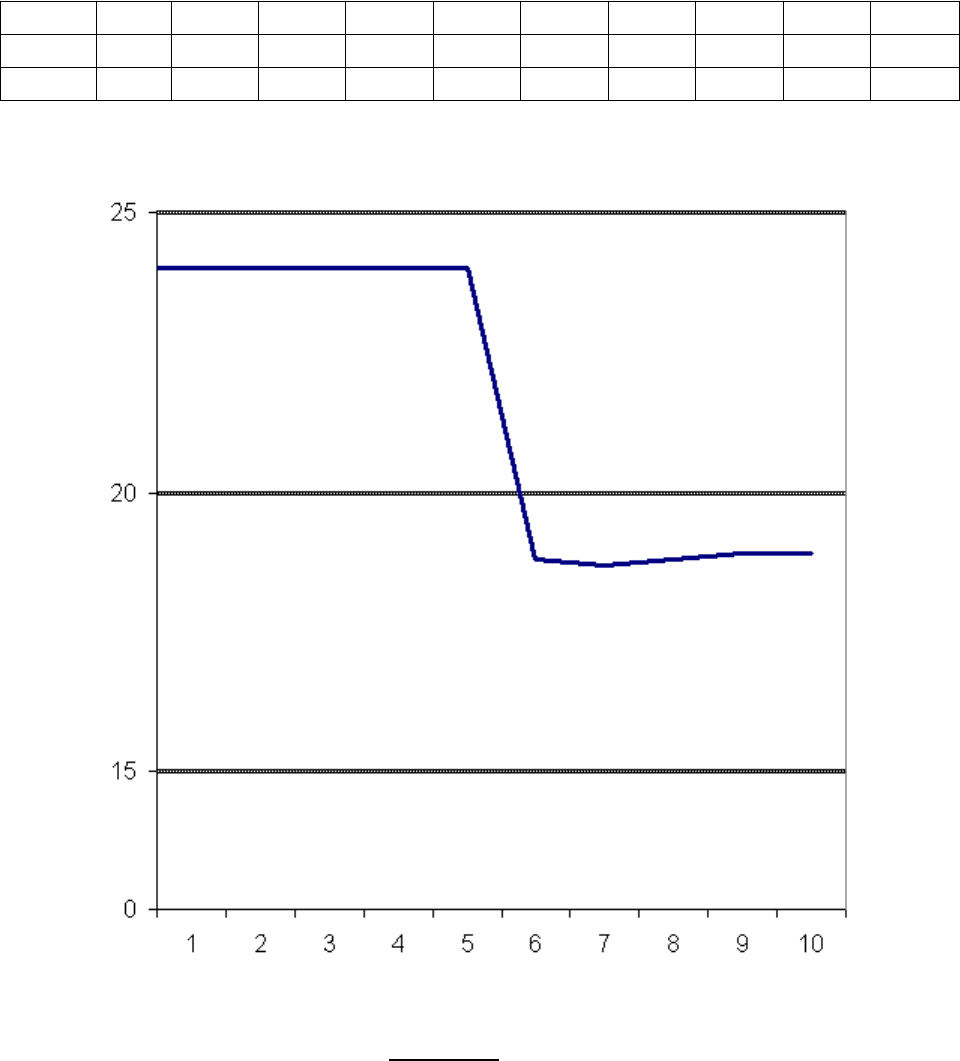
Таблица 1
τ, мин 1 2 3 4 5 6 7 8 9 10
T
1
,
0
C 24 24 24 24 24 - - - - -
T
2
,
0
C - - - - - 18,8 18,7 18,8 18,9 18,9
Используя таблицу, построим график зависимости температуры от времени.
а) Определим тепловой эффект процесса и пересчитаем на моль
вещества по формуле: Q * M
c
ΔН = m
c
* 1000 , кДж/моль (1)
Q – тепловой эффект, Дж
m
с
– масса соли, г
Q=(c
1
m
1
+c
2
m
2
+k)*(T
2
-T
1
) (2)
c
1
=4,185 кДж/кг

c
2
=4,103 кДж/кг
m
1
=50 мл=0,05 кг
m
2
=5 г=0,005 кг
k=150 кДж/кг
ΔТ=5,8
0
С
Подставим данные в формулу (2):
Q=(4,185*0,05+4,103*0,005+150)*(-5,8)=-871,3 кДж
Подставим данные в формулу (1):
M
c
=74,5 г/моль
ΔН=(871,3*74,5)/(5*1000)=12,982 кДж/моль
б) рассчитаем изменение энтропии процесса по формуле:
ΔS=R *2,303*lg V
2
/V
1
R=8,314 Дж/моль
ΔН
р-ра
* M
c
ΔН
m
= m
1
* 1000 = 193,7 кДж/моль
Ответ: Q= Дж.
Вывод: на лабораторной работе мы научились определять тепловые
эффекты, рассчитывать выделенную тепловую энергию.
Расчёт теплового эффекта реакции нейтрализации
NHCl = 0.2 VHCl =8 мл NNaOH =0.4 VNaOH = 50мл МNaCl = 58 г/моль МHOH=18 г/моль
Масса соли NaCl в граммах: m
NaCl
= N
HCl
* V
HCl
* M
NaCl
/1000 = 0.2*8*58/1000= 0,1 кг
mH
2
O = 0.4*50*18/1000 =0.36 кг
∆T = 2,21-1,93 = 0,28 К
Для подсчёта Q
нейтр.
по формуле считается, что с
NaCl
= 4.103 кДж/кг. сH
2
O = 4.1 кДж/кг,
К=239 Дж
Q
нейтр.
= (сH
2
O mH
2
O+ с
NaCl
m
NaCl
+K)∆T =(4,185*10³*0,36+4,103*10³*0,1+239)*0.45=108,4 Дж
кол-во молей соли n
NaCl
= (N
HCl
*V
HCl
)/1000 = 0,2*8/1000 = 0,0016 моль
Полученная величина теплового эффекта выделилась при взаимодействии объёма
кислоты V
HCl
с молярностью М. Вычислим количество молей кислоты n
HCl
, вступившей в
реакцию нейтрализации. Количество молей кислоты составит
n
HCl
= n
NaCl
= 0,0016 моль
Моль кислоты при реакции нейтрализации выделяет ∆H
o
298
= -57 кДж/моль. Найдем
экспериментальное значение молярного теплового эффекта реакции нейтрализации по
формуле
∆H
экспер =
∆H
м нейтр. /
n
кислоты
=108,4/0,0016 = 67750Дж=67,8кДж
Вывод.
Таким образом мы получили экспериментальное значение теплового эффекта, которое
отличается от экспериментального на величину теплоты разбавления кислоты при её
растворении в калориметре.
