Лабораторная работа №1 (Муллаянов)
Подождите немного. Документ загружается.


Федеральное агентство по образованию Российской Федерации
Уфимский Государственный Авиационный Технический Университет
Кумертауский филиал
Кафедра «ЕН и ОТД»
Отчёт
о лабораторной работе №1
Выполнил:
студент гр. ТМ-108
Тимербаев Рафаэль
Проверил:
преподаватель
Муллаянов Р.Х.
2008 г.
ЛАБОРАТОРНАЯ РАБОТА № 1.
Строение атома.
Цель: Экспериментально изучить природу оптических спектров
щелочных и щелочноземельных солей.
Краткая справка
Спектры свободных атомов в газообразном состоянии называются
атомными спектрами. Они состоят из ограниченного числа спектральных
линий, каждая из которых характеризуется определенной длиной волны. Так,
желтое окрашивание пламени газовой горелки при испарении в нем соли
натрия обусловливается характеристической линией спектра натрия.
λ = 589,3 нм
Атомы в возбужденном состоянии испускают световые излучения,
характеризуемые спектральными линиями. При нагревании атома
электрическим зарядом его электроны приобретают избыточную энергию и
переходят на более высокие энергетические уровни (возбужденное состояние
атома). В возбужденном состоянии электроны находятся короткое время (10
-7
– 10
-8
с), далее они возвращаются на низкие энергетические уровни и при
этом излучают энергию в виде спектральных линий.
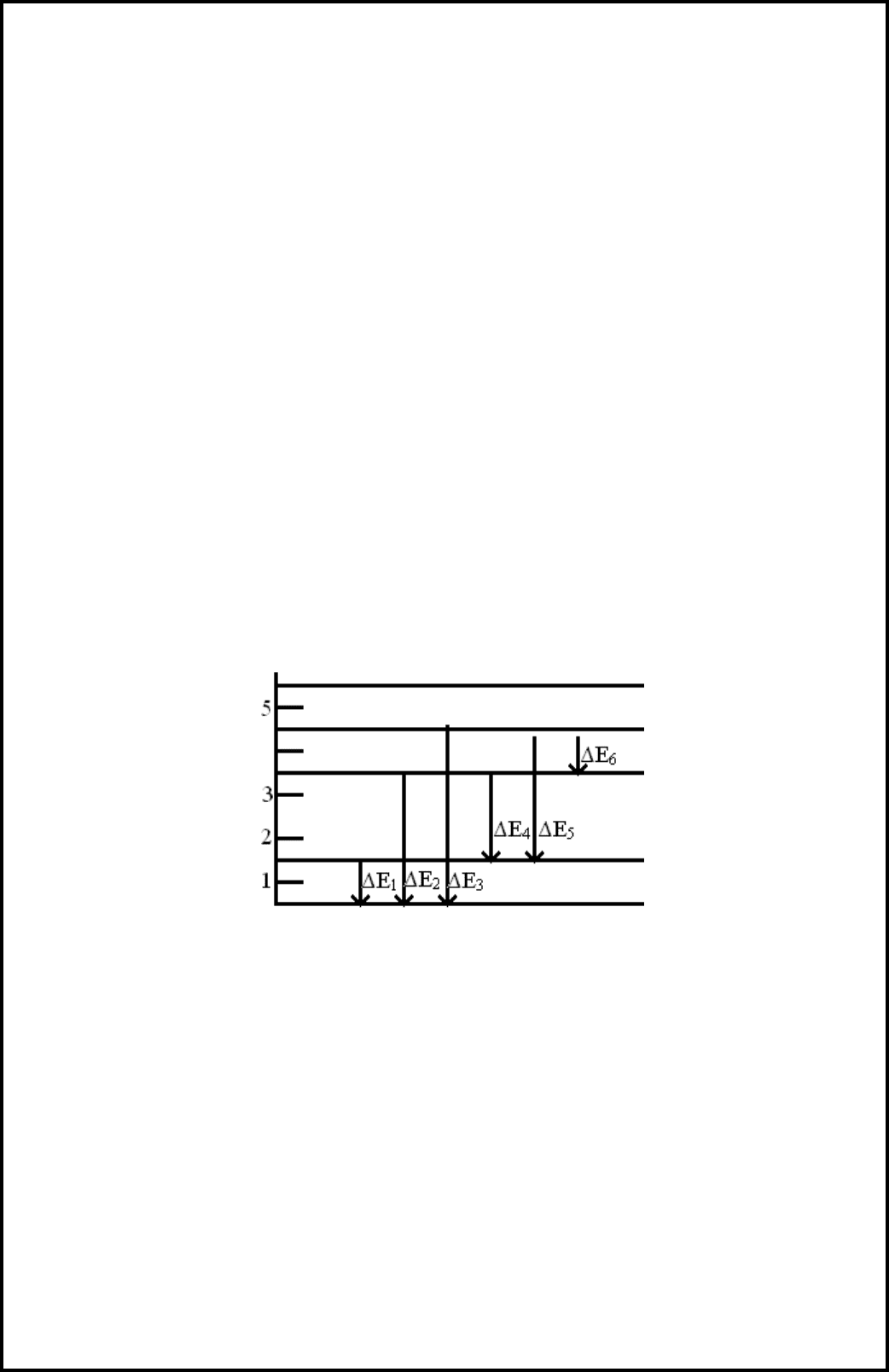
На примере атома лития на рис. 1.2 показаны энергетические уровни
вероятных перескоков наружных s-электронов в возбужденном состоянии на
нижние уровни.
Рис. 1.2 Энергетические уровни вероятных перескоков наружного электрона
в возбужденном состоянии и соответствующие энергии
Избыточная энергия электронов ΔЕ равна разности энергии электронов
на высшем Е
в
и низшем Е
н
уровнях.
Согласно уравнению М. Планка, Е=hv, где h – постоянная планка
(h=6,626*10
-34
Дж/с); v – частота излучения; v = c/λ, где с = 3*10
8
мс
-1
, отсюда
ΔЕ = hc/ λ .
Для щелочных и щелочноземельных металлов длина излучаемых
электронами электромагнитных волн находится в пределах длин волн
видимого света. В таблице 1.1 приведены энергии квантовых уровней, на
которые возможен перескок наружного электрона s-элементов в
возбужденном состоянии.

Таблица 1.1
Энергия наружных электронов s-элементов
на различных энергетических уровнях.
Атомы Е
1
Е
2
Е
3
Е
4
Е
5
Е
6
Li 1,84 - 3,90 4,5 - 5,39
Na 3,027 - - - 5,11 5,14
Экспериментальная часть
Построим диаграмму энергетических уровней вероятных перескоков
наружного электрона атома Li. Пользуясь данными таблицы 1.1, вычислим
значение ΔЕ и длину волны, соответствующую этому переходу.
ΔЕ
31
=3,9-1,84=2,06
ΔЕ
41
=4,5-1,84=2,66
ΔЕ
61
=5,39-1,84=3,55
ΔЕ
43
=4,5-3,9=0,6
ΔЕ
63
=5,39-3,9=1,49
ΔЕ
64
=5,39-4,5=0,89
λ
31
=1240,8/2,06=602нм
λ
41
=1240,8/2,66=467нм
λ
61
=1240,8/3,55=350нм
λ
43
=1240,8/0,6=2068нм
λ
63
=1240,8/1,49=833нм
λ
64
=1240,8/0,89=1394нм
Построим диаграмму энергетических уровней вероятных перескоков
наружного электрона атома Na. Пользуясь данными таблицы 1.1, вычислим
значение ΔЕ и длину волны, соответствующую этому переходу.
ΔЕ
51
=5,11-3,027=2,083
ΔЕ
61
=5,14-3,027=2,113
ΔЕ
65
=5,14-5,11=0,03
λ
51
=1240,8/2,083=596нм
λ
61
=1240,8/2,113=587нм
λ
65
=1240,8/0,03=41360нм
Таблица 1.2
Значения длин волн в видимой области спектра
λ, нм цвет λ, нм цвет
390-410 фиолетовый 540-580 желтый
420-450 синий 580-610 оранжевый
470-530 зеленый 620-780 красный
Опыт № 1
В чашку налили 5 мл спирта, зажгли ее и насыпали в пламя небольшое
количество соли LiNO
3
. Цвет пламени изменился на красный. По таблице 1.2
определили, что такая окраска пламени соответствует длинам волн в 620-
780нм. Сопоставим значения длин волн для красного цвета с расчетными
длинами волн Li. После сравнения можно сказать, что данная красная
окраска пламени вследствие излучения атома в возбужденном состоянии при
помещении его в пламя, обусловлен переходом электрона с 3 уровня на
первый.
Опыт № 2
В чашку налили 5 мл спирта, зажгли ее и насыпали в пламя небольшое
количество соли NaNO
3
. Цвет пламени изменился на оранжевый. По таблице
1.2 определили, что такая окраска пламени соответствует длинам волн в 580-
610нм. Сопоставим значения длин волн для оранжевого цвета с расчетными
длинами волн Na. После сравнения можно сказать, что данная оранжевая

окраска пламени вследствие излучения атома в возбужденном состоянии при
помещении его в пламя, обусловлен переходом электрона с 5 уровня на
первый.
Вывод: на лабораторной работе мы экспериментально изучили
природу оптических спектров для солей LiNO
3
и NaNO
3
. В первом опыте
произошел переход электрона с 3 уровня на первый, а во втором опыте
переход электрона с 5 уровня на первый.
