Курсовой проект - Екстремальні гіпертермофільні археї
Подождите немного. Документ загружается.

42
6.2. Термостабільність білків і ферментів
Багато дослідників вважають, що визначальна роль в термофілії
належить білкам, в першу чергу ферментним. Виділяють декілька основних
факторів їх термостабільності :
1.Особливості амінокислотного складу.
При температурах вище 100°C, стабільність амінокислот знижується в
ряду:
(Val,Leu)>Ile>Tyr>Lys>His>Met>Thr>Ser> Trp>(Asp, Glu, Arg, Cys)[51]
Виходячи з відносно повільного росту гіпертермофільних архей, період
напіврозпаду найбільш нестабільних амінокислот значно коротший ніж
період регенерації цих організмів. Тому деякі амінокислоти проходять
прискорену ковалентну модифікацію, що включає дезамінування, ß-
окислення, гідроліз, утворення дисульфідних містків та інші реакції, за
максимальної температури, тиску і крайніх значень pH, які гіпертермофіли
можуть витримувати[52]. Деякі амінокислоти більш стійкіші, знаходячись в
гідрофобному ядрі протеїнів, ніж у водних розчинах. Незважаючи на це, Asp,
Glu, Arg, Cys зустрічаються в термостабільних варіантах деяких загальних
білків значно рідше[18]. Крім цього, додатковий захист архебактеріальних
білків від денатурації в екстремальних умовах забезпечується збільшенням
вмісту неполярних амінокислотних залишків (наприклад, для протеїнів
Pyrococcus furiosus співвідношення неполярних і полярних амінокислотних
залишків складає 3 : 1)[7]
2.Гідрофобні взаємодії.
Щільно, ефективно упаковане гідрофобне ядро є загальною
особливістю термостійких глобулярних протеїнів гіпертермофілів[18]. Слід
зазначити, що в даний час вплив температури на гідрофобні взаємодії
активно вивчається, але однозначної відповіді все ще не знайдено. Є
свідчення, що збирання субодиниць термостійкого ферменту
43
глутаматдегідрогенази проходить лише за високих температур завдяки
гідрофобним взаємодіям. Причому за відносно помірних умов частково
зібрані ферменти знаходяться в „замороженому” стані, а включаються лише
за оптимальної температури[53]. Ця система демонструє пристосованість
гіпертермофілів до високотемпературних умов проживання.
3.Іонні взаємодії.
Кислотні чи основні бокові групи амінокислотних ланцюгів на поверхні
субодиниць або доменів ферментів сприяють їх кооперативному
зв’язуванню[18]. Іонні взаємодії за природою діють на значно більш довших
радіусах ніж гідрофобні, і є відносно стійкішими до змін структури води за
високих температур. Тому найбільш широко поширені мережі іонних
взаємодій спостерігаються в протеїнах екстремальних гіпертермофілів
( наприклад, глутаматдегідрогенази Pyrococcus furiosus ) порівняно з
відповідними в термофілах або мезофілах[53].
4. Кооперативна Асоціація.
Міжмолекулярні асоціації можуть попередити процес дисоціації
мономерів олігомерних білків. Тому багато ферментів, які в мезофілах
знаходять мономерними, в гіпертермофільних представників формують
олігомери. (Наприклад, хорізматмутаза
Methanococcus
jannaschii в процесі
термоадаптації набула тетрамерної організації)[54].
5.Фіксація білкових N-,C-кінців.
Доведено, що термінальні N-,C-кінці багатьох гіперстабільних білків
зафіксовані для запобігання розплітанню і денатурації протеїнів ( Наприклад,
кінцева карбоксильна група димерної гіпертермофільної цитратсинтази,
знаходячись в місці з’єднання мономерів, захищена від негативних взаємодій
і від самочинного вивільнення )[18].
6.Великий вклад в термостабільність вносять також координаційні,
водневі, дисульфідні та ароматичні зв’язки, а також додаткова стабілізація
ά-спіралей глобулярних білків[10].
44
Для гіпертермофілів характерна наявність великої кількості шаперонів.
Термостабільні білки теплового шоку (шаперони сімейств Hsp60 і Hsp70) при
зв'язуванні з іншими протеїнами роблять їх стійкішими до нагрівання. Так, в
гіпертермофільних архебактерій роду Pyrodictium 80 % цитоплазматичних
білків - шапероніни, що складаються з декількох субодиниць - шаперонів
сімейства Hsp60. Шапероніни архей близькі по будові еукаріотичним,
складаються з 3 різних мономерів, утворюючи 8- і 9-членні кільця. Шаперони
сімейства Hsp90 в архей поки не знайдені[55].
Слід додати, що основні температурні точки гіпертермофілів залежать
від конформації одного або декількох ключових ферментів: при мінімальних
температурах білкові молекули переходять до жорсткої неактивної
конформації; оптимальна температура визначає найбільш сприятливий
конформаційний стан ферментних білків; при максимальній температурі
починаються порушення структури білків і зниження їх ферментативної
активності, а за вищих температур ріст організмів припиняється унаслідок
теплової денатурації білків[2].
6.3. Термостабільність ДНК та інших нуклеїнових кислот
Стійкість ДНК до денатурації в екстремальних умовах проживання
гіпертермофільних архей може забезпечуватися ДНК-зв'язуючими білками -
аналогами гістонів еукаріот, поліамінами, відносно високим вмістом
нуклеотидних залишків G і C[7]. Зв'язування гістонів з еукаріотичними ДНК
призводить до її негативної спіриалізації, тоді як для комплексів ДНК з
білком HMf архей Methanobacteriales характерна позитивна
суперспіриалізація[56]. Клітинні поліаміни, що стабілізують ДНК і вторинні
структури РНК, в гіпертермофільних архей досить різноманітні : лінійні
триаміни (спермідин, норспермідин і гомоспермідин), тетрааміни (спермін і
норспермін), пента- і гексааміни, гуанідоамін (агматин), четвертинний
пентаамін N4-біс(амінопропіл)спермідин та ацетильований пентаамін[57].
45
Крім цього, денатурація ДНК за високих температур зменшується завдяки
присутності стабілізуючого фактора -- циклічного 2,3- дифосфогліцерата ( в
присутності K
+
), але лише в деяких гіпертермофілах[10]. Незначна кількість
ДНК-зв'язуючих білків, названих Sac7d, виявлена в членів роду Sulfolobus
(Сrenarchaeotа ), вони підвищують температуру плавлення ДНК приблизно
на 40°C[33] . Натомість Euryarchaeotа містять вищезгадані гістоноподібні
протеїни, які зумовлюють компактну укладку ДНК в подібні до нуклеосоми
структури, захищаючи її таким чином від теплової денатурації.
Серед гіпертермофільних архей діють ефективні механізми репарації та
відновлення нативної структури ДНК. Так, американський мікробіолог
Денніс Гроган виявив в Sulfolobus acidocaldarius особливий світлозалежний
процес відновлення пошкоджених ділянок ДНК, відомий як
„фотооживлення”[56]. Цікавим виявилось те, що даний механізм відмінно
працював лише за кімнатних температур, які далекі від оптимальних для
даної групи мікроорганізмів, а також те, що пошкодження ДНК, здійснені
ультрафіолетовим випромінюванням, були більш відчутнішими, ніж
здійснені високою температурою. Можливо, в термальних біотопах головним
агресивним щодо ДНК фактором є короткохвильова частина сонячного
спектра, ніж екстремально високі температури.
6.4. Межі термоадаптації
Лабораторні дослідження доводять, що межі високотемпературної
витривалості екстремальних архей лежать в діапазоні від 140 до 150°C[33].
Такі умови в природі реалізуються лише в глибоководних гідротермальних
джерелах ( типу „ чорних курців”). З’являються дані про ідентифікацію архей
за температур більш ніж 250°C[2]. Це видається можливим завдяки високим
тискам за яких вода не кипить, бо життєво необхідною умовою існування є
наявність води саме в рідкому агрегатному стані[12]. Цікавим видається те,
46
що в таких випадках АТФ не може слугувати енергетичним ресурсом, бо
переходить в інші нестабільні форми[33]
Розібрані вище гіпотези, імовірно, вносять певний вклад в механізми
термофілії, доповнюючи один одного, хоча не виключено, що молекулярні
механізми цього явища можуть бути значно ширше і для їх розуміння
необхідні додаткові дослідження.
7. КОРОТКА ХАРАКТЕРИСТИКА ОКРЕМИХ ПРЕДСТАВНИКІВ
ГІПЕРТЕРМОФІЛЬНИХ АРХЕЙ
Тип: Nanoarchaeota. Рід: Nanoarchaeum. Вид: Nanoarchaeum equitans
Nanoarchaeum equitans (або наноархей) – унікальний вид
гіпертермофільних архей, знайдений в 2002 році в гідротермальних джерелах
біля узбережжя Ісландії німецьким мікробіологом Карлом Шеттером (Karl
Stetter), єдиний відомий до теперішнього часу представник типу
Nanoarchaeota[26]. Може розвиватися лише в кокультурі з археями роду
Ignicoccus з царства Crenarchaeota , що є унікальним явищем серед
екстремальних архей. На одній клітині Ignicoccus паразитує від 2 до 4 клітин
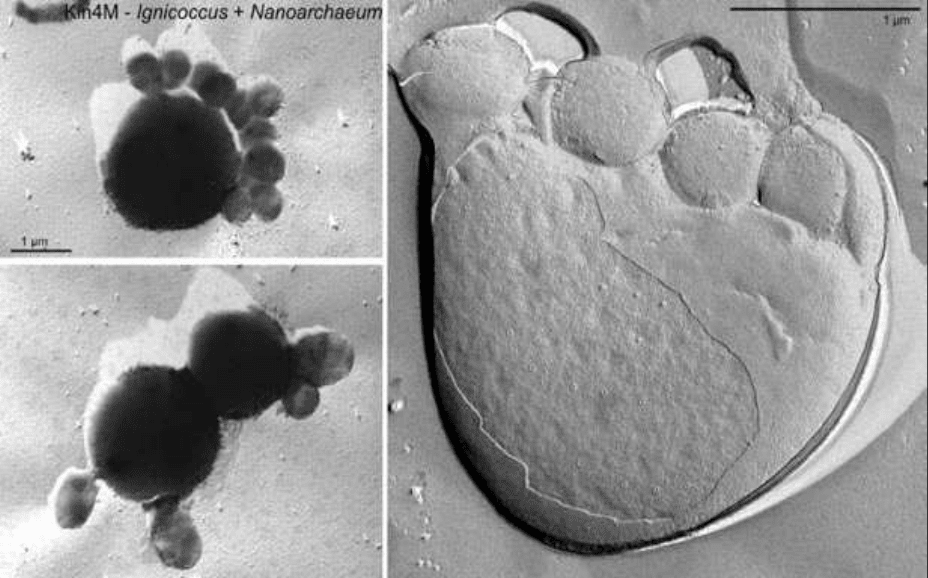
Nanoarchaeum equitans, діаметр яких 0,35-0,50 мкм ( Рисунок 7.1) – це одні з
найменших живих організмів[23]. Клітинна стінка наноархей складається з S-
шару, який, здається, вкриває периплазматичний простір. У місці їх контакту
прикріплювальних структур не виявлено[33]. Відділення Nanoarchaeum
equitans від клітин Ignicoccus може бути викликане м'яким ультразвуковим
опроміненням. При культивуванні кокультури в штучних умовах на пізній
експоненціальній фазі росту спостерігалося самостійне відділення близько
80% клітин Nanoarchaeum equitans від Ignicoccus[58].
47
Метаболізм Nanoarchaeum equitans поки не відомий. Вони не
розмножуються у відсутності живих клітин Ignicoccus. Nanoarchaeum equitans
строгі анаероби. Оптимальна температура проживання цих архей складає
90°C[58].
Рисунок 11 -- Електронні мікрофотографії клітин Nanoarchaeum
equitans (менші) на поверхні Ignicoccus штаму
Kin 4M (більші)[23].
Їх геном повністю секвенований і складає 490 885 пар основ. Це
найменший геном (менше лише у вірусів), який поки що вдалося
зафіксувати. В Nanoarchaeum equitans залишилися лише гени, що
відповідають за біосинтез білка, реплікацію, транскрипцію і трансляцію, 95
% генома кодують білки. Nanoarchaeum equitans не можуть синтезувати
ліпіди, нуклеотиди і амінокислоти отримуючи їх від Ignicoccus, можливо
вони також залежать від енергетичного метаболізму господаря[26].
Швидкість росту Ignicoccus в чистій культурі і кокультурі з Nanoarchaeum
equitans не відрізняється, лише дуже велике число наноархей пригнічує
48
розвиток Ignicoccus. У зв'язку з цим Nanoarchaeum equitans можна розглядати
як паразитів, що робить їх єдиними відомими паразитами серед архей[10].
Nanoarchaeum equitans виділені з гарячих сірчаних джерел Серединно-
атлантичного хребта на глибині 106 м. Пізніше 16s рРНК наноархей з
послідовностями, схожими на Nanoarchaeum equitans, виявили в чорних
курцях Тихого океану, у гейзерах Йеллоустона і Камчатки. Методом FISH
встановлено, що всі Nanoarchaeota прикріпляються до клітин інших архей,
тому паразитизм може бути характерною ознакою всього типу[58].
Тип: Euryarchaeota. Рід: Thermococcus.
Вид: Thermococcus kodakaraensis
Раніше відомий як представник роду Pyrococcus, Thermococcus
kodakarensis - гіпертермофільний архей, метаболізм якого пов’язаний з
молекулярною сіркою; зазвичай населяє морські гідротермальні джерела і
наземні гарячі сірковмісні сольфатари. Вперше був виявлений в сольфатарах
острова Кодакара (Японія), завдяки якому і отримав свою назву. Цей
унікальний мікроорганізм представляє значний інтерес для науковців,
оскільки розвинув особливі механізми адаптації до надзвичайно
високотемпературних умов. Крім цього, він виробляє комерційно цінні
термостійкі ДНК-полімерази та інші ферменти, які використовуються для
реалізації ПЛР (Полімеразної Ланцюгової Реакції)[19]. Thermococcus
kodakarensis росте за оптимальної температури 86°C, в діапазоні 60-100°C, і
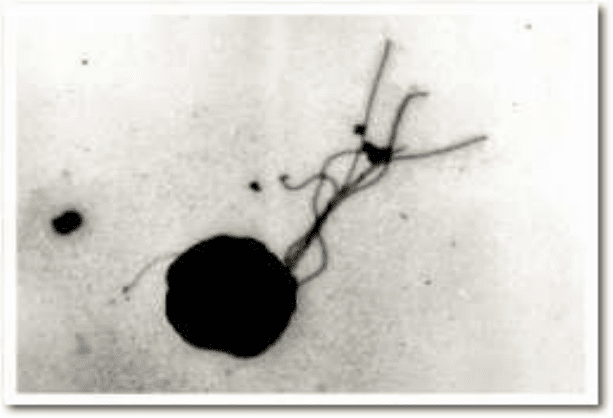
при pH 5-9. Клітини мають форму нерегулярних кокків (1-2 мкм в діаметрі) з
єдиною ліпідною мембраною і рухливі завдяки полярним жгутикам (
Рисунок 7.2)[23]. Це строгі анаероби що окрім сірки, використовують як
джерела вуглецю та енергії амінокислоти, пептиди, піруват та крохмаль.
Метаболічні шляхи T. kodakarensis включають глюконеогенезис і гліколіз;
продукти метаболізму - водень і сірководень[33].
49
Рисунок 12 --Мікрофотографія характерної клітини гіпертермофільної
археї Thermococcus kodakarensis[23]
Нещодавно японські біохіміки виявили в Thermococcus kodakarensis
незвичайний спосіб фіксації вуглекислого газу, що відрізняється від циклу
Кальвіна безпосередньою участю в ньому рибонуклеотидов
(АМФ).Можливо, цей спосіб фіксації неорганічного вуглецю найдревніший з
тих, що були відомі до цих пір[59].Thermococcus kodakarensis відіграють
важливу роль в екології гідротермальних систем і зустрічаються в багатьох
гіпертермофільних мікробних співтовариствах.
Тип: Crenarchaeota. Рід: Pyrodictium. Вид: Pyrodictium occultum
Pyrodictium occultum – яскравий представник гіпертермофільних архей
з оптимальною температурою росту приблизно в межах 80°C-105°C,
метаболізм якого тісно пов’язаний з молекулярною сіркою. Має унікальну
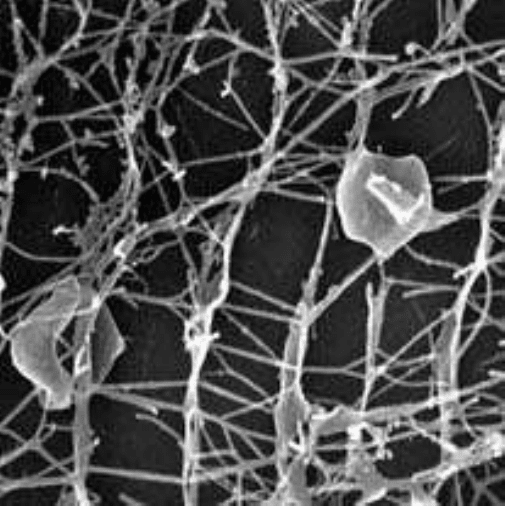
клітинну структуру, що включає мережу порожнистих канальців і плоских,
дископодібних клітин -- 0.3 - 2.5 мікрон в діаметрі і аж до 3 мікрон в ширину
( Рисунок 13)[43].
50
Рисунок 13 -- Мікрофотографія дисків і канальців Pyrodictium occultum[43].
Поки точна причина такої морфології невідома, ймовірно, що діапазон
рухливості, забезпечений порожнистими канальцями, дозволяє клітинам
вільно переходити в найбільш сприятливі місця існування, дозволяючи
Pyrodictium occultum населяти різноманітні щілини в глибоководних
пористих стінках гідротермальних джерел „чорних.курців”[10].
Екологічна роль даних архей досі нез’ясована через труднощі
виділення непошкоджених клітин мікроорганізмів і недослідженість
природних біотопів Pyrodictium.
51
8. ПРАКТИЧНЕ ЗНАЧЕННЯ І ВИКОРИСТАННЯ В БІОТЕХНОЛОГІЇ
Практичне використання гіпертермофільних архей перш за все
пов’язане з комерційною цінністю їх термостабільних ферментів, до яких
прикутий зростаючий інтерес з боку наукових та індустріальних кіл. З
появою потужних сучасних інструментів молекулярної біології та значної
кількості описаних і виділених гіпертермофільних ензимів, їх впровадження
в нові технологічні процеси зростає з року в рік[43]. Але на даний час
використовують лише невелику частину відомих термостабільних ферментів
і тому доцільно розглянути й подальші перспективи на наступні роки.
8.1. Використання в молекулярній біології
Найбільш поширеного використання набули термостабільні ДНК-
полімерази (Tfu-ДНК-полімерази) з гіпертермофільних архей Pyrococcus
furiosus, оптимум роботи яких знаходиться в області 72°С; їх впровадження в
метод ПЛР призвело до забезпечення як високої процесивності (протяжності
ділянки, що синтезується за одне зв'язування ферменту, і в результаті
швидкості синтезу), так і високої точності копіювання ДНК [19]. Крім того,
що ця полімераза витримує високу (94—96°C) температуру, необхідну для
денатурації ДНК, у неї присутній механізм корекції помилок у 3'→5'
напрямку (3'→5' екзонуклеазна активність)[54].Такі полімерази дозволили
значно скоротити число мутацій, які зустрічаються в копійованій
послідовності ДНК, якісно вдосконаливши метод ПЛР, що в наш час широко
використовується в біологічній і медичній практиці, наприклад для
клонування генів, введення мутацій, виділення нових генів, секвенування,
для створення генетично модифікованих організмів, діагностики
захворювань (спадкових, інфекційних), ідентифікації малих кількостей ДНК,
встановлення батьківства.
