Костецкий Э.Я. Как возникла жизнь.Теория возникновения протоклеток и их структурных компонентов. Часть 1
Подождите немного. Документ загружается.

т.е. способность значительно нарушать стехиометрию состава (Са/Р=1,67-
1,50) при изменении рН без изменения основных параметров структуры, и
др. Расположение фосфатных групп в кристалле апатита сходно с их
расположением в Z-форме ДНК. Соответствие кристаллохимической
характеристики апатита с характеристикой Z-формы ДНК выражается в
следующем: возможность выбора в апатите левой спирали из фосфатов;
сходство расстояний от оси в апатите и ДНК (около 9 Å); одинаковое
количество фосфатных остатков, приходящееся на один оборот (12 пар); шаг
спирали ДНК в Z-форме 44,6 Å, или 12 пар нуклеотидов, хорошо
соответствует высоте 6 элементарных ячеек (43,3 Å); поворот цепей
полиэдров в апатите на 30
0
и период трансляции 3,4 Å согласуется с
поворотом спирали Z-формы ДНК на один нуклеотид (30
0
) и проекцией
нуклеотида на ось спирали (3,4-3,7 Å); расстояние между атомами фосфора
комплементарных пар в Z-форме для d(ГфЦ) – 15 Å – и d(ЦфГ) – 12,5 Å –
близки к расстояниям между соответствующими фосфатами в апатите (15,3 и
13,1 Å); расстояние между атомами фосфора, соответствующими одной
«полинуклеотидной цепи» в апатите, близко к расстоянию в нуклеиновой
кислоте (~6 Å) [4, 5].
Кристаллохимические особенности апатита наряду с синтезом ДНК
допускают одновременный синтез белковых цепей гистонов, коллагена и
других белков (рис. 1, Б; 4; 5).
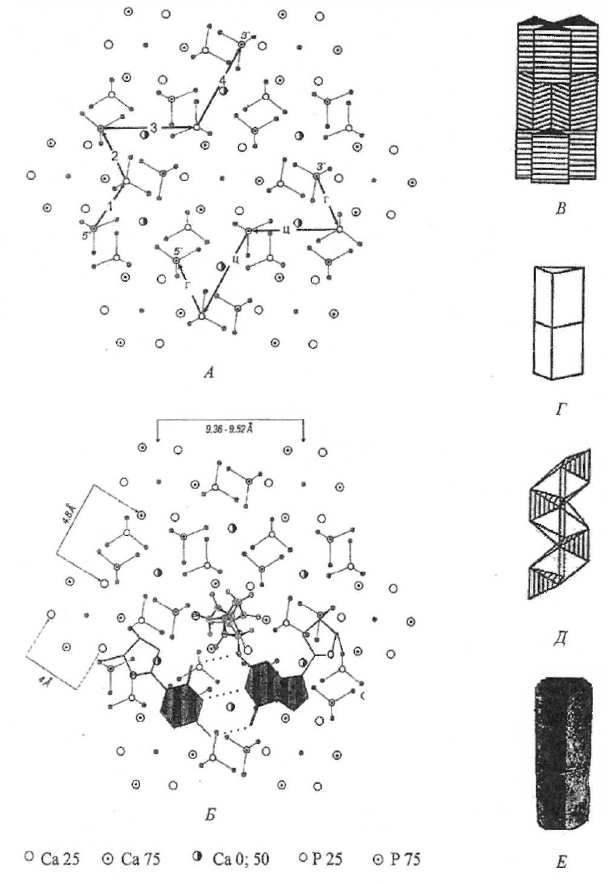
Рис. 1. Структура апатита. А – гексагональная ячейка, вид сверху, по данным рентгеноструктурного
анализа [26, 43] с указанием направления комплементарных цепей ДНК. Б – гексагональная ячейка, вид
сверху, с указанием положения dГфЦ-пары, взятой из Z-формы ДНК, и фрагмента пептидной цепи (в
центре) [4, 5]. В-Д – по Н.В. Белову [6, с. 9]: В - призмы с катионами CaII, Г – призмы с катионами CaI, Д –
анионы РO
4
. Е – апатит с горы Витоша, Болгария (4/5 натуральной величины). Числа указывают доли от
высоты элементарной ячейки: 0, 25, 50, 75, 100; стрелками показано направление полинуклеотидных цепей.
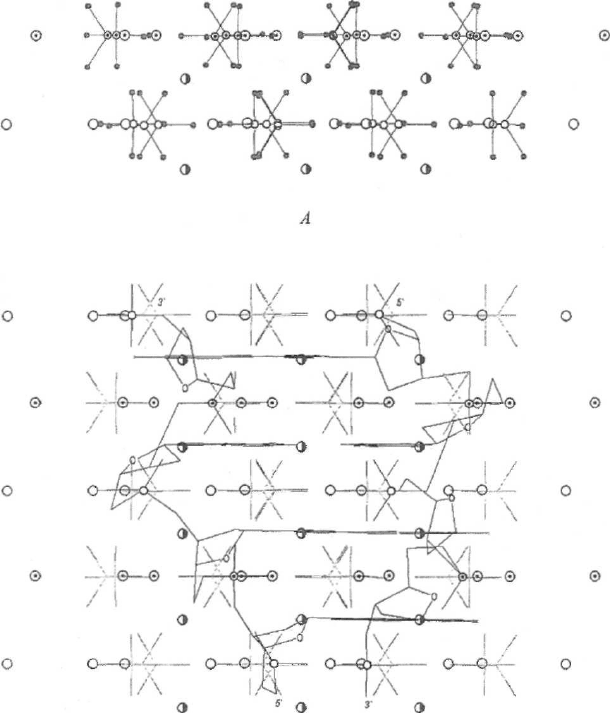
Рис. 2. Структура апатита, вид сбоку (компьютерная графика). А - по данным рентгеноструктурного
анализа [26, 43]; Б - с цепями ДНК, введенными в его состав (структура апатита допускает наклон
оснований до 10
0
). Условные обозначения см. на рис. 1.
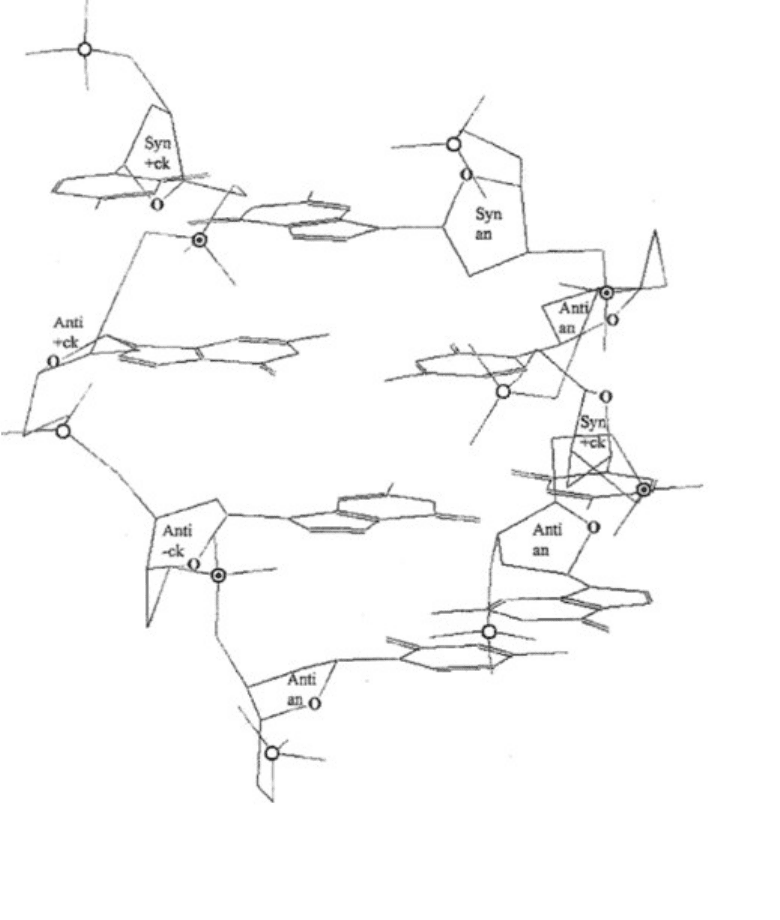
Рис. 3. Структура связей в комплементарных цепях Ап-ДНК (рис. 2, Б). Для наглядности основания
даны под небольшим углом. Syn-, anti- – угол вращения вокруг гликозидной связи С1'-N; || или
–
параллельное или перпендикулярное положение плоскости (С1'-С4') d-рибозы относительно оси спирали
при переходе от одного фосфата к другому через гуанин или цитозин; торсионный угол вращения вокруг
С4'-С5'-связи имеет ап,+ск, -ск-конформацию; С2'-endo- или (когда С2' более, чем С3') удален от плоскости
С1'-О1'-С4' и находится по одну сторону с С5'; О1' у d-рибоз обеих цепей, имеющих syn-конформацию
гликозидной связи, всегда направлен в dГ и dЦ вниз или вверх относительно оси спирали, а у d-рибоз,
имеющих anti-конформацию, – в сторону от оси спирали.

Кристаллохимические характеристики В-, Z-ДНК и возможно
синтезируемых при участии апатита форм ДНК (Ап-ДНК)
Параметры B-ДНК Z-ДНК Ап-ДНК
Направление спирали
Правое Левое Левое
Число остатков на виток,
кол-во пар
10 12 12
(6
димеров)
(3 тетрамера)
Диаметр спирали, Å ~20 ~18 ~18
Трансляция на нуклеотид, Å 3,4 3,7 3,4
Шаг спирали, Å 34 44,6 41,3
Наклон пары оснований, град 6 7 0
Поворот на нуклеотид, град 36 -60
(на димер)
-120
(на тетрамер)
Угол вращения вокруг
гликозидной связи
d-гуанозин Anti Syn Anti, syn
d-цитидин Anti Syn Anti, syn
Sugar pucker
d-гуанозин С2'
endo
СЗ' endo C2' endo
d-цитидин С2'
endo
С2' endo C2' endo
Торсионный угол вращения
вокруг С4'-С5' -связи of-
гуанозин
an (gauche-
trans)+ck
(gauche-
gauche)
an (gauche-trans)
an (gauche-
trans)
d-гуанозин
d-цитидин
Расстояние атомов фосфора от
оси, Å
dГфЦ 9 8 8
dЦфГ 9 6,9 8,5
dГфГ 9 - 5,8
dЦфЦ 9 - 3,6
Расстояние между атомами
фосфора комплементарных пар,
Å
d(ГфЦ) 17,5 15 15,3
d(ЦфГ) 17,5 12,5 13,1
d(ГфГ) 17,5 - 8,9
d(ЦфЦ) 17,5 - 7,9
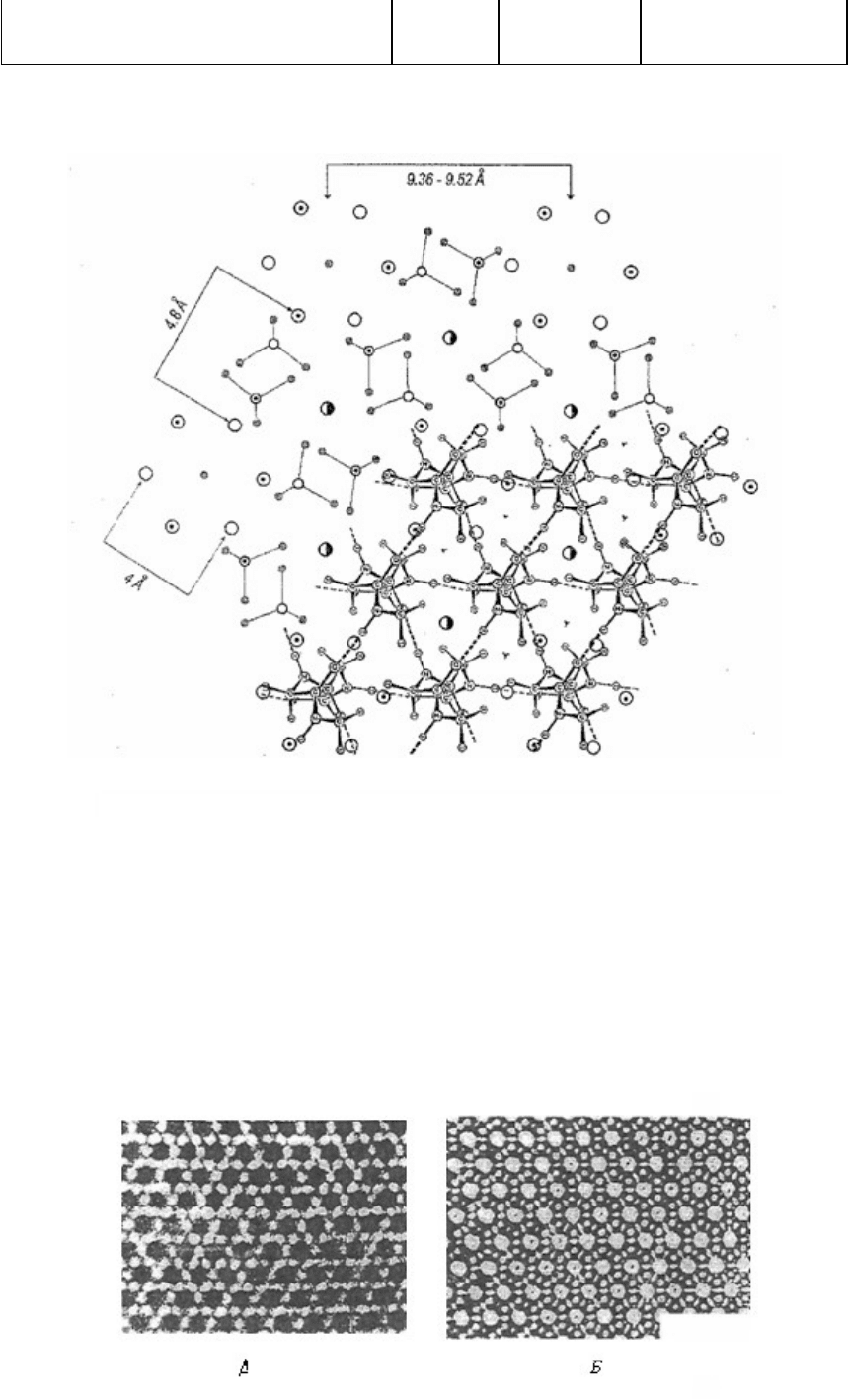
Рис. 4. Структура апатита с расположенными в ней цепями полиглицина II (полипролина II,
коллагена). Кристаллическая структура полиглицина II сходна со структурой полипролина II и коллагена
[21, 36, 37, 40]. В зоне формирования белковых цепей в ячейке апатита анионы РО
4
3-
замещены на СО
3
2-
[4,
5]. Структура получена путем совмещения кристаллической структуры полиглицина II [21, 40] и апатита
[26, 43], установленных методом рентгеноструктурного анализа.

Рис. 5. Электронная микрофотография гексагональной упаковки молекулы белка в кристалле каталазы из
печени быка (увел.
5-10
5
) (А) и кристаллической лейцинаминопептидазы (Б)
Мы предполагаем, что в формировании ДНК будущих протоклеток
могло участвовать разное количество элементарных ячеек апатита. В
результате протоклетки могли иметь разное число хромосом (рис. 6).
Рис. 6. Предполагаемая схема появления разного числа хромосом в будущих протоклетках.
Для подтверждения приведенных выше предпосылок о возможности синтеза
Ап-ДНК на кристалле апатита с параметрами, сходными с Z-ДНК, нами была
построена пространственная модель кристалла апатита с встроенным в него
гипотетическим фрагментом Ап-ДНК из 4 пар нуклеотидов в виде модели
Дрейдинга и компьютерной модели, построенной по данным рентгеноструктурного
анализа [26, 43, 45, 46]. На рис. 1, А-Д; 2; 3, а также в таблице приведены
отдельные фрагменты обсуждаемой ниже Ап-ДНК.
В качестве оснований в модели использовали гуанин и цитозин, как главные
структурообразующие компоненты Z-формы ДНК, а также в связи с тем, что они
способны кодировать основные аминокислоты коллагеновых белков (глицин – ГГГ,
ГГЦ; аланин – ГЦГ, ГЦЦ; пролин – ЦЦЦ, ЦЦГ), участвующих в синтезе апатита в
организме. При построении модели мы исходили из того, что фосфатный скелет
апатита (без изменения положения в пространстве атомов кислорода в РO
4
-
группах) определял положение и конформацию d-рибоз, а они, в свою очередь, –

азотистых оснований в апатите. Положение фосфатов соответствует уровням 1/3 и
3/4 апатитовой ячейки, а расстояние между соседними фосфатами одной цепи 1/2
ячейки (3,4 Å по высоте) (см. рис. 1, 2). Все основания располагаются на уровне 0 и
50 апатитовой ячейки, т.е. между фосфатными группами. Ап-ДНК типичная левая
Z-спираль, у которой повторяющимся элементом является тетрамер d(ГГЦЦ),
состоящий из двух димеров d(ГГ) и d(ЦЦ) или d(ГЦ) и d(ЦГ) (-120
0
на тетрамер), в
отличие от Z-ДНК, где чередуются дуплексы d(ГЦ) (-60
0
на димер). Диаметр
спирали, как у Z-ДНК, 18 Å. Фосфаты в цепях идут зигзагом и сильно сближены в
противолежащих цепях (см. таблицу). При переходе фосфатов в спирали от одного
к другому через гуанин или цитозин плоскость прилежащей дезоксирибозы то
параллельна, то перпендикулярна главной оси (рис. 2, Б; 3). При сравнении
полученных нами результатов с таковыми по Z-, А-и В-формам ДНК мы будем
пользоваться данными, приведенными в обзоре В. Зенгера [41] и работах Э. Уонга
[45, 46]. Взаимная ориентация основания и сахарного кольца в обеих цепях Ап-
ДНК характеризуется чередованием anti-, anti -, anti -, syn- в цепи 5'
3' d(ЦГГЦ) и
anti-, syn-, anti-, syn- в комплементарной цепи 3'
5' d(ГЦЦГ), что приводит к
зигзагообразному остову спирали. В целом в Ап-ДНК dГ и dЦ остатки имеют syn- и
anti- альтернативные конформации гликозидной связи, сахарные остатки имеют
С2'-endo конформацию и торсионный угол вращения вокруг С4'-С5' -связи как an,
+ck-, -ck.
Ап-ДНК отличается от Z-, А- и В-форм в основном расположением и углом
наклона пар оснований по отношению к оси спирали. В Ап-ДНК угол наклона,
наиболее вероятно, не равен нулю, а близок наклону в Z-форме ДНК (7-9
0
) и
отличается от такового в А-форме (13-19
0
). В Ап-ДНК пары оснований сдвинуты к
наружной поверхности, так что ось спирали лежит в малой бороздке, не
пронизывая пар оснований, как в Z-ДНК, в отличие от А-ДНК, где ось проходит в
большой бороздке, и В-ДНК, где ось пересекает плоскость пары оснований.
Получающийся в Ап-ДНК сахарофосфатный остов имеет такую же
зигзагообразную форму, как в Z-ДНК. Модель подтвердила сходство ряда
конформационных характеристик Ап-ДНК с Z-ДНК, А-и В-ДНК [41, 45, 46].
О синтезе белковых цепей на апатите и карбонатапатите.
Кристаллохимические особенности апатита наряду с синтезом ДНК допускают
одновременный синтез белковых цепей гистонов, коллагена и др. (рис. 1, Б; 4). В
случае гистонов наиболее приемлем для синтеза апатит, т.к. идет формирование
НП, а в случае коллагена и других белков – карбонатапатит или кальцит. Кавасаки
была предложена пространственная модель адсорбции поли-L-лизина в цепочечной
форме на поверхности ГА [24]. При этом каждая аминогруппа полипептида
попадает в центр фосфатного участка гексагона. Этим достигается строгое
пространственное соответствие поверхности ГА и поли-L-лизина. Решетка
кальцита, как ключ с замком, стыкуется с аминокислотами [5]. Синтез пептидных
цепей в кристалле апатита, по нашему мнению, мог осуществляться наряду с
синтезом ДНК на местах CaII. В случае гистоновых белков синтез, по-видимому,
шел одновременно с ДНК в тех же Э. Я. апатита (спираль в спираль) по принципу
стереоспецифической комплементарности. При этом кристалло-химические
характеристики исследованных пептидных цепей полиглицина II, полипролина II и
коллагена [21, 40] находятся в хорошем соответствии с характеристикой
кристаллической решетки апатита [4, 5]. В кристалле полиглицина II все цепи
параллельны друг другу и каждая из них обладает винтовой осью третьего порядка
с поворотом вокруг оси спирали одного аминокислотного остатка на 120
0
. Семь
цепей уложены в гексагональную структуру. Каждая из них соединена с шестью
соседними водородными связями. Расстояние между полипептидными цепями 4,8
Å. Структура полиглицина II оказалась сходной со структурой полипролина II и
коллагена [21, 36, 37, 40]. Между белками в β-форме (или форме II) и цепями ДНК
существует стереоспецифическая комплементарность [48]. Укладка, конфигурация
и размеры полиглицина II, полипролина II и коллагеновых цепей аналогичны
мотиву пространственного расположения CaII-полиэдров в апатите. Периодичность
структуры в коллагене (9,5 и 4 Å) [37-39] соответствует размеру Э. Я. апатита (9,5
Å) и расстоянию между двумя атомами Са, находящимися на одном уровне (4 Å) в
тригональной призме CaII-полиэдров, а расстояние между двумя белковыми
цепями (4,8 Å) соответствует расстоянию между двумя CaII-полиэдрами.
Кристаллическая структура белка каталазы и лейцииаминопептидазы
свидетельствует о сходстве белков, возможно сформировавшихся на апатите,
карбонатапатите или кальците (рис. 5).
Формирование стереоспецифического НП-комплекса на матрице апатита в
определенной мере подтверждается аналогиями, имеющими место в живом
организме в процессе биоминерализации при синтезе апатита в костях и зубах
позвоночных животных, а также в прокариотах и одноклеточных; достаточно
только обратить процесс сопряжения органической матрицы с минеральной
решеткой (рис. 7). Формирование минеральных кристаллов идет под контролем
органической матрицы. При биоминерализации большая часть веществ
жидкокристаллической матрицы «заменяется» на минеральные кристаллы,
ориентация которых наследует жидкокристаллическую геометрию, например
размеры конфокальных доменов жидких кристаллов [1]. Фактически получаются
твердые тела с кристаллической структурой и жидкокристаллическими
закономерностями во взаимной ориентации микрокристаллов. Механизм
сопряжения решеток основных скелетных минералов с органическим веществом
базируется на физике жидкокристаллических конфокальных текстур [1].
Конфокальные текстуры в жидких кристаллах создают единую систему
нетривиально упорядоченных электромагнитных взаимодействий. Они способны
заполнять пространство безразрывным способом [16] без промежутков.
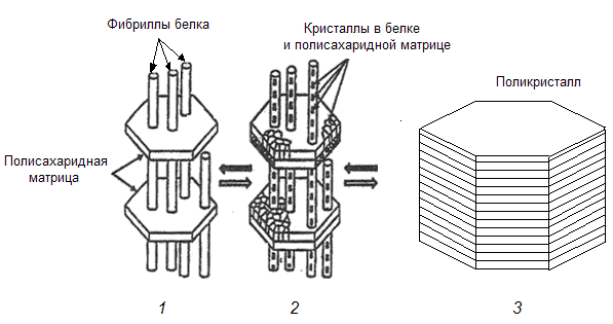
Рис. 7. Схема образования биогенных кристаллов. Вначале образуется органическая матрица (1), состоящая
из стопки полисахаридных пластин гексагональной или эллиптической формы и «прошитая» фибриллами белка.
Затем внутри фибрилл и между белковыми фибриллами в самой полисахаридной матрице возникают зародыши
минеральных кристаллов, которые растут и формируют элементарный минеральный кристаллит (2). Конечная
