Контрольная работа (вар.80). Строение атома. Периодическая система элементов. Химическая связь. Ионно-молекулярные реакции
Подождите немного. Документ загружается.


Министерство образования и науки РФ
Иркутский Государственный Технический Университет
Факультет ___Заочно - вечерний_____
Кафедра _____Автомобили и автомобильное хозяйство_____
Контрольная работа №1
по химии
(НАЗВАНИЕ ДИСЦИПЛИНЫ)
(вариант № __80__)
Выполнил: __________
(Ф.И.О. студента)
группа______________
(индекс группы)
____________________
(номер зачетной книжки)
Проверил: __________
(должность)
___________________
(Ф.И.О. преподавателя)
___________________
(город)
___________________
(год)

Задача №20
Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42,
учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d-подуровень.
К какому электронному семейству относится каждый из этих элементов?
Решение:
Электронные формулы отображают распределение электронов в атоме по
энергетическим уровням, подуровням (атомным орбиталям).Электронная конфигурация
обозначается группами символов
lx
n
, где n-главное квантовое число, l-орбитальное
квантовое число (вместо него указывают соответствующее буквенное обозначение- s ,p,
d, f), х- число электронов в данном подуровне (орбитали). При этом следует учитывать,
что электрон занимает тот энергетический подуровень, на котором он обладает
наименьшей энергией – меньшая сумма n+1 (правило Клечковского)
Так как число электронов в атоме того или иного элемента равно его порядковому
номеру в таблице Д.И.Менделеева, то для элементов №32(Германий) и №42(Молибден)
электронные формулы имеют вид:
2 2 6 2 6 10 2 2
32
1 2 2 3 3 3 4 4Ge s s p s p d s p
2 2 6 2 6 10 2 6 5 1
42
1 2 2 3 3 3 4 4 4 5Mo s s p s p d s p d s
Германий относится к семейству p-элементов, его валентные электроны
2 2
4 4s p
Молибден относится к семейству d-элементов, его валентные электроны
5 1
4 5d s
Задача №24
Исходя из положения германия, молибдена и рения в периодической системе, составьте
формулы водородного соединения германия, оксида молибдена и рениевой кислоты,
отвечающие их высшей степени окисления. Изобразите формулы этих соединений
графически
Решение:
Высшую степень окисления элемента определяет номер группы периодической системы
Д.И.Менделеева, в которой он находится. Германий, молибден и рений находятся
соответственно в IV, VI и VII группах периодической системы, поэтому высшая степень
окисления германия равна +4, молибдена +6, рения +7.
Водородное соединение германия:
4
4
GeH
H
H
Ge
H
H
Оксид молибдена
6
3
MO
Mo
OO
O
Рениевая кислота
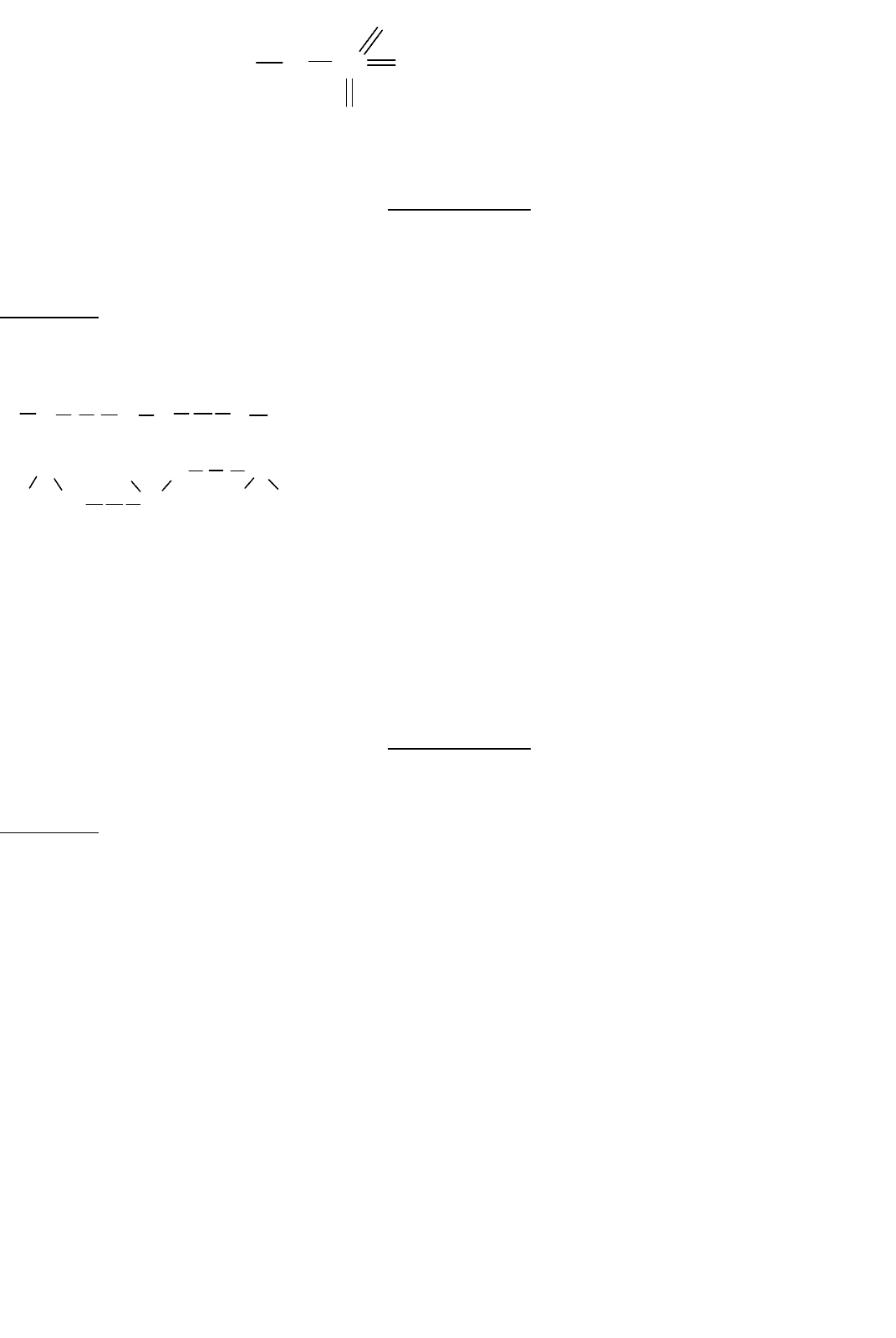
7
4
ReH O
Re
O
O
O
O
H
Задача №52
Какую химическую связь называют водородной? Между молекулами каких веществ она
образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при
более высоких температурах, чем их аналоги?
Решение:
Водородная связь – это связь между атомом водорода одной молекулы и отрицательно
заряженным атомом другого элемента, другой молекулы. Это связь между молекулами,
она обозначается пунктиром:
H F H F H F
или
O
H
H
O
H
H O
H
H
и т.д.
Эта связь менее прочная, чем ковалентная связь. Вода и плавиковая кислота плавятся и
кипят при более высоких температурах, чем их аналоги
2
H S
,
HCl
. Это объясняется тем,
что вода и HF состоят из ассоциированных молекул, благодаря водородной связи
2
2
H O
,
2
HF
и т.д.
Поэтому при нагревании часть энергии идет на разрыв водородной связи.
Задача №61
Какое из веществ
3
( )Al OH
;
2 4
H SO
;
2
( )Ba OH
- будет взаимодействовать с гидроксидом
калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Решение:
Запишем уравнения реакций взаимодействия указанных веществ в молекулярном виде:
а)
3 4
Al OH KOH K Al OH
б)
2 4 2 4 2
2 2H SO KOH K SO H O
Протекание этих реакций возможно, так как в результате образуются комплексный ион
(
4
K Al OH
) и слабый электролит
2
H O
. Поскольку
2
( )Ba OH
не обладает
амфотерными свойствами, то он с гидроксидом калия взаимодействовать не будет.
При составлении полных ионно-молекулярных уравнений будем пользоваться таблицей
растворимости, учитывая, что сильные электролиты записываются в виде ионов, а
слабые - в виде молекул:
а)
3 4
3 4
Al(OH) + KOH = K [Al(OH) ]
Al(OH) + K + OH = K + [Al(OH) ]
б)
2 4 2 4 2
2 2
4 4 2
2 2
2 2 2 2 2
H SO KOH K SO H O
H SO K OH K SO H O

Исключая одинаковые ионы из обеих частей равенства, получаем сокращённые ионно-
молекулярные уравнения:
а)
3 4
Al(OH) + OH = [Al(OH) ]
б)
2 2
2H + 2OH = 2H O èëè H + OH = H O
Задача №81
При смешивании растворов
3
FeCl
и
2 3
Na CO
каждая из взятых солей гидролизуется
необратимо до конца с образованием соответствующих основания и кислоты. Выразите
этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
Решение:
Молекулярное уравнение:
3 2 3 2 2 3
3
2 3 6 2 3 6FeCl Na CO H O Fe OH H CO NaCl
Ионно-молекулярное уравнение:
3 2
3 2 2 3
3
2 3 6 2 3Fe CO H O Fe OH H CO
Гидроксид железа выпадет в осадок, а угольная кислота разлагается на воду и
углекислый газ:
2 3 2 2
H CO H O CO
Молекулярное уравнение:
3 2 3 2 2
3
2 3 3 2 3 6FeCl Na CO H O Fe OH CO NaCl
Ионно-молекулярное уравнение:
3 2
3 2 2
3
2 6 6 3 3 2 3 6 6Fe Cl Na CO H O Fe OH CO Na Cl
Исключая одинаковые ионы из обеих частей равенства, получаем сокращённое ионно-
молекулярное уравнение:
3 2
3 2 2
3
2 3 3 2 3Fe CO H O Fe OH CO
