Контрольная по химии вариант 3 (5 вопросов с ответами)
Подождите немного. Документ загружается.


Задание 1
Строение молекулы. Типы химических связей в молекуле. Привести
примеры.
Ответ.
В 1916 г. были предложены первые предельно упрощенные теории
строения молекул, в которых использовались электронные представления:
теория американского физико-химика Г.Льюиса (1875-1946) и немецкого
ученого В.Косселя. По теории Льюиса в образовании химической связи у
двухатомной молекулы участвуют валентные электроны сразу двух атомов.
Поэтому, например, в молекуле водорода вместо валентного штриха стали
рисовать электронную пару, образующую химическую связь:
Химическую связь, образованную электронной парой, называют
ковалентной связью. Молекулу фтористого водорода изображают так:
Отличие молекул простых веществ (H
2
, F
2
, N
2
, O
2
) от молекул сложных
веществ (HF, NO, H
2
O, NH
3
) состоит в том, что первые не имеют дипольного
момента, а вторые - имеют. Дипольный момент m определяется как
произведение абсолютной величины заряда q на расстояние между двумя
противоположными зарядами r:
Дипольный момент m двухатомной молекулы можно определить двумя
способами. Во-первых, поскольку молекула электронейтральна, то известен
суммарный положительный заряд молекулы Z' (он равен сумме зарядов ядер
атомов: Z' = ZA + ZB). Зная межъядерное расстояние r
e
, можно определить
местоположение центра тяжести положительного заряда молекулы. Значение
m молекулы находят из эксперимента. Поэтому можно найти r' - расстояние
между центрами тяжести положительного и суммарного отрицательного
заряда молекулы:
2
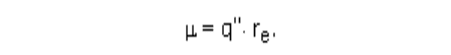
Во-вторых, можно считать, что при смещении электронной пары,
образующей химическую связь, к одному из атомов, на этом атоме
появляется некоторый избыточный отрицательный заряд -q" и заряд +q"
возникает у второго атома. Расстояние между атомами равно r
e
:
Поэтому зная m можно рассчитать заряд q".
Дипольный момент молекулы HF равен 6.4Ч 10-30 КлЧ м, межъядерное
расстояние H-F равно 0.917Ч 10-10 м. Расчет q" дает: q" = 0.4 элементарного
заряда (т.е. заряда электрона). Раз на атоме фтора появился избыточный
отрицательный заряд, значит электронная пара, образующая химическую
связь в молекуле HF, смещена к атому фтора. Такая химическая связь
называется ковалентной полярной связью. Молекулы типа A
2
дипольного
момента не имеют. Образующие эти молекулы химические связи называются
ковалентными неполярными связями.
Теория Косселя была предложена для описания молекул, образованных
активными металлами (щелочными и щелочноземельными) и активными
неметаллами (галогенами, кислородом, азотом). Внешние валентные
электроны у атомов металлов наиболее далеко удалены от ядра атома и
поэтому сравнительно слабо удерживаются атомом металла. У атомов
химических элементов, расположенных в одном и том же ряду
Периодической системы, при переходе слева направо заряд ядра все время
возрастает, а дополнительные электроны располагаются в том же самом
электронном слое. Это приводит к тому, что внешняя электронная оболочка
сжимается и электроны все более прочно удерживаются в атоме. Поэтому в
молекуле MeX появляется возможность слабо удерживаемый внешний
валентный электрон металла переместить с затратой энергии, равной
потенциалу ионизации, в валентную электронную оболочку атома неметалла
с выделением энергии, равной сродству к электрону. В результате
образуются два иона: Me+ и X-. Электростатическое взаимодействие этих
ионов и является химической связью. Такой тип связи назвали ионной.
Если определить дипольные моменты молекул MeX в парах, то
окажется, что заряд с атома металла не переходит полностью к атому
неметалла, и химическая связь в таких молекулах лучше описывается как
ковалентная сильно полярная связь. Положительные катионы металлов Ме
+
и
отрицательные анионы атомов неметаллов Х
-
обычно существуют в узлах
3
кристаллической решетки кристаллов этих веществ. Но в этом случае
каждый положительный ион металла прежде всего электростатически
взаимодействует с ближайшими к нему анионами неметаллов, потом с
катионами металлов и т.д. То есть в ионных кристаллах химические связи
делокализованы и каждый ион в конечном итоге взаимодействует со всеми
остальными ионами, входящими в кристалл, который и представляет собой
гигантскую молекулу.
Наряду с четко определенными характеристиками атомов, такими как
заряды ядер атомов, потенциалы ионизации, сродство к электрону, в химии
используются и менее определенные характеристики. Одной из них является
электроотрицательность. Она была введена в науку американским химиком
Л.Полингом. Сначала рассмотрим для элементов первых трех периодов
данные о первом потенциале ионизации и о сродстве к электрону.
Закономерности в потенциалах ионизации и сродство к электрону
полностью объясняются структурой валентных электронных оболочек
атомов. Cродство к электрону у изолированного атома азота гораздо меньше,
чем у атомов щелочных металлов, хотя азот - это активный неметалл.
Именно в молекулах при взаимодействии с атомами других химических
элементов азот доказывает, что он - активный неметалл. Это и пытался
сделать Л.Полинг, вводя "электроотрицательность" как способность атомов
химических элементов смещать к себе электронную пару при образовании
ковалентных полярных связей. Шкала электроотрицательности для
химических элементов была предложена Л.Полингом. Наибольшую
электротрицательность в условных безразмерных единицах он приписал
фтору - 4,0 кислороду - 3.5, хлору и азоту - 3.0, брому - 2.8. Характер
изменения электроотрицательности у атомов полностью отвечают тем
закономерностям, которые выражены в Периодической системе. Поэтому
применение понятия "электроотрицательность" просто переводит на другой
язык те закономерности в изменении свойств металлов и неметаллов,
которые уже отражены в Периодической системе.
Многие металлы в твердом состоянии представляют собой почти
идеально образованные кристаллы. В узлах кристаллической решетки в
кристалле расположены атомы или положительные ионы металлов.
Электроны тех атомов металлов, из которых образовались положительные
ионы, в виде электронного газа находятся в пространстве между узлами
кристаллической решетки и принадлежат всем атомам и ионам. Именно они
определяют характерный металлический блеск, высокую электропроводность
и теплопроводность металлов. Тип химической связи, которую
4
осуществляют обобществленные электроны в кристалле металла, называется
металлической связью.
В 1819 г. французские ученые П.Дюлонг и А.Пти экспериментально
установили, что мольная теплоемкость почти всех металлов в
кристаллическом состоянии равна 25 Дж/моль. Сейчас мы легко можем
объяснить, почему это так. Атомы металлов в узлах кристаллической
решетки все время находятся в движении - совершают колебательные
движения. Это сложное движение можно разложить на три простых
колебательных движения в трех взаимно перпендикулярных плоскостях.
Каждому колебательному движению соответствует своя энергия и свой закон
ее изменения с ростом температуры - своя теплоемкость. Предельное
значение теплоемкости для любого колебательного движения атомов
равняется R - Универсальной газовой постоянной. Трем независимым
колебательным движениям атомов в кристалле будет соответствовать
теплоемкость, равная 3R. При нагревании металлов, начиная с очень низких
температур, их теплоемкость растет от нулевого значения. При комнатной и
более высокой температуре значение теплоемкости большинства металлов
выходит на свое максимальное значение - 3R.
При нагревании кристаллическая решетка металлов разрушается и они
переходят в расплавленное состояние. При дальнейшем нагревании металлы
испаряются. В парах многие металлы существуют в виде молекул Me2. В
этих молекулах атомы металла способны образовывать ковалентные
неполярные связи.
5
Задание 2.
Обязательные условия протекания химических реакций. Энергия
активации. Зависимость между величиной энергии активации и
скоростью реакции. Уравнение Аррениуса.
Ответ:
Для осуществления реакций химических часто требуются
определенные условия-температура, давление, облучение (например., УФ
светом), наличие растворителя и др. Реакции химические могут
сопровождаться выделением тепла, испусканием света, изменением
агрегатного состояния веществ и т.п.
Для описания реакций химических используют хим. уравнения, в левой
части которых указывают исходные вещества, в правой-продукты. Обе части
уравнения могут быть соединены знаком равенства (в этом случае
количество атомов хим. элементов справа и слева должно быть уравнено с
помощью стехиометрических коэффициентов.; стрелкой (в случае
необратимых химических превращений) или прямой и обратной стрелками
(для обратимых реакций). Иногда химические уравнения дополняют
указанием энтальпии реакции, агрегатного состояния веществ и другими
характеристиками.
Реакции химические могут осуществляться как один элементарный акт
(стадия) или через последовательность отдельных стадий, составляющих в
совокупности механизм реакции. Ключевые элементы в описании любого
механизма - характер интермедиата (реально существующие промежуточное
вещество, в ряде случаев фиксируемое экспериментально) и переходное
состояние, представляющее собой гипотетическое промежуточное
состояние реагирующей системы, соответствующее ее максимальной
энергии. Величина энергетического барьера между начальным и конечным
состояниями реагирующей системы (т.е. разность энергий исходных
соединений и переходного состояния) называется энергией активации.
Уравнение Аррениуса устанавливает зависимость константы скорости
химической реакции k от температуры T.
Согласно простой модели столкновений химическая реакция между
двумя исходными веществами может происходить только в результате
столкновения молекул этих веществ. Но не каждое столкновение ведёт к
химической реакции. Необходимо преодолеть определённый энергетический
6

барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы
должны обладать некой минимальной энергией (энергия активации ),
чтобы этот барьер преодолеть. Из распределения Больцмана для
кинетической энергии молекул известно, что число молекул, обладающих
энергией , пропорционально . В результате скорость
химической реакции представляется уравнением, которое было получено
шведским химиком Сванте Аррениусом из термодинамических соображений:
Здесь A характеризует частоту столкновений реагирующих молекул, R
— универсальная газовая постоянная.
В рамках теории активных соударений A зависит от температуры, но
эта зависимость достаточно медленная:
Оценки этого параметра показывают, что изменение температуры в
диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений
A на 10 %.
В рамках теории активированного комплекса получаются другие
зависимости A от температуры, но во всех случаях более слабые, чем
экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической
кинетики, а энергия активации — важной количественной характеристикой
реакционной способности веществ.
7
Задание 3.
Общая характеристика ароматических соединений. Физико-химические
свойства и химические свойства бензола.
ОТВЕТ.
Ароматические соединения — циклические органические соединения,
которые имеют в своём составе ароматическую систему. Основными
отличительными свойствами являются повышенная устойчивость
ароматической системы и, несмотря на ненасыщенность, склонность к
реакциям замещения, а не присоединения.
Различают бензоидные (арены и структурные производные аренов,
содержат бензольные ядра) и небензоидные (все остальные) ароматические
соединения. Среди небензоидных ароматических соединений хорошо
известны азулен, аннулены, гетарены (пиридин, пиррол, фуран, тиофен),
ферроцен. Известны и неорганические ароматические соединения, например
боразол («неорганический бензол»). Иногда понятие «ароматические
соединения» расширяют и распространяют также и на такие соединения как
гуанидин, гомобензол, спирарен, карбонилы металлов, циклопропан и др.
В структуре молекул многих соединений можно выделить несколько
ароматических систем, которые могут быть по отношению друг к другу
изолированными либо конденсированными. В качестве примеров
бензоидных соединений с изолированными бензольными ядрами можно
назвать такие соединения как дифенилметан и полистирол, с удалёнными
друг от друга бензольные ядра, а также дифенил и терфенилы с
непосредственно связанными ядрами. Примерами бензоидных соединений с
конденсированными (аннелированными) бензольными ядрами являются
такие соединения как нафталин, пирен и прочие ПАУ. В структуре
дифенилена бензольные ядра непосредственно связаны друг с другом, но, в
отличии от дифенила, у дифенилена бензольные ядра не являются
изолированными. Если принять во внимание тот факт, что в одной молекуле
может различным образом сочетаться различное число различных
ароматических и неароматических групп, то становится очевидно, что число
возможных ароматических соединений и их разнообразие практически не
ограничены.
Широко распространены и имеют большое практическое значение
бензоидные ароматические углеводороды (арены). Помимо бензольных
колец арены часто содержат другие разнообразные углеводородные группы
(алифатические, нафтеновые, полициклические). Основным источником
8
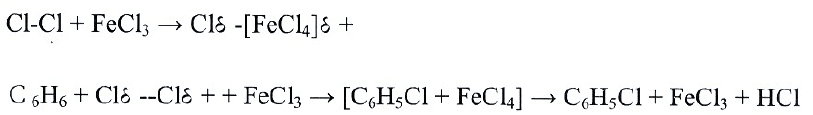
получения ароматических углеводородов служат каменноугольная смола,
нефть и нефтепродукты. Большое значение имеют синтетические методы
получения. Наиболее важными аренами являются: бензол С6Н6 и его
гомологи (толуол С
6
Н
5
СН
3
, ксилолы С
6
Н
4
(СНз)
2
, дурол, мезитилен,
этилбензол), кумол, нафталин C
10
H
8
, антрацен С
14
Н
10
и их производные.
Ароматические углеводороды — исходное сырьё для промышленного
получения кетонов, альдегидов и кислот ароматического ряда, а также
многих других веществ.
Рассмотрим бензол.
Бензол (C
6
H
6
) — органическое химическое соединение, бесцветная
жидкость с приятным сладковатым запахом. Ароматический углеводород.
Бензол входит в состав бензина, широко применяется в промышленности,
является исходным сырьём для производства лекарств, различных пластмасс,
синтетической резины, красителей. Хотя бензол входит в состав сырой
нефти, в промышленных масштабах он синтезируется из других её
компонентов. Токсичен, канцерогенен.
Физические свойства
Бензол (жидкий)
Бесцветная жидкость со своеобразным резким запахом. Температура
плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³,
молекулярная масса = 78,11 г/моль. Подобно всем углеводородам бензол
горит и образует много копоти. С воздухом образует взрывоопасные смеси,
хорошо смешивается с эфирами, бензином и другими органическими
растворителями, с водой образует азеотропную смесь с температурой
кипения 69,25 °C (91% бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами,
хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва
бензольного кольца проходят в жёстких условиях (температура, давление).
Взаимодействие с хлором в присутствии катализатора:
С
6
H
6
+ Cl
2
-(FeCl
3
)→ С
6
H
5
Cl + HCl образуется хлорбензол
Катализаторы содействуют созданию активной электрофильной
частицы путём поляризации между атомами галогена.
9
В отсутствие катализатора при нагревании или освещении идёт
радикальная реакция замещения.
С
6
H
6
+ 3Cl
2
- (освещение)→ C
6
H
6
Cl
6
образуется смесь изомеров
гексахлорциклогексана
Взаимодействие с бромом (чистый):
С
6
H
6
+ Br
2
- (FeBr
3
или AlCl
3
) → С
6
H
5
Br + HBr образуется бромбензол
Взаимодействие с галогенопроизводными алканов (реакция Фриделя-
Крафтса):
С
6
H
6
+ С
2
H
5
Cl - (AlCl
3
)→ С
6
H
5
С
2
H
5
+ HCl образуется этилбензол
С
6
H
6
+ HNO
3
-(H
2
SO
4
)→ С
6
H
5
NO
2
+ H
2
O
Задание 4.
10
Написать формулы изомеров гексена и назвать их по международной
номенклатуре.
Ответ:
гексен изомеры 1) CH
2
=CH-CH
2
-CH
2
-CH
2
-CH
3
гексен-1
2) CH
3
-CH=CH-CH
2
-CH
2
-CH
3
гексен-2
3) CH
3
-CH
2
-CH=CH-CH
2
-CH
3
гексен-3
4) CH
2
=C(CH
3
)-CH
2
-CH
2
-CH
3
2-метилпентен-1
5) CH
2
=CH-CH(CH
3
)-CH
2
-CH
3
3-метилпентен-1
6) CH
2
=CH-CH
2
-CH(CH
3
)-CH
3
4-метилпентен-1
7) CH
3
-C(CH
3
)=CH-CH
2
-CH
3
2-метилпентен-2
8) CH
3
-CH=C(CH
3
)-CH
2
-CH
3
3-метилпентен-2
9) CH
3
-CH=CH-CH(CH
3
)-CH
3
4-метилпентен-2
10) CH
2
=C(CH
2
-CH
3
)-CH
2
-CH
3
2-этилбутен-1
11) CH
2
=C(CH
3
)-CH(CH
3
)-CH
3
2,3-диметилбутен-1
12) CH
2
=CH-C(CH
3
)(CH
3
)-CH
3
3,3-диметилбутен-1
13) CH
3
-C(CH
3
)=C(CH
3
)-CH
3
2,3-диметилбутен-2
Задание 5.
11
