Кауричев И.С., Гречин И.П. (ред.) Почвоведение
Подождите немного. Документ загружается.


Продолжение
Почвы
Черноземы
Минимальное
Максимальное
Каштановые
Минимальное
Максимальное
Сероземы
Минимальное
Максимальное
Микроэлементы, в мг на 1 кг почвы
Си в вы-
тяжке
1
н.
НС1
4
30
9,4
14
5
25
Zn в вы-
тяжке
1
н.
КС1
0,06
0,2
0,06
0,2
0,1
10,0
Мп в вы-
тяжке 0,1н.
H
2
SO.
1
50
1,5
75
1,5
125
Mo в ок-
Со в вы- салатной
тяжке
1
н. вытяжке
HNO,
(по Григ-
1 гу)
1
2,5
1
6
1
2
0,05
0,40
0,09
0,60
0,05
0,20
В в вод-
ной вы-
тяжке
0,4
1,5
0,5
0,9
0,1
0,6
По ориентировочным данным Г. Я. Ринькиса (1963), почвы харак-
теризуются как очень бедные подвижными формами микроэлементов
при следующем их содержании: медь<0,3; цинк<0,2; марганец<1; ко-
бальт<0,2; молибден<0,05; бор<0,1 мг на 1 кг почвы, а бедные —соот-
ветственно 1,5; 1; 10; 1; 0,15; 0,2. Очевидно, при указанном содержании
на таких почвах возможен эффект от применения микроэлементов в ка-
честве удобрений.
РАДИОАКТИВНОСТЬ ПОЧВ
Радиоактивность почвы обусловлена содержанием в ней радиоак-
тивных химических элементов. Различают естественную и искусствен-
ную радиоактивность почв.
Естественная радиоактивность. Этот вид радиоактивности вызы-
вается естественными радиоактивными элементами.
Все известные естественные радиоактивные элементы делят на сле-
дующие три группы (В. И. Баранов, Н. Т. Морозова, 1966).
1.
Собственно радиоактивные элементы, все изученные изотопы ко-
торых радиоактивны. К ним относятся три семейства последовательно
превращающихся изотопов: урана — радия, актиния и тория. Промежу-
точными продуктами распада химических элементов этих семейств яв-
ляются как твердые, так и газообразные изотопы (эманации). Наиболь-
шее значение из этой группы элементов имеют уран (U
238
, U
235
), торий
(Th
232
),
радий (Ra
226
) и радон (Rn
222
, Rn
220
).
2.
Изотопы «обычных» химических элементов, обладающие радио-
активными свойствами. К ним относятся калий (К
40
), рубидий (Rb
87
),
самарий (Sm
147
), кальций (Са
48
), цирконий (Zr
96
) и др. Ведущее зна-
чение из этой группы элементов имеет калий: он обусловливает наиболь-
шую величину естественной радиоактивности.
3.
Радиоактивные изотопы, образующиеся в атмосфере под действи-
ем космических лучей, например тритий (Н
3
), бериллий (Be
7
, Be
10
)
и углерод (С
14
).
Естественные радиоактивные элементы представлены в основном
долгоживущими изотопами, с большим периодом полураспада — поряд-
ка 10
8
—10
16
лет. В процессе распада они испускают а- и р-частицы и
Y-лучи. Обычно эти изотопы находятся в крайне рассеянном состоянии.
Естественная радиоактивность почв зависит главным образом от
содержания урана, радия, тория и радиоактивного изотопа калия (К
40
).
100

Их энергия излучения составляет около 98% суммарной энергии излуче-
ния всех природных радиоактивных элементов.
В таблице 31 приводится содержание тория, урана и радия в поч-
вах СССР. Содержание радиоактивного калия (К.
40
) легко вычислить,
исходя из его валового запаса и изотопного состава. Содержание вало-
вого калия в почвах колеблется в пределах от 0,33% в песчаных до
2,64% в глинистых (С. А. Кудрин). Стабильные изотопы по весу состав-
ляют: К
39
—около 93,08% и К
41
— 6,9%, а радиоактивный К
40
—0,0119%.
ТАБЛИЦА 31
Содержание радиоактивных изотопов в почвах СССР
(по В. И. Баранову, Н. Т. Морозовой, 1966)
Элемент
Торий
Уран
Радий
Содержание в весовых процентах на воздушносухую почву
4-10-е— 16-10-*
•3-10-е —5,1-10-*
1.
Ю-12—
1,7-Ю-
1
»
Валовое содержание радиоактивных элементов в почвах зависит
в основном от почвообразующих пород. Так, в почвах, сформировав-
шихся на продуктах выветривания кислых горных пород, радиоактив-
ных элементов содержится больше, чем в почвах, образовавшихся на
основных или ультраосновных породах. Почвы тяжелого механического
состава содержат радиоактивных элементов больше, чем почвы легкого
механического состава. Высокой радиоактивностью обладают суглини-
стые дерново-луговые почвы речных пойм, тогда как торфяноболотные
почвы, особенно верховых торфяников, характеризуются низким содер-
жанием радиоактивных элементов. Например, в торфяниках верховых
болот содержится тория (4—8) •
10~
6
%,
радия (0,8—2,2)
•
10~
12
%.
По профилю почв радиоактивные элементы распределяются обыч-
но довольно равномерно, хотя в некоторых случаях наблюдается их от-
четливая аккумуляция в иллювиальных и глеевых горизонтах.
По данным В. И. Баранова (1962), суммарная энергия излучений
почвы при среднем содержании в ней радиоактивных элементов (U, Th
и К) составляет 4,0128 мэв в 1 сек. на 1 г почвы. При этом энергия
а-излучения составляет 65%, энергия р-излучения— 28% и энергия
7-излучения — 7%. Р-излучение почв обязано главным образом К
-40
.
а
у
-излучение распределяется почти равномерно между торием, ураном
и калием. В почвах Армении естественная доля у -радиоактивности, вы-
званная калием, составляет 60—70% (В. Л. Ананян, 1962), в почвах
Харьковской области —56—90% (Н. К- Крупский, Э. И. Вешко, 1962).
В почвенном воздухе содержатся газообразные продукты распада
радиоактивных элементов — эманации. К ним принадлежат изотопы ра-
дона: радон (Rn
222
), торон (Rn
220
) и актинон (Rn
219
). Перечисленные
изотопы принадлежат к инертным радиоактивным газам. При распаде
они выделяют а-частицы и образуют ряд короткоживущих твердых р- и
у -излучателей, которые, оседая на окружающих веществах, придают им
так называемую наведенную радиоактивность. Эманации растворимы
в воде. Период полураспада их равен: у радона — 3,8 дня, у торона
—
54,5 сек., у актинона
—
3,9 сек.
Поступление эманации в почвенный воздух зависит от концентра-
ции радия, тория и актиния в почвах и породах и значения коэффици-
ента эманирования (отношения количества эманации, выделяемой в поч-
венный воздух, к полному количеству эманации, образовавшейся за тот
же период времени). В почвах он может изменяться от
1
до 99%.
101

Концентрация эманации в почвенном воздухе определяется про-
должительностью их жизни и скоростью газообмена почвенного возду-
ха с атмосферным, причем концентрация, например, радона в атмо-
сферном воздухе значительно меньше (в 100 раз и более), чем в поч-
венном воздухе.
В таблице 32 представлена концентрация радона и торона в поч-
венном воздухе.
ТАБЛИЦА 32
Концентрация эманации в почвенном воздухе
(по В. И. Баранову, Н. Г. Морозовой, 1962)
Почвы
Дерново-подзолистая
Серая лесная
Чернозем
Каштановая
Солонец среднестолбчатый
Коричневая горная
Торфяная
Глубина отбора
почвенного воз-
духа, в см
40
30—40
25—50
30—50
30—50
25—35
'25—35
Эманации, 10
Rn
0,4—0,7
3,7—4,0
2,3—3,5
1,5—1,67
3,67
2,4—3,0
0,07
13
кюри/см
3
Тп
0,07-0,43
2,7—3,0
2,33—3,83
2,96—3,33
2,34
1,43-2,94
0,07
Искусственная радиоактивность почв вызывается теми радиоактив-
ными изотопами, которые образуются в результате атомных и термо-
ядерных взрывов или являются отходами атомной промышленности.
При атомных взрывах в результате деления тяжелых ядер урана
(U
235
, U
233
) и плутония (Ри
239
) образуется большое количество нбвых
радиоизотопов с периодом полураспада от долей секунды до многих лет.
Образующиеся радиоактивные вещества, попадая в воздушное прост-
ранство, переносятся на большие расстояния, постепенно выпадая на
земную поверхность, в том числе и на почву. В результате происходит'
глобальное загрязнение искусственными радиоизотопами. Загрязнение
отходами атомной промышленности имеет локальное значение.
Искусственные радиоизотопы, включаясь в биологический круго-
ворот веществ, попадают через растительную и животную пищу в орга-
низм человека, накапливаются в костях и других тканях, вызывая ра-
диоактивное облучение. Наибольшую опасность в биологическом отно-
шении представляют изотопы стронция (Sr
90
) и цезия (Cs
137
).
Искусственная радиоактивность почв обусловлена в основном Sr
90
и Cs
137
. Они представляют наибольшую опасность для человека, что оп-
ределяется большим периодом полураспада (28 лет у Sr
80
и 33 года у
Cs
137
),
высокой энергией излучения (оба они р-излучатели, a Cs
137
, кро-
ме того, и у-излучатель), способностью легко включаться в биологичес-
кий круговорот и попадать в организм человека.
Содержание и распределение Sr
90
и Cs
137
в почвах определяется
интенсивностью и характером их выпадения из атмосферы, свойствами
самих изотопов и почв и в целом совокупностью всех природных уело-'
вий (растительность, климат, рельеф).
Распределение выпадающих из атмосферы Sr
90
и Cs
137
по террито-
рии СССР зависит от широты местности. Максимальное выпадение на-
блюдается в пределах 30—50° с. ш.
По данным В. И. Баранова и его сотрудников, в поверхностном го-
ризонте почв (0—5 см) в 1959—1960 гг. содержание Sr
90
колебалось
в пределах 6,6—25,8 мкюри/км
2
(в среднем 14,1 и 17,8). Эти числа при-
мерно того же порядка, что и в почвах других стран северного полуша-
рия. В 1960 г. уровень содержания этого изотопа увеличился примерно
в 3 раза по сравнению с 1957 г. По состоянию на 1 июля" 1963 г. содер-
жание Sr
90
и Cs
137
в среднем по СССР составляло соответственно 44
и 86 мкюри/км
2
(В. Н. Чуркин, В. Ф. Брендаков).
102

В таблице 33 приводится содержание Sr
90
в некоторых типах почв
СССР. Высокое содержание Sr
90
в пойменных почвах объясняется тем,
что в пойму с водосборного бассейна дополнительно сносится поверх-
ностным и внутрипочвенными стоками некоторое количество стронция.
Послойное определение Sr
90
в различных почвах показало, что ос-
новная часть его (80—90%) сосредоточена в самом Верхнем горизон-
те — мощностью 0—5 см, а остальная часть распределяется до глубины
25—30 см.
ТАБЛИЦА 33
Содержание Sr
so
в различных типах почв европейской части СССР в 1961 г.
(Э.
Б. Тюрюканова, Ф. И. Павлоцкая, В. И. Баранов, 1966)
Почва
Дерново-подзолистая суглинистая
Торфяная переходного водораздельного бо-
лота
Чернозем типичный мощный
Суглинистый на лёссовидном суглинке
Генетический
горизонт
А
п
А
п
А*
Ti
т
2
Тз
А
0
Ai
Ai
Aj
Глубина, в см
0-5
5—20
20—30
0—5
5—10
10—20
0—2
2—5
5-20
20—30
Содержание,
в Ю-
13
кюри/см'
0,1—1,0 .
0,2—0,4
0,2—0.4
3,9
1.2
0,3
1—2
4,8
0,1—0,5
0,1-0,2
На хорошо проницаемых почвах Грузии при обилии осадков Sr
90
проникает до глубины 80 см (Н. Т. Кварацхелиа, Г. Г. Глонти, 1965).
Радиоактивный стронций по своим радиоактивным свойствам бли-
зок к кальцию, а радиоактивный цезий
—
к калию, поэтому в почве в их
поведении наблюдается некоторое сходство с указанными химическими
элементами. Закрепление и содержание Sr
90
и Cs
137
в почве зависит от
того,
в форме каких соединений они находятся (водорастворимые, ионо-
обменные, труднорастворимые), а также от свойств почвы. Значитель-
ная часть Sr
90
и Cs
137
содержится в обменном состоянии, при этом строн-
ций может легко вытесняться, а цезий способен поглощаться более проч-
но (необменно).
При возделывании сельскохозяйственных культур на почвах, за-
грязненных искусственными радиоизотопами, они извлекаются корня-
ми растений и накапливаются в урожае. Уменьшить поступление их
в
•растения можно соответствующими приемами. Для этого необходимо
знать содержание и поведение радиоактивных изотопов в почвах, а так-
же закономерности Их поступления в растения. Большой вклад в изу-
чение этих вопросов внесли В. М. Клечковский, И. В. Гулякин,
Е. В. Юдинцева, М. К- Мельникова и другие ученые.
Исследованиями показано, что Sr
90
по сравнению с Cs
137
интенсив-
нее поступает в растения, что объясняется различной степенью их за-
крепления в почве. Кальциелюбивые растения обычно поглощают боль-
ше Sr
90
, чем растения, бедные кальцием. Больше всего накапливают
стронция бобовые культуры, меньше
—
корнеплоды и клубнеплоды и
еще меньше
—
злаковые. Растения, содержащие больше калия, больше
поглощают Cs
137
.
На почвах легкого механического состава и бедных гумусом при
прочих равных условиях в растения больше поступает радиоактивных
изотопов, чем на почвах тяжелого механического состава и богатых гу-
мусом. Поступление Sr
90
в растения снижается на Окультуренных поч-
вах, при известковании и внесении удобрений. Резко снижают поступле-
ние Cs
137
в растения различные калийные удобрения, а поступление Sr
90
тормозится при внесении фосфатов щелочных металлов.
103

ГЛАВА VII
•
ПОГЛОТИТЕЛЬНАЯ
СПОСОБНОСТЬ ПОЧВ
Твердая фаза почвы представляет собой полидисперсную
систему, состоящую из частиц разных размеров
—
от крупных (песок,
гравий) до мельчайших (илистых и коллоидных). Благодаря содержа-
нию тонкодисперсных частиц и пористости почва обладает способностью
задерживать те или иные вещества, приходящие с ней в соприкоснове-
ние.
Почвой задерживаются вещества в молекулярном и ионном состоя-
нии, тонкие и коллоидальные суспензии. Явление поглощения и удер-
живания веществ из почвенного раствора, а также коллоидально рас-
пыленных частиц, паров, газов и живых микроорганизмов получило
название поглотительной способности почв.
С поглотительной способностью связаны важнейшие особенности
почвообразовательных процессов и многие свойства, определяющие пло-
дородие почв.
Поглотительная способность почв оказывает большое влияние на
условия произрастания растений. Под влиянием последних в процессе
сельскохозяйственного использования наблюдается существенное из-
менение поглотительных свойств почв.
Явление поглощения получило научное объяснение благодаря тру-
дам Д. Т. Уэя (1850), Т. Грема (1860). Ван Беммелена (1878),
П. А. Костычева (1886), К. К. Гедройца (1909, 1922). Дальнейшее раз-
витие учения о поглотительной способности почв связано с работами
В.
Р. Вильямса, Г. Вигнера, И. Н. Антипова-Каратаева, С. Маттсона,
А. Н. Соколовского, Н. П. Ремезова, С. Н. Алешина, Н. И. Горбунова
и других исследователей.
ПОЧВЕННЫЕ КОЛЛОИДЫ, ИХ СОСТАВ,
СТРОЕНИЕ И СВОЙСТВА
Коллоидами называют частицы размером от 0,2 до 0,001 ц. Вслед-
ствие небольшой величины коллоидные частицы проходят через обыч-
ные фильтры, не оседают в воде, обнаруживают броуновское движение
и характеризуются рядом других свойств. В воде такие частицы дают
коллоидные растворы, или системы. Последние отличаются как от ис-
тинных (молекулярных) растворов, характеризующихся еще более мел-
ким размером частиц (<0,001(л), так и от грубых суспензий (частицы
крупнее 1[х). Коллоидные свойства начинают проявляться у частиц
размером меньше 1 ц. Поэтому выделяют так называемую предколло-
идную фракцию, объединяющую частицы размером от 1 до 0,2ц..
В природных условиях коллоидные частицы образуются двумя пу-
тями— конденсационным и дисперсионным. В первом случае коллоид-
ные частицы образуются вследствие физического или химического сое-
динения молекул или ионов. Дисперсионное образование коллоидных
104

*Иоиы
Дд+
О Ионы
Br'
Рис.
10. Кубическая кристаллическая
решетка бромистого серебра.
частиц происходит при механиче-
ском или химическом раздроблении
более крупных частиц.
Состав почвенных коллоидов.
Почвенные коллоиды по своей при-
роде делятся на минеральные, орга-
нические и комплексные (органо-
минеральные). Минеральная часть
почвенных коллоидов состоит из не-
большого количества тонкодисперс-
ных первичных минералов, главным
образом кварца и слюд, и в преоб-
ладающем большинстве — из вто-
ричных минералов. Последние раз-
деляются по строению на кристал-
лические и аморфные.
Вторичные минералы кристал-
лического строения чаще всего пред-
ставлены группой гидрослюд (ил-
лит, гидробиотит), группой монтмо-
риллонита (монтмориллонит, бей-
деллит, нонтронит), группой каоли-
нита (каолинит, галлуазит) и группой полуторных окислов (гетит, гиб-
бсит и др.). Минеральные коллоиды различаются по степени раздроблен-
ности, или дисперсности. Самой высокой степенью дисперсности отлича-
ются минералы группы монтмориллонита. К вторичным минералам
аморфного строения относятся гидраты окиси железа, алюминия и крем-
ния.
В различных почвах соотношение между кристаллическими и
аморфными коллоидами неодинаково. Для большинства почв мине-
ральные кристаллические коллоиды составляют 87—90%, а аморфные
10—13%
(А. Ф. Тюлин, 1950).
Органические коллоиды почв, отличающиеся высокой степенью
дисперсности, представлены основными группами гумусовых веществ:
гуминовыми кислотами, фульвокислотами и их солями.
Органо-минеральные коллоидные комплексы представлены преиму-
щественно соединениями гумусовых веществ с глинистыми и другими
вторичными минералами.
Строение почвенных коллоидов. Почвенные коллоиды вследствие
высокой степени дисперсности отличаются большой поверхностной энер-
гией. При взаимодействии почвенных коллоидов (дисперсной фазы)
с водой (дисперсионная среда) в системе возникают электрические си-
лы.
Вокруг коллоидных частиц в растворе образуется двойной электри-
ческий слой, состоящий из зарядов противоположного знака.
Представление о генезисе двойного электрического слоя можно по-
лучить на примере простейшего кристаллического коллоида — броми-
стого серебра, имеющего кубическую решетку (по Г. Вигнеру, 1929).
Каждый ион, расположенный внутри кристаллической решетки (рис. 10),
связан с шестью соседними ионами противоположного заряда. Он пол-
ностью уравновешивает свою атомную энергию и находится в состоя-
нии покоя. На поверхности решетки ионы связаны менее чем с шестью
противоположно заряженными ионами, и поэтому их электрические за-
ряды компенсированы не полностью: на гранях у ионов остается несвязан-
ной '/в их валентности, на ребрах —
2
/
6
, а в углах кристаллической
решетки
—
3
/б их валентности. Наличие неизрасходованных частей валент-
ности («остаточных валентностей»), увеличивающихся при раздробле-
нии вещества, обусловливает появление электрического поля, вызываю-
щего притягивание ионов из раствора, то есть их поглощение. Если кри-
105

сталл притягивает из раствора равное количество катионов и анионов,
то наблюдается его рост. В растворе создаются условия, когда *кристадл
поглощает преимущественно катионы или анионы. Закрепляются те ио-
ны,
которые дают при взаимодействии с ионами кристаллической ре-
шетки труднорастворимые соединения. Например, если в растворе бу-
дут находиться ионы Ag
+
и N0^", то произойдет преимущественное
^при-
соединение Ag
+
, Дающее труднорастворимое соединение AgBr; если же
в растворе будут ионы К
+
и Вг~, то произойдет присоединение Вг~.
В результате присоединения ионов к поверхности кристаллической
решетки вокруг коллоида возникает слой катионов или анионов, при-
тянутых из окружающего раствора и удерживаемых остаточными ва-
лентностями ионов, расположенных на поверхности решетки. Каждый
притягиваемый ион несет электрический заряд, который не полностью
расходуется на связь й поверхностными ионами кристаллической ре-
шетки. Расход электрической энергии у отдельных ионов зависит от ме-
ста взаимодействия их с ионами кристаллической решетки. Он колеб-
лется от 7б до
3
/в их заряда, равного для одновалентных ионов 4,77- Ю
-10
электростатических единиц. Остающийся избыток электрической энер-
гии сообщает кристаллу (коллоиду) электрический заряд. Величина
последнего тем выше, чем больше присоединено ионов и выше их ва-
лентность. Ионы, закрепленные на коллоиде силами остаточных валент-
ностей, составляют внутренний электрический слой частицы. Он полу-
чил название потенциалопределяющего слоя. В результате различия
зарядов коллоида с потенциалопредедяющим слоем
и
окружающего рас-
твора возникает разность потенциалов, которая носит название элект-
ростатического или термодинамического потенциала.
Коллоидная частица, обладая высоким потенциалом, не может су-
ществовать в растворе в таком виде. Избыток электрической энергии,
сообщенной частице потенциалопределяющим слоем, компенсируется
притягиванием из окружающего раствора ионов с противоположным
знаком заряда. Эти ионы образуют вокруг коллоидной частицы второй,
внешний слой, называемый слоем противоионов, или компенсирующих
ионов. В отличие от ионов внутреннего слоя, прочно удерживаемых си-
лами свободных валентностей, слой противоионов, удерживаемый элек-
тростатическими силами, неодинаков по плотности: часть ионов притя-
гивается коллоидом с большей силой и располагается более плотно,
нейтрализуя значительную часть электрического заряда, сообщенного
ио-
нами внутреннего слоя; другая часть ионов находится вне пределов
влияния электростатических сил. Разность потенциалов той части жид-
кости, которая непосредственно связана с поверхностью коллоида и в
которой сосредоточены прочно удерживаемые компенсирующие ионы,
и окружающего раствора получила название электрокинетического
потенциала, или дзета-потенциала. Коллоидную частицу вместе с внут-
ренним и внешним слоями ионов Г. Вигнер называл мицеллой.
Н. И. Горбунов (1948) предложил обобщенную схему строения
коллоидной мицеллы (рис. 11). Вокруг ядра мицеллы, которое может
быть разнообразным по составу и строению, прочно удерживается слой
ионов, несущий заряд
— слой
потенциалопределяющих ионов. Ядро ми-
целлы вместе со слоем потенциалопределяющих ионов, прочно удержи-
ваемых силами остаточных валентностей, называется гранулой. Между
гранулой и раствором, окружающим коллоид, возникает электростати-
ческий потенциал, под влиянием которого ионы притягиваются из рас-
твора. Компенсирующие ионы располагаются вокруг гранулы двумя сло-
ями. Ионы, удерживаемые электростатическими силами, образуют не-
подвижный слой компенсирующих ионов. Ядро мицеллы вместе со слоя-
ми потенциалопределяющих ионов и неподвижных компенсирующих
ио-
нов называется коллоидной частицей. Между коллоидной частицей и ок-
ружающим раствором возникает электрокинетический потенциал, под
106
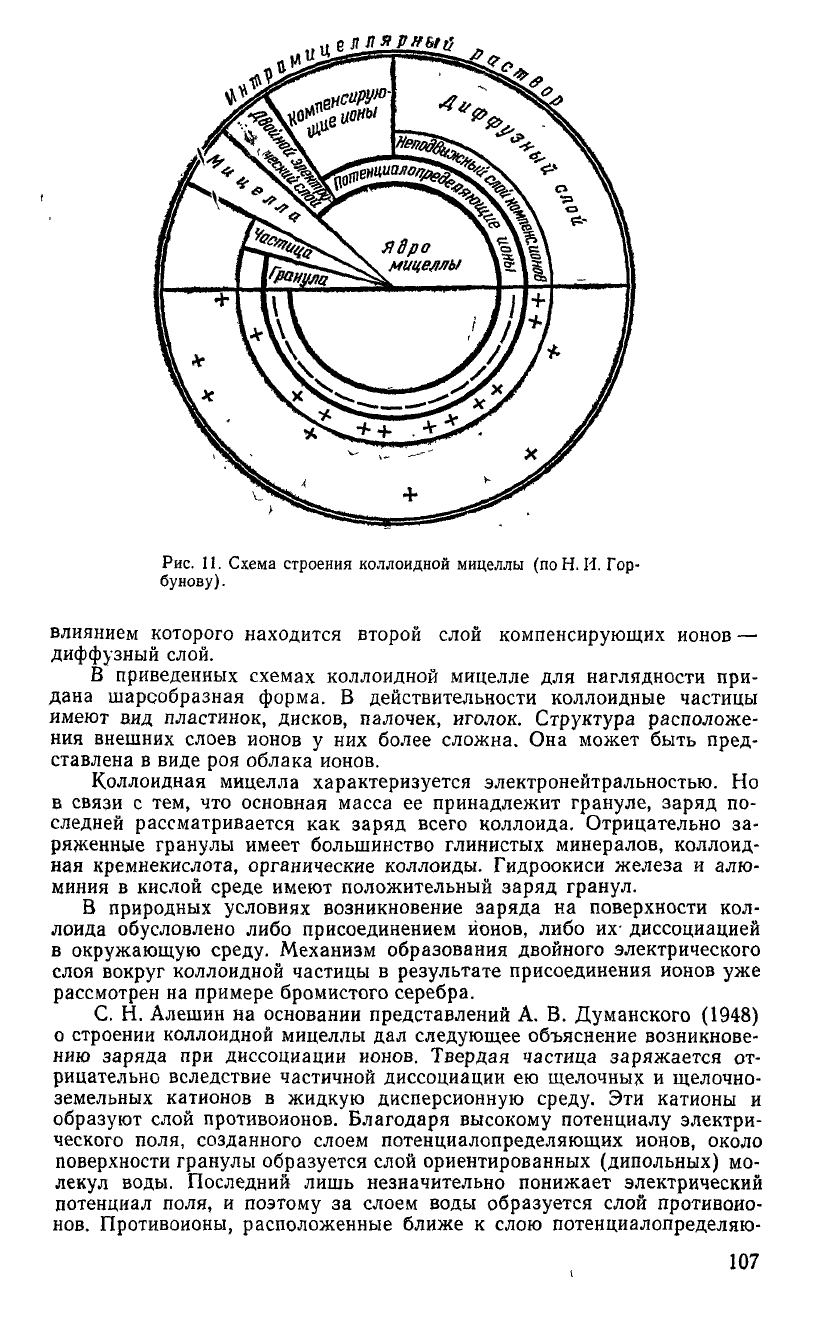
Рис.
11. Схема строения коллоидной мицеллы (поН. И. Гор-
бунову).
влиянием которого находится второй слой компенсирующих ионов
—
диффузный слой.
В приведенных схемах коллоидной мицелле для наглядности при-
дана шарообразная форма. В действительности коллоидные частицы
имеют вид пластинок, дисков, палочек, иголок. Структура расположе-
ния внешних слоев ионов у них более сложна. Она может быть пред-
ставлена в виде роя облака ионов.
Коллоидная мицелла характеризуется электронейтральностью. Но
в связи с тем, что основная масса ее принадлежит грануле, заряд по-
следней рассматривается как заряд всего коллоида. Отрицательно за-
ряженные гранулы имеет большинство глинистых минералов, коллоид-
ная кремнекислота, органические коллоиды. Гидроокиси железа и алю-
миния в кислой среде имеют положительный заряд гранул.
В природных условиях возникновение заряда на поверхности кол-
лоида обусловлено либо присоединением ионов, либо их- диссоциацией
в окружающую среду. Механизм образования двойного электрического
слоя вокруг коллоидной частицы в результате присоединения ионов уже
рассмотрен на примере бромистого серебра.
С. Н. Алешин на основании представлений А. В. Думанского (1948)
о строении коллоидной мицеллы дал следующее объяснение возникнове-
нию заряда при диссоциации ионов. Твердая частица заряжается от-
рицательно вследствие частичной диссоциации ею щелочных и щелочно-
земельных катионов в жидкую дисперсионную среду. Эти катионы и
образуют слой противоионов. Благодаря высокому потенциалу электри-
ческого поля, созданного слоем потенциалопределяющих ионов, около
поверхности гранулы образуется слой ориентированных (дипольных) мо-
лекул воды. Последний лишь незначительно понижает электрический
потенциал поля, и поэтому за слоем воды образуется слой противоио-
нов.
Противоионы, расположенные ближе к слою потенциалопределяю-
107

Рис.
12. Схема строения двойного электрического слоя вокруг дисперсной
частицы (по С. Н. Алешину):
/—ядро;
2
—
слой потенциалопределяющих ионов; 3
—
адсорбционный слой воды;
4 — прочносвязанный слой противоионов (обменные ионы); 5
—
подвижный (диффуз-
ный) слой противоионов; 6
—
интермицеллярная жидкость.
щих ионов, удерживаются электростатическими силами относительно
прочно. Противоионы,
как и
ионы, находящиеся
в
интермицеллярной
жидкости, гидратированы диполями воды.
Появление зарядов
у
различных коллоидов обусловливается
их хи-
мическим составом
и
структурными свойствами.
В
двухслойных мине-
ралах группы каолинита
и в
трехслойных минералах группы монтмо-
риллонита присоединение катионов может проявляться
в
результате
возникновения электрического заряда
при
освобождении валентностей
краевых ионов кислорода
на
местах разрыва связей. Отрицательные
за-
ряды могут появляться
на
поверхности пластинок таких коллоидов
в
результате изоморфного замещения четырехвалентного кремния трех-
валентным алюминием,
а
также алюминия двухвалентными катиона-
ми — железом, магнием
(рис.
13).
У
гидрослюд заряды появляются
в ре-
зультате изоморфного замещения ионов
в
кристаллической решетке.
Коллоидная кремнекислота является устойчивым отрицательно заря-
женным коллоидом,
в
котором электрический потенциал создается бла-
годаря диссоциации ионов водорода
(рис. 14).
Коллоиды органической природы (гуминовые кислоты
и
фульвокис-
лоты) проявляют способность присоединения благодаря наличию функ-
циональных групп, диссоциирующих водород, таких
как
карбоксильные
(СООН)
и
фенолгидроксильные
(ОН), а
также карбонильных
(СО),
характеризующихся двойной кислородной связью.
108
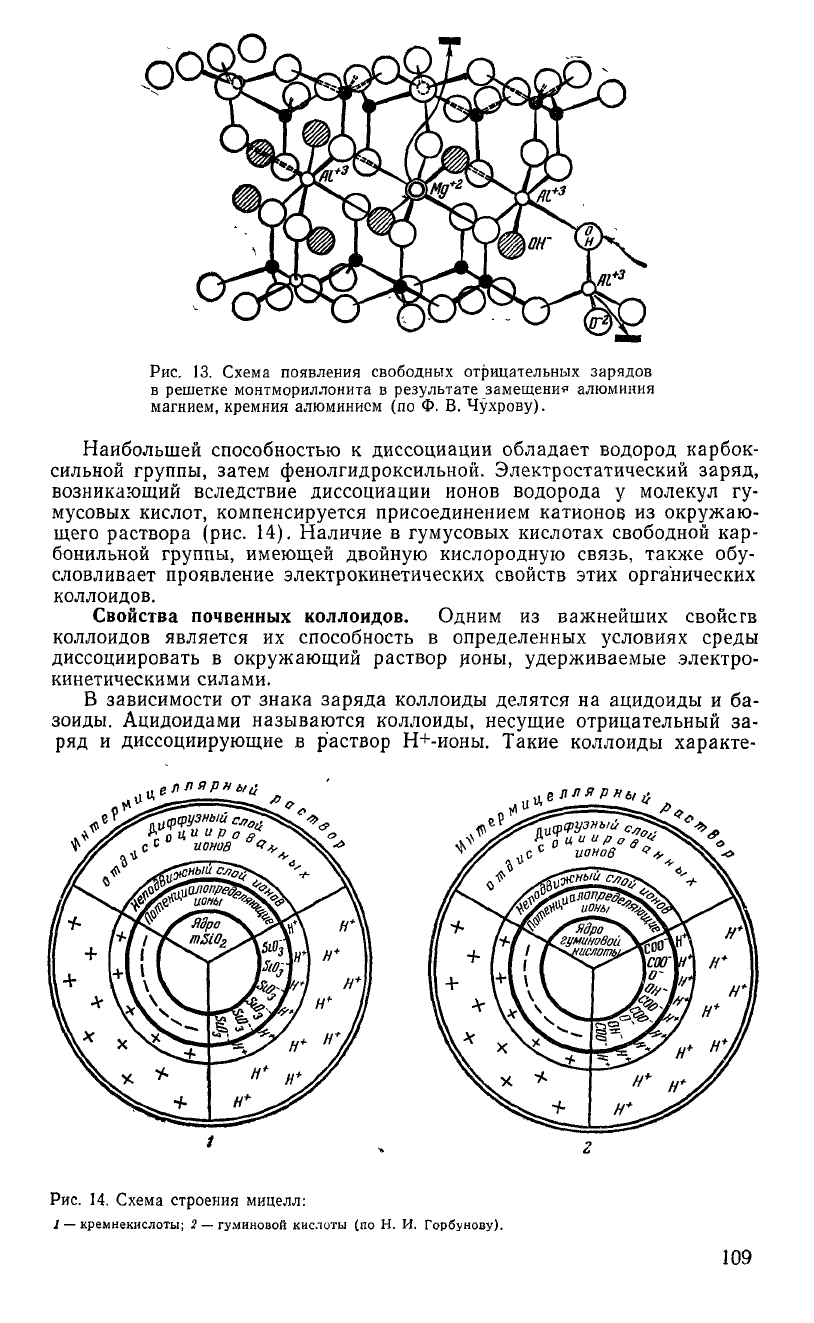
Рис.
13. Схема появления свободных отрицательных зарядов
в решетке монтмориллонита в результате замещения алюминия
магнием, кремния алюминием (по Ф. В. Чухрову).
Наибольшей способностью к диссоциации обладает водород карбок-
сильной группы, затем фенолгидроксильной. Электростатический заряд,
возникающий вследствие диссоциации ионов водорода у молекул гу-
мусовых кислот, компенсируется присоединением катионов из окружаю-
щего раствора (рис. 14). Наличие в гумусовых кислотах свободной кар-
бонильной группы, имеющей двойную кислородную связь, также обу-
словливает проявление электрокинетических свойств этих органических
коллоидов.
Свойства почвенных коллоидов. Одним из важнейших свойств
коллоидов является их способность в определенных условиях среды
диссоциировать в окружающий раствор ионы, удерживаемые электро-
кинетическими силами.
В зависимости от знака заряда коллоиды делятся на ацидоиды и ба-
зоиды. Ацидоидами называются коллоиды, несущие отрицательный за-
ряд и диссоциирующие в раствор Н+-ионы. Такие коллоиды характе-
Рис.
14. Схема строения мицелл:
/
—
кремнекислоты; 2
—
гуминовой кислоты (по Н. И. Горбунову).
109
