Каримов З.Ф., Павлов Е.П. Теоретические основы теплотехники. Термодинамика
Подождите немного. Документ загружается.

4.2. Методические указания к выполнению
контрольных заданий и практических работ
Эти указания реализованы в виде решения ряда характерных примеров с
иллюстрацией хода решения, используемых справочных данных, порядка и спо-
соба представления полученных результатов. Рекомендуется ознакомиться с
этими примерами до выполнения практических и контрольных работ.
Пример 1. Смесь идеальных газов задана объемными долями: =0,6;
=0,3; =0,1. Общая масса смеси
m
2
CO
r
2
N
r
2
O
r
см
=20 кг. В начальном состоянии объем
смеси
V
1
=15 м
3
и температура t
1
=47˚C. В результате адиабатного сжатия давле-
ние смеси увеличивается до
p
2
=0,9 МПа.
Определить давление смеси p
1
в начальном состоянии, температуру t
2
и
объем
V
2
смеси в конечном состоянии, работу сжатия L
1-2
и изменение внутрен-
ней энергии Δ
U. Считать, что теплоемкость газов не зависит от температуры и
определяется из приложения [П.1].
Определить парциальные давления газов, входящих в смесь, в конечном
состоянии. Изобразить процесс в
pv - и Ts - диаграммах.
Решение
Дано: V
1
, m
см
, p
2
, t
1
,
2
CO
r,
2
N
r,
2
O
r.
Необходимо найти:
p
1
, t
2
, V
2
, L
1-2
, ΔU=U
2
–U
1
.
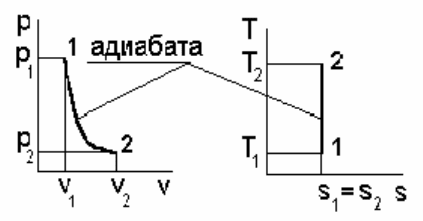
1. Сначала схематично представим рассматриваемый процесс в
pv - и Ts - диа-
граммах, следуя рис. 4.1.
Рис. 4.1
2. Состояние исследуемой газовой смеси описывается уравнением Клапейрона -
Менделеева (см. формулу 1), которое в обозначениях, принятых в данной зада-
че, можно представить в виде
p·V=m
см
·R
см
·T. (4.1)
Газовая смесь из состояния 1 переходит в состояние 2 по адиабате, поэтому
211

параметры начального и конечного состояний смеси связаны с уравнениями
(1.59, 1.60, 1.61). Применительно ко всему объему (
V
i
=m
см
·v
i
) эти уравнения
принимают вид
p
1
· =p
k
V
1
2
· ; T
k
V
2
1
·
1
1
−
k
V =T
2
·
1
2
−
k
V ; T
1
k
·
1
1
−
k
p =T
2
k
· . (4.2)
1
2
−k
p
Из структуры формулы (4.1) следует, что, в начале необходимо определить
газовую постоянную смеси
R
см
. Для этого используем формулу (1.18):
()
()
()
.
,,,
rrrr
R
OONNCOCOii
см
219
321030284460
8314
83148314
222222
=
⋅+⋅+⋅
=
μ⋅+μ⋅+μ⋅
=
μ⋅
=
∑
Анализ процесса сжатия смеси осуществляется при помощи уравнений
(4.2), но прежде необходимо найти показатель адиабаты
vcм
рсм
с
c
k =
, для нахож-
дения значения которого нужно рассчитать изобарную
c
pсм
и изохорную c
vсм
те-
плоемкости смеси, используя формулы (1.22,1.21):
222222
pOOpNNpCOCOpiiрсм
ccccc
⋅
γ
+
⋅
γ
+
⋅
γ
=⋅
γ
=
∑
. (4.3)
222222
vOOvNNvCOCOviivcм
ccccc
⋅
γ
+
⋅
γ
+
⋅
γ
=
⋅
γ
=
∑
По условию рассматриваемой задачи смесь задана объемными долями r
i
, а
в формулах (4.3) состав смеси выражен в массовых долях γ
i
. Перевод в массо-
вые доли производим при помощи формулы (1.19):
(
)
()
∑
μ⋅
μ
⋅
=γ
ii
ii
i
r
r
.
(
)
()
(
)
()
695,0
321,0283,0446,0
446,0
222222
22
2
=
⋅+⋅+⋅
⋅
μ⋅+μ⋅+μ⋅
μ⋅
=γ
OONNCOCO
COCO
CO
rrr
r
.
(
)
()
(
)
()
221,0
321,0283,0446,0
283,0
222222
22
2
=
⋅+⋅+⋅
⋅
μ⋅+μ⋅+μ⋅
μ⋅
=γ
OONNCOCO
NN
NO
rrr
r
.
212
(
)
()
(
)
()
084,0
321,0283,0446,0
321,0
222222
22
2
=
⋅+⋅+⋅
⋅
μ⋅+μ⋅+μ⋅
μ⋅
=
OONNCOCO
OO
O
rrr
r
g
.
Из [П.1] находим значения мольных изобарных и изохорных теплоемко-
стей компонентов газовой смеси
= 37,4;
2
pCO
cμ
2
vCO
c
μ
= 29,1
= 29,1 ;
2
pN
cμ
2
vN
c
μ
= 20,8
2
pO
cμ = 29,1 ;
2
vO
c
μ
= 20,8
Переводим значения мольных теплоемкостей в массовые с помощью
формул:
i
pi
pi
c
с
μ
μ
= ;
i
vi
vi
c
с
μ
μ
=
85,0
4,37
2
2
2
=
μ
μ
=
CO
pCO
pCO
c
c
;
66,0
44
1,29
2
==
мCO
c ;
039,1
28
1,29
2
==
pN
c ;
743,0
28
8,20
2
==
vN
c ;
909,0
32
1,29
2
==
pO
c ;
650,0
32
8,20
2
==
vO
c .
Найденные массовые доли компонентов газовой смеси γ
i
и их изобарные,
изохорные теплоемкости подставляем в уравнения (4.3):
c
pсм
=0,695·0,85+0,221·1,039+0,084·0,909=0,8967.
c
vсм
=0,695·0,66+0,221·1,743+0,084·0,650=0,6775.
213
Определяем значение показателя адиабаты:
324,1
6775,0
8967,0
===
vcм
рсм
с
c
k
.
Формулу (4.1) напишем применительно к начальному состоянию смеси
р
1
V
1
=m
см
·R
см
·T
1
,
где
T
1
=t
1
+273.
Из последнего выражения находим начальное давление:
093,0
15
32021820
1
1
1
=
⋅
⋅
=
⋅
⋅
=
V
ТRm
р
смсм
.
Далее в соответствии с первой из формул (4.2)
p
1
k
V
1
=p
2
k
V
2
определяем
конечный объем смеси:
7,2
9,0
093,0
15
324,1
1
1
2
1
12
=
⎟
⎠
⎞
⎜
⎝
⎛
⋅=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
k
p
p
VV
.
Пользуясь второй из формул (4.2)
T
1
1
1
−
k
V
=T
2
1
2
−
k
V
, рассчитываем конеч-
ную температуру смеси:
557
7,2
15
320
324,0
1
2
1
12
=
⎟
⎠
⎞
⎜
⎝
⎛
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
⋅=
−k
V
V
TT
.
284273557273
22
=
−
=
−
= Tt
.
Обращаясь к формуле (1.63), находим удельную работу сжатия газовой
смеси:
(
)
1
21
21
−
−
=
−
k
ТТR
l
см
.
214

Применительно ко всей массе смеси работа сжатия равна
19,3
1324,1
)557320(21820
1
)(
21
21
−=
−
−
⋅
=
−
−
⋅
⋅
=⋅=
−
k
ТТRm
lmL
смсм
смсм
.
Отрицательное значение
L
1-2
означает, что эта работа внешних сил над га-
зовой смесью.
Изменение удельной внутренней энергии смеси определяем, используя
формулу (1.64)
Δ
u=(u
2
-u
1
)=c
v
·(T
2
-T
1
).
Применительно ко всей массе смеси изменение внутренней энергии равно
Δ
U=U
2
-U
1
=m
см
·(u
2
-u
1
)=m
см
·c
v
·(T
2
-T
1
)=
=
20·0,6775(557-320)=3,19.
Определяем парциальные давления компонентов газовой смеси. Из зако-
на Бойля - Мариотта следует
iсм
см
i
смiiсмсмi
rр
V
V
ppVрVp
⋅=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
⋅=⇒⋅=⋅ .
Используя последнее выражение, определяем парциальные давления
компонентов газовой смеси:
2
CO
p = ·p
2
CO
r
2
=0,6·0,9=0,54,
2
N
p = ·p
2
N
r
2
=0,3·0,9=0,27,
2
O
p = ·p
2
O
r
2
=0,1·0,9=0,09.
Пример 2. Рассчитать цикл ДВС с изохорным подводом теплоты (цикл
Отто), если начальные параметры рабочего тела
p
1
=0,1 МПа, t
1
=20 ˚C, степень
сжатия ε=6,5, а отведенная теплота |
q
2
|=320 кДж/кг. Определить параметры со-
стояния рабочего тела в характерных точках цикла, подведенное количество
теплоты
q
1
, работу цикла l
ц
и термический КПД η
t
, а также термический КПД
цикла Карно в том же диапазоне температур. Изобразить цикл в координатах
p,
v и T, s. Рабочее тело - воздух. Средняя изохорная теплоемкость
c
vm
=0,716 кДж/(кг·К); удельная газовая постоянная R
в
=287 Дж/(кг·К); показа-
тель адиабаты
k=1,4.
215
Решение
Дано: p
1
, t
1
,
2
1
V
V
=ε , |q
2
|.
Необходимо определить
v
1
, v
2
, v
3
, v
4
, p
2
, p
3
, p
4
, t
2
, t
3
, t
4
, η
t
, l
ц
.
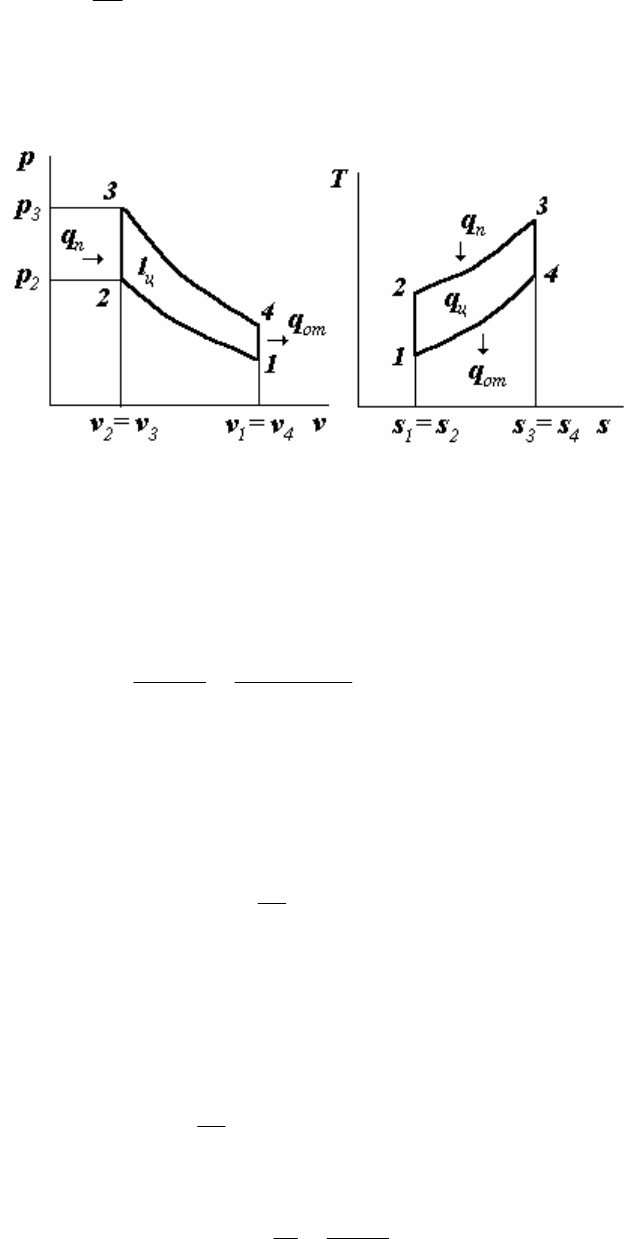
1. Представим рассматриваемый цикл в координатах
p, v и T, s, следуя рис. 4.2.
Рис. 4.2
Параметры точки 1:
p
1
=0,1·10
6
Па; T
1
=273+t
1
=293 К.
Удельный объем определяем с помощью формулы (1.4).
(
)
841,0
101,0
293287
6
1
1
1
=
⋅
⋅
=
⋅
=⇒⋅=⋅
p
ТR
vТRvp
в
в
.
Параметры точки 2: находим, исследуя адиабатный процесс 1-2, который
описывается формулой (1.59):
64,16
1
2
1
122211
10374,15,6101,0 ⋅=⋅⋅=ε=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=⇒=
k
k
kk
p
v
v
ppvpvp .
В соответствии с формулой (1.60)
=⋅ = ε=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
−
6195,6293T
v
T T
4,01
1
1-k
2
1
12
k
v
,
129,0
5,6
841,0
1
2
==
ε
=
v
v
.
Для нахождения параметров точек 3, 4 составляем зависимости, соответ-
ствующие процессам:
2-3; 3-4; 4-1. Процесс 2-3 - изохорный, v
3
=v
2
=const. Из
216
уравнения состояния pv=R
в
·T
следует ==
v
R
T
p
в
const. Следовательно,
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=⇒=
2
3
23
3
3
2
2
T
T
pp
T
p
T
p
. (4.4)
Для изохорного подвода теплоты справедлива зависимость
q
1
=с
v
·(T
3
-T
2
). (4.5)
Процесс 3-4 - адиабатный:
p
3
k
v
3
=p
4
k
v
4
. (4.6)
Процесс 4-1 - изохорный:
,
14
vv
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
1
4
14
T
T
pp
; (4.7)
и изохорный отвод теплоты
q
2
=с
v
·(T
4
–T
1
). (4.8)
В уравнениях (4.4 – 4.8) неизвестными являются
p
3
, T
3
, p
4
, T
4
, q
1
. Решая
эту замкнутую систему уравнений, находим искомые величины:
9,739
716,0
320
293
2
14
=+=+=
v
c
q
TТ
,
66
1
4
14
10252,0
293
9,739
101,0 ⋅=⋅⋅==
T
T
pp
,
p
3
= p
4
·ε
k
=0,252·10
6
·6,5
1,4
=3,46·10
6
,
1559
107741
10463
619
6
6
2
3
23
=
⋅
⋅
==
б
б
р
р
ТТ
.
Параметры всех характерных точек найдены.
217

Находим количество подведенной теплоты в соответствии с формулами:
q
1
=c
v
(T
3
-T
2
)=0,716 (1559-619)=673 .
Определяем термический КПД по формуле (3.16):
527,0
5,6
1
1
1
1
4,01
=−=
ε
−=η
−k
t
.
Рассчитываем работу цикла
l
ц
=q
1
-q
2
=(673-320)=353 кДж/кг.
Находим термический КПД цикла Карно в диапазоне температур
max
n
T =T
3
=1559 K, =T
min
от
T
1
=293 .
81,0
1559
293
11
3
1
=−=−=η
T
T
t
.
Пример 3. Из сужающегося сопла вытекает кислород, находящийся в ре-
зервуаре, давление и температура в котором
р
1
=6 МПа, t
1
=100
о
С. Давление сре-
ды, в которую проходит истечение
р
2
=3,6 МПа.
Определить скорость истечения и расход кислорода, если площадь вы-
ходного сечения
f=20 мм
2
.
Газ подчиняется уравнению Клапейрона - Менделеева
pv=RT, теплоем-
кость не зависит от температуры. Входная скорость кислорода близка к нулю.
Процесс изменения состояния текущего газа изоэнтропный.
Решение. Прежде всего, устанавливаем каков режим истечения, для чего
находим значение параметра
6,0
6
6,3
1
2
===β
р
р
.
Сравниваем полученное значение с критическим отношением давлений в
соответствии с формулой (2.56).
528,0
1
2
1
1
=
⎟
⎠
⎞
⎜
⎝
⎛
+
==β
−k
k
кр
кр
kр
р
,
где
k=1,4 - коэффициент адиабаты;
218

кр
β>β , т.е. это означает, что давление среды перед соплом больше, чем крити-
ческое, следовательно, располагаемый перепад давления будет использован
полностью для разгона потока газа.
На выходе из сопла установится давление, равное давлению среды, а ско-
рость истечения окажется меньше критической скорости, т.е. режим истечения
будет - дозвуковой.
Определяем скорость истечения в соответствии с формулой (2.52):
()
3036,01373
32
8314
14,1
4,12
1
1
2
286,0
1
12
=−⋅⋅
−
⋅
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
β−
−
=
−
k
k
RT
k
k
w
.
Подсчитываем удельный объем кислорода на выходе из сопла:
()
743,067,1
106
3738314
4,1
1
6
1
2
1
1
1
1
2
1
12
=
⋅
⋅
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
kk
p
p
p
RT
p
p
vv
.
В заключение находим массовый расход кислорода при помощи уравне-
ния неразрывности (2.40):
008,0
743,0
3031020
6
2
22
=
⋅⋅
==
v
wf
G .
Пример 4. Необходимо определить конструктивные параметры сопла
Лаваля, которое должно работать при следующих условиях.
На входе сопла давление и температура воздуха соответственно
р
1
=0,9 МПа, Т
1
=1100 К, в выходном сечении давление р
2
=0,11 МПа. Массовый
расход газа G=0,7 кг/с.
Истечение через сопло адиабатное, при k=1,4. Трение газа в каннале и
входная скорость его не учитываются. Удельная газовая постоянная
R=287 Дж/(кг·К).
Решение. Находим отношение давлений в выходном сечении сопла:
12,0
109,0
1011,0
6
6
1
2
=
⋅
⋅
==β
p
p
.
219
По формуле (2.56) определяем критическое значение
β
:
528,0
14,1
2
1
2
14,1
4,1
1
=
⎟
⎠
⎞
⎜
⎝
⎛
+
=
⎟
⎠
⎞
⎜
⎝
⎛
+
=β
−
−k
k
кр
k
.
Для условий данного примера имеет место условие
кр
β<
β
, следователь-
но, в минимальном сечении сопла будет достигнута критическая скорость и со-
пло Лаваля будет работать в сверхзвуковом режиме. Критическую скорость,
соответствующую начальной температуре Т
1
=1100 К, определяем по формуле
(2.57)
6071100287
14,1
4,12
1
2
1
2
111
=⋅
+
⋅
=
+
=
+
= RT
k
k
vp
k
k
w
кр
.
Площадь минимального сечения сопла находим по формуле:
кр
кр
w
Gv
f =
min
,
где
k
кркр
vv
1
1
−
β= ; 351,0
109
1100287
5
1
1
1
=
⋅
⋅
==
p
RT
v .
554,0528,0351,0
4,1
1
=⋅=
−
кр
v
м
3
/кг; 638
607
554,07,0
min
=
⋅
=f .
Диаметр минимального сечения сопла
29
14,3
63844
min
min
=
⋅
=
π
=
f
d .
Длину сужающейся части сопла l
1
обычно принимают равной диаметру
минимального сечения:
l
1
=29.
Скорость газов в выходном сечении сопла находим по формуле (2.52):
220
