Формулы для расчета термодинамических процессов
Подождите немного. Документ загружается.

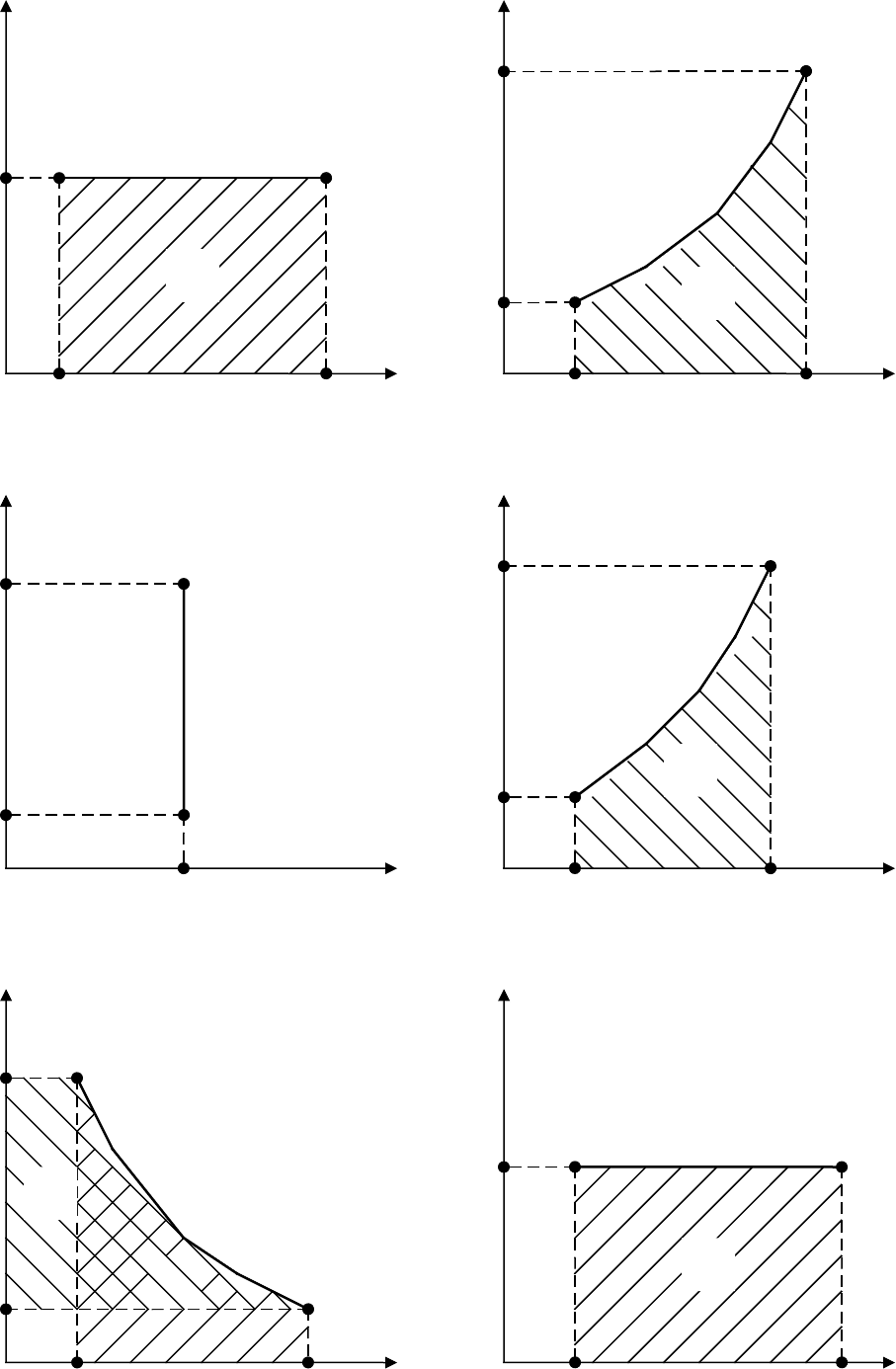
Ниже приводятся формулы для равновесных обратимых процессов, которые
для идеальных газов в pv- и Ts- диаграммах изображаются следующим образом:
1) изобарный – при постоянном давлении p = const, dp = 0;
2) изохорный – при постоянном объеме v = const, dv = 0;
3) изотермический – при постоянной температуре T = const, dT = 0;
vv
2
v
1
1
2
p
1
= p
2
p
l
T
s
1
2
q
s
2
s
1
T
1
T
2
vv
1
= v
2
1
2
p
1
p
l = 0
T
s
1
2
q
s
2
s
1
T
1
T
2
p
2
v
v
1
p
2
p T
s
1
2
s
2
s
1
T
1
=T
2
p
1
1
2
q
l
l'
v
2
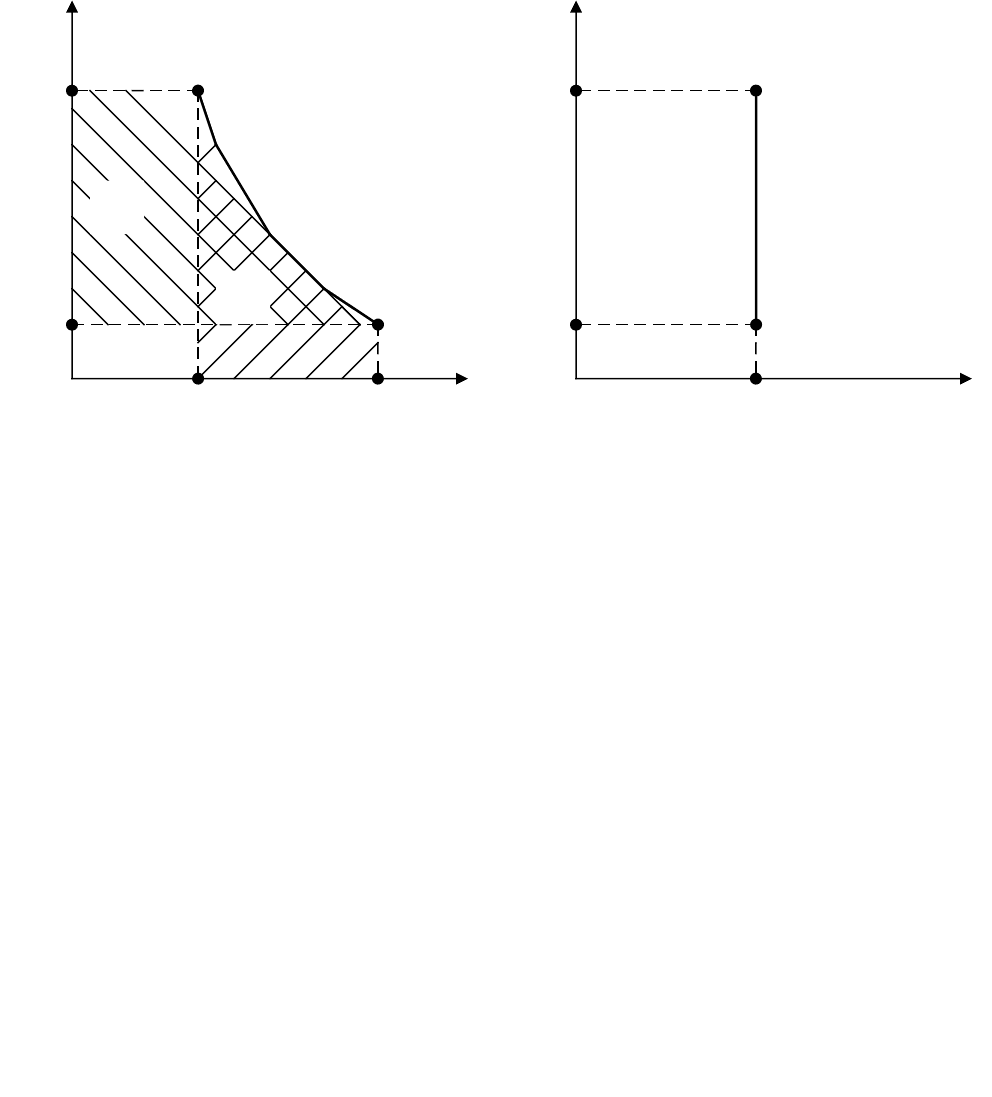
4) адиабатный – без подвода или отвода теплоты q = 0, q = 0, обратимый
адиабатный процесс, кроме того, протекает при постоянной энтропии, т.
е. является изоэнтропным s = const, ds = 0;
5) политропный – любой процесс при постоянной теплоемкости, для этого
процесса pv
n
= const, где n – показатель политропы для данного процесса.
При расчете процесса обычно определяют параметры рабочего тела в начале
p
1
, v
1
, T
1
и конце p
2
, v
2
, T
2
процесса, изменение функций состояния
12
uuu
,
12
hhh
,
12
sss
, а также теплоту q и работу l. Основные соотношения для
расчета равновесных процессов в идеальных газах можно получить из уравнения
состояния идеального газа
RTp v
и аналитического выражения первого закона термодинамики
luuq
12
,
2
1
12
v
v
vpduuq
,
2
1
12
p
p
dphhq v
,
'
12
lhhq
.
v
v
1
p
2
p T
s
1
2
s
1
= s
2
T
1
p
1
l'
v
2
l
1
2T
2
q = 0

Соотношения для идеального газа.
T=const, dT=0, T
2
=T
1
v=const, dv
=0, v
2
=v
1
p=const,
dp=0, p
2
=p
1
pv
n
=const
q=0, q=0,
s=const, ds=0,
s
2
=s
1
, pv
k
=const
n=k
2
1
1
2
v
v
p
p
1
2
1
2
T
T
p
p
1
2
1
2
T
T
v
v
n
pp
2112
vv
1
2112
n
TT vv
n
n
ppTT
1
1212
k
pp
2112
vv
1
2112
k
TT vv
k
k
ppTT
1
1212
Т. к.
0
12
uu
1
2
2
1
ln
ln
v
v
vp
p
p
RTqll
Т.к. dv =0
0l
21
ppl
v
Т.к. dp=0
0
l
12
vv pl
n
n
p
p
n
RT
T
T
n
RT
TT
n
R
l
1
1
21
1
21
21
1
1
1
1
1
nll
n
n
p
p
k
RT
T
T
k
RT
TT
k
R
l
1
1
21
1
21
21
1
1
1
1
1
kll
12
TTcq
x
q=0
c
2
3
в
Rc
v
Rcc
p
v
1
n
kn
cc
n v
c=0
21
12
ln ppR
Tqsss
1212
ln TTcsss
x
0
12
sss
0
12
uuu
0
12
hhh
1212
TTcuuu
v
1212
TTchhh
p
Все соотношения в таблице справедливы при условии, что теплоемкость в
процессе не изменяется. Здесь c
x
– удельная массовая теплоемкость любого
процесса, где индекс x заменяется на p, v или n в зависимости от процесса для
которого выполняется расчет (c
p
– теплоемкость изобарного процесса, c
v
–
изохорного, c
n
–политропного). k – показатель адиабаты, k=c
p
/c
v
.
Все перечисленные процессы изотермический, изохорный, изобарный,
адиабатный при постоянной теплоемкости являются частными случаями
политропного процесса, т.е. их параметры описываются уравнениями для
политропного процесса, а линия политропы в диаграммах может совпадать с
линиями вышеперечисленных процессов.
Из анализа выражения
1
n
kn
cc
n v
,
следует, что при n = ±1,
n
c
, т.е. политропный процесс обращается в –
изотермический, при
n
,
v
cc
n
, – в изохорный, при
0n
,
pn
cc
– в
изобарный и при
kn
,
0
n
c
– в адиабатный. Кроме того, политропный процесс
может обращаться в бесконечное множество различных процессов, линии которых
не совпадают в диаграммах с линиями ни одного из вышеперечисленных
процессов, если показатель политропы имеет иные значения.
Для идеальных газов и реальных веществ, в том числе для воды и водяного
пара справедливы соотношения, полученные на основе аналитического выражения
первого закона термодинамики без привлечения уравнения состояния идеального
газа.
Соотношения справедливые для идеальных газов и реальных веществ.
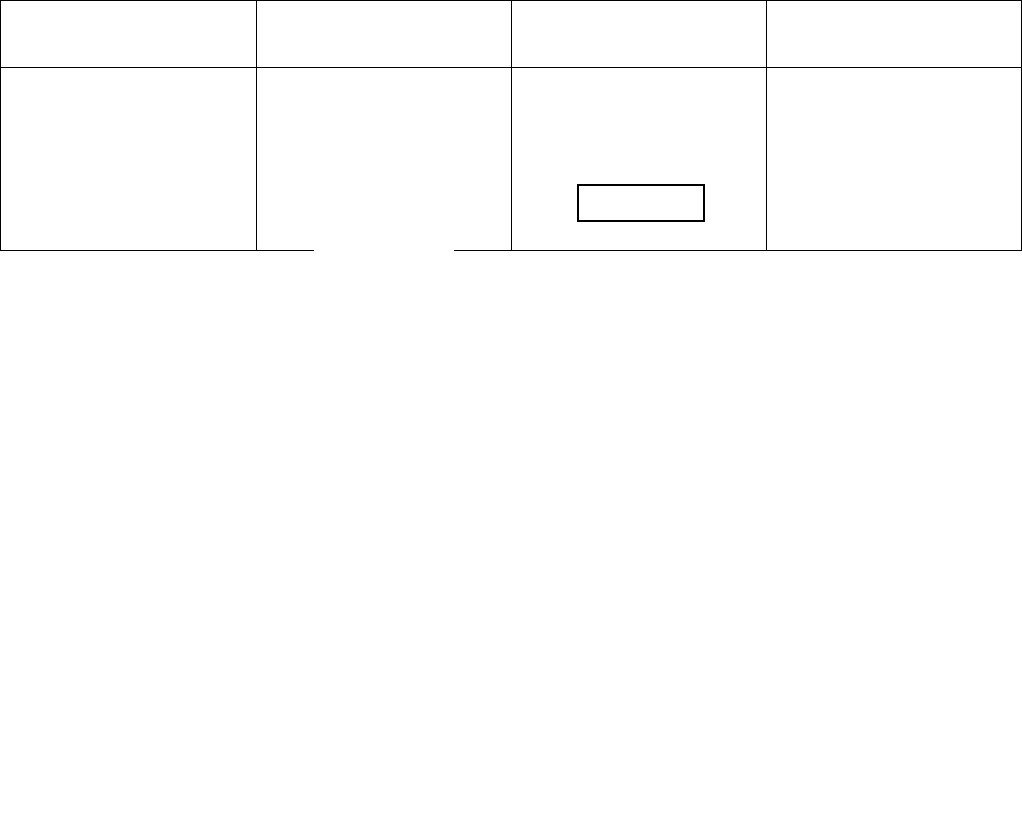
T=const, dT=0,
T
2
=T
1
v=const, dv =0,
v
2
=v
1
p=const, dp=0,
p
2
=p
1
q=0, q=0, s=const,
ds=0, s
2
=s
1
,
12
uuql
12
hhql
12
ssTq
Т.к. dv =0,
0
2
1
v
v
vpdl
и
12
uuq
21
ppl
v
Т.к. dp=0,
0
2
1
p
p
dpl v
и
12
hhq
12
vv pl
т.к.
0q
12
uul
12
hhl
Если в процессе не происходит фазовых превращений, то и для реальных веществ
с некоторыми допущениями применимы формулы
12
TTcq
x
,
1212
ln TTcsss
x
.
Параметры реальных веществ в начале и конце процесса, а также их теплоемкости
определяются по справочным таблицам или диаграммам.
Все соотношения в таблицах записаны в удельных величинах (т.е. для 1 кг
вещества). Величины для тел произвольной массой m определяются из очевидных
соотношений
mqQ
,
mlL
,
12
uumumU
,
12
hhmhmH
,
12
ssmsmS
.
