Ефимов А.И. и др. Свойства неорганических соединений. Справочник
Подождите немного. Документ загружается.

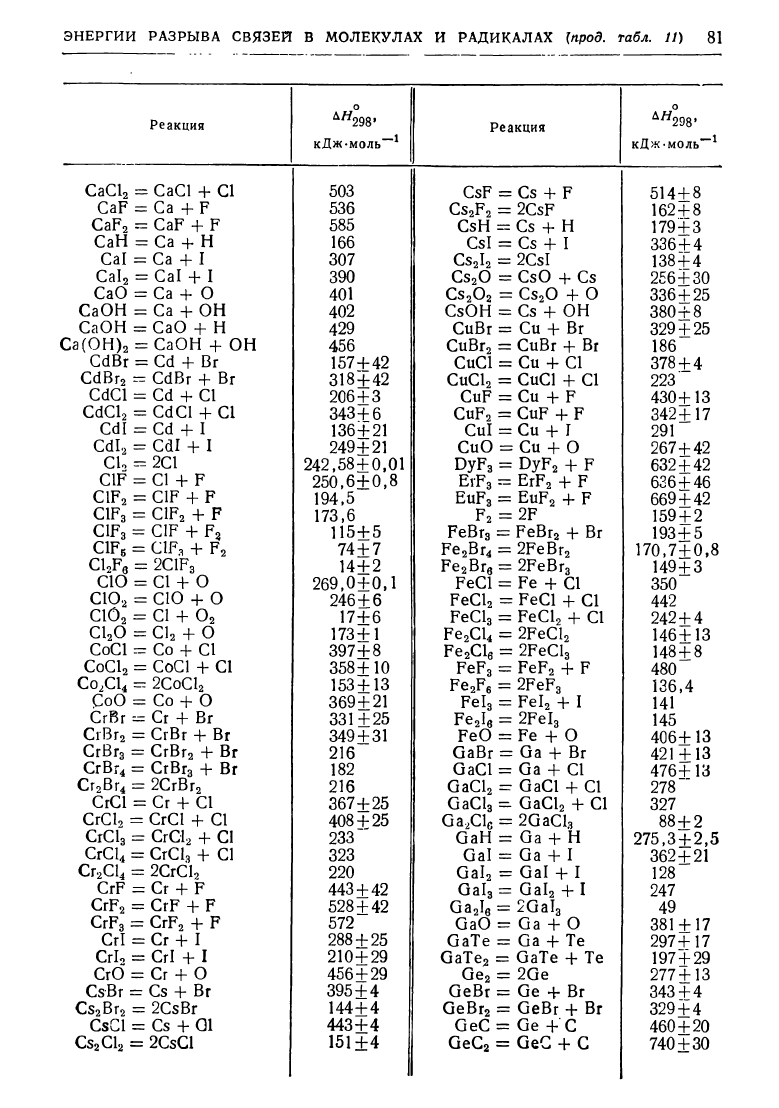
ЭНЕРГИИ
РАЗРЫВА
связви
В
МОЛЕКУЛАХ
И
РАДИКАЛАХ
(nрод.
табл.
11) 81
о
о
Реакция
АН
2 9
8,
Реакция
АН
2
9
8,
к.Дж-моль
-1
кДж,моль-
1
----
CaC1
2
==
СаСl
+
Сl
503
CsF
==
Cs + F
514+8
СаР
==
Са
+ F
536
Cs
2F
2
==
2CsF
162+8
СаР
2
==
СаР
+ F
585
CsH
= Cs +
Н
179+3
СаН
==
Са
+
Н
166
CsI
==
Cs + I
336+4
Са!
==
Са
+ 1 307
Cs
2I2
==
2CsI
138+4
CaI
2
==
Са!
+ 1
390
Cs
20
==
CsO
+ Cs
256+30
СаО
==
Са
+
О
401
CS
20
2
==
Cs
20
+
О
336+25
СаОН
==
Са
+
ОН
402
CsOH
==
Cs +
ОН
380+8
СаОН
==
СаО
+
Н
429
CuBr
==
Cu + Br
329125
Са(ОН)2
==
СаОН
+
ОН
456
сев-,
==
CuBr
+ Br
186
CdBr
==
Cd + I3r
157+42
CuCl
==
Cu + Cl
378±4
CdBr2
==
CdBr + Br
318+42
CuC1
2
==
CuC1 + Cl
223
CdCl
==
Cd + Cl
206+3
CuF
==
Cu + F
430+
13
CdC1
2
==
CdCl
+
Сl
343+6
CuF
2
==
CuF
+ F
342±
17
CdI
==
Cd + 1
136+21
Cu!
==
Cu + 1
291
CdI
2
==
CdI + 1
249+21
CuO
==
Cu +
О
267+42
Cl')
==
2Cl
242,58±0,01
DуF
э
==
DyF
2
+ F
632+42
CIF
==
Сl
+ F
250,6±0,8
Е1'F
э
==
ErF
2
+ F
636+46
CIF
2
==
CIF + F
194,5
ЕuF
э
==
EuF
2
+ F
669+42
СIF
з
==
CIF
2
+ F
173,6
Р
2
==
2Р
159+2
СIF
з
==
CIF +
p~
115+5
FеВrз
==
FeBr2 + Br
193+5
сп,
==
CIF~
+
Р
2
74+7
Fe2Br4
==
2FeBr2
170,7±0,8
С1
2F
в
==
2СIF
з
14+2
Fе2Вrв
==
2FеВrз
149±3
CIO
==
Cl +
О
269,0±0,1
FeCl
==
Ре
+Cl
350
CI0
2
==
CIO +
О
246+6
FeC1
2
==
FeCl
+ Cl
442
сто,
==
Сl
+ 02
17+6
FеСl
з
==
РеС1
2
+ Cl
242+4
C1
20
==
CI
2
+
О
173+1
Fe
2C1
4
==
2FeC1
2
146+13
CoCl
==
Со
+ Cl
397+8
Fe2C1B
==
2FеСl
з
148±8
CoC1
2
==
СоСI
+
Сl
358+
10
FеF
з
==
РеР
2
+ F
480
C0
2C1
4
==
2CoC1
2
153+
13
Ре
2Р
в
==
2FеF
з
136,4
(::00
==
Со
+
О
369+21
FеI
з
==
Fel
2
+ 1
141
Cr~r
==
Cr + Br
331
+25
Fе
2I
в
==
2Ре
I
з
145
С1"ВТ2
==
CrBr +
Вт
349±31
РеО
==
Ре
+
О
406+
13
СrВrз
==
CrBr2 + Br
216
GaBr
==
Оа
+ Br
421
+13
с-в.,
==
СrВrз
+ Br
182
GaCl
==
Оа
+ Cl
47611:i
Cr2Br4
==
2ССВТ
2
216
ОаС1
2
==
GaCl
+ Cl
278
CrCl
==
Cr + Cl
367+25
GаСl
э
=-
GaC1
2
+
Сl
327
CrC1
2
==
CrCl + Cl
408±25
Oa~C1c
==
2GаСl
з
88+2
СrСl
з
==
CrC1
2
+ CI
233
ОаН
==
Оа
+
Н
275,3±2,5
CrC1
4
==
СrСl
э
+
С1
323
GaI
==
Оа
+ 1
362±21
Cr2C14
==
2CrC1
2
220
GaI
2
==
ОаI
+ 1
128
CrF
==
Cr + F
443+42
Gаl
э
==
GaI
2
+1
247
CrF
2
==
CrF
+ F
528±42
Оа
2I
в
==
2Gаl
з
49
СrF
э
==
CrF
2
+ F 572
ОаО
==
аа
+
О
381
+17
CrI
==
Cr + 1
288+25
ОаТе
==
аа
+
Те
297+
17
Crl2
==
СтI
+ 1
210+29
ОаТе2
==
ОаТе
+
Те
197+29
CrO
==
Cr +
О
456+29
Ое2
==
2Ое
277+
13
Cs'Br
==
Cs + Br
395+4
GeBr
==
Ое
+ Br
343+4
CS2Br2
==
2CsBr
144+4
GeBr2
==
GeBr
+ Br
329+4
CsCl
==
Cs +01
443+4
аеС
==
ае
+'С
460+20
CS
2
С1
2
==
2CsCl
151±4
ОеС
2
==
ОеС
+
С
740±30

82
ЭНЕРГИИ
РАЗРЫВА
СВЯЗЕй
о
о
Реакция
~H298'
Реакция
~H298'
КДЖ'МОЛЬ
-1
КДЖ'М~ЛЬ
-1
Ое2С
==
ОеС
+
Ое
470+30
ьо,
=IrO +
О
597+25
ОеСl
==
Ое
+ Cl
4.10±25
11'0з
=
ьо,
+
О
452+
17
GeC1
2
==
GeCl + Cl
388
I<.Br
=
К
+ Br
382±5
ОеР
==
Ое
+ F 485+21
K2Br2
=
2I<.Br
180+17
GeF
2
==
GeF
+ F
524~
ксн
==
К
+ CN
438+21
ОеН
4
==
GеН
з
+
Н
364+21
KCl
==
К
+
Сl
425±2
ОеО
==
Ое
+
О
659+8
K
2C1
2
==
2KCl
188+4
Ое202
==
2ОеО
310+25
кг
ь
к
ч
г
497+8
GeSe
==
Ое
+ Se
490±21
K
2
F
2
=
2КР
209+8
GeSi
==
Ое
+ Si
302+21
I<.H
==
К
+
Н
182+7
G
e2
Si
=:
GeSi
+
Ое
392+29
КI
=
К
+ 1
325+
13
ОеТе
=
Ое
+
Те
4С6±8
К
2
;
2
=-
2KI
171±4
HBr
==
Н
+Br
366,1
I<.Oh
==
I(
+
но
347+
]3
не1
==
н
+ Cl
431,6±О,2
Li
2
==
2Li
101,
7±
0.6
HF
==
Н
+F
568,5±
1,2
LiBr = Li + Br
423+2
НI
==
Н
+ 1
298,3±0,8
Li2Br2
=
зцв,
193+21
НО
==
Н
+
О
427,8±0,2
LiCl
==
ц
+ Cl
477+4
Н0
2
==
НО
+
О
~6~+8
I..i
2C1
2
= 2LiCl
207+
]3
НО
2
==
Н
+ 02
197±8
LiF =Li + F
577+4
Н
2О
==
НО
+
Н
498,
7±
1,2
Li
2F
2
= 2LiF
261+-]1
Н
2О
2
==
2НО
214+2
LiH
==
Li +
Н
236:1
HS =
Н
+ S
349+8
ш
=Li + 1
353+2
H
2S
==
HS +
Н
385±8
L1
2I2
=2LiI
182+21
H
2S0
4
==
Н
2О
+
SОз
106,3
LiO
==
Li +
О
343~
13
H%Br
==
Hg + Br
71±2
ц,о
=
цо
+ Li
393+
17
HJ;
r2
= HgBr +Br
300
Li
20
2
=
ц.о
+
О
306+31
gCl
==
Hg + Cl
99±8
LiOH
==
ц
+
ОН
442+4
HfIC1
2
=HgCl +
Сl
354
MgBr
==
Mg + Br
254+30
gF
==
Hg +F
129+30
МД'Вr
2
==
MgBr +
Вг
416+30
HgF
2
==
HgF +F
385+42
gCl
==
Mg + Cl
324+6
H~I
=Hg +1
36±2
MgC1
2
==
MgCl +
С1
468±6
Hg 2
==
HgI + 1
254
MgF
==
Mg + F
459±5
InBr
==
Iп
+ Br
387±
13
MgF
2
= MgF +F
584+5
InBr2
==
InBr + Br
201
MnBr
==
Мп
+
Вт
312±8
IпВrэ
= InBr2 + Br
255
MnBr2
==
MnBr + Br
37]
InCl
==
In + Cl
430±8
MnCl =
Мп
+ Cl
359±8
InC1
2
==
InC1 + Cl
251
мьсг,
==
MnCl + Cl
432±9
IпСl
э
==
InC1
2
+Cl
·297
МП2(СО)1О
==
2Мп
гсоь
108+9
In2Cl6
=
2IпСl
э
130±13
MnF
==
Мп
+ F
447±21
Inli
==
In +
Н
241±2
MnF
2
=MnF + F
528+28
InI
==
In + 1
336±
13
МпF
э
==
MnF
2
+ F
259+25
InI
2
==
InI + 1
138
мпн
=
Мп
+
Н
234±30
Iпl
э
=InI
2
+ 1
201
MnI
=
Мп
+ 1
283±
13
InS
==
In + S
285+
17 MnI
2
= MnI + 1
257
In2S
==
InS + In
339+21
MoCllj
==
месь
+ Cl
184+13
InSe = In + Se
243+25
М'оО
=
Мо
+
О
502+42
In
2Se
==
InSe + In
318+30
МоО
2
=
МоО
+
О
660±46
InTe =In +
Те
218+21
МоО
з
=
МоО
2
+
О
600±30
ьт-,
=InTe +
Те
238+25
(МОО
З)2
=
2МоО
з
477+50
IП2Те
=InTe + In
255+25
N
2
= 2N
945,3±0.8
IrO=Ir+O
355±21
NF
a
=NF
2
+ F
250±5

В
МОЛЕКУЛАХ
И
РАДИКАЛАХ
(nроа.
табл.
//)
83
-----------
-------------
'1
о
о
Реакция
АН
2
9 8•
Реакции
А8
2
9
8
•
КДЖ-МОJlь-
1
КДЖ-МОJlь-
1
NH = N +
Н
313±13
Р
2
=
2Р
489,1±0,4
NH
2
= NH +
Н
421+15
Р
4
=
2Р2
229+2
нн,
=NH
2
+
Н
438+8
PF =
Р
+F
464±42
NO = N +
О
631,6±0,4
PF
2
=PF +F
4~
N0
2
= NO +
О
305,9±0,8
РF
з
=PF
2
+ F
607
N
20
= NO + N
481,2±0,8
РН
=
Р
+
Н
343+30
N
20
=N
2
-f
О
167,4±0,8
РН
2
=
РН
+
Н
339+42
N
20
2
=2NO
12
РН
з
=
РН
2
+
Н
284+59
N
2О
з
=
N0
2
+ NO
41+1
РО
=
Р
+
О
5973:29
N
20
4
=
2N0
2
57,4±0,2
Р08rз
=
РВr
з
+
О
506
N
20
6
= N
20
4
+
О
247+3
РОСl
з
=
РСl
з
+
О
527
NOBr
= NO + Br
123+2
РОF
з
=
РF
з
+
О
544
NOC1
=NO + Cl
159,0±0,8
РSВrз
=
РВr
з
+ S
397
но.с:
=
N0
2
+ Cl
134+8
РSСl
з
=
РСl
з
+ 5
406
N0
2Cl
= NOCl +
О
281
+8
РSF
з
=PF
s
+ 5 414
NOf
= NO + F
236±4
PbBr
==
РЬ
+ Br
240+25
N0
2F
=
N0
2
+ F
192
PbBr2
==
PbBr + Br
284+25
Na
2
==
2Na
73+2
РЬСl
=
РЬ
+
Cl_
300±25
NaBr = Na + Br
370+8
РЬС1
2
==
РЬСl
+ Cl
406
Na2Br2
=2NaBr
184+17
РЬР
=
РЬ
+ F
355+8
NaCl =Na +
Сl
411,0±0,8
PbF
2
=PbF + F
436+
13
Na
2C1
2
=2NaCl
210+4
PbS =
РЬ
+ S
341+2
NaCN
==
Na + CN
441+5
PbSe
==
РЬ
+ Se
302±6
NaF =Na + F
480+8
РЫе
=
РЬ
+
Те
245+
13
Na
2F
2
= 2NaF
259+7
PtO
==
Pt +
О
359+42
NaH =Na +
Н
200+·21
Pt0
2
==
PtO
+
О
522+25
NaI
==
Na + 1
290+4
PuF
=
Ри
+ F
540+29
Na
20
==
NaO + Na
251
+13
PuF
2
=PllF + F
565+33
NaOH = Na +
ОН
329±
13
РuF
з
==
PuF
2
+ F
615+42
Nэ
2'Оj
==
Na20 +
50з
575
РиО
==
Рп
+
О
724+21
кьсь
=
NЬСl
з
+ Cl
330
RbBr
==
Rb +
Вс
387+8
NbC1
6
= NbC1
4
+ Cl
272
кь.в-,
==
2НЬВт
163±8
NbO
==
Nb +
О
773+42
RbCl
==
Rb + Cl
429+8
ньо,
==
NbO +
О
661
±46
Rb
2C1
2
==
2RbCl
172±13
NЬОСl
з
==
NЬСl
з
+
О
658
RbF
==
Rb + F
505+
13
NIBr
= Ni + Br 360+21
Rb
2F
2
==
2RbF
201+13
NiBr
2
=NiBr + Br
273+25
RbH =Rb +
Н
165±21
NiCl
= Ni +
Сl
372+8
RbI
==
Rb + 1
337±8
NIC1
2
==
NICl +
Сl
265±
13
Re2
(СО)10
==
2Не
(СО)б
187±4
N:IF
==
Ni + F
435
ньст,
==
RhC1
2
+ Cl
180±17
NIF
2
==
NIF + F
479
RuC1
4
==
RuСl
з
+ Cl 271±21
NiH
==
Ni +
Н
291+13
R1l0
==
Ru +
О
490±42
NiI = Ni + 1
292±21
Ru0
2
==
RuO +
О
490±60
нп,
==
NiI + 1
212
Ruо
з
==
RU02 +
О
498
NiO
==
Ni +
О
.-
364+21
Ru0
4
==
RuОз
+
О
355±
12
NI(OH)2
==
NiO +
Н
2О
327+25
52
==
25
425,47±0,04
02=20
498,4±0,2
в,
==
52 + 5
272±8
Оз
= 02 +
О
107+2
54
==
5з
+ 5
272±
15
OF
==
0+
F
2~0+
17
5(;
==
54 + 5
287+21
OF
2
==
OF + F
165±21
56=
51)
+ 5
301+19
OS04 =
050з
+
О
306 5
7=5
6
+ S
267±19

84
ЭНЕРГИИ
РАЗРЫВА
СВЯЗЕй
о
о
Реакция
l:1H
298
I
Реакция
l:1H
298,
кдж-моль-
1
к.Дж-моль
-1
88 =S7 +S
288±
17 SiH
2
==
SiH +
Н
247
SCl
=S +
Сl
267
SiН
з
=
SiH
2
+
Н
345
SC1
2
==
SCl +
Сl
274
SiH
4
==
SiН
з
+
Н
395+
13
S2C12
==
зст,
+S
272
Si
2H
G
=:
2SiН
з
344+25
SF =S +F
360±21
SnBr =Sn +
В!
337±4
SF
G
=
SF
Б
+F
324
SnBr2
=SnBr +Br
310
S2
F
10 = 2SF
G
142
SnCl
=Sn +Cl
413±17
S2
F
10 =SF
4
+
вг,
82+4
SnC1
2
==
SnCl +
Сl
339
HS
==
S +
н
349+8
SnF
=Sn +F
472±
13
H
2S
==
I-I') +S
385+8
SnF
2
=
SnF
+ F
439
SO
==
S +
О
521,710,3
SnO
=Sn +
О
531+8
S02
==
SO +
О
550,6±
1,2
(SnO)2 =2SnO
279+
17
SO:~
:=.
S02
+
О
348,2±0,5
SnS
==
Sn +S
465+3
S20
==
SO + S
383
SnSe
=Sn + Se
400+21
SOCl
==
SO +
Сl
227
SnTe
=Sn +
Те
316+4
SOCl
==
SCl +
О
486
SnTe
2
==
~пТе
+
Те
205+
13
SOCl
=СI0
+ S
484
SnTe2
=Sn +
Те2
258+8
50С1
2
=SOCl +
Сl
229
SrCl
=Sr +
Сl
408+10
SOC1
2
==
SC1
2
+
О
441
SrC1
2
= SrCl +
Сl
483+
10
S02C12
==
SOC1
2
+
О
400±5
SrF =Sr +F
544+8
SOF
2
==
SF'
l
+
О
657
SrF
2
=SrF +F
553+8
S02F2 =
SOF
2
+
О
393
SrH
=Sr +
Н
161+8
S02F2
==
SO;t +
2Р
720+33
SrO = Sr +
О
427+8
Sb
2
==
25Ь
323+7
SrOH
==
Sr +
ОН
392+20
Sb
4
=2Sb
2
221+7
5rOH
=SrO +
Н
393+20
SbCl
==
Sb +
Сl
360+42
Sr
(ОН)2
=
SгОН
+
ОН
436±20
ScCl
==
Sc +
Сl
493+42
ТаС1
5
==
TaC1
4
+
Сl
32~i
ScC1
2
==
ScCl +
Сl
439+42
ТаF
Б
=-
ТаР
4
+
Сl
598
SсСl
з
=ScC1
2
+Cl
494+42
ТаО
=
Та
+
О
811
+42
Sc
2Cl
a
=
2SсСl
з
201+21
ТеО
=
Те
+
О
391+Н
~cP
=Sc +F
Е993:
13
Те0
2
==
ТеО
+
О
375±
13
ScF
2
=ScF +F 594
ТhF
з
==
ТЬР
2
+ F
59()
SсF
з
=
~cP2
+F 63:2+42
ТЬР
4
=
ТhF
з
+F
66~)
ScO
==
Sc +
О
674+
13
тьо
=
ТЬ
+
О
8331~1
SeO
==
~e
+
О
423+
13
TiBr
=
Т!
+Br
438
SeO
z
=
SeO
+
О
4~6±
14
пв-,
==
TiBr +
Вт
433
SeO
J
==
Se0
2
+
О
213
пв-,
=
пв-,
+Br
307
H
2Se0
4
==
SеО
з
+
Н
2О
84
TiBr4
=
ТiВrз
+ Br
289
Si
2
=2Si
311+13
TiCl = Ti +
СI
494
SiBr
==
Si +
В!
384+25
TiC1
2
==
TiCl +
Сl
456
SiBr2
==
SiBr + Br
334+26
ТIСl
з
==
TIC1
2
+
Сl
424
SiC
= Si +
С
439+21
TiC1
4
=
ТiСl
з
+
Сl
343
SiCl
= Si +
Сl
454+42
TiCI0
=
по
+
Сl
423
5iC1
2
=SiCl +
Сl
399±42
TiCI0
==
TiCl +
О
591
SiСl
з
=SiC1
2
+
Сl
363
TiC1
20
=
TICI0
+
Сl
423
SiC1
4
=
SiСl
з
+
Сl
377
TiF
=
Т!
+F
570+33
SiF =Si +F
540±
13
TiF
2
=TiF +F
811+42
SiF
2
=SiF +F
690
ТiF
з
=TiF
2
+F
515~-42
SiF
з
= SiF
2
+F 460
TiF
4
=
ТiF
з
+F
442
{ 42
SiF
4
==
SiF
з
+F
695+42
TIFO
=TiF +
О
66~
SiH =51 +
Н
302f21
TiFO
= TiO +F
566
TiF
20
=
TiFO
+F
571

В
МОЛЕКУЛАХ
И
РАДИКАЛАХ
(проб.
табл.
11)
85
-----_.-
-- .
о
о
Реакция
I1H
298,
Реакция
I1H
298
,
кдж,моль-
1
кйж-мояь
"!
TiF
20
= TiF
2
+
а
421
va
==
v +
а
612+42
ТiI
=
Т!
+ 1
309±42
va
2
=:
va
+
а
634±30
Тil
2
=
ТВ
+ 1
436
WBrG
=
WBIc;
+ Br 133
Тil
э
=
ТН
2
+ 1
195
WСl
б
=
WC1
4
+ C1
2
158
ТН
4
=
ТiI
з
+ 1
245
WC1
G
=:
WClc;
+
Сl
203
TlBr
=
Тl
+
Вт
з32+2
WCl
4a
=
WC1
4
+
а
520
T1
2Br
2
= 2T1Br
109+8
WC1
2a
2
=
W0
2
+ Cl
2
749
TICl
= Tl +
Сl
371+2
WF
G
==
WF[)
+ F 452
Тl:.!СI
2
=2TICl
117+13
WO = W +
о
678+30
ТIР
=
Тl
+ F
445±2
wa.)
==
wo +
о
602+42
Т1
2
Р
2
= 2TIF
140±8
WO~
==
W0
2
+
О
625±42
ИF
= U + F
724
ХеР
4
:=
XeF
2
+
2Р
266
UF
2
= UF + F
565
х-г,
=
ХеР
4
+
Р
2
79
UF
з
= UF
2
+ F
536
УР
==
У
+ F
600+2]
UF
4
=
UF
з
+ F
628
Уа
=
у
+
о
7]5+]3
UF
б
= UF
4
+ F
515
ZrCl
=Zr +
Сl
523±21
UF
e
= UF
G
+ F
188
ZrC1
2
= ZrCl +
Сl
508
UO
=U +
а
757+
]7
ZrСl
з
=
ZrCl~
+
Сl
461
VBr
= V + Br
4391:42
Zl'C1
4
= ZrC1
H
+
Сl
469
VBr2
= VBr + Br
45]
ZrF
=Zr
-1-
F
623±63
VВrз
= VBr2 + Br
217
ZrF
2
= ZrF + F
697
VBr
4
=
VВrз
+
В,
205
ZrF
з
= ZrF
2
+ F
632
VCl = V +
Сl
477±6З
ZrF
4
=
ZrF
з
+ F
649+21
VC1
2
= VCl +Cl
496+63
ZrO = Zr +
а
758+42
VСl
з
= VCl
2
+Cl
274+
]8
Zra~
=
ZrO
+
О
647+46
V1з
=VI
2
+ 1
131
±зо
ZnCl =Zn +Cl
225+8
VI
4
=
Vl
э
+1
200
ZnCl
2
=ZnCl + Cl
414±8

111.
ПРОСТЫЕ
ВЕЩЕСТВА
И
СОЕДИНЕНИЯ
Таблица
12.
ФИЗИЧЕСКИЕ
СВОйСТВА
и
РАСТВОРИМОСТЬ
Расположение
веществ.
Вещества
в
таблице
располагаются
в
алфавитном
порядке
русских
названий
элементов,
причем
в
раздел
данного
элемента
отне
-сены
соединения,
в
которых
он
является
электроположительной
частью
или
входит
в
качестве
центрального
или
характеристического
атома
в
электропо
ложительную
часть.
В
соответствии
с
этим
КМпО.
помещен
в
раздел
«Калий»,
SOCl
2
рассматривается
среди
соединения
серы,
а
Nаз[АIF6]
-
среди
соедине
ний
натрия.
Соединения
аммония,
в
виде
исключения,
выделены
в
отдельную
группу,
Кислоты
и
водородные
соединения
неметаллических
элементов
приво
дятся
в
разделах
образующих
их
элементов
(H
2S
-
В
соединениях
серы,
Н
з
Р
0
4
-
фосфора).
Внутри
разделов,
отвечающих
тому
или
иному
элементу,
соединения
рас
..
положены
в
алфавитном
порядке
их
названий,
причем
числовые.
приставки,
а
также
приставки
«мета»,
«орто»,
«гидро»,
«гидроксо»
для
удобства
представ
..
.ления
материала
написаны
после
названия
элемента
или
иона
с
дефисом
на
конце:
SF
6
-
сера
фторид,
гекса-;
N
2S
4
-
азот
ДИ-,
сульфид,
тетра-;
Са
(РО
З
)
2
кальций
фосфат,
мета-,
NaH
2P0
4
-
натрий
фосфат,
дигидро-.
*
Соединения,
названия
которых
не
могут
быть
начаты
с
наименования
эле
мента,
расположены
в
алфавитном
порядке
в
конце
перечня
соединений
дан
ного
элемента.
Например:
азотная
кислота,
аммиак,
гидразин
и
т.
д.
помещены
в
конце
пеnечня
соединений
азота.
Номенклатура
и
написание
формул
основываются
на
рекомендациях
Меж
дународного
союза
теоретической
и
прикладной
химии
(IUPAC)
с
учетом
еПроекта
правил
номенклатуры
неорганических
соединений»,
разработанного
Комиссией
по
номенклатуре
неорганических
соединений
Отделения
общей
и
тех
..
нической
химии
АН
СССР
(Материалы
к
проекту
номенклатуры
неорганиче
ских
соединений.
М.,
«Наука»,
1968).
Некоторые
отступления
сделаны
в
пользу
традиционных
для
русского
языка
названий.
В
ряде
случаев
после
названия
вещества
в
круглых
скобках
даны
его
синонимы,
а в
квадратных
скобках-
название
образуемого
им
минерала
(указатель
минералов
см.
табл.
13).
В
необходимых
случаях
степень
окисленности
элемента
приводится
рим
сними
цифрами
в
круглых
скобках
после
названия
элемента.
Написание
формул
и
наименование
соединений
производятся
по
принципу,
'Согласно
которому
все
соединения
рассматриваются
как
бинарные
(иногда
условно,
с
точки
зрения
номенклатуры),
состоящие
из
электроположительной
и
влекгроотрицательной
частей.
В
формуле
на
первое
место
помещается
электро
положительная
часть,
например:
KCl, ZnS04,
SОз,
MgS,
K2[PtCI]6.
Если
в
со
..
единении
содержится
более
одного
катиона
или
более
одного
аниона,
то
внутри
каждого
класса
составляющих
применяется
алфавитный
порядок
в
написании
их
символов,
например:
CrK(S04)2·
12Н
2О,
KMgCI
2
F.
В
формулах
бинарных
со
..
единений
неметаплов
в
соответствии
с
установившейся
практикой
на
первое
место
ставится
тот
элемент,
который
стоит
раньше
в
условном
ряду,
приведен
..
ном
в
правилах
номенклатуры
IUPAC:
Rn,
х-,
к-,
В,
5i,
С,
Sb, As,
Р,
N,
Н,
Те,
Se, 5, At, 1,
в-,
Сl,
О.
F
Примерами
могут
служить
следующие
соединения:
SЬ
2
S
З
,
NН
з,
CS
2,
H
2Se,
нсь
ог,
ДЛЯ
цепных
соединений,
содержащих
три
или
более
элементов,
порядок
их
указания
в
формуле
должен
соответствовать
последовательности,
в
которой
атомы
связаны
в
молекуле
или
ионе,
например,
SCN-
(тиоцианат-ион),
а
не
CNS-,
HOCN
(циановая
кислота),
а
не
HONC
(гремучая
кислота).
*
Здесь
и
далее
названия
приводятся
в
той
же
форме,
что
и
в
самой
таб
..
лице.

ФИЗИЧЕС}(ИЕ
СВОйСТВА
И
РАСТВОРИМОСТЬ
87
Если
два
или
более
разных
атомов
или
групп
атомов
присоединены
1{
од
ному
центральному
атому,
на
первое
место
помещается
символ
центрального
атома,
а
за
ним
в
алфавитном
порядке
символы
остальных
атомов
или
групп,
например:
PBrC1
2.
Однако
в
формулах
кислот
водород
помещается
на
первое
место:
H
2
S0
4
,
Н
з
Р
О
4
.
Отклонения
от
этого
правила
также
возможны,
когда
часть
молекулы
рассматривается
как
радикал,
представляющий
собой
группу
атомов,
неодно
кратно
встречающуюся
в
различных
соединениях:
SOC1
2
-
тионил
хлорид.
UО
2(NО
З)2·
2Н
2О
-
уравил
нитрат.
Названия
некоторых
радикалов
ПрИБОДЯТСЯ
ниже:
ОН
-
гидроксил
СО
-
карбонил
NO -
ннтрозил
N0
2
-нитрил
РО
-
фосфорил
50
-тионил
502 -
сульфурил
U0
2
-
уранил
Радикалы,
аналогичные
вышеназванным
и
содержащие
другие
халькогены
вместо
кислорода,
получают
названия
путем
добавления
префиксов
«ТИО».
«селеноэ,
и
т.
Д.,
например:
PS -
тиофосфорил,
CSe -
селенокарбонил,
Стехиометрические
отношения
указываются
греческими
префиксами
(моно,
ди,
три,
тетра,
пента,
гекса,
гепта,
окта
и
т.
д.),
присоединяемыми
к
элемен
там,
к
которым
они
относятся.
Префикс
«моно»
принято
опускать.
Выше
числа
10
греческие
префиксы
обычно
заменяются
арабскими
цифрами.
Название
электроположительной
части
соединения
приводится
в
таблице
в
именительном
падеже,
например:
KCl -
калий
хлорид,
CUS04-
медь
суль
фат,
SOC1
2
-
тионил
хлорид.
При
наличии
нескольких
катионов
(например,
двойные
соли
и
окислы)
они
перечисляются
в
алфавитном
порядке
их
русских
названий,
который
может
не
совпадать
с
порядком
написания
символов
эле
ментов
в
формулах,
например:
CrK(S04)2·
12Н
2О
-
калий
хром
сульфат,
AIK(S04)2·
12Н
2О
-
алюминий
калий
сульфат,
CaI~e201
(Са
О
·
Fе
2Оз)
-
железо.
ДИ-,
кальций
оксид,
'1
егра-.
В
соответствии
с
названием
первое
соединение
по
мещено
в
разделе
«калин»,
второе
-
«алюминий»,
а
третье
в
разделе
«желеао».'
Наз-ванию
моноатомной
или
томополиатомной
влектрострицательной
части
соединения
придается
окончание
«ИД»,
например:
KF -
калий
фгорид,
LiH
-
Ли
тий
гидрид,
CaS -
кальций
сульфид.
Для
бинарных
соединений
неметаллов
название
элемента,
стоящего
правее
D
приведеином
выше
условном
ряду
также
приобретает
окончание
еид»,
SF&
-
сера
фгорид,
гекса-,
или
сера
(VI)
фгорид,
CI0
2
-
хлор
оксид, ди-
или
хлор
(IV)
оксид,
В
4С
-
бор,
тегра-,
карбид.
Названия
соединений
немсталлов
с
водородом
образуются
путем
присоеди
нения
к
корню
латинского
названия
элемента
суффикса
«ан»:
SiI-I
4
-
силан,
GeH
4
-
герман,
В
2Н
6
-
диборвн,
В
качестве
исключения
из
приведенного
пра
вила
сохранены
традиционно
сложившиеся
названия
следующих
веществ:
NН
з
-
аммиак,
N
2H
4
-
гидразин,
РН
з
-
фосфин,
AsI-I
з
-
ареин,
SЫ-I
з
-
стибин,
ВiН
з
-
висмутин.
Для
бинарных
соединений
неметаллов
с
водородом
исполь
зуются
также
названия,
приводимые
ниже:
HF
-"фтороводород
Н
2
О
-
вода
Hel
-
хлороводород
H
2S
-
сероводород
HBr -
бромоводород
H
2Se
-
селеневодород
НI
-
иодоводород
Н
2Те
-
геллуроводород
Гетерополиатомная
влектроотрицательная
составляющая
рассматривается
как
комплекс,
и
ее
название
образуется
из
корня
латинского
названия
цен
трального
атома
с
окончанием
еатэ.
Атомы,
ионы
или
молекулы,
связанные
с
центральным
атомом,
рассматриваются
как
лигаилы
и
число
их
указывается
греческими
префиксами:
NазSЬS.
-
натрий
тиоантимонат,
тетра-.
В
названиях
анионов
кислородсодержащих
кислот
КИСЛОРОД,
как
лиганд,
не
перечисляется
и
'Используются
сокращенные
названия
солей,
например:
Na
2
S0 4-
натрий
сульфат
(вместо
систематического
названия
динатрий
гетра
оксосульфат},
Nа2S2ОЗ
-
натрий
тиосульфат
(вместо
динатрий
трноксотиосуль
фат).

-88
еиэичвскив
СВОйСТВА
И
РАСТВОРИМОСТЬ
-------------
-------------------
----
---------
Названия
кислородсодержащих
кислот
(оксокислот)
составляются
из
сло
..
ва
«кислота»
И
предшествующего
ему
прилагательного,
образованного
из
корня
русского
названия
кислотообразующего
элемента
и
суффикса,
характеризую
щего
степень
окисленности
этого
элемента.
При
этом
максимальной
степени
окисленности
элемента
соответствует
суффикс
-н(ая)
или
-ов(ая),
например:
H
2
S0
4
-
серная
кислота,
H
2SeO.
-
селеновая
кислота.
Меньшей
степени
окис
..
ленности
соответствует
суффикс
ист
(ая),
например:
Н
2SО
з
-
сернистая
кислота.
В
случаях,
когда
элемент
обрааует
кислоты,
находясь
в
нескольких
степенях
окнслепности,
используются
следующие
суффиксы
(В
порядке
понижения
степени
окисленпости
элемента);
-н(ая)
или
-ов(ая),
-оват(ая),
-ист(ая),
оватисттая},
Например:
HCI0
4
-
хлорная,
НСIО
з
-
хлорноватая,
HCI0
2
-
хлористая,
I-ICIO
-
хлорноватистая
кислоты.
П
рефиксы
«мета»
И
«орто»
используются
для
различия
кислот
одного
и
того
эке
элемента
(находящегося
в
одинаковой
степени
окисленности)
в
зави
симости
от
содержания
кислорода,
причем
«мета»
отвечает
меньшему
количеству
кислорода,
а
«орто»
-
большему:
НРОз
и
НзРО.
-
соответственно,
фосфор"
ная
мета-
и
орто-кислоты.
Для
образования
названий
гомополикислот
исполь
зуются
русские
числовые
префиксы
(в
названиях
анионов
-
греческие),
указы
..
вающие
число
атомов
кислотообразующего
элемента.
Например:
Н.Р207
-
дву-
фосфорная
кислота,
Н
2В
4
О
7
-
четырехборная
кислота
(но
В
4О
~-
-
тетраборат
ион).
Названия
кислот,
содержащих
перекисную
группу
атомов
-0-0-,
снаб
..
жаются
префиксом
«пероксо»
(епер»
В
названиях
анионов),
который
не
отде
..
ляется
от
названия
кислоты:
H
2SO
s
-
пероксосерная
кислота,
H
2S
20
a
-
пероксо
двусерная
кислота.
Названия
солей
составляются
из
названий
катиона
и
аниона,
при
этом
назьапия
анионов
кислородсодержащих
кислот
слагаются
из
корней
латинских
наименований
элементов
(см.
с.
6)
с
префиксами
и
суффиксами,
отвечающими
степени
окислениости
элемента:
Кис
ло
га
•..
ная
или
...
овая
,
..
оватая
...
истая
...
оватнстая
Анион
...
ат
гипо
...
ат
...
ит
гипо
...
ит
в
соответствии
с
традицией,
соли
хлорной
HCIO.,
марганцовой
НМпО..
и
рениевой
HRe04
кислот,
не
относящихся
к
пероксокислотам,
называют
перхло
рагами,
перманганатами
и
перренатами;
в
связи
с
этим
соли
марганцовистой
Н
2МпО4,
хлорноватой
НСIО
з,
а
также
бромноватой
НВrОз
и
иодноватой
НIО
з
кислот
называют,
соответственно,
манганатами,
хлоратами,
броматами,
иода
..
тами,
Ниже
в
таблице
приводятся
названия
кислородсодержащих
кислот
и
их
анионов.
Названия
кислых
солей
образуются
путем
добавления
к
названию
их
ани
..
она
приставки
«гидро»,
а
основных
-
приставки
«гидроксо»,
напримерз
Na2I-IР()4
-
натрий
фосфат,
гидро-,
КН
2РО4
-
калий
фосфат,
дигидро-,
(CtlOI-I)
2СО
з
-
медь
карбонат,
гидроксо-.
При
написании
формул
комплексных
частиц
центральный
атом
ставится
на
первом
месте,
затем
в
алфавитном
порядке
для
каждой
группы
следуют
нейтральные
и
ионные
лиганды,
а
весь
комплекс
заключается
в
квадрат
..
·ные
скобки.
В
названиях
центральный
атом
указывается
после
названий
ли
гандов,
В
анионных
комплексах
к
латинскому
корню
названия
центрального
атома
добавляется
окончание
«ат»,
в
катионных
или
нейтральных
комплексах
сохра
..
няется
русское
название
центрального
атома:
Кз(Fе
(CN)
6]
-
калий
цианофер
..
-ратгШ),
гекса-,
Ре(СО)б
-
железо
карбонил,
пента-,
[Со
(NН
З)6]С1
2
-
гекса
.амминкобальт(II)
хлорид.

ФИЗИЧЕСКИЕ
СВОАС1'ВА
И
РАСТВОРИМОСТЬ
Название
89
Кислота
НАsО
з
Н
з
А
s
О
4
НзАsО
з
НВО
2
НзВО
з
Н
2В
4О
1
нв-о,
Н
2СО
з
нсоан
сн.соон
Н
2С
2О
4
нсю,
нсю,
нсю,
нсю
НзСrОв
Н
2
С
т
О
4
H
2
Cr
2
0
7
нс-о,
нло,
HI0
4
НIО
з
нмьо,
Н
2МпО.
Н
2МоО
4
HOCN
нно,
нно.
НРО
а
НзРО.
H
4
P
:10 7
Н;>РОз
Н;:
Р
О
2
нньо,
.Н
~S::08
кислоты
мышьяковая,
мета
мышьяковая,
орто
мышьяковистая
борная,
мета
борная,
орто
борная,
четырех
бромноватая
угольная
муравьиная
уксусная
щавелевая
хлорная
хлорноватая
хлористая
хлорноватистая
пероксохромовая
хромовая
хромовая,
дву
хромистая
иодная,
орто
водная,
мета
иодноватая
марганцовая
марганцовистая
молибденовая
циановая
азотная
азотистая
фосфорная,
мета
фосфорная,
орто
фосфорная,
дву
фосфористая
фосфорноватистая
рутениевая
пероксодвусерная
серная
серная,
дву
сернистая
сернистая,
дву
тиосерная
тиосернистая
дитионовая
сурьмяная,
мета
сурьмяная,
орто
селеновая
кремниевая,
мета
кремниевая,
орто
оловянная
танталовая
теллуровая,
орто
ванадиевая
вольфрамовая
аниона
арсенат,
мета
арсенат,
орто
арсенит
борат,
мета
борат,
ОрТО
тетраборат
бромат
карбонат
формиат
ацетат
оксалат
перхлорат
хлорат
,
хлорит
гипохлорит
пероксохромат
хромат
хромат,
ди
хромит
периодат,
орто
периодат,
мета
иодат
перманганат
манганат
молибдат
цианат
нитрат
нитрит
фосфат,
мета
фосфат,
орто
фосфат,
ди
фосфит
гипофосфит
перрутенат
пероксодисульфат
(персульфат)
сульфат
дисульфат
(пиросульфат)
сульфит
сульфит,
ди-
тиосульфат
тиссульфит
дитионат
антимонат,
мета
..
антимонат,
орто-
селенат
силикат,
мета-
силикат,
орто-
станнат
танталат
теллурат,
орто-
ванадат
вольфрамат

90
ФИЗИЧЕСКИЕ
СВОйСТВА
И
РАСТВОРИМОСТЬ
в
тексте
таблицы
в
случае
анионных
комплексов
числовые
приставки
ОТ
делены
и
помещены
после
названия
соединения
Кз[Fе
(CN)
6]
-
калий
цианофер
paT(III),
гекса-,
К[ВН
4
]
-
калий
гидридоборат,
тетра-.
Таким
обраяом,
сведения
об
этих
соединениях
содержатся
в
разделе
«Калий»
соответственно
на
буквы
«ц»
и
«г»
-
по
названию
лигандов,
В
случае
катионных
или
нейтральных
комплексов
отделение
приставок
не
производится
и
сведения
о
таких
соединениях
помещены
в
конце
разделов,
отвечающих
центральному
атому.
среди
соединений
этого
элемента,
названия
которых
начинаются
не
с
названия
элемента.
В
соответствии
со
сказанным
св
е
..
дения
о
соединении
[Со(NН
З)БJСI
2
помещены
в
конце
раздела
«кобальт)
на
букву
«г»,
с
которой
начинается
название
этого
вешества
-
гексаамминко
бальт
(11)
хлорид.
Ниже
приводятся
названия
некоторых
анионных
лигандов:
Лигаил
Название
Лиганд
Название
р-
фторо
Н-
гидридо
Cl-
хлоро
ОН-
гидроксо
Br-
бромо
02-
пероксо
2
1-
иодо
S2-
тио
02-
оксо
CN-
циано
Названия
нейтральных
лигандов
применяются
без
изменения,
за
исключе
нием
следующих
случаев:
Н
2О
-
«аква»,
NН
з
-
«аммин»;
группы
NO
и
СО,
непосредственно
связанные
с
атомами
металла,
называются,
соответственно,
~нитрозил»
и
«карбонил».
Цвет,
состояние,
кристаллическая
форма.
В
этой
графе,
наряду
с
описа
нием
внешнего
вида
вещества,
указывается
его
агрегатное
состояние
при обыч
ных
условиях,
сингония,
кристаллическая
модификация
(греческими
буквами
*)
или
форма
кристаллов
для
твердого
состояния,
а
также
некоторые
другие
ха
рактеристики
(гигроскопичность
и
др.),
например:
бц,
геке
означает,
что
ве
щество
образует
бесцветные
кристаллы
гексагональной
сингонии.
В
тех
случаях,
когда
кристаллическая
структура
одной
из
модификации
неизвестна,
в
соответствующей
графе
она
обозначена
сокращением
«кр».
Плотность
твердых
и
жидких
веществ
приведена
в г/см
З
,
температура
в
"С
указана
верхним
индексом;
плотность
газов
выражена
в
г/л
и
отнесена
к
нормальным
условиям
(температура
ООС,
давление
101,325
кПа).
Температуры
фазовых
переходов
приведены
в
ос
дЛЯ
нормального
атмо
сферного
давления.
В
случаях,
когда
давление
отличается
от
нормального,
его
величина
в
мегапаскалях
(МПа)
указывается
верхним
индексом.
Например,
4000,3
означает,
что
жидкость
кипит
при
400
0С,
находясь
под
давлением
0,3
i\'lПа.
Если
приводится
температура
возгонки,
то
после
нее
стоит
обозначе
ние
«воэг»,
например:
160
возг.
Если
оно
предшествует
температуре
(возг
160),
это
значи~
что
при
указанной
температуре
давление
паров
вещества
не
дости
гает
нормального
атмосферного
давления,
но
происходит
заметная
возгонка
вещества.
В
случае
плавления
или
кипения
с
разложением
после
значения
темпера
туры
стоит
«раэл».
Если
эта
пометка
предшествует
значению
температуры,
то
последняя
рассматривается
как
температура
разложения
вещества.
Внекото
..
рых
случаях
указаны
продукты
разложения
вещества:
-2Н
2О,
150
означает,
что
вещество
при
150
0
С
теряет
две
молекулы
воды.
При
наличии
у
вещества
кристаллических
модификаций
может
быть
ука
зана
температура
превращения
одной
модификации
в
другую,
напримеР2
a-+~
600.
*
Эти
обозначения
кристаллических
модификаций
веществ
могут
не
сов
падать
с
принятыми
В
других
источниках.
