Цыренов В.Ж. Основы биотехнологии: Культивирование изолированных клеток и тканей
Подождите немного. Документ загружается.

23 24
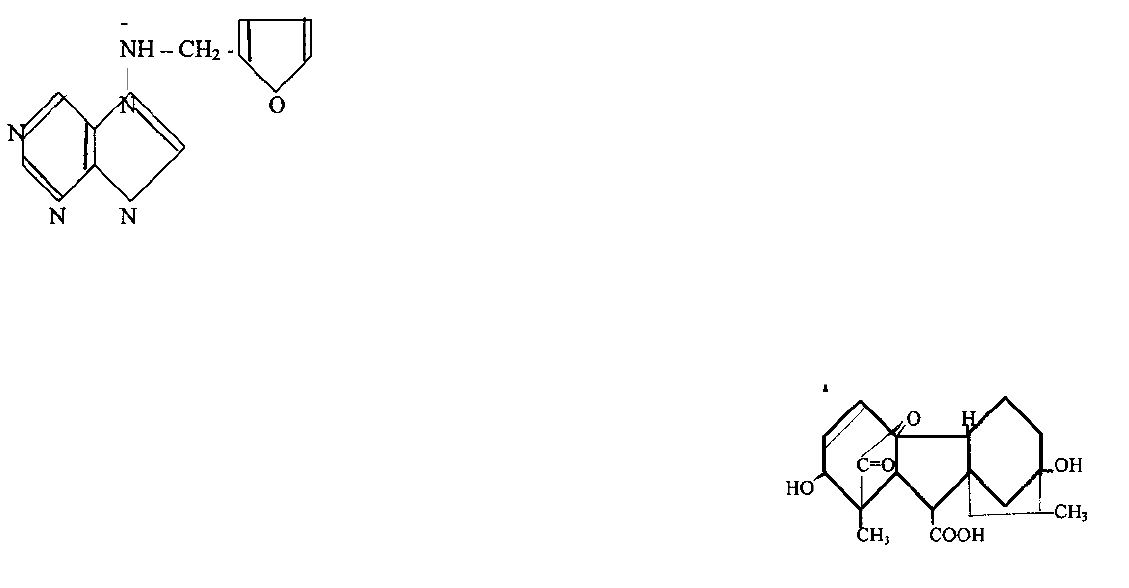
- кинетин (6-
фурфуриламинопурин)
Действие цитокининов проявляется прежде всего в ускоре-
нии клеточных делений, что опосредуется усилением синтеза ДНК
и РНК и белков. Благодаря этому замедляется старение клеток и
повышается их устойчивость к неблагоприятным факторам среды.
Цитокинины в составе сред включают для стимуляции кле-
точного деления в каллусных и суспензионных культурах, в куль-
турах протопластов, при регенерации проростков из соматических
эмбриондов или стеблевых почек.
При культивировании протопластов в составе культурных
сред используют и абсцизовую кислоту. Абсцизовая кислота ока-
зывает противодействие ауксинам, гиббереллинам и цитокининам.
Гиббереллины оказывают множественные действия: стиму-
лируют рост в фазе растяжения и деления клеток (например, кам-
бия), вызывают рост плодов. Важное свойство гиббереллинов –
вызывать вытягивание стебля у розеточных растений или у расте-
ний с укороченным стеблем, т.е. устранять физиологическую и ге-
нетическую карликовость.
Гиббереллины относят к условно половым гормонам; напри-
мер, у тыквенных они способствуют образованию мужских цвет-
ков.
Для гиббереллинов доказано их непосредственное действие
на биосинтез ферментов, например, α-амилазы и других гидролаз в
прорастающих семенах злаков; эти ферменты расщепляют крахмал
до простых сахаров, которые усваиваются развивающимся заро-
дышем.
Гиббереллины обнаружены у сумчатого гриба (аскомицета)
Gibberella fujikuroi, а также в тканях высших растений.
Гиббереллины – это дитерпеноиды с тетрациклическим гиб-
береллановым скелетом из 19-20 С-атомов.
Для практических целей наиболее часто используют гиббе-
релловую кислоту, которая производится в промышленности.
Обработка гибберелловой кислотой семян и клубней приво-
дит к снятию у них покоя и стимулирует быстрое прорастание. Ее
действие на озимые злаки заменяет яровизацию, необходимую для
таких растений.
В составе культуральных сред используют гибберелловую
кислоту для поддержания роста суспензионных культур, а также
для индукции побегообразования.
- гибберелловая кислота
В настоящее время известно большое число различных по
составу питательных сред (табл.2). Среда Mypacсиге и Скуга – са-
мая универсальная. Она пригодна для образования и роста каллу-
сов, индукции морфогенеза у большинства двудольных растений.
Так изменение соотношения ауксина и кинетина приводит к обра-
зованию либо корней (преобладание ауксина), либо стеблевых
культур (преобладание кинетина). Среда Ганборга и Эвелега под-
ходит для культивирования клетокк и тканей бобовых растений и
злаков. Среда Уайта обеспечивает укоренение побегов и нормаль-
ный рост стебля после регенерации, а среда Нича и Нич пригодна
для индукции андрогенеза в культуре пыльников. В состав некото-
рых сред входит ЭДТА (этилендиаминтетрауксусная кислота) или
25 26
ее натриевая соль, которые улучшают доступность железа для кле-
ток.
Таблица 2
Состав питательных сред, применяемых при культивировании клеток и тканей
(по Р.Г.Бутенко, 1999)
Концентрация питательных сред, мг/л
Компонент сред
Мурасиге
и Ску-
га,1962
Гамборга
и Эвеле-
га,1968
Уайта,
1939
Нича и
Нич,1974
-1975
1 2 3 4 5
KNO
3
NH
4
NO
3
Ca(NO
3
)
2
Ca(NO
3
)
2
⋅4H
2
O
(NH
4
)
2
SO
4
MgSO
4
⋅7H
2
O
СaCl
2
⋅H
2
O
CaCl
2
⋅2H
2
O
KCl
KH
2
PO
4
NaH
2
PO
4
⋅H
2
O
MnSO
4
⋅Н
2
О
MnSO
4
⋅4Н
2
О
ZnSO
4
⋅4Н
2
О
ZnSO
4
⋅7Н
2
О
H
3
BO
4
CuSO
4
⋅5Н
2
О
Na
2
MoO
4
⋅2Н
2
О
CoCl
2
⋅6Н
2
О
FeSO
4
⋅7Н
2
О
NaEDTA⋅2Н
2
О
Cеквестрен 330-Fe
Мезоинозит
Аскорбиновая кислота
Тиамин – HCl
Пиридоксин – HCl
Никотиновая кислота
Сахароза
Агар «Дифко», гель-
1900
1650
-
-
-
370
-
440
-
170
-
-
22,3
8,6
-
6,2
0,025
0,25
0,025
27,8
37,3
-
100
-
-
0,5
0,5
0,5
30 000
3000
-
-
-
134
500
-
150
-
-
150
10
-
-
2
3
0,075
0,25
-
-
-
28
-
-
-
-
-
20 000
81
-
142
-
-
74
-
-
65
12
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
2000
950
72
-
-
-
185
166
-
-
68
-
-
25
-
10
10
0,025
0,25
-
27,8
37,3
-
200
3
3
1
-
60 000
7000
1 2 3 4 5
рит, агароза - -
2.3. Влияние физических факторов.
На рост и развитие растительных тканей in vitro большое
влияние оказывают физические факторы – свет, температура,
аэрация, влажность.
Свет. Большинство каллусных тканей могут расти в условиях
сильного освещения или в темноте, так как они не способны фото-
синтезировать. Вместе с тем свет может выступать как фактор,
обеспечивающий морфогенез и активирующий процесс вторично-
го синтеза. В качестве источника света используют люминесцент-
ные лампы. Для большинства растений оптимум освещенности со-
ставляет примерно 1000 люкс. Кроме интенсивности освещенности
на культуру ткани и её физиологические особенности влияет каче-
ство света. Так, более 20 флавонов и флавонолевых гликозидов об-
разуются в культурах клеток петрушки после освещения её непре-
рывным люминесцентным светом «холодный белый».
Температура. Для большинства каллусных культур опти-
мальна температура 26°С. В отличие от роста культур клеток и
тканей индукция их морфогенеза требует более низких температур
(18-20°С).
Аэрация. Для выращивания суспензионных культур большое
значение имеет аэрация. Особенно важно снабжение воздухом
культивируемых клеток в больших объемах ферментеров.
При выращивании клеток в малых объемах (в колбах) нор-
мальная аэрация достигается при постоянном перемешивании сус-
пензии.
Влажность. Оптимальная влажность в помещении, где растут
культуры, должны составлять 60-70%.
2.4. Методы культивирования изолированных клеток и
тканей для получения БАВ.
27 28
В качестве источника БАВ используют каллусную ткань, ко-
торую получают твердофазным способом культивирования и глу-
бинным суспензионным культивированием, осуществленным в пе-
риодическом и непрерывном (проточном) режимах (Чуегов и др.,
2003).
2.4.1. Твердофазный способ культивирования.
Каллусные клетки получают из фрагментов тканей разных
органов высших растений, помещая кусочки такой ткани в пита-
тельную среду (пробирки, колбы, чашки Петри). Соблюдают стро-
гую стерильность.
Чтобы обеспечить развитие каллусных клеток в питательных
средах (табл. 2), содержащих необходимые для роста вещества,
клетки тканей, запасающей паренхимы, корня и стебля, мезофилла
листа и других тканей должны терять способность дифференци-
ровки. Недифференцированному развитию клеток способствует
прединкубация эксплантов на среде без гормонов в течение 3-6 су-
ток.
Через 4-6 недели культивирования трансплантанта возникает
первичный каллус, который необходимо перенести на свежую пи-
тательную среду. При культивировании на агаризованных средах
кусочек каллуса должен иметь массу 60-100 мг на 30-40 мл свежей
среды. Каллусная ткань, вырасшая на поверхности твердой пита-
тельной среды, имеет аморфную структуру, представляющую со-
бой массу тонкостенных пареахимных клеток. Химический состав
каллусной ткани обычно незначительно отличается от соответст-
вующего органа растения.
Каллусные клетки после ряда делений переходят на обычный
для данного растения цикл развития, т.е. начинается дифферен-
циация. Этот процесс регулируют гормоны.
2.4.2. Глубинное суспензионное культивирование.
Для глубинного культивирования и получения суспензион-
ных культур необходимо использовать линии клеток, образующих
небольшие агрегаты (по 5-10 клеток). Более пригодна каллусная
ткань рыхлого типа, которая легко фрагментируется на отдельные
клетки и небольшие агрегаты при перемешивании её в нере…..
жидкую среду. Трансплантат желательно обрабатывать пектина-
зой. Рекомендуется использовать среды, содержащие 2,4-
дихлорфеноксиуксусную кислоту и не содержащие ионы Ca. При
подборе среды культивирования важно из среды исключить цито-
кинины или снижать их концентрацию, а концентрацию ауксинов
увеличивать.
Перед пересевом первичную культуру фильтруют через два
слоя марли или через сита (нейлоновые, металлические), чтобы
отделить крупные агрегаты каллусной ткани и остатки трансплан-
тата. На образование клеточных агрегатов также сказывает влия-
ние интенсивность перемешивания среды, так как клетки чрезвы-
чайно чувствительны и быстро лизируются. Большинство клеток
погибает.
Суспензионные культуры, как правило, состоят из отдельных
клеток, варьирующих по форме и размеру, и неоднородных много-
клеточных агрегатов. Соотношение отдельных клеток и таких аг-
регатов в суспензии зависит от видовой принадлежности растения
и условий культивирования.
В процессе культивирования активно делящиеся клетки не
только поглощают питательные вещества, но и выделяют продук-
ты собственной жизнедеятельности, в том числе и ферменты: α-
амилаза, фосфогидролаза и др. они изменяют дисперсность сус-
пензии. Повышать дисперсность суспензионных культур можно
добавлением в среду низких концентраций пектиназы и целлюло-
зы. При управлении процессом выращивания клеток важно иметь
гомогенную систему.
Глубинное культивирование можно осуществлять в колбах
на качалках при частоте вращения 100-120 об/мин. На 60-100 мл
среды используют 2-3 г свежей каллусной ткани, чтобы начальная
плотность клеточной популяции составила 0,5⋅10
5
– 2,5⋅10
5
кле-
ток/мл среды. Сосуды с суспензией закрепляют на платформе тей-

29 30
кера или устанавливают на качалки ротационного типа. В этих ус-
ловиях обеспечивается аэрация и, кроме того, нарастающая масса
клеточных агрегатов распадается на отдельные фрагменты. В ла-
бораторных условиях обычно используют сосуды объемом 100-250
мл с небольшим объемом питательной среды.
Необходимо отметить, что растительные клетки растут и
размножаются значительно медленнее, чем клетки микроорганиз-
мов. Время их удвоения 1-3сут. Процесс культивирования расти-
тельных клеток занимает 2-3 нед., что повышает требования к
обеспечению асептических условий.
При выполнении работ с использованием культуры клеточ-
ных суспензий необходимо знать их основные параметры.
Плотность клеточной популяции - концентрация клеток в 1
мл суспензии.
Минимальное время удвоения клеточной популяции в нако-
пительной суспензионной культуре. Например, время клеточного
удвоения для сахарной свеклы составляет 86 часов, табака - 48 ча-
сов, фасоли - 22 часа.
Вес сырого вещества суспензии определяют после помеще-
ния ее на предварительно взвешенный фильтр из нейлоновой тка-
ни и промывания водой для удаления остатков питательной среды.
Вес сухого вещества определяют после просушивания опре-
деленной навески сырой биомассы при 60-70 °С в течение суток.
Количество клеток. Чтобы установить количество клеток в
определенном объеме суспензии, необходимо диспергировать ее
содержимое до одноклеточного состояния обработкой 5-10% хро-
мовой кислотой. Подсчет клеток проводят, используя 1 мл одно-
клеточной суспензии, нанесенный на сетку счетной камеры.
Размер клеток определяют их измерением под микроскопом с
помощью шкалы окуляр-микрометра.
Жизнеспособность культуры определяют соотношением ко-
личества жизнеспособных клеток к общему количеству в милли-
литре суспензии. Жизнеспособные или живые культуры характе-
ризуются наличием клеток с ядрами и движением цитоплазмы при
окрашивании препаратов красителями: 0,5 %-ным раствором синей
Эванса или 0,01 %-ным раствором флуоресцеив-ацетата.
Во многих случаях изучение особенностей размножения и
роста клеток связано с необходимостью использования синхрони-
зированных клеточных популяций.
Как правило, клеточная популяция суспензионных культур
не только гетерогенна, но и асинхронна, так как содержит клетки,
различающиеся по времени вхождения в митоз. Для синхрониза-
ции клеточных культур используют методы индукции, когда тече-
ние клеточного цикла блокируется в определенном периоде под
влиянием или физических факторов, например, пониженной тем-
пературой, или химических соединений.
Так, индукторами синхронизации в системе культивируемых
клеток могут быть ингибиторы синтеза ДНК - тимидин, 5-
аминоурацил, оксимочевина. В результате обработки клеток этими
веществами клеточный цикл продолжается только до G
1
-периода,
и клетки накапливаются перед синтетическим периодом. Удаление
из среды ингибитора приводит к синхронизированному переходу
клеток к синтезу ДНК, а затем и делению.
Другой способ синхронизации заключается в создании усло-
вий «голодания» по одному из компонентов культуральной среды
например, ауксину, цитокинину, углеводам, азоту. Клетки накап-
ливаются в G
1
или С
2
-периоде клеточного цикла.
Затем пассирование суспензии на среду с недостающим ком-
понентом приводит к синхронизации клеточного деления.
С помощью индукции синхронизации клеточных делений
удается повысить митотический индекс с 2-3 % до 30-35 %.
Фазы ростового цикла в периодическом суспензионной
культуре.
Ростовой цикл, или цикл выращивания - это период от помеще-
ния инокулюма (части суспензионной культуры) на свежую среду до
следующего субкультивирования.

31 32
Суспензионная культура представляет собой популяцию от-
дельных клеток и небольших клеточных агрегатов, которые, в
свою очередь, являются субпопуляциями, состоящими из не-
скольких клеток.
Несмотря на морфологическую и физиологическую гетероген-
ность внутри популяции, рост клеточных культур описывается одно-
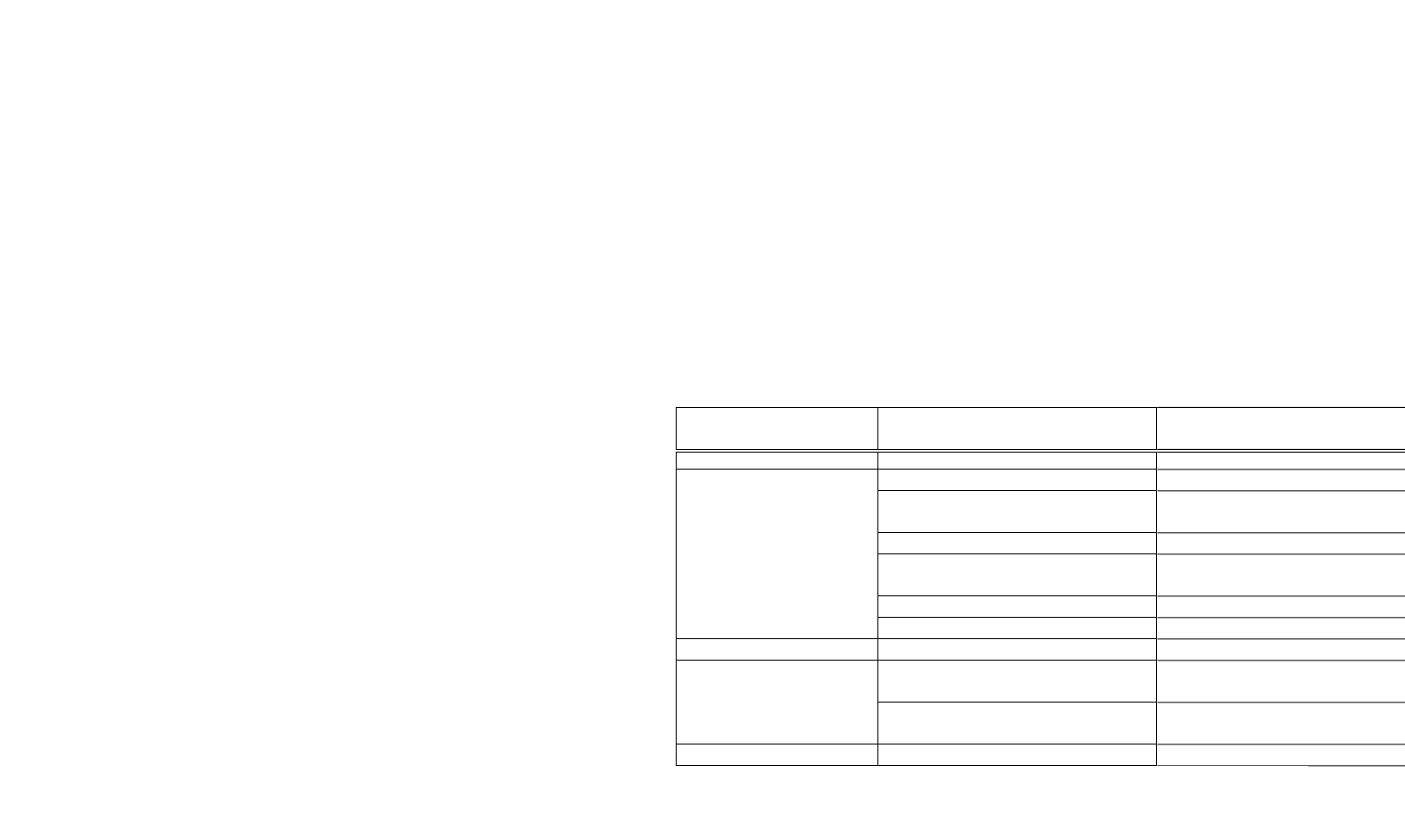
значно S-образной кривой (рис.1).
Рис. 1. Рост клеточной популяции при культивировании в накопительном
режиме: 1 - латентная фаза; 2 - экспоненциальная фаза; 3 - линейная фаза
роста; 4 - фаза замедления роста; 5 - стационарная фаза
Различают следующие фазы ростового цикла:
Латентная фаза (лаг-фаза). В этот период клетки не раз-
множаются, отсутствует их видимый рост, но происходит актив-
ный процесс поглощения воды и питательных веществ.
Экспоненциальная (логарифмическая) фаза роста. Это огра-
ниченный период в ростовом цикле периодической (накопитель-
ной) культуры, в ходе которого происходит экспоненциальное (ло-
гарифмическое) увеличение количества клеток за счет их интен-
сивного деления, и как следствие - увеличение сухого вещества.
Различают раннюю и позднюю экспоненциальные фазы. В
течение ранней экспоненциальной фазы наблюдается ряд цитоло-
гических изменений: в клетках исчезает большая вакуоль, проис-
ходит увеличение объема цитоплазмы, увеличивается число поли-
рибосом и митохондрий. Наряду с цитологическими изменениями
имеет место и активация клеточного метаболизма: увеличивается
содержание РНК, белка, ДНК, интенсивность поглощения кисло-
рода. Все эти процессы приводят к активному делению клеток и
образованию клеточных агрегатов.
В течение поздней экспоненциальной фазы роста суспензи-
онной культуры наблюдается замедление клеточного деления, но
происходит увеличение размера клеток. Таким образом, увеличе-
ние биомассы в этот период происходит в основном за счет растя-
жения клеток.
Линейная фаза очень короткая. Удельная скорость роста
культуры в этой фазе практически постоянная.
Фаза замедления роста (ранняя стационарная фаза). В этот
период средний размер клеток продолжает возрастать, отмечается
гетерогенность клеточной популяции и начало синтеза вторичных
веществ.
Стационарная фаза. К этому периоду ростового цикла сус-
пензионная культура достигает максимума сухого веса. В культу-
ральной среде накапливаются продукты жизнедеятельности кле-
ток, угнетающие рост культуры. Культуральная среда истощается
по наличию основных компонентов, обеспечивающих азотное,
фосфорное, углеводное питание. С тем чтобы не наступила гибель
клеток, необходимо субкультивирование суспензионной культуры
на свежую среду.
В среднем от начала культивирования до стационарной фазы
роста проходит 21 -28 дней.
Продолжительность ростового цикла зависит от условий
культивирования, исходной плотности, возраста инокулюма, со-
става и объема питательной среды, видоспецифичности исходной
культуры.
33 34
Непрерывное культивирование
Другой метод выращивания клеточных культур - непрерыв-
ное культивирование - основан на поддержании баланса между
разбавлением питательной среды и удалением части суспензии.
Установлено, что если при периодическом культивировании
клеточных суспензий в экспоненциальной фазе роста в культу-
ральную систему добавлять свежую среду, то деление клеток мо-
жет поддерживаться неограниченно долго. Это послужило основой
создания систем, позволяющих осуществлять непрерывное куль-
тивирование.
Культуральные системы, функционирующие непрерывно,
разделяют на полупроточные и проточные.
При полупроточном режиме выращивания через определен-
ные интервалы времени производится отбор части суспензии и
разбавление оставшейся суспензии свежей средой. Через суспен-
зию пропускают стерильный воздух. Культуру перемешивают с
помощью магнитной мешалки. Культивирование может продол-
жаться в течение нескольких месяцев.
Проточный режим культивирования позволяет осуществлять
непрерывное снабжение культуральной системы свежей средой с
удалением равного объема клеточной суспензии. В таком режиме
автоматизированные ферментеры (культуральные сосуды) могут
функционировать в течение нескольких лет. Ферментеры, исполь-
зуемые для производства больших клеточных биомасс, могут дос-
тигать объема до 1500 л. Для осуществления многостадийных про-
цессов при промышленном культивировании клеток-продуцентов
веществ вторичного обмена используют конструкции, состоящие
из системы нескольких ферментеров.
3. РАСТЕНИЯ И ИХ КУЛЬТУРА ИЗОЛИРОВАННЫХ КЛЕ-
ТОК И ТКАНЕЙ КАК ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ
БАВ
3.1. Растения.
Растения являются продуцентами многих БАВ – соединений,
способных оказывать слияние на биологические процессы в орга-
низме. К таким соединениям принадлежат сердечные гликозиды,
сапонины, стерины, каратиноиды, полифенолы, алкалоиды, вита-
мины, хиноны, а также вещества, обладающие специфическим
ароматом, вкусом и окраской.
Биологически активные вещества принадлежат к продуктам
вторичного обмена, которые называют вторичными метаболитами
или вторичными продуктами биосинтеза. В настоящее время из-
вестно более 100 000 вторичных метаболитов, продуцируемых
растениями. Многие из них являются практически, экономически
важными продуктами и используются в фармакологической, кос-
метической, пищевой промышленности. (табл.3)
Таблица 3
Промышленное использование некоторых растительных продуктов
Промышленное произ-
водство
Растительный продукт Вид растения
1 2 3
Кодеин (алкалоид) Papaver somniferum
Диосгенин (стероид) Dioscorea deltoidea
Хинин (алкалоид) Cinchona ledgeriana
Дигоксин (сердечный гликозид) Digitalias lanata
Скополамин (алкалоид) Datura stramonium
Фармацевтические
средства
Винкристин (алкалоид) Catharanthus roseus
Агрохимикаты Пиретрин Chrysanthemum cinerariaefoliu
m
Хинин (алкалоид) Cinchona ledgeriana Производство продук-
тов питания
Тауматин (халькон) Thaumatococcus danielli
Косметические Жасмин Jasminum sp
Лекарственные препараты составляют основную статью рас-
хода веществ растительного происхождения, но скорее, в финан-
35 36
совом отношении, чем по объему. Лекарственные растения все еще
вносят значительный вклад в фармацевтическую промышленность,
составляя около 25% важнейших лекарственных средств. В табл. 4
приведены сведения о 10 основных лекарственных препаратах, их
происхождении и клиническом действии. Это вещества не только
самых разнообразных химических форм, но и широкого спектра
терапевтического действия.
Таблица 4
Десять наиболее употребляемых лекарственных веществ,
получаемых из растений
Лекарственное
вещество
Активность Растение – источник
1 2 3
Стероиды из
диосгенина
Противозачаточные средства Dioscorea deltoidea
Кодеин Болеутоляющее Papaver somniferum
Атропин Антихолинэргическое Atropa belladonna L.
Резерпин Снижающее давление Rauwolfia serpentina L.
Геоциамин Антихолинэргическое Hyoscyamus niger L.
Дигоксин Тонизирующее сердечную деятельность Digitalis lanata L.
Скопомамин Антихолинэргическое Datura metel L.
Дигитоксин Сердечно-сосудистые Digitalis purpurea L.
Пилокарпин Холинэргическое Pilocarpus jabonandi
Хинидин Антималярийное Cinchona ledgeriana
К лекарственным веществам примыкают наркотики и стиму-
лирующие вещества. Наркотики являются промежуточным звеном
между ядами и лекарственными препаратами. В небольших коли-
чествах они часто являются эффективными лекарствами, например
морфий. При высоких концентрациях или при постоянном приме-
нении они могут стать причиной пагубного влечения (наркомании)
или смерти. Они представляют собой основную группу запрещен-
ных натуральных продуктов. Наиболее известными являются ма-
рихуана (или гашиш) из Cannabis, опиум и героин из Papaver som-
niferum и кокаин Erythroxylon. Табак тоже принадлежит к этой
группе, поскольку содержит никотин.
Стимуляторы – отличные от наркотиков вещества и в целом
не вредны. Чаще всего применяют кофеин или связанные с ним
теобромин, используя в виде напитков. Кофеин найден во многих
растениях, из которых наиболее известны Camellia sinensis (чай) и
Coffea arabica (кофе).
Яды – вероятно, крайнее лекарственное средство. Нейроток-
сические яды растений все еще используют охотники в Африке и
Южной Америке, например, яд кураре. Многие растительные яды
обладают сильным нейротоксическим действием, например, рицин
из клещевины обыкновенной.
Химикаты, применяемые в сельском хозяйстве. Помимо ре-
гуляторов роста растений наиболее выдающимся событием было
открытие пиретринов. Перетрины, выделяемые из цветков Chry-
santhemum cinerariacfolium, являются мощными инсектицидами
(уничтожающие насекомых). С природными пиретринами конку-
рируют синтетические, однако, при применении последних появ-
ляется устойчивость к ним у насекомых, а также возникает куму-
лятивная токсичность.
Тонкие химические соединения. «Тонкие химикаты» - это
общее название веществ, применяемых в качестве добавок для ду-
хов, а также вкусовые ароматические вещества, красители пище-
вых продуктов. Это и очень дорогие, выпускаемые в небольших
количествах вещества и дешевые препараты, производимые десят-
ками тысяч тонн. Например, жасминовая эссенция.стоит в США
6000 долларов за 1 кг и производится в объеме лишь 20-30 кг в год,
а масло какао, основной компонент шоколада, стоимостью 4 дол-
лара за 1 кг производится в объеме 20 000 т в год. Вещества варьи-
руют от простых соединений типа хинина до сложных смесей типа
эфирных масел. Последние представляют собой типичные моно-
терпены, часто летучие соединения, составляющие основу про-
мышленности, производящей ароматические соединения – отрас-
ли, создающие ценные и дорогостоящие продукты.

37 38
Следует отметить все возрастающий интерес промышленно-
сти к миру растений как к источнику химических соединений. Раз-
работка нового синтетического лекарственного препарата обхо-
дится примерно в 100 млн. американских долларов и занимает в 10
лет, поэтому нетрудно понять возобновляющейся интерес к расте-
ниям как «фабрикам» для их синтеза.
3.2 Культура изолированных клеток и тканей растений.
Культуры клеток и тканей, полученные in vitro, как и клетки
интактного растения, могут синтезировать вторичные метаболиты,
которые могут иметь большое практическое значение. Причем по
качественному составу и количественному составу они могут схо-
жи.
Культуры клеток и тканей можно использовать для получе-
ния природных веществ растительного происхождения следую-
щими способами:
- новые пути синтеза уже известных веществ, например ко-
деина, хинина, пиретроинов;
- синтез новых продуктов из тех растений, которые трудно
выращивать или внедрять, например тебаин из Papaver brac-
teatum;
- использование культуры клеток как источника совершено
новых веществ, например, рутакультин из культур Ruta;
- использование культуры клеток в качестве систем для био-
трансформации: как самого процесса с получением конеч-
ного продукта, так и отдельного звена химического процес-
са, например при синтезе дигоксина.
Практически важные результаты использования культуры
клеток и тканей были получены в 60-х годах ХХ века. Было пока-
зано, что такие практически важные БАВ как диосгенин, гармин и
виснагин синтезируются культурами клеток в тех же количествах,
как в исходном растении.
Скрининг, проведенные среди большого количества растений
показал, что, во-первых, круг БАВ, синтезируемых в культурах,
свидетельствует об огромном синтетическом потенциале и разно-
образии вторичного метаболизма; во-вторых, относительно не-
большое число их пригодно для использования в промышленно-
сти. К тому же, определенной трудностью биосинтеза является то,
что во многих системах растений вторичные метаболиты накапли-
ваются в значительных количествах на стационарной фазе роста; в
физиологическом плане биосинтез БАВ связан с морфологическим
развитием растения, с формированием дифференцированных тка-
ней.
В настоящее время собрана большая коллекция клеточных
культур растений из различных семейств синтезирующие вторич-
ные метаболиты, широко используемые в промышленности. К ним
относятся: женьшень дальневосточный – источник диосгенина,
диоскорея дельтовидная – стероидные гликозиды, равольфия
змеиная – продуцент антиаритмического алкалоида аймалина и т.д.
Установлено недавно, что клетки тиса ягодного синтезирует веще-
ство-таксон, которое является антираковым препаратом.
Осуществляются большие научно-технологические исследо-
вания по культивированию клеток и тканей растений in vitro.
Прирост клеточной биомассы в условиях in vitro и in vivo
может проходить с разной скоростью. Биомасса клеток женьшеня
в суспензии при выращивании в 50 литровом ферментере увеличи-
вается на 2,0 г в литре среды за сутки, что в 1000 раз больше, чем
выращивании на плантации.
Учитывая высокую стоимость женьшеня (килограмм планта-
ционного корня стоит 100-150 дол. США; цена дикорастущего
корня может доходить до нескольких тысяч долларов США) био-
технологический способ получения биомассы культуры клеток
женьшеня весьма привлекателен.
В таб. 5 приведены некоторые экономически важные продук-
ты, синтез которых получен в культуре клеток высших растений.
Таблица 5
Экономически важные продукты, полученные в культуре клеток
высших растений (по Р.Г. Бутенко, 1999)

39 40
Традиционные раститель-
ные продукты
Новые
активные вещества
Продукты
биотрансформации
Алкалоиды Ингибиторы фито-
вирусов
Метилдигоксин,
дигоксин
Стероиды
терпены и терленоиды
Антиканцерогены,
композиции
Ментол
Неоментол
Бетанины
гликозиды
полифенолы
полисахариды
эфирные масла
натуральные красители
(пигменты
убихинон
вкусовые добавки
инсектициды
латекс
Ингибиторы про-
теиназ необычные
белки
Герониол
Нерол
цитронеллол
4. ПРОМЫШЛЕННОЕ ПРОИЗВОДСТВО БАВ ИЗ КУЛЬТУ-
РЫ КЛЕТОК РАСТЕНИЙ
В основе промышленного производства БАВ (лекарственный
субстанций и др.) из культуры клеток растений лежит ряд после-
довательных стадий и операций: получение высокопродуктивных
продуцентов, разработка оптимальных условий культивирования
продуцента БАВ с максимальным биосинтезом целевого продукта,
разработка и внедрение в практику соответствующих методов и
условий выделения и очистки БАВ, создание готовых препаратов и
контроль качества. Работа на каждом из этих этапов должны про-
водится соответствующими специалистами: биотехнологами, гене-
тиками, химиками-технолагами (Чуешов и др., 2002).
4.1 Подготовка среды для культивирования продуцента и
посевного материала (первая стадия).
Для каждого продуцента БАВ, для каждого вновь образуемо-
го каллуса и суспензионной культуры растений разрабатывается
своя оптимальная среда, которая должна отвечать следующим ос-
новным требованиям:
1) обеспечивать хороший рост биомассы и максимально воз-
можное образование целевого продукта – алкалоидов, гли-
козидов, полисахаридов и др. продуктов вторичного синте-
за;
2) содержать доступные по стоимости компоненты;
3) обеспечивать применение наиболее экономических и эф-
фективных приемов выделения и очистки БАВ.
Среды Мурасиге-Скуча (МС) и Шенке-Хильдебрандта (ШХ)
относятся к наиболее употребляемым в работе с культурами кле-
ток растений и оказались эффективными для роста различных од-
но- и двудольных растений (табл. 2). Их считают средами с высо-
ким содержанием солей (по сравнению с низкосолевой средой
Уайта). Среда ШХ от других сред отличается очень высоким, деся-
тикратным содержанием мезоинозината. Среди МС и ШХ содер-
жат железо в хелатированной форме в комплексе с ЭДТА. Это
обеспечивает его доступность при рН до 8,0 в течение всего пе-
риода роста культуры, тогда как при отсутствии хелатирующего
агента недостаток железа может проявиться очень быстро.
Компоненты среды для выращивания каллусных и суспензи-
онных культур можно разделить на шесть групп, что обычно отра-
жает порядок приготовления концентрированных растворов:
1) основные неорганические питательные вещества (макро-
элементы);
2) микроэлементы
3) источники железа;
4) органические добавки (витамины);
5) источники углерода;
6) регуляторы роста растений.
В реактор с мешалкой с помощью вакуума вносят поочеред-
но приготовляемые растворы, соблюдая следующий порядок:

41 42
- раствор макросолей;
- агарированный раствор;
- раствор хелата железа;
- раствор микроэлементов;
- раствор кальция, нитрата;
- раствор сахара.
Смеси тщательно перемешивают в течение 5 мин., затем 1-2
мин ведут вертикальное перемешивание путем барботажа при
включенной мешалке. Обязательно отбирают контрольные пробы
для опредления рН среды (рН должно быть в пределах 5,0-6,2;
температура раствора (22 ± 2,5°С).
В промышленных условиях стерилизация питательных сред
осуществляется двумя основными методами: периодическим и не-
прерывным.
Периодический метод стерилизации применяют при исполь-
зовании небольших объемов среды. Он заключается в том, что
среда, нагретая до определенной температуры (120-125°С) непо-
средственно в ферментаторах или в специальных паровых стери-
лизаторах ГПСД-1700, выдерживается при этой температуре в те-
чение 30-60 мин (в заивисимости от объема среды или от её соста-
ва, после чего охлаждается до 27-30°С).
Непрерывный метод стерилизации целесообразно применять
при использовании больших объемов среды. Приготовленная сре-
да из специального сосуда с помощью насоса подается в стерили-
зационную колонну, через которую пропускается острый пар (дав-
ление пара около 5 атм.). Пар подается сверху по внутренней тру-
бе, имеющей щелевидные прорези, благодаря чему пар поступает в
среду и быстро её нагревает. Среда в колонну подается снизу и
движется по спирали вокруг внутренней трубы.
Нагретая в колонне до необходимой для стерилизации тем-
пературы (около 125°С), среда поступает в специальный аппарат –
выдерживатель, где она выдерживается при температуре 120-
125°С. время выдерживания зависит от состава среды и составляет
5-10 мин. Из выдерживателя стерильная среда поступает в змееви-
ковый холодильник.здесь она охлаждается до 30-35°С (на выходе)
и поступает в ферментатор. Непрерывный метод стерилизации
имеет ряд преимуществ перед периодическим методом: возмож-
ность автоматического регулирования процесса, быстрый и равно-
мерный нагрев среды, обеспечение более полной стерильности
среды.
Подготовка посевного материала – одна из ответственных
операций в цикле биологического методы получения БАВ из куль-
туры тканей.
Культуру ткани (коллекцию культуры) заводы получают из
академий и университетов. Каждая культура имеет паспорт с под-
робным описанием морфологии, физиологии, характеристики сре-
ды для культивирования и хранения.
Для твердофазного метода культуру ткани выращивают на
агаризованной стерильной питательной среде в колбах вместимо-
стью 0,25 л в термостатируемом помещении или термостате с тем-
пературой 27±1°С. на 38-46 сут. Роста ткань материнской культу-
ры режут ткаим образом, чтобы инокулюм состоял из вертикаль-
ного столба (верхний слой, средний и часть нижнего слоя безага-
ризованной среды). Нельзя допускать воздействия на культуру
дезсредств, бактерицидных ламп, так как это приводит к инактива-
ции роста. Из материнской культуры пересаживают 7-9 дочерних
культур и через 38-46 сут. Роста в термостатируемом помещении
отбирают колбы с культурами тканей лучших ростовых признаков.
Для таких культур характерен быстрый рост, максимальное ис-
пользование питательной среды, цвет ткани от светло-желтого до
молочного, отсутствие некротических включений.
Для глубинного (суспензионного) метода культуру ткани
предварительно выращивают на агаризованной стерильной среде в
пробирках, затем из пробирок высеивают в колбы с жидкой пита-
тельной средой и проводят две генерации глубинного выращива-
ния на качалках в течение 38-46 сут. для каждой генерации. Из
второй генерации культуры (в колбе) делают посев в небольшой
(10 л) инокулятор, а затем хорошо развивающуюся культуру пере-
