Букин В.И., Игумнов М.С. и др. Переработка производственных отходов и вторичных сырьевых ресурсов, содержащих редкие, благородные и цветные металлы
Подождите немного. Документ загружается.


Глава 3.
В зависимости от механизма экстракции все экстра-
генты можно разделить на две группы.
Нейтральные экстрагенты - это простые и сложные
эфиры, спирты, кетоны, сложные эфиры фосфорной кис-
лоты, диалкилсульфиды и сульфоксиды, амины;
Ионообменные экстрагенты, которые подразделяют-
ся на катионообменные и анионообменные экстрагенты.
К катионообменным экстрагентам относятся органичес-
кие кислоты и их соли, например, жирные карбоновые и
диалкилфосфорные. К анионообменным экстрагентам
соли аминов и четвертичных аммониевых оснований.
Нейтральные экстрагенты, в зависимости от концент-
рации кислоты в водном растворе, могут реализовать раз-
личные механизмы - сольватационный или гидрато-сольва-
тационный, которые основаны на образовании донорно-ак-
цепторной связи между неподеленной электронной парой
атомов кислорода, азота или серы экстрагента и свободной
орбитой катиона. В первом случае идет непосредственная
координация экстрагента (8) к извлекаемому металлу:
М
+
в
+ А-
в
+ п8
0
- М8 Д.
Во втором - экстрагент координируется к иону гид-
роксония, частично вытесняя воду из его гидратной обо-
лочки, в этом случае образуется крупный органический
катион, который может присоединять металлсодержащие
анионы и экстрагировать их в виде ионных ассоциатов:
[Н
3
0(Н
2
0)
9
]
+
в
+ [МСу
В
+ п8
0
=[Н
3
0(Н
2
0)
3
8
п
]
+
[МСд
0
+ 6Н
2
0.
Катионообменные экстрагенты в процессе экстракции
извлекают катионы за счёт катионного обмена, а анионо-
обменные - за счёт анионного обмена:
(п+1)(НК)
0
+ М(Н
2
0)
х
+
в
= МК(НЯ)
п0
+ Н
+
В
+ хН
2
0,
АтНС1
0
+ А-
в
= АтНА
0
+ С1
в
.
Процесс экстракции протекает успешно в том случае,
если образующиеся при этом экстрагируемые соединения
63

хорошо растворяются в органической фазе. Однако при
этом следует помнить, что органическая и водная фазы
имеют ограниченную взаимную растворимость и значи-
тельно различаются по плотности.
При экстракции, как правило, используют не индивиду-
альные экстрагенты, поскольку они обладают высокой вязко-
стью, а их растворы в нейтральных органических растворите-
лях, в качестве которых используют керосин, толуол, и др.
Для количественной оценки процесса экстракции исполь-
зуют следующие характеристики: 1- коэффициент распреде-
ления (О) - отношение концентрации металла в органической
фазе к его равновесной концентрации в водной фазе; 2 - коэф-
фициент разделения ((З
м; м
= 0,/0
2
) - отношение коэффици-
ентов распределения экстрагируемых металлов в случае их
разделения, причём О^О^ 3 - степень извлечения - отноше-
ние количества металла, перешедшего в органическую фазу, к
его суммарному количеству в органической и водной фазах.
Следует отметить, что по сравнению с ионным обменом экст-
ракция является более производительным процессом.
Электрохимические методы обогащения достаточно
широко применяются при концентрировании и переработ-
ке вторичного сырья и различных промышленных отхо-
дов. Наибольшее распространение получили методы це-
ментации, электроэкстракции и электродиализ.
Цементация [13] - электрохимический процесс выделе-
ния металлов из раствора (расплава), основанный на разно-
сти равновесных электродных потенциалов цементируемо-
го металла и металла-цементатора. Процесс выделения (вос-
становления) более электроположительного металла проис-
ходит за счёт растворения (окисления) более электроотрица-
тельного металла. При этом происходит передача избыточ-
ных электронов от цементируемого металла к металлу-це-
ментатору в режиме короткозамкнутого элемента (рис. 3.2.1).
Скорость процесса цементации определяется разностью
равновесных потенциалов цементируемого металла и металла-
цементатора, и чем она больше, тем выше скорость цементации.
64

Глава 3.
катодный процесс
[Оа(ОН)
6
]
3
"+Зе = Са°+6 0Н-
анодный процесс I
А1° - Зё+4 ОН" = [А1(ОН)
4
] ооо Оа металлический
А1 метагшическш
Рис. 3.2.1. Схема процесса цементации галия металлическим
алюминием из щелочного галлатного раствора.
Равновесный потенциал (Е) может быть рассчитан по
уравнению Нернста:
Н.Т. а
т
Е =К+—-1п
пЕ а
гЫ
где а и а , - активности окисленной и восстановленной
ох геа
форм металла, равные произведению концентраций ионов
на коэффициент активности; Е
о
- стандартный потенци-
ал, В; п - число электронов, участвующих в реакции; Е-
число Фарадея, 96500 к (26,8 А-ч); Г- абсолютная темпера-
тура, К; К- газовая постоянная, равная 8,315 Дж/моль»град.
Поскольку все величины, кроме концентраций ионов,
поддерживаются постоянными, то процесс цементации
будет определяться стандартными потенциалами и соот-
ношением концентраций ионов металла-цементатора и це-
ментируемого металла. Цементация будет протекать до тех
пор, пока равновесные потенциалы не сравняются. В урав-
нении Нернста Е, п, Ей К - величины постоянные, актив-
ности металлов а
1
= а
7
= 1 и температура в процессе цемен-
тации изменяются незначительно. Повышение величины
равновесного потенциала может произойти в том случае,
если концентрация ионов более электроположительного
цементируемого металла в растворе существенно умень-
шится, концентрация металла-цементатора возрастёт.
65

Особо следует выделить процесс цементации метал-
лов из растворов, в которых они существуют в виде устой-
чивых комплексов. В этом случае величину равновесного
потенциала катодного процесса, а следовательно, и ско-
рость цементации будет определять константа нестойкос-
ти комплексов, величина которых может быть очень ма-
ленькой (Аи[СК|- - К
н
=5-К)"
39
, Си[С1Ч]
4
3
- - К, = 5-Ю"
33
).
При выборе металла-цементатора учитывают его сто-
имость и величину стандартного потенциала. В качестве
металлов-цементаторов используют специально приготов-
ленные порошки (пыли) и гранулы или отходы различных
производств - опилки, стружку, проволоку и др. Для по-
лучения концентрата редких, благородных или цветных ме-
таллов методом цементации чаще всего применяют цинк,
алюминий и железо.
При проведении процесса цементации необходимо со-
здать определенный рН раствора и исключить присутствие
электроположительных примесей, поскольку это позволяет
сократить расход металла-цементатора и получить более
чистый цементат.
Скорость цементации может быть лимитирована проте-
канием как анодного, так и катодного процессов. Скорость
анодного процесса значительно падает при экранировании
поверхности цементатора плотным слоем осаждаемого метал-
ла. Скорость катодного процесса может быть ограничена внут-
ренней диффузией ионов осаждаемого металла к цементатору
через слой продуктов реакции. Поэтому повышение темпера-
туры, увеличение поверхности цементатора, перемешивание
раствора способствуют интенсификации процесса цементации.
Однако, при этом существенно возрастает расход металла-це-
ментатора за счёт протекания побочных реакций.
Следует отметить, что процесс цементации прост в ап-
паратурном оформлении и эффективен при выделении элек-
троположительных металлов, например, Аи, А§, Си, Рё, Р1
(при их малой концентрации) из сильнокислых растворов,
1п, Сё, В1 (при их повышенной концентрации) из слабокис-
лых растворов и Оа, 8п, РЬ, 8Ь из щелочных растворов.
66

Глава 3.
Электроэкстракционный метод [14, 15]. Процесс ос-
нован на электрохимическом выделении (восстановлении)
металлов под действием постоянного тока. На катоде про-
текают процессы восстановления, связанные с присоеди-
нением электронов. Это могут быть процессы:
а - восстановления катионов до металла (К| М
2+
+ 2ё
= М°; К| [М(ОНу
3
- + Зё= М° + 60Н );
б - выделения водорода (в нейтральной и щелочной
средах К| 2Н
2
0 + 2ё= Н
2
+ 20Н, в кислой среде -
К| 2Н
3
0
+
+ 4ё= Н
2
+ 2Н
2
0);
в-частичного восстановления катионов (К| М
3+
+ё= М
2+
).
На аноде (нерастворимом) протекают процессы окис-
ления, связанные с отдачей электронов. Это могут быть
процессы окисления анионов хлора, брома или йода до эле-
ментарного состояния, процессы выделения кислорода (в
нейтральной: А| 6Н
2
0 - 4 ё = 0
2
+ 4Н
3
0
+
или в щелочной
средах: А| 40Н - 4 5= 0
2
+ Н
2
0), или неполного окисления
(А| М
2+
-ё= М
3+
). В качестве нерастворимого анода в зави-
симости от среды используют никель или железо (щелоч-
ные растворы), свинец, легированный сурьмой и серебром
(сернокислые растворы), графит, титан, покрытый смесью
оксидов титана и рутения (ОРТА) или платинированный
титан (солянокислые растворы) и углеродистый материал
(в случае расплавленных сред).
Процесс электроэкстракции можно применять для
концентрирования металлов из промышленных растворов
и промывных вод. В зависимости от состава раствора и
условий электролиза можно выделять как индивидуальные
металлы, так и их сумму. Очерёдность выделения металла
на катоде определяется стандартным электродным потен-
циалом, концентрацией его в растворе, поляризацией и
анионным составом раствора (электролита). В первую оче-
редь на катоде выделяется металл, стандартный потенци-
ал которого электроположительнее остальных, концент-
рация в электролите больше, а поляризация меньше.
67

Присутствие в составе раствора, поступающего на элект-
ролиз, органических или неорганических комплексообра-
зователей может изменить реальные потенциалы и очеред-
ность выделения металлов на катоде. Следует заметить, что
в ряде случаев специально вводят органические вещества,
позволяющие существенно влиять на электрохимическое
поведение металлов. Последнее с успехом используется для
очистки и разделения близких по химическим свойствам
элементов, например, платиновых металлов [24].
В случае низкой концентрации металла (или образова-
ния прочных комплексов) в растворе быстро достигается
плотность тока, при которой его дальнейшее выделение бу-
дет происходить совместно с более электроотрицательным
металлом или водородом. Необходимо сказать, что элект-
роотрицательные металлы (А1, М§, Ьа и др.) невозможно
выделить электролизом из кислых растворов, так как рань-
ше достигается потенциал выделения водорода. Последний
зависит от рН раствора, но во всех случаях он положитель-
нее потенциалов выделения указанных выше металлов.
При проведении процесса электроэкстракции метал-
лов из разбавленных растворов целесообразно применять
электроды с высокоразвитой поверхностью: насыпные,
псевдоожиженные, трехмерные графитовые и др. [16-23].
Это позволяет работать при низких плотностях тока
(ниже предельного) с низким расходом электроэнергии,
так как затраты тока на выделение водорода в этом слу-
чае минимальны.
Электроэкстракция является высокопроизводитель-
ным, легко регулируемым и управляемым процессом, ко-
торый эффективен при удалении из растворов электропо-
ложительных металлов или примесей. Однако следует от-
метить, что для проведения процесса электроэкстракции
требуются достаточно сложное оборудование и специаль-
ные условия (температура, рН и др.). Необходимо также
отметить, что электроэкстракция не может быть примене-
на для выделения электроотрицательных металлов и ме-
таллов, склонных к катодной пассивации (XV, Та, 1ЧЪ и др.).
68
Глава 3.
В случаях, когда методы цементации и электроэкст-
ракции неэффективны, используют электродиализ.
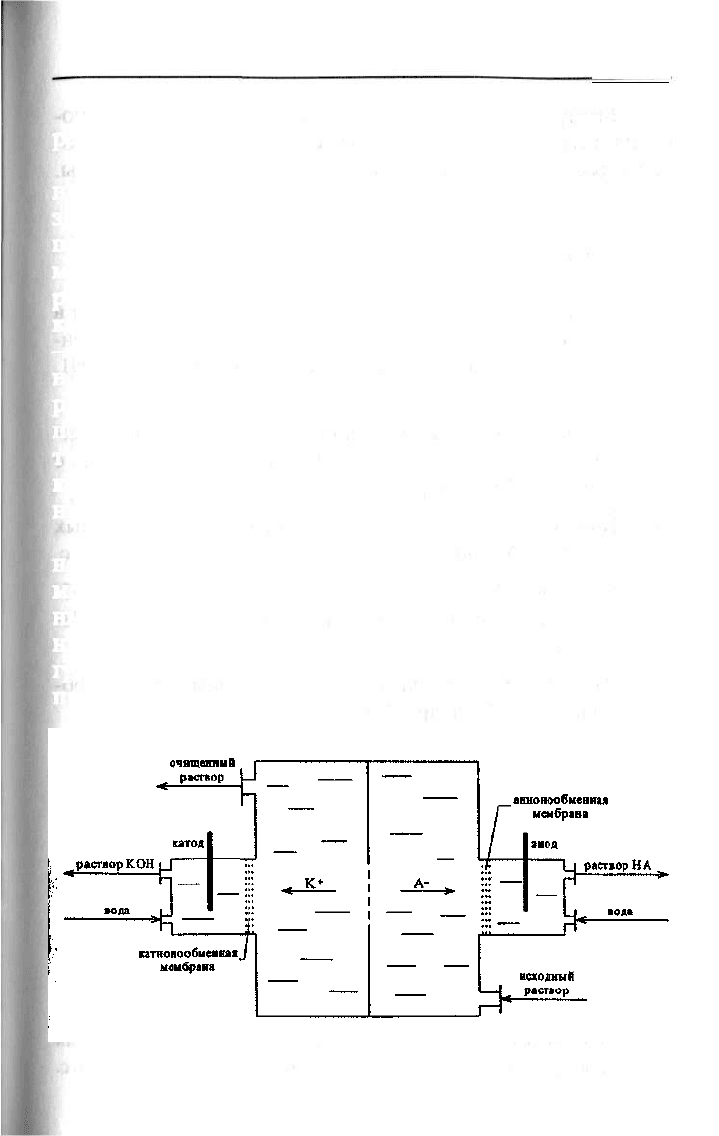
Метод электродиализа [25] основан на использовании
направленного движения в электрическом поле ионов, со-
здаваемом постоянным током. Электродиализатор, как
правило, состоит из трёх камер: большой загрузочной ка-
меры и двух маленьких камер, в которые помещены элект-
роды (рис. 3.2.2). Маленькие камеры отделены от большой
камеры ионообменными мембранами: со стороны катода
- катионообменной, а со стороны анода - анионообмен-
ной. При заполнении большой камеры перерабатываемым
раствором, содержащим катионы и анионы, и наложении
постоянного тока на электроды происходит процесс элек-
тродиализа. За счёт электромиграции катионы из большой
камеры движутся к катоду, проходят через катионообмен-
ную мембрану и концентрируются в катодной камере.
Анионы же движутся к аноду, проходят через анио-
нообменную мембрану и концентрируются в анодной ка-
мере. В центральной (большой) камере остаётся очищен-
ный раствор. Катоды для электродиализа изготовляют из
никеля или нержавеющей стали, а аноды, как правило, из
графита, платинированного титана или ОРТА. Общее на-
пряжение на электродах может достигать порядка 1500 В.
Рис. 3.2.2. Схема работы электродиализатора.
69

Электродиализ с успехом применяют для концентриро-
вания в растворе электроотрицательных металлов, обессо-
ливания сбросных и сточных вод и опреснения морской воды.
Литература
1. Малоотходные процессы и охрана окружающей среды в
металлургии редких металлов. / Кожемякин А.А., Зубчен-
ко Г.В., Митник В.Л., Вакс Г.Л.- М.: Металлургия, 1991.
-160 с.
2. Шуберт Г. Подготовка металлических вторичных мате-
риалов. (Ресурсы, классификация, измельчение). / Пер. с
нем. - М.: Металлургия, 1989. - 360 с.
3. Колобов Г.А. Первичная переработка отходов цветных
металлов. Учебн. пособие. - Киев: УМК ВО, 1991. - 172 с.
4. Колобов Г.А., Бредихин В.Н., Чернобаев В.М. Сбор и об-
работка вторичного сырья цветных металлов. - М.: Ме-
таллургия, 1993. - 289 с.
5. Шохин В.Н., Лопатин А.Г. Гравитационные методы обо-
гащения. - М.: Недра, 1980. - 400 с.
6. Олофинский Н.Ф. Электрические методы обогащения. -
М.: Недра, 1977.-518 с.
7. Кравец Б.Н. Специальные и комбинированные методы
обогащения. - М.: Недра, 1986. - 346 с.
8. Тареев Б.М. Физика диэлектрических материалов. - М.:
Энергоиздат, 1982. - 320 с.
9. Ягодин Г.А., Синегрибова О.А., Чекмарев А.М. Техноло-
гия редких металлов в атомной технике. - М.: Атомиздат,
1974.-344 с.
10. Вольдман Г.М. Основы экстракционных и ионнообменных
процессов гидрометаллургии. - М.: Металлургия, 1982. - 376 с.
70

Глава 3.
11. Гиндин Л.М. Экстракционные процессы и их применение.
-М.: Наука, 1984.-144 с.
12. Меретуков М.А. Процессы жидкостной экстракции в цвет-
ной металлургии. - М.: Металлургия, 1985. - 222 с.
13. Алкацев М.И. Процессы цементации в цветной металлур-
гии. - М.: Металлургия, 1961. - 113 с.
14. Измайлов Н.А. Электрохимия растворов. - М.: Химия,
1976.-483 с.
15. Баймаков Ю.В.. Журин А.И. Электролиз в гидрометал-
лургии. - М.: Металлургия, 1977. - 380 с.
16. Кгеува О. Ыесггоспегше тк ёгеЫнпетюпакп Иекггоёеп.
// СЬегше Гп§ешеиг ТесЬшс. 1983. В. 55. №1.8. 23-30.
17. Кипарисов С.С, Бескин А.Л., Кожиков СБ. Новые спо-
собы электроосаждения металлов из производственных
растворов и сточных вод металлургических предприятий.
(Производство тяжелых цветных металлов. Обзорн. ин-
форм. МЦМ СССР. Вып. 4). - М.: ЦНИИцветмет эконо-
мики и информации, 1984. - 48 с.
18. Кипарисов С.С, Бескин А.Л., Кожиков СБ. Трёхмерные
электроды и процессы извлечения металлов из промышлен-
ных стоков. (Обзорн. информ. МЦМ СССР. Вып. 3). - М.:
ЦНИИцветмет экономики и информации, 1987. - 64 с.
19. Варенцов В.К. Интенсификация электрохимических про-
цессов. // Сборник научных трудов института электрохи-
мии имени Фрумкина А.Н. Под ред. Томилова А.П. - М.:
Наука, 1988.-216 с.
20. Заозулков И.В. Разработка технологии электрорафини-
рования и электроэкстракции тяжелых цветных метал-
лов с трёхмерными электродами. // Цветные металлы.
1990. №3. С 31-36.
21. Белов С.Ф., Ерофеев С.А., Игумнов М.С, Токарь Л.Л. Ис-
пользование трёхмерных электродов при переработке вто-
71

ричных медно-серебряных сплавов. // Цветная металлур-
гия. 1991. №3. С. 34-37.
22. Ерофеев С.А., Токарь Л.Л., Павлов М.Ю., Бузин В.И., Са-
фонов В.В. Комплексная переработка припоя в процессе
электрохимического анодного растворения с использова-
нием трёхмерного анода. // Сборник научных трудов ГИ-
НАЛМАЗЗОЛОТО "Производство, анализ и применение
благородных металлов и алмазов". - М.: Гиналмаззолото,
1992. С. 53-59.
23. Токарь Л.Л., Игумнов М.С, Павлов М.Ю., Ерофеев С.А.
Электролизёр для переработки металлических отходов, со-
держащих благородные металлы, растворимым взвешен-
ным анодом. // А. с. № 1737023, СССР. МКИ
5
С 25 с 7/00.
Бюлл. 1992. № 20. С. 98.
24. Игумнов М.С, Карманников В.Т., Юрасова О.В. Влияние
органических компонентов на электрохимические процес-
сы выделения платиновых металлов из промышленных ра-
створов. // Сб. инф. материалов III Международной конф.
"Благородные и редкие металлы" (БРМ - 2000). Донецк,
2000. - С. 279.
25. Гребенюк В.Д. Электродиализ.- Киев: Техника, 1976. -
159с.
7?
