Билеты по общей и неорганической химии
Подождите немного. Документ загружается.

После измерения его положения точно предсказать, где будет находиться электрон в
последующие моменты времени, невозможно. Мы можем лишь вычислить вероятность
обнаружения электрона в различных точках. Как отмечал впоследствии Бор, бессмысленно даже
спрашивать, как при испускании атомом светового фотона, электрон переходит из одного
состояния в другое.
Итак, если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой
механике дискретные значения энергии, являясь следствием самой теории, вытекают
непосредственно из решения уравнения Шредингера.
0)]([2
22
2
xVE
h
m
dx
d
a
x
npAsin
УРАВНЕНИЕ ЛУИ ДЕ БРОЙЛЯ:
mv
h
h – постоянная Планка.
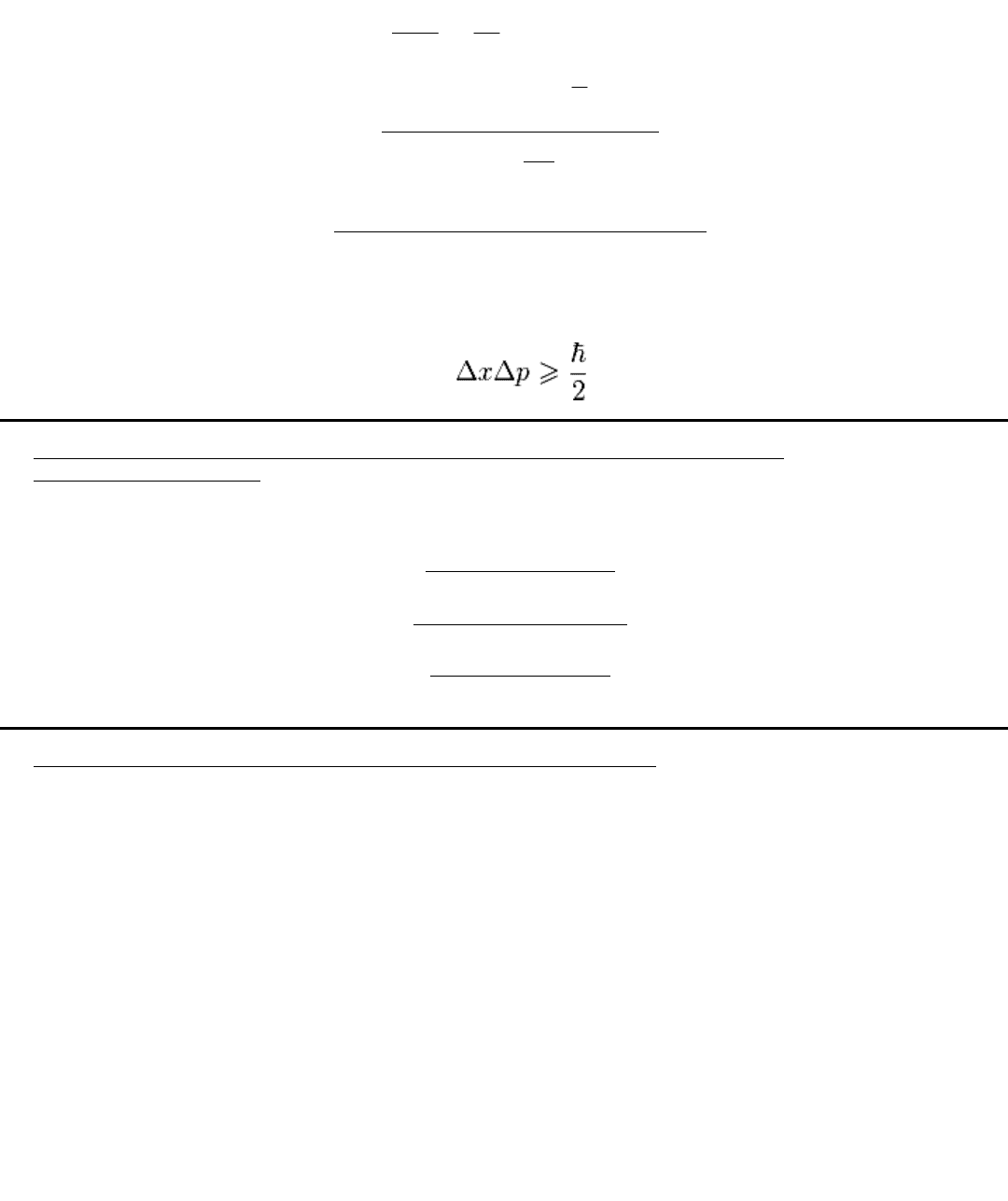
Принцип неопределенности Гейзенберга:
Любая частица (в общем смысле, например несущая дискретный электрический заряд) не
может быть описана одновременно как «классическая точечная частица» и как волна. (Сам факт
того, что какое-либо из этих описаний может быть справедливо, по крайней мере в отдельных
случаях, называют корпускулярно-волновым дуализмом).
20. Окислительно-восстановительные свойства перманганата калия.
П е р м а н г а н а т к а л и я
проявляет окислительные свойства за счет марганца в степени
окисления +7. В зависимости от среды, в которой протекает реакция, он восстанавливается до
разных продуктов: в кислотной среде — до солей марганца (II), в нейтральной — до оксида
марганца (IV) в гидратной форме МnО(ОН)
2
, в щелочной — до манганат-иона МnО
4
2−
:
КИСЛОТНАЯ СРЕДА:
42243)(4242
325325 SOKOHMnSOKNOSOHKMnOKNO
разб
НЕЙТРАЛЬНАЯ СРЕДА:
242
)(2223 OHMnOKOHKMnOH
ЩЕЛЕЧНАЯ СРЕДА:
OHMnOKSONaKOHKMnOSONa
24242432
222
21. Структура атома и периодичность свойств элементов.
Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая
часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра
нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом
электронейтрален. Заряд ядра (выраженный в единицах заряда электрона) численно равен
порядковому номеру элемента в периодической системе. Из электронейтральности атома следует,
что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента.
Заряд атома является той основной величиной, от которой зависят свойства элемента и его
положение в периодической системе.
Периодический закон Менделеева: «С вой с т в а э л е м е н т о в и о б р а з у е м ы х и м и п о р о т ы х
и с лож н ы х в е щ е с тв н а х о д я т с я в п е ри о д и ч е с к о й за в и с им о с т и о т з а р я д а а т о м о в
э л е м е н т о в ».
Ядро атома состоит из протона p и нейтрона n. Обе эти частицы рассматриваются как два
различных состояния ядерной частицы нуклона. Элементарные частицы характеризуются
определенной массой и зарядом. Протон обладает массой 1.0073 а.е.м. и зарядом +1. Масса
нейтрона равна 1.0087 а.е.м., а его заряд равен нулю (частица электронейтральная).
Ядра всех атомов, кроме ядра водорода, состоят из Z протонов и (A − Z) нейтронов, где Z –
порядковый номер элемента, А – массовое число.
Массовое число А указывает суммарное число протонов Z и нейтронов N в ядре, т.е.
NZA
Наиболее ярко периодичность свойств элементов выражена в электронной структуре атомов.
Периодически изменяются и свойства атомов элементов, определяемые их электронным
11

строением. К важнейшим характеристикам атомов относятся их размеры, энергия ионизации,
сродство к электрону, электроотрицательность.
Атомные радиусы. Атомы не имеют строго определенных границ. Если исходить из квантово-
механических представлений, то за радиус атома можно принять теоретически рассчитанное
расстояние от ядра до максимума радиальной функции распределения вероятности. Так
определяется орбитальный радиус атома.
Орбитальные радиусы атомов элементов изменяются периодически:
1) В периодах по мере роста заряда ядер орбитальные радиусы атомов уменьшаются. Это
связано с тем, что при одинаковом числе энергетических уровней в периоде возрастает заряд ядра,
а следовательно, и притяжение электронов к ядру;
2) В группах с ростом заряда ядер орбитальные радиусы атомов увеличиваются. При этом в
главных подгруппах (группах А) такое увеличение происходит в большей степени, чем в побочных
подгруппах (группах В). Это связано с увеличением числа энергетических уровней и экранирующим
действием внутренних электронов.
Иногда наблюдаются отклонения от монотонной зависимости, что объясняется особенностями
электронной структуры атомов.
Энергетические характеристики атомов. Для химии особый интерес представляет
энергетическое состояние электронов внешних уровней, так как именно они ответственны за
образование химических связей, определяют прочность этих связей. Количественные
характеристики необходимы для оценки реакционной способности атомов.
Энергия ионизации Е
1
- минимальная энергия, которую требуется затратить на то, чтобы удалить
данный
периодов электрон с атомной орбитали невозбужденного атома на бесконечно большое
расстояние от ядра без сообщения ему кинетической энергии. Энергия ионизации соответствует
следующему процессу:
eЭEЭ
1
,
где E
1
— в кДж/моль. Энергия ионизации количественно характеризует способность атома
удерживать электроны, что является важной характеристикой его химической активности. Для
многоэлектронных атомов можно рассматривать несколько энергий ионизации, соответствующих
энергиям отрыва 1, 2, 3, ... электронов, считая от наиболее удаленного.
Энергия ионизации возрастает в периоде по мере увеличения порядкового номера элемента.
Наименьшее ее значение имеют щелочные металлы, находящиеся в начале периода. Наибольшие
значения энергии ионизации характерны для инертных газов (Не, Ne, Ar, Кг, Хе), находящихся в
конце периодов.
Отклонения от монотонной зависимости наблюдаются при переходе в пределах периода от s-
элементов (Be, Mg) к р-элементам (В, Аl) или от d-элементов (Zn, Cd, Hg) к p-элементам (Ga, In, Tl).
В группе элементов энергия ионизации уменьшается с повышением порядкового номера
элемента. Это обусловлено увеличением размеров атомов и экранированием внешних электронов
внутренними.
Для характеристики способности атома отдавать электроны иногда используют понятие
«потенциал ионизации». Под потенциалом ионизации понимают разность потенциалов, под
воздействием которой электрон приобретает энергию, соответствующую энергии ионизации, и
измеряют в вольтах. Численное значение потенциала ионизации в вольтах равно энергии
ионизации в электронвольтах на атом.
Сродство к электрону атома Е
А
— энергия, которая выделяется (или затрачивается) при
присоединении к нейтральному атому электрона с образованием отрицательного иона:
A
EЭеЭ
.
где Е
А
— в кДж/моль.
Сродство к электрону считают положительным, если присоединение электрона сопровождается
выделением энергии (Е
А
> 0). Если для присоединения электрона нужно затратить энергию, то
сродство к электрону считается отрицательным (Е
А
< 0). Сродство к электрону зависит от
электронной структуры атома. Наибольшим сродством к электрону обладают элементы подгруппы
VII А (галогены: F, Сl, Вr, I). У большинства металлов и благородных газов сродство к электрону
невелико или даже отрицательно. Наименьшие значения сродства к электрону у атомов с
заполненными и наполовину заполненными s- и p-подуровнями.
В подгруппах сверху вниз сродство к электрону атомов уменьшается, но не всегда монотонно.
Это связано с особенностями электронной структуры атомов.
Электроотрицательность. Электроотрицательность — это способность атома в молекуле или
сложном ионе притягивать к себе электроны, участвующие в образовании химической связи.
Электроотрицательность зависит от типа соединений, валентного состояния элемента. Поэтому
такая характеристика имеет условный характер. Однако ее использование полезно для
качественного объяснения типа химических связей и свойств соединений.
12

Существуют несколько шкал электроотрицательности. Наиболее часто используемая шкала
Полинга составлена на основе термохимических данных по энергиям связей в двухатомных
молекулах. Каждому элементу приписывается вполне определенное значение
электроотрицательности. В периоде электроотрицательность возрастает с увеличением
порядкового номера элемента (слева направо), а в группе, как правило, убывает по мере
увеличения заряда ядра (сверху вниз). Таким образом, наименьшие значения
электроотрицательности имеют s-элементы I группы, а наибольшие — р-элементы VI и VII групп.
22. Гидролиз солей, образованных слабым основанием и слабой кислотой.
Если катионы и анионы обладают значительным поляризующим действием, т.е. соли
образованы слабым основанием и слабой кислотой, то происходит гидролиз по катиону и аниону.
Al
2
S
3
+ 6H
2
O = 2Al(OН)
3
+ 3H
2
S
2Аl
3+
+ 3S
2-
+ 6Н
2
О = 2Аl(OН)
3
(осадок) + ЗН
2
S(газ)
Растворы солей этого типа могут иметь слабокислотную или слабощелочную реакцию (рН ≈ 7) в
зависимости от соотношения констант диссоциации, образующихся при гидролизе кислоты или
основания. Если эти величины близки по силе, то гидролиз идет практически до конца.
23. Слабые электролиты. Степень диссоциации. Константа диссоциации.
Слабые электролиты – химические соединения, молекулы которых даже в сильно
разбавленных растворах не полностью диссоциированы на ионы, которые находятся в
динамическом равновесии с недиссоциированными молекулами.
Понятие степени диссоциации электролита α как величины, равной отношению числа
распавшихся молекул N
дисс
к общему числу молекул N
0
электролита,
0
N
N
дисс
Константа диссоциации — вид константы равновесия, которая показывает склонность
большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как
например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в
водном растворе на ионы.
В общей реакции:
yBxABA
yx
,
тогда константа диссоциации:
][
][][
yx
yx
д
BA
BA
K
24. Отношение металлов к азотной кислоте.
А з о т н а я к и с л о т а
проявляет окислительные свойства за счет азота в степени окисления +5.
Окислительная активность азотной кислоты усиливается с
ростом концентрации, поэтому концентрированная HNO
3
окисляет не только активные, но и малоактивные металлы,
такие как медь и серебро, образуя преимущественно оксид
азота (IV):
)2
223)(3
HNOAgNOHNOAg
конц
Соли азотной кислоты (нитраты) могут восстанавливаться в
кислотной, а при взаимодействии с активными металлами и в щелочной средах, а также в
расплавах:
OHKNOZnOKKOHKNOZn
сплавление
22223
2
Смесь трех объёмов соляной кислотой и одного объёма азотной называется «царской водкой».
Царская водка растворяет большинство металлов, в том числе и золото. Её сильные окислительные
способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
3HCl + HNO
3
→ NOCl + 2[Cl]↑ + 2H
2
O
25. Гидролиз. Факторы, влияющие на процесс гидролиза.
Гидролиз соли — обменное взаимодействие ионов соли с молекулами воды, приводящее к
увеличению кислотности или щелочности раствора и образованию слабых электролитов.
Факторы, влияющие на степень гидролиза.
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры
смещает равновесие в системе вправо, степень гидролиза возрастает.
13
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье (е с л и н а
с и с т е м у , н а х о д я щ у ю с я в р а в н о в е с и и , в о з д е й с т в о в а т ь и з в н е п у т е м
и з м е н е н и я к а к о г о - л и б о п а р а м е т р а , т о р а в н о в е с и е б у д е т с д в и г а т ь с я в
н а п р а в л е н и и , с п о с о б с т в у ю щ е м в о с с т а н о в л е н и ю р а в н о в е с и я с и с т е м ы ),
повышение концентрации ионов водорода приведет к смещению равновесия влево. Степень
гидролиза будет уменьшаться.
Концентрация соли. Равновесие в системе смещается вправо, в соответствии с принципом Ле
Шателье, но степень гидролиза уменьшается.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в
растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к
смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза
протекает с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в
сторону протекания этой реакции, вправо, степень гидролиза возрастает. К этому же выводу
придем из рассмотрения константы гидролиза.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти
вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата
меди раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать
с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье,
равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору
добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы
ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в
практически нерастворимый сульфид меди.
26. Электронная структура атомов. s -, p -, d -, f - электронные семейства атомов.
s, p, d, f— первые буквы английских слов, использованных для названия спектральных линий:
sharp (резкий), principal (главный), diffuse (диффузный), fundamental (основной). Обозначения
других орбиталей приведены в алфавитном порядке: g, h...
Принцип Паули: «В атоме не может быть двух электронов, у которых все четыре квантовых
числа были бы одинаковыми». Из этого следует, что каждая атомная орбиталь, характеризующаяся
определенными значениями n, l и m, может быть занята не более чем двумя электронами, спины
которых имеют противоположные знаки. Два таких электрона, находящиеся на одной орбитали и
обладающие противоположно направленными спинами, называются спаренными, в отличие от
одиночного электрона, занимающую орбиталь.
При l = 0, т.е. на s-подуровне, магнитное квантовое число тоже равно 0. Следовательно, на s-
подуровне имеется всего одна орбиталь. Максимальное число электронов на s-подуровне
каждого электронного слоя равно 2. При l = 1 (p-подуровень) возможны уже три различных
значения магнитного квантового числа (−1, 0, +1). Следовательно, на p-подуровне имеется три
орбитали, каждая из которых может быть занята не более чем двумя электронами. Всего на p-
подуровне может разместиться 6 электронов.
Подуровень d (l = 2) состоит из пяти орбиталей, соответствующих пяти разным значениям m;
здесь максимальное число электронов равно 10.
На f-подуровне (l = 3) может размещаться 14 электронов; вообще максимальное число
электронов на подуровне с орбитальным квантовым числом l равно 2(2l +1).
МАКСИМАЛЬНОЕ ЧИСЛО ЭЛЕКТРОНОВ НА АТОМНЫХ ЭНЕРГЕТИЧЕСКИХ УРОВНЯХ И ПОУРОВНЯХ.
Энергетически
й уровень
Энергетически
й подуровень
Возможные
значения
магнитного
квантового
числа m
Число орбиталей
Максимальное число
электронов
в
подуровне
в уровне
на
подуровне
на уровне
K(n = 1) s(l = 0) 0 1 1 2 2
L(n = 2)
s(l = 0)
p(l = 1)
0
−1, 0, +1
1
3
4
2
6
8
M(n = 3)
s(l = 0)
p(l = 1)
d(l = 2)
0
−1, 0, +1
−2, −1, 0,
+1, +2
1
3
5
9
2
6
10
18
N(n = 4) s(l = 0)
p(l = 1)
d(l = 2)
0
−1, 0, +1
−2, −1, 0,
1
3
5
16 2
6
10
32
14
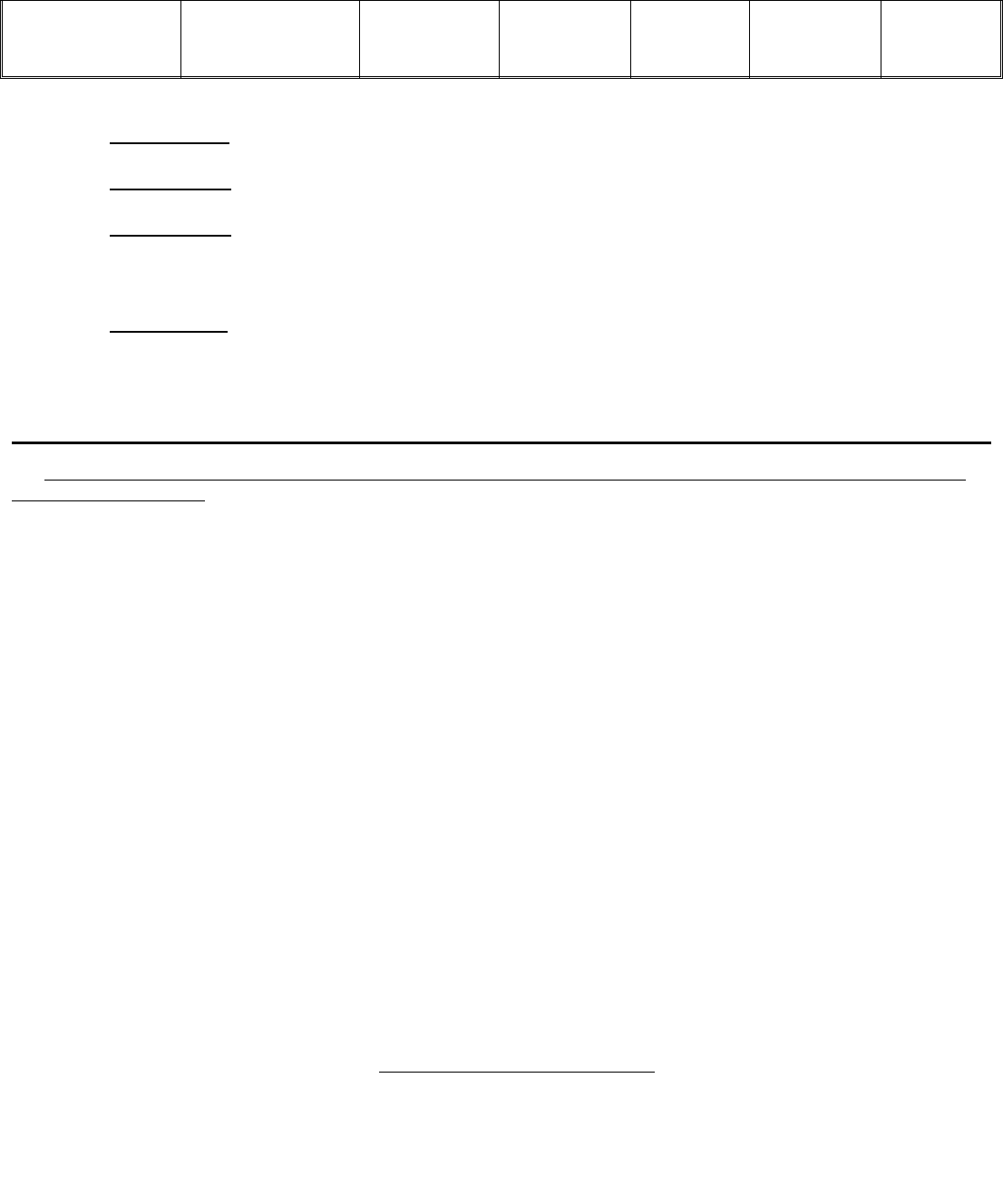
f(l = 3)
+1, +2
−3, −2, −1,
0,+1, +2, +3
7 14
В зависимости от того, какой подуровень последним заполняется электронами, все элементы
делятся на 4 типа (семейства).
1) s -Элементы : заполняются электронами s-подуровень внешнего уровня. К ним относятся
первые два элемента каждого периода.
2) p -Элементы : заполняется электронами p-подуровень внешнего уровня. Это последние 6
элементов каждого периода (кроме первого и седьмого).
3) d -Элементы : заполняется электронами d-подуровень второго снаружи уровня, а на
внешнем уровне остается один или два электрона (у Pb – ноль). К ним относятся
элементы вставных декад больших периодов, расположенных между s- и р-элементами
(их также называют переходными элементами).
4) f -Элементы : заполняется электронами f-подуровень третьего снаружи уровня, а на
внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, p-элементов 30, d-элементов 35, f-элементов 28.
Элементы одного типа имеют ряд общих химических свойств.
27. Растворимость. Растворение газов, жидкостей и твердых тел. Физико-химическая
теория растворов.
Р а с т в о р и м о с т ь ю называется способность вещества растворяться в том или ином
растворителе. М е р ой р а с т в о р и м о с т и ве щ е с тв а п р и д а н н ы х у с ло в и я х с л у ж и т
с о д е р ж а н и е е г о в н а с ы щ е н н о м р а с т в ор е . Поэтому численно растворимость может быть
выражена теми же способами, что и состав, например, процентным отношением массы
растворенного вещества к массе насыщенного раствора или количеством растворенного вещества,
содержащимся в 1 литре насыщенного раствора. Часто растворимость выражают также числом
единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы
растворителя; иногда выраженную этим способом растворимость называют коэффициентом
растворимости.
Вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше
растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные – в
неполярных растворителях (бензол, сероуглерод).
Процесс растворимости избирательный и зависит от природы веществ и термодинамических
условий (давления, температуры).
Насыщенным называется раствор, находящийся в равновесии с растворимым веществом в
виде отдельной фазы.
Константой растворимости называется количество гр вещества, образующее насыщенный
раствор в 100 гр растворителя при данных условиях.
По растворимости вещества разделяют на:
- хорошо растворимые (в 100 гр растворителя содержится больше 1 гр вещества)
- малорастворимые (в 100 гр растворителя содержится больше 1∙10
−3
гр)
- практически нерастворимые (в 100 гр растворителя содержится меньше 10
−3
гр)
Абсолютно нерастворимых веществ нет.
При растворении веществ всегда происходит выделение или поглощение тепла. Количество
теплоты, выделяющейся или поглощающейся при растворении 1 моль вещества называется
теплотой растворения.
РАСТВОРЕНИЕ ТВЕРДЫХ ТЕЛ:
Растворение большинства твердых тел сопровождается поглощением теплоты. Это объясняется
затратой количества энергии на разрушение кристаллической решетки твердого тела, что обычно
не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его
насыщенным раствором
Q. растворНасыщенльРастворитеКристал
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии,
повышение температуры должно приводить к увеличению его растворимости. Если же, энергия
гидратации (сольватации) достаточно велика, чтобы образование раствора сопровождалось
выделением энергии, растворимость с ростом температуры понижается. Это происходит,
например, при растворении в воде щелочей, многих солей лития, магния, алюминия.
При растворении твердых тел в воде объем системы обычно изменяется незначительно.
Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от
давления.
15

РАСТВОРЕНИЕ ЖИДКОСТЕЙ:
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы
одна в другой, т.е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода,
другие – взаимно растворяются лишь до известного предела.
Температура, при которой ограниченная взаимная растворимость жидкостей переходит в
неограниченную, называется к ри т и ч е с к о й тем п е р а т у р о й р а с т в о р е н и я .
Как и в случае растворения твердых тел, взаимное растворение жидкостей обычно не
сопровождается значительным изменением объема. Поэтому взаимная растворимость жидкостей
мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (порядка тысяч
атмосфер).
Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещество,
способное растворяться в каждой из этих жидкостей, то растворенное вещество будет
распределяться между обеими жидкостями пропорционально своей растворимости в каждой из
них.
Закон распределения: «Вещество, способное растворяться в двух несмешивающихся
растворителях, распределяется между ними так, что отношение его концентраций в этих
растворителях при постоянной температуре остается постоянным, независимо от общего
количества растворенного вещества»:
K
C
C
2
1
Здесь C
1
и C
2
– концентрации растворенного вещества в первом и втором растворителях; K –
коэффициент распределения.
РАСТВОРЕНИЕ ГАЗОВ:
При увеличении давления, растворимость газа в жидкости увеличивается. По правилу Генри
масса растворенного газа прямо пропорциональна давлению.
)().( ДавлениеГенрипостоянг
PkC
,
Постоянная Генри зависит от температуры, природы газа и растворителя. Объем растворенного
газа не зависит от давления.
При повышении температуры растворимость газа в жидкости понижается.
Растворение является сложным Физико-химическим процессом. Если растворителем является
вода, то процесс растворения называется гидратацией и образуются кристаллогидраты.
Процесс растворения происходит в три стадии:
1) Разрушается связь между молекулами и атомами растворенного вещества и
растворителя. Затрачивается энергия – Q
2) Происходит сольватация, процесс которой сопровождается выделением тепла + Q
3) Диффузия (Сольватирующие частицы равномерно распределяются по всему объему).
Происходит поглощение тепла – Q.
28. Заполнение атомных орбиталей в атомах с возрастанием порядкового номера
элемента (правило Клечковского).
Последовательность заполнения атомных электронных орбиталей в зависимости от значений
главного и орбитального квантовых чисел была исследована советским ученым В.М. Клечковским,
который установил, что энергия электрона возрастает по мере увеличения суммы этих двух
квантовых чисел, т.е. величины (n + l).
Первое правило Клечковского: «П р и у в е ли ч е н и и з а р я да а т о м а п о с л е д о ва т е л ь н о е
з а п о л н е н и е э л е к т р о н н ы х о р бит а л е й п р о и с х о д и т о т о р би т а л е й с м ен ь ш и м з н а ч е н и е м
с у м м ы г л а вн о г о и о р б и т а л ь н о г о к в а н т о в ы х ч и с е л к ор б и т а л ям с б о л ь ш им з н а ч е н и е м
э т о й с у м м ы ».
Второе правило Клечковского: «П р и о д и на к о в ы х з н а ч е н и я х с у м м ы ( n + l ) з а п о л н е н и е
о р б и т а л е й пр о и с х о д и т по с л е д о в а т е ль н о в н а п р а в л е н и и в о з р а с т а н и я з н а ч е н и я
г л а в н о г о к в а н т о в о г о ч и с л а n ».
29. Давление пара над жидкостью. Первый закон Рауля.
При данной температуре давление насыщенного пара над каждой жидкостью – величина
постоянная. При растворении в жидкости какого-либо вещества давление насыщенного пара этой
жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором
всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими
величинами называют понижением давления пара над раствором. Отношение величины этого
понижения к давлению насыщенного пара над чистым растворителем называется относительным
понижением давления пара над раствором, выражается дробью:
16

0
0
)(
p
pp
,
где р
0
– давление насыщенного пара растворителя над чистым растворителем; р – давление
насыщенного пара растворителя над раствором.
Первый закон Рауля: «О тно с и т е л ь н о е по н и ж е н и е д а в л е н и я н а сы щ е н н о го п а р а
р а с т в о р и т е л я н а д р а с т в о р о м р а в н о м о л я р но й д о л е р а с тв о р е н н о г о в е щ е с т в а ».
A
x
p
pp
)(
0
,
где x
А
– молярная доля растворенного вещества А.
30. Ядерная модель строения атома. Атомные ядра, их состав. Изотопы, изобары.
Ядерная модель атома (Резерфорд, 1911): Атом состоит из положительно заряженного ядра, в
котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него
электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом
электронов, поэтому атом в целом электронейтрален. Возникающая вследствие вращения
электронов центробежная сила уравновешивается силой электростатического притяжения
электронов к противоположно заряженному ядру. Размеры ядра очень малы по сравнению с
размерами атома в целом: диаметр атома – величина порядка 10
-8
см, а диаметр ядра – порядка 10
-13
– 10
-12
см.
Чем больше заряд атомного ядра, чем сильнее будет отталкиваться от него α-частица, тем чаще
будут встречаться случаи сильных отклонений α-частиц, проходящие через слои металла, от
первоначального направления движения. Поэтому опыты по рассеянию α-частиц дают возможность
не только обнаружить существования атомного ядра, но и определить его заряд. Из опытов
Резерфорда следовало, что заряд ядра (выраженный в единицах заряда электрона) численно
равен порядковому номеру элемента в периодической системе.
Изото́пы — разновидности атомов (и ядер) одного химического элемента с разным количеством
нейтронов в ядре. Химические свойства атома зависят практически только от строения
электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть
количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного
числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра,
отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к
которому он относится, с добавлением верхнего левого индекса, означающего массовое число
(например,
12
C,
222
Rn). Можно также написать название элемента с добавлением через дефис
массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные
собственные названия (например, дейтерий, актинон).
Изоба́ры — нуклиды, имеющие одинаковое массовое число; например, изобарами являются
40
Ar,
40
K,
40
Ca. Хотя массовое число (т.е. число нуклонов) A = N + Z в ядрах-изобарах одинаково,
числа протонов Z и нейтронов N различаются: Z
1
≠Z
2
, N
1
≠N
2
. Совокупность изотопов с одинаковым A,
но разным Z называют изобарической цепочкой. В то время как массовое число изобаров
одинаково, их атомные массы совпадают лишь приближённо. Зависимость атомной массы (или
избытка массы) от Z в изобарической цепочке показывает направление возможных бета-распадов.
Эта зависимость в первом приближении представляет собой параболу — сечение долины
стабильности плоскостью A=const.
31. Растворы сильных электролитов.
Полярные молекулы и кристаллы ионного типа образуют раствор, проводящий ток.
Электропроводность растворов электролитов создается направленным перемещением ионов
электрически заряженных частиц имеющих положительный катион или отрицательный анион
заряд.
Любой раствор электронейтрален.
Вещества, проводящие электрический ток расплавленном или растворенном состоянии
называются электролитами. Процесс распада вещества на ионы называется электролитической
диссоциацией.
Теорию электролитической диссоциации была выдвинута Каблуковым и Кистяковским.
За счет диполь-дипольного ориентационного и диполь-ионного взаимодействия молекулы
растворителя притягиваются к полярным молекулам растворенного вещества или кристалл-
ионного типа и происходит поляризация-ионизация, а затем диссоциация веществ. Перед
диссоциацией обязательно наблюдается сольватация (гидратация частиц).
В том случае если энергия кристаллической решетки больше энергии гидратации, то не
происходит растворение веществ.
В водных растворах сильные электролиты обычно полностью диссоциированы. Поэтому число
ионов в них больше, чем в растворах слабых электролитах той же концентрации. И если в
17

растворах слабых электролитов концентрация ионов мала, расстояния между ними велики и
взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах
сильных электролитов среднее расстояние между ионами вследствие значительной концентрации
сравнимо мало. При этом силы межионного притяжения и отталкивания довольно велики. В таких
растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу.
Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно
заряженных ионов, получившим название «ионной атмосферы».
На процесс электролитической диссоциации влияет диэлектрическая проницаемость
растворителя (ξ). Чем больше ξ, тем в большей степени ослабляются связи между ионами
электролита.
2
21
r
ll
F
32. Квантовые числа: главное, орбитальное, магнитное, спиновое.
Главное квантовое число n.
Энергия электрона величина квантовая. В о з м о ж н ы е э н е р г е т и ч е с к и е с о с т о я н и я
э л е к т р о н а о п р е д е л я ю т с я в е л и ч и н о й г л а в н о г о к в а н т о в о г о ч и с л а n , к о т о р о е м о ж е т
п р и н и м а т ь по л о ж и т е л ь ны е ц е л о ч и с ле н н ы е з н а ч е н и я : 1, 2 , 3 … и т. д . Наименьшей
энергией электрон обладает при n = 1; с увеличением n энергия электрона возрастает. Поэтому
состояние электрона, характеризующееся определенным значением главного квантового числа,
принято называть э н ер г е т и че с к и м у р о в не м электрона в атоме: при n = 1 электрон находится на
первом энергетическом уровне, при n = 2 – на втором и т.д.
Г л а в н о е к ва н т о в о е ч и с л о о п р е д е л я е т и р а з м е р ы э л е к тр о н н о го о б ла к а . Для того
чтобы увеличить размеры электронного облака, нужно часть его удалить на большее расстояние от
ядра. Этому препятствуют силы электростатического притяжения электрона к ядру, преодоление
которых требует затраты энергия. Поэтому большим размером электронного облака соответствует
более высокая энергия электрона в атоме и, следовательно, большее значение главного
квантового числа n. Электроны же, характеризующиеся одним и тем же значением главного
квантового числа, образуют в атоме электронные облака приблизительно одинаковых размеров;
поэтому можно говорить о существовании в атоме э л е к т р о н н ы х с л о е в или э л е к т р о н н ы х
о б о л оч е к , отвечающих определенным значениям главного квантового числа.
Для энергетических уровней электрона в атоме (т.е. для электронных слоев, или оболочек),
соответствующих различным значениям n, приняты следующие буквенные значения:
Главное квантовое число n 1 2 3 4 5 6 7
Обозначение энергетического уровня K L M N O P Q
Орбитальное квантовое число l.
Ф о р м а э л е кт р о н н ы х о б л а к о в оп р е д е ляе т с я о р б и т а л ь н ы м к в а н т о в ы м ч и с л о м l ,
к о т о ро е м о ж е т п р и н и м а ть ц е л о ч и с л е н н ы е з н а ч е н и я о т 0 д о (n − 1 ) , г д е n – г л а в н о е
к в а н то в о е ч и с л о . Различным значениям n отвечает разное число возможных значений l. Так, при
n = 1 возможно только одно значение орбитального квантового числа – ноль (l = 0), при n = 2 l
может быть равным 0 или 1, при n = 3 возможны значения l, равные 0, 1 и 2, данному значению
главного квантового числа n соответствуют n различных возможных значений орбитального
квантового числа.
Энергия электрона в атоме зависит от главного квантового числа. В атоме водорода энергия
электрона полностью определяется значением n. Однако, в многоэлектронных атомах энергия
электрона зависит и от значения орбитального квантового числа. Поэтому состояния электрона,
характеризующиеся различными значениями l, принято называть энергетическими подуровнями
электрона в атоме. Этим подуровням присвоены следующие буквенные значения:
Орбитальное главное число 1 2 3 4
Обозначение энергетического подуровня s p d f
В соответствии с этими обозначениями говорят об s-подуровне, p-подуровне и т.д. Электроны,
характеризующиеся значениями побочного квантового числа 0, 1, 2 и 3, называют соответственно
s-электронами, p-электронами, d-электронами и f-электронами. При данном значении главного
квантового числа наименьшей энергией обладают s-электроны, затем p-, d- и f-электроны.
Состояние электрона в атоме, отвечающее
определенным значениям n и l, записывается
следующим образом: сначала цифрой указывается
значение главного квантового числа, а затем буквой –
орбитального квантового числа. Так, обозначение 2p
18

относится к электрону, у которого n = 2 и l = 1, обозначение 3d – к электрону, у которого n = 3 и l =
2.
Магнитное квантовое число m.
Из уравнения Шредингера следует, что о ри е н т а ци я э л е к т р о н н о г о о б л а к а в
п р о с т р а н с т ве н е м о ж е т б ы т ь п р о и з в о л ь н о й : о на о п р е де л я е т с я з н а ч е н и е м т р е тье г о ,
т а к н а з ы в ае м о г о м а г н и т н о г о к в а н т о в о г о ч и с л а m .
Магнитное квантовое число может принимать любые
целочисленные значения – как положительные, так и отрицательные –
в пределах от +l до −l. Таким образом, для разных значений l число
возможных значений m различно. Так, для s-электронов (l = 0)
возможно только одно значение m (m = 0); для p-электронов (l = 1)
возможны три различных значения m (−1, 0, +1); при l = 2 (d-
электроны) m может принимать пять различных значений (−2, −1, 0,
+1, +2). Вообще, некоторому значению l соответствует (2l + 1)
возможных значений магнитного квантового числа, т.е. (2l + 1)
возможных расположений электронного облака в пространстве.
С о с т о я н и е эл е к т р о н а в а т о м е , х а р а к т е р и з у ю щ и е с я о п р е д е л е н н ы м и з н а ч е н и я м и
к в а н то в ы х ч и с е л n , l и m , т. е . о пр е д е ле н н ы м и р а з ме р а м и , ф о р м ой и ор и е н т а ц и е й в
п р о с т р а н с т ве э л е к т р о н но г о о б л а к а , п о л у чи л о н а з в а н ие а т о м н о й э л е к т р о н н о й
о р б и т а л и .
Спиновое квантовое число s.
Электрон характеризуется еще одной квантованной величиной, не связанной с движением
электрона вокруг ядра, а о п р е д е л я ю щ е й е го с о б с т в е н н о е с о с т о я н и е . Эта величина получила
н а з в а н и е с п и н о в о г о к в а н т о в о го ч и с л а и ли п р о с то с п и на ( s p i n – к р у ч е н ие , в ра щ е н и е ) .
Спин электрона может иметь только два значения: + ½ или −½; таким образом, как и в случае
остальных квантовых чисел, возможные значения спинового квантового числа различаются на
единицу.
33. Общее понятие о растворах. Способы выражения концентрации раствора: моляльность,
массовая доя, титр.
Р а с т в о р о м называется твердая или жидкая гомогенная система, состоящая из двух или
более компонентов (составных частей), относительные количества которых могут изменяться в
широких пределах.
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти
вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот
компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный
раствор (например, в случае водного раствора соли растворителем, конечно, является вода). Если
же оба компонента до растворения находились в одинаковом агрегатном состоянии (например,
спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Отличие растворов от химических соединений состоит в том, что состав раствора может
изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие
свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям, но от последних они
резко отличаются своей однородностью. Таким образом, растворы занимают промежуточное
положение между механическими смесями и химическими соединениями.
М о л я л ь н о с т ь – отношение количества растворенного вещества к массе растворителя;
показывает количество молей вещества, приходящихся на 1 кг растворителя. Моляльность
раствора в отличие от его молярности не изменяется при изменении температуры.
gM
m
C
m
1000
,
где m – масса растворенного вещества; M – молярная масса растворенного вещества; g – масса
растворителя.
М а с с о в а я д о л я – отношение массы растворенного вещества к массе всего раствора
%100
.
раствора
вавраств
m
m
,
Т и т р – показывает граммовое содержание вещества 1 мл раствора.
млг
MC
T
m
/
1000
млг
ЭC
T
Н
/
1000
млгT /
100
19

34. Гидролиз солей, образованных сильным основанием и слабой кислотой.
Если поляризующая активность аниона превосходит поляризующее действие катиона, имеет
место гидролиз по аниону. Соли в этом случае образованы сильным основанием и слабой кислотой:
Например, гидролиз соли К
2
СО
3
:
I ступень
К
2
СО
3
+ Н
2
О
КНСО
з
+ КОН
или сокращенное ионно-молекулярное уравнение
СО
3
2-
+ Н
2
О
НСО
3
-
+ ОН
-
II ступень
КНСО
3
+ Н
2
О
Н
2
СО
3
+ КОН
или сокращенное ионно-молекулярное уравнение
НСОз + Н
2
О
Н
2
СО
3
+ ОН
-
Ясно, что гидролиз по аниону приводит к появлению избытка ионов ОН
-
, т.е. раствор становится
щелочным (рН > 7).
35. Осмос. Осмотическое давление.
О
́
смос— процесс односторонней диффузии, возникающая при наличии полупроницаемой
перегородки, которая пропускает через себя молекулы растворителя, на не пропускает молекулы
растворенного вещества.
Осмотическое давление – внутреннее давление растворенного вещества, численно равное
тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от
температуры и концентрации, но не зависит ни от природы растворенного вещества, ни от
природы растворителя. Эту зависимость Вант Гофф уподобил поведению идеального газа (1886):
cRTP
,
где P – осмотичекое давление раствора, кПа; с – его молярная концентрация (молярность),
моль/л; R – универсальная газовая постоянная, 8.314 Дж/(моль∙К); Т – абсолютная температура
раствора, К.
Это уравнение позволяет по величине осмотического давления определить молярную массу (а
значит, и относительную молекулярную массу), растворенного вещества:
VM
mRT
P
,
где m – масса растворенного вещества, кг; V – объем раствора, л; M – молярная масса, кг/моль.
36. Сильные электролиты.
Сильные электролиты – вещества, которые в растворе практически полностью
диссоциированы на ионы.
К сильным электролитам относятся:
1) почти все соли;
2) многие минеральные кислоты, например H
2
SO
4
, HNO
3
, HCl, HB
r
, HI, HMnO
4
, HClO
3
,
HClO
4
;
3) основания щелочных и щелочно-земельных металлов.
Диссоциация сильного электролита, например NaCl, обычно изображается уравнением
NaCl
Na
+
+ Cl
-
В кристалле хлорида натрия отсутствуют молекулы NaCl. При растворении кристаллическая
структура разрушается, гидратированных ионы переходят в раствор. Молекулы в растворе также
отсутствуют. Поэтому о недиссоциированных молекулах в растворах сильных электролитов можно
говорить лишь условно. Их скорее можно представлять как ионные пары: (Na
+
Cl
-
), т.е. находящиеся
близко друг около друга противоположно заряженные ионы (сблизившиеся до расстояния, равного
сумме радиусов ионов). Это якобы недиссоциированные молекулы или, как их называют,
квазимолекулы. Тогда уравнение реакции следовало бы записать так:
Na
+
Cl
-
(тв.)
Na
+
(водн.) + Cl
-
(водн.)
Под символом (Na
+
Cl
-
) понимая ионную пару (квазимолекулу). Концентрация квазимолекул в
растворе всегда очень мала, а концентрация ионов велика.
Увеличение числа частиц в сильном электролите приводит к их взаимодействию. Подвижность
ионов в сильных электролитах затруднена, и это проявляется в кажущимся уменьшении его
20
