Батуев Б.Б., Матханова В.Э., Аюрова О.Б. Техническая термодинамика. Методические указания и контрольные задания
Подождите немного. Документ загружается.

Министерство образования Российской Федерации
Восточно-Сибирский государственный технологический
университет
Кафедра «Теплогазоснабжения, вентиляции и
теплотехники»
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Методические указания и контрольные задания для
студентов-заочников специальности
«Тепловые электрические станции»
Составители: Батуев Б.Б.
Матханова В.Э.
Аюрова О.Б.
Улан-Удэ,2003
ОБЩИЕ УКАЗАНИЯ
ВВЕДЕНИЕ
Предмет «Техническая термодинамика» и сле-
дующий за ним предмет «Тепломассообмен» являются тео-
ретическим фундаментом теплотехники. На базе дис-
циплин осуществляются расчеты и проектирование тепло-
вых двигателей , компрессоров , сушильных и холодильных
установок, теплогенераторов, теплообменников и др. Зна-
ние материала этих дисциплин позволяет технически гра-
мотно эксплуатировать указанное оборудование и осущест-
влять мероприятия по повышению его экономических пока-
зателей.
При изучении указанных предметов рекомендуется
обратить внимание на основные направления развития те-
плоэнергетики в .нашей стране и за рубежом, на вклад оте-
чественных ученых и инженерно-технических работни-
ков в формирование технической термодинамики и тео-
рии тепло- и массообмена.
СОДЕРЖАНИЕ КУРСА
Техническая термодинамика рассматривает вопросы
взаимного превращения тепловой и механической энергии,
в том числе наиболее эффективные условия осуществления
этих превращений. Кроме того, в курсе технической термо-
динамики изучаются свойства рабочих тел, участвующих в
энергетических преобразованиях, и способы определения
(расчета) термодинамических параметров состояния рабо-
чих тел.
В качестве рабочего тела в технической термодинами-
ке выступает вещество в газообразном и парообразном со-
стоянии. Следует разобраться в понятиях – идеальный газ и
реальный газ.
Основные параметры состояния рабочего тела (абсо-
лютное удельное давление (р), удельный объем (V) и абсо-
лютная температура (Т) связаны уравнением состояния.
Уравнением состояния идеального газа является уравнение
Клапейрона, которое может быть записано для 1 кг вещест-
ва или для произвольного его количества. Уравнение со-
стояния идеального газа для киломоля вещества предложе-
но Менделеевым. Примером уравнения состояния реально-
го газа является уравнение Ван-дер-Ваальса.
Уравнение состояния рабочего тела, кроме основных
его параметров, включает также газовую постоянную. Раз-
личают газовую постоянную 1 кг вещества (R) и газовую
постоянную киломоля вещества – универсальную газовую
постоянную (μR) . Необходимо знать физический смысл R и
μR, а также связь между ними.
Основные положения технической термодинамики
рассматриваются на примере идеального газа.
Поскольку в тепловых машинах и аппаратах весьма
часто в качестве рабочего тела выступают смеси газов (на-
пример, газообразные топливно-воздушные смеси, продук-
ты сгорания топлива и др.), курс знакомит с методами рас-
чета газовых смесей.
Приступая к изучению термодинамических процессов,
следует иметь в виду, что классическая термодинамика рас-
сматривает их как равновесные и обратимые.
При анализе термодинамических процессов (изохор-
ного, изобарного, изотермического, адиабатного и обоб-
щенного политропного процессов) прежде всего выясняют
закономерности изменения основных параметров состояния
рабочего тела (р, V и Т), а также количество тепла (q), под-
веденное к рабочему телу ( или отведенное от него) в ходе
процесса, работу (l ) расширения (или сжатия) рабочего те-
ла, изменение внутренней энергии рабочего тела (ΔU=U
2
–
U
1
) в процессе, изменение энтальпии (Δh = h
2
– h
1
) и изме-
нение энтропии (ΔS = S
2
- S
1
) в ходе процесса.
Для определения количества тепла, участвующего в
процессе, важно правильно использовать теплоемкость ра-
бочего тела. Вещества, находящиеся в газообразном состоя-
нии, характеризуются массовой (с), объемной (с′) и мольной
(μс) теплоемкостями. Необходимо понять зависимость теп-
лоемкости рабочего тела от физической природы вещества,
от температуры и от характера термодинамического про-
цесса, в котором рабочее тело участвует. Необходимо нау-
читься пользоваться таблицами теплоемкостей газов, а так-
же владеть приемом выбора теплоемкости как величины,
независимой от температуры. Следует освоить формулы
для расчета теплоемкости рабочего тела в политропном
процессе и формулы определения теплоемкостей газовых
смесей.
В курсе дан вывод формулы для определения работы,
выполняемой рабочим телом при расширении или затрачи-
ваемой на его сжатие.
Следует обратить внимание, что при изображении
термодинамического процесса в координатах p-V площадь
между линией процесса и осью абсцисс дает графическое
изображение работы 1 кг рабочего тела в этом процессе –
работы расширения (если V
2
> V
1
) и работы сжатия (если V
2
< V
1
). При изображении термодинамического процесса в
координатах T-S площадь между линией процесса и осью
абсцисс дает графическое изображение тепла, участвующе-
го в этом процессе, в расчете на 1 кг рабочего тела – тепла,
подводимого к рабочему телу (если S
2
> S
1
), или тепла, от-
водимого от рабочего тела (если S
2
< S
1
). При изучении кур-
са необходимо понять физический смысл энтальпии и эн-
тропии, которые также как P, V, Т и U являются параметра-
ми состояния рабочего тела, и освоить их использование в
расчетах термодинамических процессов. Введение этих па-
раметрических величин в курс дало возможность применить
для анализа термодинамических процессов диаграмму h-S,
которая нашла широкое признание в инженерной практике
(прежде всего для расчета процессов изменения состояния
водяного пара).
Курс технической термодинамики базируется на двух
принципиальных положениях – первом и втором законах
термодинамики.
Первый закон термодинамики отражает закон сохра-
нения и превращения энергии применительно к термоди-
намическому процессу. Он устанавливает эквивалентность
при взаимных превращениях механической и тепловой
энергии и количественное соотношение при переходе одно-
го вида энергии в другой.
Согласно первому закону термодинамики, нельзя по-
строить «вечный двигатель 1-го рода» , т.е. тепловую ма-
шину , которая бы совершала работу, не расходуя на это
никакой энергии.
Необходимо освоить и другие формулировки первого
закона термодинамики , которые сложились в период фор-
мирования изучаемой дисциплины.
Уравнение первого закона термодинамики является
энергетическим балансом рабочего тела, участвующего в
термодинамическом процессе. Оно может быть записано
(как для 1 кг вещества, так и для произвольного его количе-
ства) в форме, где связаны между собой количество тепла,
участвующее в процессе, работа, совершаемая рабочим те-
лом против внешних сил, и изменение внутренней энергии в
процессе, а также в форме , где связаны между собой коли-
чество тепла, изменение энтальпии и располагаемая работа.
Второй закон термодинамики определяет направле-
ние, в котором протекают термодинамические процессы,
устанавливает условия преобразования тепловой энергии в
механическую, а также определяет максимальное значение
работы, которая может быть произведена тепловым двига-
телем.
Согласно второму закону термодинамики нельзя соз-
дать «вечный двигатель 2-го рода», т.е. тепловую машину,
которая бы в течении длительного времени совершала не-
прерывную работу при условии перехода в «получаемую»
механическую энергию всего количества тепловой энергии,
подводимой для этой цели к рабочему телу.
Необходимо освоить и другие трактовки второго зако-
на термодинамики, которые сложились в период формиро-
вания изучаемой дисциплины. Следует также знать анали-
тическое выражение второго закона термодинамики.
Специальный раздел курса посвящен водяному пару.
Изучение его свойств и связанных с ним расчетов тем более
важно, что водяной пар используется как рабочее тело в те-
плосиловых установках, а также как теплоноситель в про-
мышленной теплотехнике.
Следует внимательно рассмотреть процесс парообра-
зования в координатах р-V и понять основные состояния
водяного пара – состояния влажного насыщенного пара, су-
хого насыщенного пара и перегретого пара. Нужно освоить
понятие степени сухости пара (х).
Для того, чтобы иметь возможность определять пара-
метры состояния водяного пара, очень важно научиться
пользоваться таблицами водяного пара – таблицами насы-
щенного пара и таблицами перегретого пара, которые
обычно приводятся в учебных пособиях по технической
термодинамике.
Термодинамические процессы водяного пара, в т.ч. и
связанные с изменением его агрегатного состояния, изуча-
ются в диаграммах р-V и Т-S. Необходимо понять характер
расположения на диаграммах, построенных для водяного
пара, пограничных кривых Х=0 и Х=1, соответственно ха-
рактеризующих состояние кипящей воды и сухого насы-
щенного пара, а также расположение точки критического
состояния водяного пара, выше которой (в указанных диа-
граммах) существование вещества в двухфазном состоянии
невозможно.
Практические задачи, связанные с расчетом водяного
пара, наглядно решаются в диаграмме h-S, на которой нане-
сена сетка изобар, изотерм, изохор и линий х=const, вклю-
чая Х=1. Следует иметь в виду, что для воды и водяного па-
ра начало расчета h и S принято от состояния вещества в
тройной точке, а внутреннюю энергию определяют по фор-
муле U=h-pV.
Диаграмма h-S водяного пара широко используется в
инженерной практике, поэтому освоение ее при изучении
курса нужно считать обязательным.
В теплотехнике многие расчеты связаны с влажным
воздухом, который представляет собой механическую смесь
сухого воздуха и водяного пара. В начале изучения свойств
влажного воздуха полезно рассмотреть возможные состоя-
ния водяного пара в воздухе в координатах р-V. Необходи-
мо понять, почему влажный воздух, несмотря на присутст-
вие в нем водяного пара, рассчитывается как идеальный газ.
Следует разобраться в понятиях влагосодержание воз-
духа (d), абсолютная влажность воздуха и относительная
влажность воздуха (ϕ). Важно понять, почему абсолютная
влажность воздуха выражается плотностью водяного пара,
содержащегося в нем.
Основные процессы изменения состояния влажного
воздуха, встречающиеся на практике, связаны с подводом
или отводом тепла при р=const, а также с повышением или
понижением его влагосодержания. Расчеты процессов из-
менения состояния влажного воздуха обычно осуществля-
ют, пользуясь диаграммой H-d. По диаграмме H-d для лю-
бого состояния влажного воздуха легко определить основ-
ные параметры, а также парциальное давление водяного па-
ра и значение температуры, при которой начинается кон-
денсация из воздуха излишней влаги (точку росы).
Диаграмма H-d влажного воздуха широко использует-
ся в инженерной практике, поэтому освоение ее при изуче-
нии курса следует считать обязательным.
В разделе курса, связанным с термодинамическими
преобразованиями в потоке газообразного рабочего тела,
рассматриваются вопросы истечения газов и паров из со-
пловых устройств, а также вопросы дросселирования.
При изучении процесса истечения газа (пара) следует
разобрать обоснование и методику определения скорости
истечения, расхода газа (пара) через сопло и размера рас-
четного сечения соплового устройства. Следует понять ха-
рактер истечения газа (пара) из простых (цилиндрических
или сужающихся) насадок, а также из комбинированного
соплового устройства (сопла Лаваля). Необходимо понять
условия, при которых скорость истечения газа (пара) из со-
пла и его расход ограничиваются пределом, равным скоро-
сти распределения звука в данной среде.
При рассмотрении процесса дросселирования (мятия)
газообразного рабочего тела следует усвоить, почему ито-
говым результатом этого процесса можно считать условие
h-const. Полезно обратить внимание на примеры явления
дросселирования, встречающиеся в инженерной практике.
Необходимо уметь выполнять расчеты истечения и
дросселирования водяного пара с помощью диаграммы h-S.
В курсе технической термодинамики подробно рас-
сматривается процесс сжатия газообразного рабочего тела в
поршневом компрессоре. При этом анализируется возмож-
ность и целесообразность сжатия идеального газа по изо-
терме, по адиабате и политропный процесс сжатия. Необхо-
димо разобрать процессы, связанные с работой компрессо-
ра, в индикаторной диаграмме (диаграмме в координатах р-
V) и понять причины, вызывающие необходимость созда-
ния многоступенчатых компрессоров. Необходимо освоить
методику определения мощности привода компрессора.
Следует познакомиться с особенностями работы центро-
бежного и осевого компрессоров.
Курс технической термодинамики показывает, что не-
прерывная работа тепловых машин должна осуществляться
на основе циклов, или круговых процессов, при осуществ-
лении которых параметры рабочего тела изменяются от
максимального значения до минимального, возвращаясь в
каждом цикле к первоначальному значению.
Циклы включают процессы расширения и сжатия ра-
бочего тела, процессы с подводом тепла и процессы с отво-
дом тепла. Процессы, из которых складываются циклы, в
теоретическом курсе рассматриваются как равновесные и
обратимые. Циклы, в которых работа расширения по абсо-
лютному значению больше работы, затрачиваемой на сжа-
тие, являются циклами тепловых двигателей (прямые цик-
лы). Циклы, в которых работа сжатия по абсолютной вели-
чине больше, чем работа расширения, являются циклами
холодильных машин или тепловых насосов (обратные цик-
лы).
Необходимо освоить графическое изображение пря-
мых и обратных циклов в координатах р-V и Т-S; понимать
значение площадей, получающихся при построении циклов
в этих координатах.
Необходимо разобрать принципиальные схемы тепло-
вых машин.
Следует разобрать прямой и обратный циклы Карно,
циклы двигателей внутреннего сгорания (ДВС) с подводом
тепла при р=const, с подводом тепла при V=const и при
комбинированном способе подвода тепла, циклы газотур-
бинных установок (ГТУ) при разных условиях подвода теп-
ла, цикл холодильной установки и теплового насоса.
Следует понять значение и способ определения тер-
мического КПД цикла теплового двигателя (η
t
). Необходи-
мо знать формулу для определения η
t
цикла Карно.
Следует детально разобрать теоретический цикл паро-
силовой установки – цикл Ренкина, в т.ч. графическое изо-
бражение его в координатах р-V и T-S, а также изображение
теоретического процесса расширения водяного пара в паро-
вой турбине в диаграмме h-S. Необходимо разобрать вывод
формул для определения термического КПД цикла пароси-
ловой установки и удельных расходов пара и тепла для вы-
работки единицы энергии при осуществлении энергетиче-
ского цикла. Следует рассмотреть основные способы по-
вышения тепловой эффективности цикла Ренкина.
Существенное значение при освоении этого материала
имеет рассмотрение принципиальных схем и тепловых ба-
лансов конденсационной теплоэлектростанции (ТЭС) и теп-
лоэлектроцентрали (ТЭЦ). Необходимо также понять ос-
новные принципы теплофикации.
При разборе цикла холодильной установки следует
освоить понятие холодильного коэффициента. При разборе
цикла теплового насоса следует освоить понятие отопи-
тельного коэффициента.
Литература :[1], [2], [3], [6], [7].
КОНТРОЛЬНЫЕ РАБОТЫ
При изучении курса «Техническая термодинамика»
студент должен выполнить две контрольные работы и отве-
тить письменно на четыре теоретических вопроса. Условия
задач и номера теоретических вопросов выбираются в соот-
ветствии с двумя последними цифрами учебного шифра
студента.
Первая контрольная работа состоит из шести задач,
содержание которых отражает материал важнейших разде-
лов курса; вторая контрольная работа посвящена расчету
термодинамических процессов водяного пара.
Предложенные задачи рекомендуется решать по мере
проработки соответствующих разделов курса. При решении
задач для всех исходных и итоговых величин, кроме отно-
сительных (безразмерных) величин, должны быть указаны
единицы измерения. Для проверки усвоенного материала
после решения задач необходимо письменно ответить на
все поставленные вопросы.
Контрольные работы должны быть аккуратно оформ-
лены в отдельной тетради, на обложке которой следует ука-
зать фамилию и инициалы студента, а также его учебный
шифр; на каждой странице тетради необходимо оставить
поля для пометок преподавателя.
Прием контрольных работ производится преподавате-
лем, ведущим данную дисциплину, после собеседования со
студентом по основным вопросам курса, связанным с вы-
полнением решенных задач.
ЗАДАНИЕ НА КОНТРОЛЬНУЮ РАБОТУ №1
Ответить письменно на вопросы , указанные в таблице 1.
Таблица 1
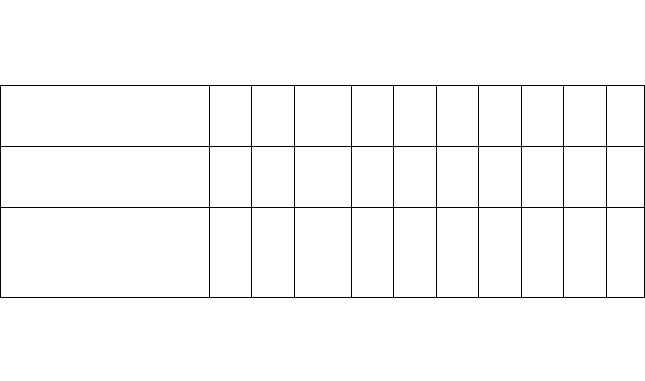
Последняя цифра
шифра
0 1 2 3 4 5 6 7 8 9
Номера вопросов 10
20
1
11
2
12
3
13
4
14
5
15
6
16
7
17
8
18
9
19
Номера вопросов
по предпоследней
цифре шифра
30
40
21
31
22
32
23
33
24
34
25
35
26
36
27
37
28
38
29
39
ВОПРОСЫ
1. Какие условия необходимо соблюдать, чтобы термо-
динамический процесс был обратимым ? Что является при-
чиной необратимости реальных термодинамических про-
цессов?
2. Почему внутреннюю энергию, энтальпию и энтро-
пию рабочего тела называют параметрами или функциями
состояния, а теплоту и работу функциями процесса?
3. В чем сущность 1-го закона термодинамики? Напи-
шите уравнение первого закона термодинамики, объясните
входящие в него величины.
4. В чем сущность второго закона термодинамики?
5. Приведите основные формулировки второго закона
термодинамики и дайте его аналитическое выражение для
обратимых и необратимых процессов. Покажите, что цикл
Карно является наивыгоднейшим в заданном интервале
температуры.
6. Покажите, что изохорный , изобарный, изотермиче-
ский и адиабатный процессы являются частными случаями
политропного процесса.
7. Пользуясь уравнениями первого закона термодина-
мики для потока и для закрытой системы, покажите за счет
чего совершаются все виды работы рабочего тела в потоке.
8. Для чего применяется сопло Лаваля? Изобразите
схематически это сопло. Как меняются давление и скорость
газа вдоль сопла?
9. Изобразите тепловой процесс в сопле Лаваля в hS –
диаграмме. Приведите уравнение для определения теорети-
ческой и действительной скоростей истечения.
10. Почему в сходящемся канале нельзя достичь скоро-
сти большей, чем местная скорость звука?
11. Приведите определение удельной массовой, объем-
ной и мольной теплоемкостей. Истинная и средняя теплоем-
кости. Напишите уравнение количества теплоты через сред-
нюю теплоемкость
12. Приведите уравнение работы в произвольном про-
цессе и покажите, что работа является функцией процесса.
13. Приведите определение идеального и реального газа.
Основные законы идеальных газов.
14. Приведите определение удельной газовой постоян-
ной и универсальной газовой постоянной, в каких единицах
они выражаются и физический смысл газовой постоянной.
15. Что такое теплоемкость при постоянном давлении и
теплоемкость при постоянном объеме? Почему теплоем-
кость газа при постоянном давлении больше теплоемкости
при постоянном объеме?
16. Изобразите в диаграммах РV и TS процесс парооб-
разования для водяного пара и объясните характерные об-
ласти, линии и точки, нанесенные на них.
17. Какие величины связывает между собой уравнение
Клапейрона – Клаузиуса?
18. Чем характерны критическая и тройная точки? Ка-
ковы значения их параметров для воды?
19. Какой пар называется сухим насыщенным? Изобра-
зите на диаграммах РV, TS и hS обратимый адиабатный
процесс расширения перегретого пара до состояния сухого
насыщенного пара. Дайте необходимые пояснения.
20. Изобразите на диаграммах РV, TS и hS изобарный
процесс нагревания влажного насыщенного водяного пара
до состояния перегретого пара. Дайте необходимые поясне-
ния .
21. Как изменяется теплота парообразования с увеличе-
нием давления? Как посчитать теплоту парообразования?
22. Изобразите теоретическую индикаторную диаграмму
поршневого компрессора для случая изотермического и
адиабатного сжатия. Покажите на ней площади, которыми
изображаются работы наполнения, сжатия и выталкивания.
Для чего применяется охлаждение компрессора ?
23. Изобразите идеальный цикл двигателя внутреннего
сгорания с изобарным подводом тепла в РV и TS диаграм-
мах. Отчего зависит к.п.д. этого цикла?
24. Изобразите идеальный цикл двигателя внутреннего
сгорания со смешанным подводом тепла в РV и TS диа-
граммах. Отчего зависит к.п.д. этого цикла?
25. Приведите принципиальную схему паросиловой ус-
тановки, работающей по циклу Ренкина, изобразите этот
цикл в координатах РV, TS и hS.
26. Как влияют начальные и конечные параметры на
термический КПД цикла Ренкина ?
27. Что такое промежуточный перегрев пара и для чего
он применяется? Приведите принципиальную схему этой
установки. Дайте необходимые пояснения?
28. Изобразите идеальный цикл двигателя внутреннего
сгорания с изохорным подводом тепла в РV и TS диаграм-
мах. Отчего зависит к.п.д. этого цикла.
29. Что называется теплофикацией? В чем ее преимуще-
ства перед раздельной выработкой тепловой и электриче-
ской энергии? Каким параметром оценивают экономичность
теплоэлектроцентрали?
30. Приведите принципиальную схему регенеративного
цикла паротурбинной установки. Дайте необходимые пояс-
нения .
31. Изобразите схему двухконтурной атомной тепло-
энергетической установки и объясните принцип ее действия.
В чем принципиальные отличия этой установки от обычных
паросиловых установок ?
32. Принцип работы теплового насоса.
33. Первый закон термодинамики для потока.
34. Цикл газотурбинной установки с подводом теплоты
при постоянном объеме.
35. Цикл газотурбинной установки с подводом теплоты
при постоянном давлении.
36. Сравнение циклов газотурбинных установок.
37. Сравнение циклов двигателей внутреннего сгорания.
38. Бинарный парогазовый цикл теплоэнергетической
установки.
39. Воздушная компрессионная холодильная установка.
40. Абсорбционная холодильная установка.
Задача №1. Расчет газовой смеси.
Газовая смесь состоит из нескольких компонентов, со-
держание которых в смеси задано в процентах по объему
(табл.2).
Определить: 1) кажущуюся молекулярную массу сме-
си; 2) газовую постоянную смеси; 3) средние мольную, объ-
емную и массовую теплоемкости смеси при постоянном
давлении в пределах температур от t
1
до t
2
( табл.3).
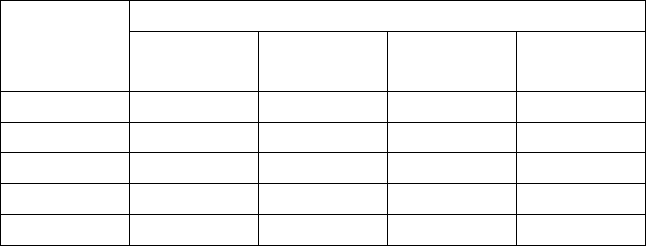
Таблица 2
Компоненты смеси, % по объему Последняя
цифра
шифра
СО
2
О
2
N
2
СО
1 2 3 4 5
1 20 15 65 -
2 18 14 68 -
3 14 13 73 -
4 10 12 78 -
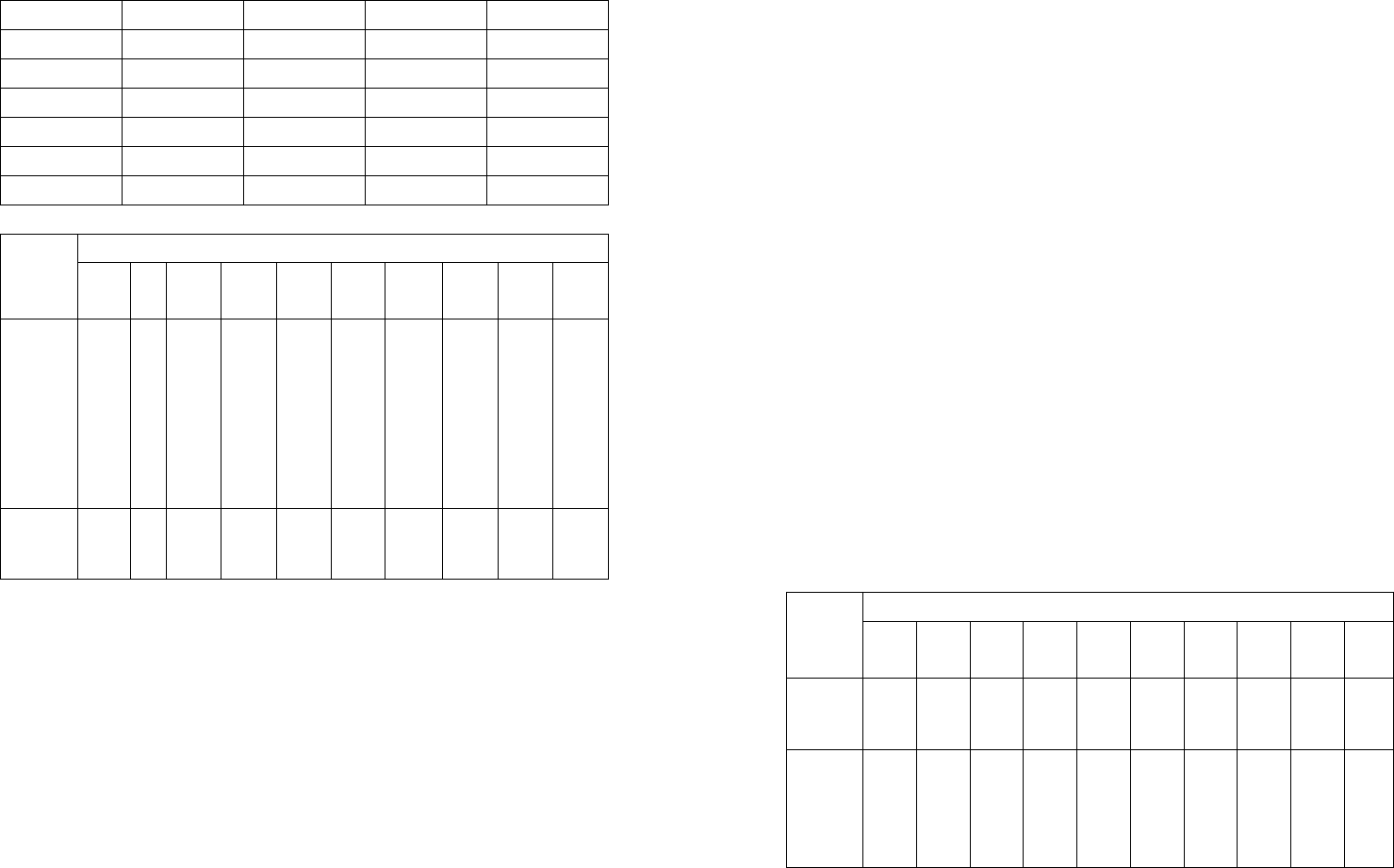
1 2 3 4 5
5 18 - 72 10
6 12 - 74 14
7 10 - 60 30
8 24 - 50 26
9 20 - 52 28
0 32 - 50 18
Таблица 3
Предпоследняя цифра шифра Пока-
зате-
ли
1 2 3 4 5 6 7 8 9 0
Тем-
пера-
тура
смеси
началь
ная
t
1
,
o
C
100 30 500 800 200 400 600 900 700 800
Ко-
нечная
t
2
,
o
C
500 90 1400 1200 1100 800 1300 1500 1600 1800
Значения средних мольных теплоемкостей компонен-
тов газовой смеси при постоянном давлении в пределах
температур от 0
0
С до t
o
C – см. Приложение (табл.3).
Ответить письменно на следующий вопрос:
Классификация теплоемкостей в зависимости от коли-
чественной единицы, температурного диапазона и термоди-
намического процесса.
Литература: [1,c.17-23]; [2, c.27-32, 62-73]; [3, c.12-23];
[4, c.30-38, 39-56]; [5, c.20-21]
Задача №2. Расчет политропного процесса сжатия
идеального газа.
Рабочее тело – азот (N
2
). Первоначальный объем, за-
нимаемый рабочим телом – V
1
(табл.4). Начальные парамет-
ры состояния рабочего тела: давление р
1
= 0,1 МПа, темпе-
ратура t
1
=27
о
С. Показатель политропы – n (табл.4). Темпе-
ратура рабочего тела в конце сжатия t
2
= 227
о
С.
Определить : 1) массу газа; 2) удельные объемы газа в
начале и конце сжатия; 3) полный объем, занимаемый газом
в конце процесса; 4) давление в конце процесса; 5) работу ,
затрачиваемую в процессе сжатия газа; 6) изменение внут-
ренней энергии рабочего тела в процессе; 7) массовую теп-
лоемкость газа в данном процессе; 8) количество теплоты в
процессе; 9) изменение энтропии в процессе.
Построить в масштабе рассмотренный процесс в коор-
динатах p-V и T-S.
При решении задачи теплоемкость рабочего тела счи-
тать постоянной, не зависимой от изменения температуры.
Приближенные значения мольных теплоемкостей идеаль-
ных газов при V=const и p=const - см Приложение (табл. 2 )
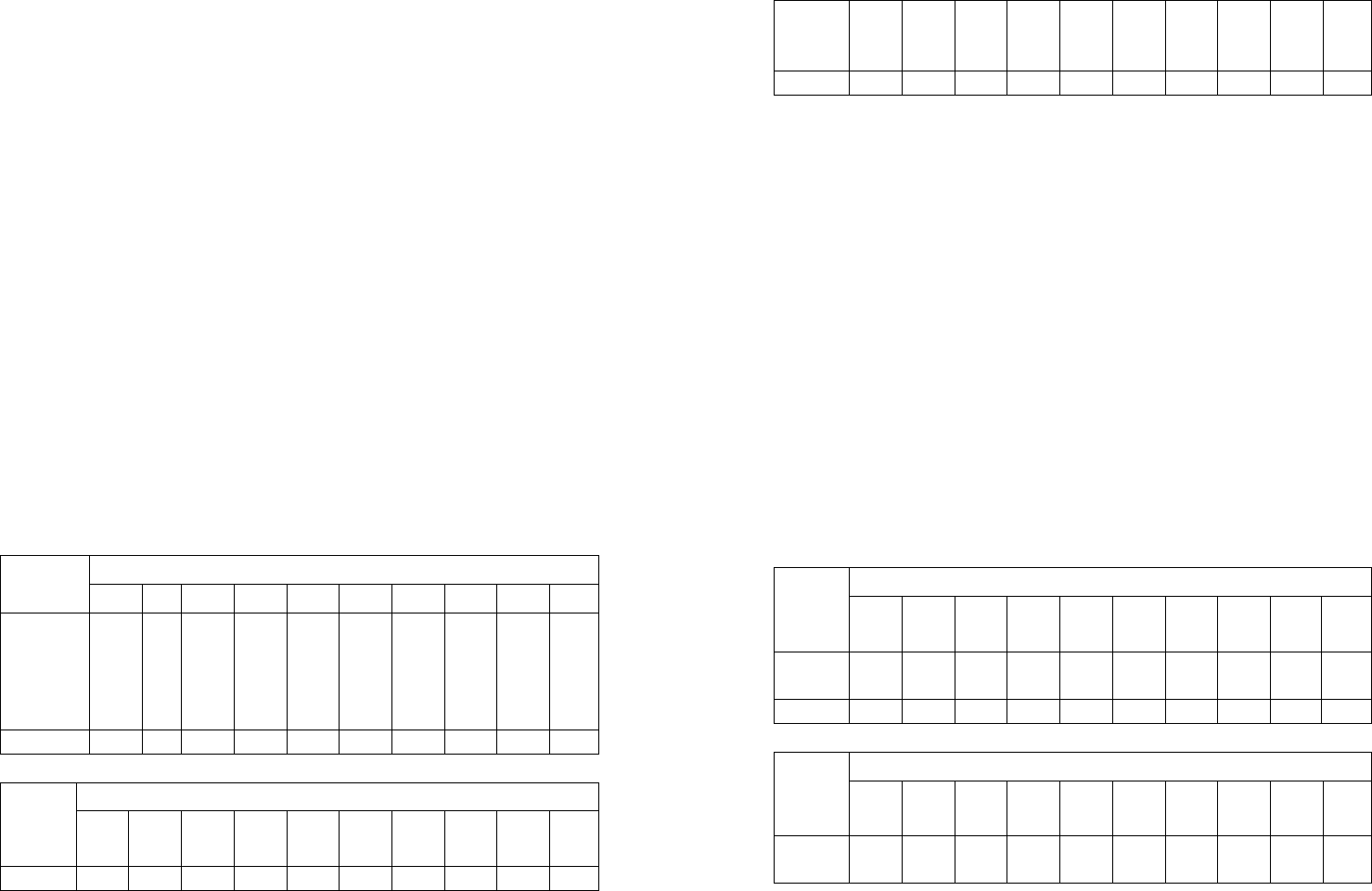
Таблица 4
Последняя цифра шифра Пока-
зате-
ли
1 2 3 4 5 6 7 8 9 0
Объем
газа
V
1
, м
3
5 10 15 20 25 30 35 40 45 50
Пока-
затель
полит-
ропы,
n
1,1 1,25 1,2 1,16 1,28 1,18 1,15 1,27 1,17 1,3
Ответить письменно на следующий вопрос:
Как выглядит уравнение первого закона термодинами-
ки применительно к рассмотренному в задаче процессу?
Литература: [1,c.210-215]; [2, c.56-57, 88-94]; [3, c.39-
49]; [4, c.57-61, 102-110]; [5, c.21-40]
Задача №3. Расчет цикла Карно применительно к
тепловому двигателю.
Рабочее тело – 1 кг сухого воздуха. Предельные тем-
пературы рабочего тела в цикле: наибольшая t
1
, наимень-
шая t
3
(табл. 5). Предельные давления рабочего тела в цикле:
наибольшее p
1
, наименьшее p
3
(табл.6) .
Определить: 1) основные параметры состояния рабо-
чего тела в характерных точках цикла; 2) количество тепла ,
подведенное в цикле; 3) количество тепла, отведенное в
цикле; 4) полезную работу , совершенную рабочим телом за
цикл; 5) термический КПД цикла; 6) изменения энтропии в
изотермических процессах цикла.
Построить цикл (в масштабе) в координатах p-V и T-S.
Таблица 5
Предпоследняя цифра шифра Пока-
затели
1 2 3 4 5 6 7 8 9 0
Темпе-
ратура
воздуха,
о
С
t
1
200 30
0
230 205 270 310 260 310 330 270
t
3
15 18 20 17 21 25 23 19 25 16
Таблица 6
Последняя цифра шифра Пока-
зате-
ли
1 2 3 4 5 6 7 8 9 0
Давле- 2 2,8 3 2,5 4 4,2 3,5 2,5 4,8 3
ние,
Мпа
Р
1
Р
3
0,16 0,1 0,15 0,12 0,12 0,1 0,11 0,13 0,14 0,17
Ответить письменно на следующий вопрос:
В каких диаграммах и какой площадью можно про-
иллюстрировать полезную работу, совершенную рабочим
телом в цикле, и количество полезной теплоты?
Литература: [1,c.51-60]; [2, c.99-101]; [3, с. 53-56]; [4,
c.136, 149-152]; [5, c.40-46]
Задача №4. Расчет цикла паротурбинной установ-
ки.
Паротурбинная установка работает по циклу Ренкина
с начальным давлением пара Р
1
и температурой t
1
(табл.7).
Давление пара в конденсаторе Р
2
(табл.8).
Определить: 1) параметры пара на входе и выходе из
турбины; 2) степень сухости пара на входе в конденсатор; 3)
удельный расход пара; 4) термический КПД цикла; 5) изо-
бразите цикл в РV-, TS- и hS – диаграммах.
Таблица 7
Предпоследняя цифра шифра Пока-
зате-
ли
1 2 3 4 5 6 7 8 9 0
Р
1
,
МПа
2,0 2,2 2,4 2,6 3,0 3,2 3,4 3,6 4,0 4.2
t
1
,
о
С 300 310 320 330 350 500 510 520 550 600
Таблица 8
Последняя цифра шифра Пока-
зате-
ли
1 2 3 4 5 6 7 8 9 0
Р
2
,
МПа
0,04 0,05 0,06 0,1 0,2 0,3 0,4 0,5 0,6 0,7
