Баранов В.В., Шахлевич Г.М., Телеш Е.В. Материаловедение (электронное). Практикум
Подождите немного. Документ загружается.


Министерство образования Республики Беларусь
Учреждение образования
«Белорусский государственный университет
информатики и радиоэлектроники»
Кафедра электронной техники и технологии
В.В. Баранов, Г.М. Шахлевич, Е.В. Телеш
МАТЕРИАЛОВЕДЕНИЕ
ПРАКТИКУМ
для студентов специальностей
«Проектирование и производство РЭС»,
«Электронно-оптическое аппаратостроение»,
«Медицинская электроника»
всех форм обучения
Минск 2004

УДК 620.22 (621.382)
ББК 32.85 я 73
Б 82
Баранов В.В.
Б82 Материаловедение: Практикум для студ. спец. “Проектирование и
производство РЭС”, “Электронно-оптическое аппаратостроение”,
“Медицинская электроника” всех форм обуч./ В.В.Баранов,
Г.М.Шахлевич, Е.В.Телеш. – Мн.: БГУИР, 2004.- 34 с.: ил.
ISBN 985-444-632-8
Практикум охватывает пять тем (химическая связь и строение вещества,
проводниковые, полупроводниковые, диэлектрические и магнитные материалы) в
соответствии с основными разделами курса «Материаловедение».
Предназначен для закрепления и углубления теоретических знаний, приобретения
практических навыков расчета основных функциональных характеристик
электрорадиотехнических материалов.
ISBN 985-444-632-8
© Баранов В.В., Шахлевич Г.М.,
Телеш Е.В., 2004
© БГУИР, 2004

СОДЕРЖАНИЕ
Тема 1. Химическая связь и строение вещества
Тема 2. Проводниковые материалы
Тема 3. Полупроводниковые материалы
Тема 4. Диэлектрические материалы
Тема 5. Магнитные материалы

Тема 1. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Необходимые теоретические сведения и расчетные формулы
Существует 4 основных вида химической связи: ионная (гетерополярная),
ковалентная (гомополярная), металлическая и молекулярная (ван-дер-
ваальсова). Первые три называются первичными, так как они относительно
прочные и возникают вследствие обмена или объединения валентных
электронов. Число находящихся в связи соседних ионов
называется
координационным числом.
Полная энергия ионной связи
,
2
21
n
i
a
b
a
eZZ
E +
⋅⋅
=
где Z
1
и Z
2
– заряды взаимодействующих ионов; a – расстояние между ними; b –
константа сил отталкивания; 6 < n < 12 (b и n определяются экспериментально).
Силы, возникающие между разноименно заряженными ионами,
.
12
2
21
+
−
⋅⋅
−==
n
a
b
n
a
eZZ
da
dE
F
В ионных бинарных соединениях устойчивы только кристаллические
решетки, в которых меньший по размеру катион окружен более крупными
катионами, т.е. координационное число зависит от соотношения их радиусов.
Ковалентная связь – направленная, т.к. образуется за счет спаривания
электронов соседних атомов. Координационное число в таких кристаллах
зависит также от валентности атомов.
Полное
кристаллографическое описание кристалла дают форма и
размеры элементарной ячейки, а также распределение в ней частиц вещества.
Элементарная ячейка строится на векторах элементарных трансляций а, b и с и
представляет собой наименьший объем кристалла, обладающий всеми его
свойствами. В общем случае ее характеризуют, кроме векторов а, b и с, три
угла между ними
α, β, γ.
Уравнение плоскости, пересекающей оси x, y, z кристаллической решетки
в точках u, v, w:
,
w
z
v
y
u
x
==
отсюда 1
=
⋅
+
⋅
+
⋅
zlykxh ,
где h, k, l – числа, обратные величине отрезков, отсекаемых плоскостью на
соответствующих осях, называемые индексами Миллера. Индексами (hkl)
обозначают как отдельную плоскость, так и набор параллельных плоскостей.
Для задания направления в кристалле выбирается прямая, проходящая
через начало координат и первый узел, лежащий на этой прямой. То есть
направление [hkl] определяется как набор наименьших целых чисел,
пропорциональных длинам векторов, направленных вдоль осей элементарной
ячейки, которые в сумме составляют вектор этого направления. В кубических
кристаллах направление перпендикулярно плоскости, имеющей те же индексы
(hkl).
Совокупность физически эквивалентных направлений (семейство
направлений) обозначается как <hkl>, а плоскости, эквивалентные по
характеру симметрии (например, шесть
граней куба), составляют семейство
плоскостей и обозначаются {hkl}.
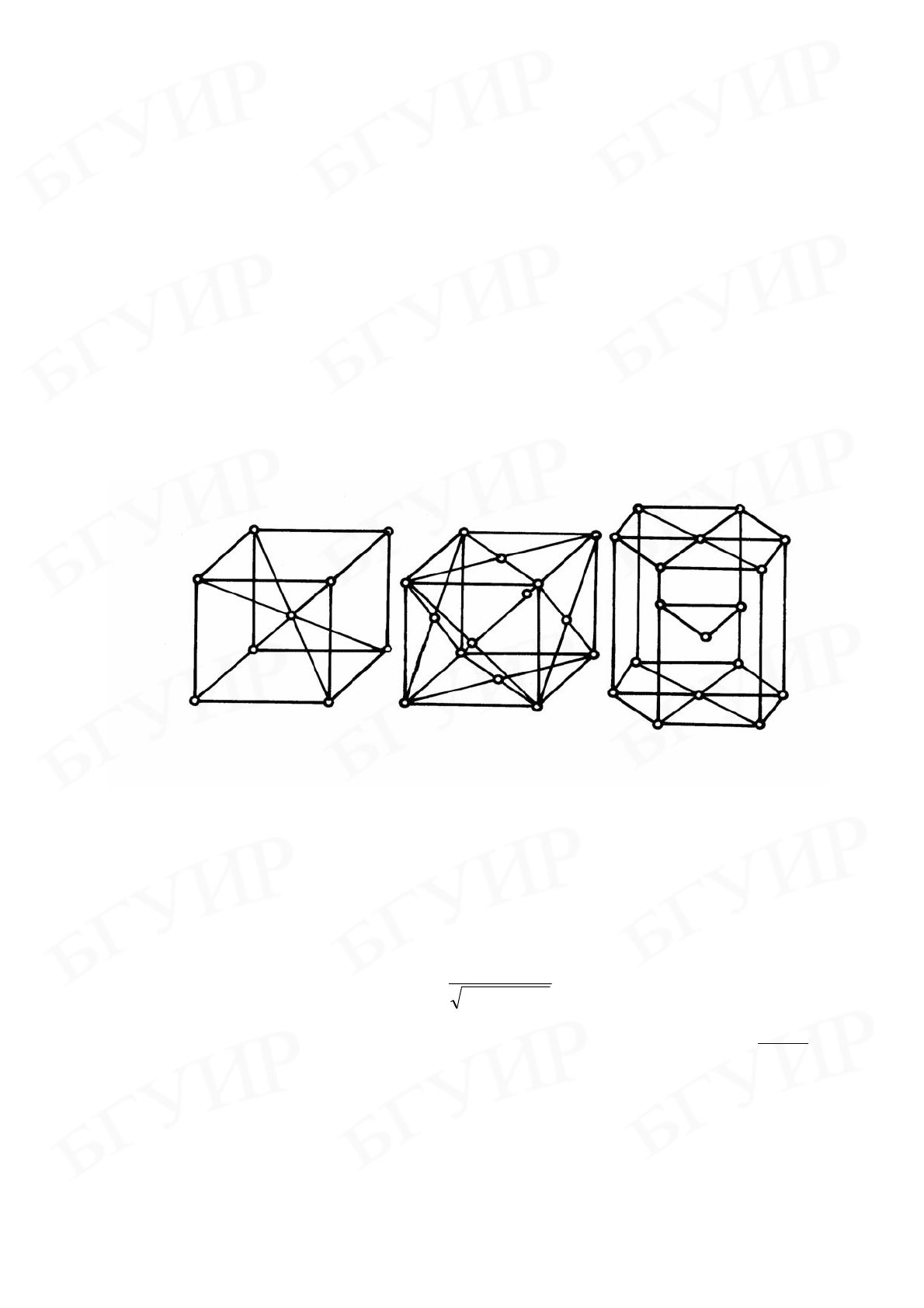
Большинство металлов и сплавов кристаллизуется в высоко-
симметричных решетках с плотной упаковкой атомов: кубических объемно-
центрированных (ОЦК), гранецентрированных (ГЦК) и гексагональных ГПУ
(см. рисунок).
Типы кристаллических решеток металлов и сплавов:
а – ОЦК, б – ГЦК, в – ГПУ.
Закон дифракции Вульфа–Брэгга:
,sin2
λ
θ
nd
hkl
=
⋅
где d
hkl
– расстояние между плоскостями (hkl); θ – угол отражения; λ – длина
волны излучения. Для кубических решеток
.
222
lkh
a
d
hkl
++
=
Число атомов, содержащихся в объеме вещества массой m:
,
A
Nm
n
O
⋅
=
где
N
o
– число Авогадро; A – атомная или молекулярная масса.
Концентрация точечных дефектов по Френкелю и Шоттки
а б
в

),exp(
);
2
exp(
kT
W
Nn
kT
W
NNn
Ш
Ш
Ф
Ф
−⋅=
−⋅
′
⋅=
где N и N´ - концентрации узлов и междоузлий в решетке; W
Ф
и W
Ш
– энергии
образования соответствующего дефекта.
Примеры решения задач
Задача 1.1. Пара противоположно заряженных двухвалентных ионов
находится в связи на равновесном расстоянии а = 0,24 нм. Показатель степени в
выражении для энергии отталкивания n = 9. Найти энергию разделения ионов.
Решение
В состоянии равновесия при а = 0,24 нм силы притяжения и отталкивания
уравновешены
0
12
2
21
=−
⋅⋅
−==
+n
a
b
n
a
eZZ
da
dE
F
.
Получаем
102
2
94
a
b
a
e
=
и
9
4
28
ea
b =
, тогда
(
)
29
9
2
192
9
282
1038
1024,09
106,132
9
32
9
44
0
−
−
∞
⋅=
⋅⋅
⋅
==
⎥
⎦
⎤
⎢
⎣
⎡
−−−=−
a
e
a
ea
a
e
EE
o
Дж.
Задача 1.2. Каждая С-С-связь в кристалле алмаза имеет энергию W
св
= =
3,7 эВ. Сколько энергии необходимо затратить для испарения m = 0,1 г алмаза?
Решение
Число атомов в объеме вещества массой m выражается через число
Авогадро N
A
= 6,02·10
26
(кг
⋅
моль)
-1
и молярную массу M (для углерода М = 12)
.105
12
1002,6101,0
21
263
⋅=
⋅⋅⋅
=
⋅
=
−
M
Nm
n
O
Каждый атом углерода в ковалентном алмазе участвует в четырех связях,
но поскольку испарение происходит с поверхности вещества, необходимо
разорвать в среднем две связи. Поэтому для испарения необходима энергия
(одновременно переводим электрон-вольты в джоули)
.5920106,17,31052)()(2
1921
ДжКлеэВWnW
свисп
=⋅⋅⋅⋅⋅=⋅⋅=
−

Задача 1.3. Удельная поверхностная энергия стекла при температуре
650
о
С равна e
S
= 0,3 Дж·м
-2
. Какая энергия ∆Е выделится при сфероидизации
нити длиной l = 0,1 м и диаметром d = 2·10
-5
м?
Решение
Объем нити
lrV
Н
⋅=
2
π
, а шара
3
3
4
RV
Ш
π
= . Поскольку V
Н
= V
Ш
:
lr ⋅
2
π
=
3
3
4
R
π
и
3
2
4
3
lrR =
≈ 2·10
-4
м.
Площадь поверхности нити
lrS
Н
⋅
≈
π
2
, а шара
2
4 RS
Ш
π
= .
При сфероидизации выделится энергия, равная разности их
поверхностных энергий:
22
68 6
(2 4 ) 2 ( 2 )
23,140,3(10 2410 ) 1,710 .
НШS Н S Ш SS
E E E e S e S e rl R e rl R
Дж
ππ π
−− −
∆= − = ⋅ − ⋅ = ⋅⋅− ⋅ = ⋅ ⋅− =
=⋅ ⋅ −⋅⋅ = ⋅
Задача 1.4. Вычислите изменение объема железа при его полиморфном
превращении, если радиусы атомов Fe в плотной объемно центрированной
упаковке r
ОЦК
= 0,1241 нм, а в гранецентрированной - r
ГЦК
= 0,127 нм.
Решение
Определим размеры элементарных ячеек железа:
- в элементарной ГЦК-ячейке (см. рисунок, б) содержится
46
6
1
8
8
1
=⋅+⋅
атома, а в
ОЦК-ячейке (см. рисунок, а)
218
8
1
=+⋅
атома;
- на диагонали грани ГЦК-ячейки, равной
2a , размещается 2 атома, т.е.
Ra 42 = и
2
4
ГЦК
ГЦК
R
a =
;
- на пространственной диагонали длиной
3a ОЦК-ячейки также должно
расположиться два атома, следовательно,
3
4
ОЦК
ОЦК
R
a =
.
Тогда
0462,0)
2
127,0
4()
2
4
(
333
=⋅===
ГЦК
ГЦКГЦК
R
aV
нм
3
;
04694,0)
3
1242,0
4()
3
4
(
333
=⋅===
ОЦК
ОЦКОЦК
R
aV
нм
3
.

Относительное изменение объема железа при полиморфном превращении
6,1
0462,0
0462,004694,0
=
−
=
∆
ОЦК
V
V
об.%.
Задача 1.5. Вычислите концентрацию свободных электронов в
алюминии, имеющем ГЦК-решетку с периодом a = 0,4041 нм, если на каждый
атом приходится три электрона?
Решение
В ГЦК-решетке на одну элементарную ячейку (см. задачу 1.4) приходится
4 атома, поэтому количество атомов в единице объема
28
393
1006,6
)104041,0(
44
⋅=
⋅
==
−
a
n
м
-3
,
а концентрация электронов
28
1018,183 ⋅== nn
e
м
-3
.
Задача 1.6. Вычислите период кристаллической решетки меди, если ее
плотность d = 8920 кг/м
3
, элементарная ячейка – ГЦК. Какой объем приходится
на один атом?
Решение
Рентгеновская плотность следующим образом связана с периодом
кубической решетки:
3
a
mk
d
⋅
=
,
где m - масса атома; k - число атомов в элементарной ячейке.
В ГЦК-ячейке k = 4. Учитывая, что
A
N
A
m =
, атомный вес Cu А = 63,54,
=
⋅⋅
⋅
=
⋅
⋅
=
3
3
26
1002,68920
54,634
A
Nd
Ak
a
3,72 · 10
-10
м = 0,372 нм.
Задача 1.7. Рефлекс от плоскости (111) на рентгенограмме меди, снятой
при длине волны рентгеновского излучения λ = 0,5405 нм, наблюдается под
углом 2Θ = 43
о
.
Найти период ГЦК-решетки а и атомный радиус r
a
меди.
Решение
Из уравнения Вульфа–Брэгга
θ
⋅
⋅
=
λ
sin2
111
d , тогда
21,0
5,21sin2
15405,0
sin2
111
==
θ
λ
=
O
d нм.

Для кубической решетки
222
lkh
a
d
hkl
++
=
, отсюда
36,03
111
222
==++= dlkhda
hkl
нм
(экспериментальное значение – а = 0,3556 нм).
На диагонали грани ГЦК-решетки находится (см. рисунок, б) два атома,
тогда
128,0
4
2
==
a
r нм.
Задачи для самостоятельного решения
1. Сколько атомов располагается на 1 мм
2
плоскостей (100) и (111) ГЦК-
свинца, если минимальное межатомное расстояние в его решетке равно 0,35
нм?
Ответ: 8,2·10
12
и 9,5·10
12
.
2. В молекуле воды угол связи Н – О – Н равен 104,5
О
, а расстояние
между ионами О
2-
и Н
+
- 0,107 нм. Вычислить электрический дипольный момент
молекулы, предполагая связь О и Н ионной.
Ответ: 6,2·10
-29
Кл·м.
3. Расстояние между ближайшими атомами в ОЦК-решетке вольфрама
равно 0,2737 нм. Найдите плотность материала (считать, что структура
плотноупакованная).
Ответ: 19 350 кг/м
3
.
4. Ион фтора имеет радиус 0,133 нм. Каков радиус наименьшего
одновалентного, положительного иона, который может соседствовать с 6-ю
ионами фтора? Рассматривать предельный случай «касания» анионов.
Ответ: 0,059 нм.
5. При температуре, на 10 К меньшей температуры плавления алюминия
(Т
пл
= 933 К), на долю вакансий приходится 0,08 % мест в кристаллической
решетке, а при 484 К – 0,01 % мест. Чему равна энергия образования вакансии?
Сколько вакансий присутствует в 1 см
3
при 527 К? Считать, что вакансии
образуются за счет ухода атомов к поверхности.
Ответ: 1,2·10
-19
Дж; 1,1·10
19
.
6. Кристалл цинка имеет плотноупакованную гексагональную решетку
(ГПУ) с постоянными а = 0,266 нм и с = 0,495 нм. Найти плотность цинка и
объем элементарной ячейки. Молярная масса цинка М = 6,537·10
-2
кг/моль.
Ответ: 3,03·10
-29
м
-3
; 7,16·10
3
кг/м
3
.

7. Для пучка рентгеновских лучей с длиной волны λ = 0,1537 нм,
падающего на кристалл ГЦК алюминия, наблюдается отражение первого
порядка от плоскостей (111) под углом θ = 19
О
20´. Определить число Авогадро,
если известно, что плотность алюминия d = 2,7·10
3
кг/м
3
, молярная масса М =
2,698·10
-2
кг/моль.
Ответ: 6,1·10
23
моль
-1
.
8. Определите индексы Миллера плоскости, отсекающей на осях
кубической решетки отрезки А = а, В = 0,5 а, С = 1,5 а и направлений,
проходящих через начало координат вдоль диагоналей решетки.
Ответ: (362), [110], [101], [011], [111].
Тема 2. ПРОВОДНИКОВЫЕ МАТЕРИАЛЫ
Необходимые теоретические сведения и расчетные формулы
Характерная особенность проводников – сильно выраженная электро-
проводность – обусловлена высокой
концентрацией свободных носителей
заряда. Их основные параметры: удельные электропроводность σ (См/м) и
сопротивление ρ (Ом·м), температурный коэффициент сопротивления α
ρ
(К
-1
),
скорость дрейфа V
д
(м/с), подвижность µ (м
2
/(В·с), длина свободного пробега
λ (м) носителей заряда и др. Они связаны следующими соотношениями:
σ
ρ
1
=
;
T∆
∆
=
ρ
ρ
α
ρ
1
;
E
V
en
д
=
σ
,
где e – заряд; n – концентрация носителей тока; Е – напряженность
электрического поля.
Закон Ома в дифференциальной форме для плотности тока в
проводнике
EEenj
σ
µ
=
=
.
