Барам С.Г., Миронова И.Н. Общая и неорганическая химия
Подождите немного. Документ загружается.

Задачи
21
10.22. При прокаливании 95,1 г смеси нитратов калия и серебра до
полного разложения этих нитратов выделилось 17,92 л газа (н. у.). Опреде-
лите количественный состав смеси нитратов.
10.23. Кусочек сплава никеля и меди массой 3,714 г растворили в кон-
центрированной азотной кислоте. При этом выделилось 2,688 л бурого
газа (н. у.). Определите содержание металлов
в сплаве (в процентах по
массе).
10.24. Массовая доля фосфора в одном из его оксидов составляет
56,36 %. Плотность паров этого вещества по воздуху равна 7,58 г / мл. Ус-
тановите молекулярную формулу этого оксида.
10.25. При гидролизе хлорида фосфора (V) образовалось 2,5 моля
хлористого водорода. Рассчитайте массу осадка, образующегося при до-
бавлении к полученному
при гидролизе раствору избытка растворенного в
воде CaCl
2
.
10.26. Составьте уравнения химических реакций, позволяющих осу-
ществить следующие превращения:
P → P
2
O
5
→ H
3
PO
4
→ Ca
3
(PO
4
)
2
→ H
3
PO
4
.
10.27. С какими из перечисленных веществ может вступить в реакцию
фосфат кальция: а) серная кислота; б) ортофосфорная кислота; в) нитрат
натрия; г) гидроксид калия? Напишите молекулярные и ионные уравнения
возможных реакций.
10.28. К водному раствору, содержащему 26,4 г сульфата аммония,
добавляют избыток гидроксида натрия и нагревают. Выделившийся при
этом газ
полностью поглощается другим раствором, содержащим 19,6 г
ортофосфорной кислоты. Какая соль и в каком количестве (в граммах) при
этом образуется?
10.29. Имеется 6,3 г серы и фосфора, которую обработали избытком
концентрированной азотной кислоты при нагревании. При этом выдели-
лось 24,64 л бурого газа (н. у.). Полученный газ был пропущен через
949,4 г 6,5 %-го раствора
гидроксида калия. Какие соли содержатся в по-
лученном растворе, и каковы их массовые доли? Определите массовые
доли серы и фосфора в исходной смеси.
Глава 11. ГЛАВНАЯ ПОДГРУППА
IV ГРУППЫ
В главную подгруппу четвертой группы Периодической системы
входят углерод, кремний, германий, олово и свинец. Электронная конфи-
гурация внешнего электронного уровня s
2
p
2
. В невозбужденном состоянии
атомы подгруппы имеют на внешнем уровне два неспаренных электрона.
Поскольку атомы всей подгруппы имеют на внешнем уровне свободные
орбитали, то при переходе в возбужденное состояние распаривают элек-
троны s-подуровней. Поэтому эти элементы могут проявлять валентности
II и IV , а степени окисления +2, +4, −4. Элементы подгруппы образуют
оксиды
общей формулы ЭО и ЭО
2
, а водородные соединения — формулы
ЭН
4
. Гидраты высших оксидов углерода и кремния обладают кислотными
свойствами, гидраты остальных элементов амфотерны.
При переходе от углерода к свинцу размеры атомов возрастают. По-
этому следует ожидать, что способность к присоединению электронов, а
следовательно, и неметаллические свойства будут при этом ослабевать.
Легкость же отдачи электронов — возрастать. Действительно, уже у гер-
мания
проявляются металлические свойства. А у олова и свинца они пре-
обладают над неметаллическими. Таким образом, только первые два члена
описываемой группы являются неметаллами, германий проявляет проме-
жуточные свойства, а олово и свинец — металлы.
В электрохимическом ряду напряжений олово и свинец стоят до во-
дорода, германий — после. Поэтому свинец и олово реагируют
с соляной
кислотой и разбавленной серной кислотой с выделением водорода, а гер-
маний — нет.
Германий — рассеянный элемент, образование рудных скоплений для
него не характерно. Он в основном сопутствует природным силикатам и
сульфидам, содержится в некоторых углях.
Основной минерал олова — кассерит (оловянный камень) SnO
2
, свин-
ца — галенит (свинцовый блеск) PbS. Олово и свинец были известны че-
ловеку еще за три тысячелетия до нашей эры. Они входили в список «семи
металлов древности»: Au, Fe, Ag, Cu, Pb, Sn и Hg.
ЗАДАЧИ
11.1. Дайте характеристику элементов главной подгруппы IV группы
по следующей схеме:
1) элементы подгруппы;
2) общая электронная формула;
3)
возможные валентности и степени окисления элементов. Ответ
обоснуйте. Приведите примеры соединений;
Задачи
23
4) как и почему изменяются вниз по подгруппе: а) радиус элементов,
б) их электроотрицательность, в) неметаллические свойства, г) агрегатное
состояние простых веществ, образованных элементами подгруппы. Ответ
обоснуйте;
5) приведите молекулярные и структурные формулы водородного со-
единения, высшего оксида и высшей кислородсодержащей кислоты для
элемента 2-го периода этой подгруппы. Укажите названия
всех веществ,
проставьте валентности и степени окисления всех элементов;
6) для элемента 2-го периода этой подгруппы предложите формулы
двух соединений, одно из которых имеет нулевой, а второе — ненулевой
дипольный момент. Опишите пространственное строение молекул этих
соединений. Укажите тип гибридизации элементов в этих соединениях.
11.1. Какую гибридизацию может проявлять углерод
в соединениях?
Приведите примеры.
11.2. Назовите все аллотропные модификации углерода и обоснуйте
различие в их физических и химических свойствах.
11.3. Перечислите основные области применения алмаза, графита,
фуллеренов.
11.4. Для следующих частиц: CH
4
, CO
2
, CO определите:
а) тип гибридизации центрального атома;
б) пространственное строение;
в) полярность молекул;
г) валентность и степень окисления всех элементов;
д) выберите из приведенных соединений такое, в котором имелись бы
ковалентные связи, образованные по двум различным механизмам. Опи-
шите эти механизмы применительно к выбранному соединению.
11.5. Напишите структурные формулы соединений CF
4
, CHClO, C
2
H
4
.
Определите степень окисления, валентность, тип гибридизации углерода и
геометрическую форму молекул.
11.6. Охарактеризуйте физические и химические свойства оксидов уг-
лерода. Перечислите области нахождения в природе и применение углеки-
слого газа.
11.7. Почему оксид углерода (II) только формально можно считать ан-
гидридом муравьиной кислоты?
11.8. Как очистить монооксид углерода от примесей
воды и углеки-
слого газа? Напишите уравнения реакций.
11.9. С какими из перечисленных веществ будет взаимодействовать
оксид углерода (II):
H
2
, CuO, O
2
, CO
2
, NaOH, HCl, Cl
2
, H
2
O?
Напишите уравнения происходящих реакций.
11.10. Почему твердый оксид углерода (IV) получил название «сухой
лед»?
Глава 11. Главная подгруппа IV группы 24
11.11. Как изменится окраска раствора, содержащего синий лакмус,
если через этот раствор пропустить углекислый газ? Что произойдет с ок-
раской, если потом этот раствор нагреть? Рассуждения подтвердите урав-
нениями реакций.
11.12. Почему рН дождевой воды всегда меньше 7?
11.13. С какими из перечисленных веществ будет взаимодействовать
оксид углерода (IV):
NH
3
, NaOH, H
2
O, C, SO
3
, BaO, HCl, CuSO
4
?
Напишите уравнения происходящих реакций.
11.14. Каким способом можно отличить соли угольной кислоты от со-
лей азотной, серной и соляной кислот?
11.15. В одной из трех склянок имеется раствор гидроксида натрия, в
другой — гидрокарбоната натрия, в третьей — карбоната натрия. С помо-
щью каких химических реакций можно распознать содержимое каждой
склянки?
11.16. Приведите пример растворимой в воде соли, при действии на
которую как кислоты, так и щелочи (при нагревании) выделяется газ? На-
пишите уравнения реакций.
11.17. Одна из солей угольной кислоты не дает твердого остатка при
термическом разложении. Что это за соль? Назовите ее. Предложите спо-
соб получения этой соли. Напишите
уравнения всех реакций.
11.18. Тонкий порошок гидрокарбоната натрия применяется для сухо-
го огнетушения. Какое превращение происходит с содой при нагревании и
как это связано с противопожарным действием?
11.19. Напишите уравнения реакций, в результате которых возможно
осуществить следующие превращения:
C → CH
4
→ CO → CO
2
→ CaCO
3
→ Ca(HCO
3
)
2
→ CaCO
3
→ CO
2
.
11.20. Составьте уравнения следующих реакций:
а) BaCO
3
+ HCl = … ;
б) Ca(OH)
2
+ CO
2
= … ;
в) CO
2
+ H
2
O + CaCO
3
=… ;
г) NaHCO
3
+ … = CaCO
3
+ … ;
д) K
2
CO
3
+ AlCl
3
+ H
2
O = … .
11.21. Какие факторы способствуют смещению равновесия в реакции
СО
2(г)
+ С
(т)
' 2СО
(г)
– 72,8 кДж
в сторону образования оксида углерода (II)? Обоснуйте свой ответ. Чему
равна константа равновесия этой реакции, если до его установления израс-
ходовался 1 моль СО
2
из 2 моль, бывших в начале? (Концентрация СО на
старте равна нулю.)
11.22. При полном гидролизе смеси карбидов кальция и алюминия
образуется смесь газов, которая в 1,6 раза легче кислорода. Определите
массовые доли карбидов в исходной смеси.
Задачи
25
11.23. В вашем распоряжении 10 г известняка и вода. Как получить,
не расходуя никаких других материалов, кроме двух названных, пять но-
вых сложных веществ, относящихся к пяти разным классам химических
соединений (каким)? Составьте уравнения всех реакций и определите мас-
су полученных соединений.
11.24. При прокаливании 50 г карбоната кальция образовалось 34,6 г
твердого
остатка. Определите степень разложения карбоната кальция и
состав остатка.
11.25. Через известковую воду пропущен 1 л (н. у.) смеси оксида уг-
лерода (II) и оксида углерода (IV). Выпавший при этом осадок был от-
фильтрован и высушен, масса его оказалась равной 2,45 г. Установите со-
держание газов в исходной смеси (в процентах по объему).
11.26.
В раствор, содержащий 4,48 г гидроксида калия, пропустили
1,12 л СО
2
(н. у.). Определите качественный и количественный (в граммах)
состав остатка, полученного при осторожном (без разложения) выпарива-
нии раствора.
11.27. Образец стали массой 5 г при сжигании в токе кислорода выде-
лил углекислый газ массой 0,1 г. Какова массовая доля углерода в стали?
11.28. Назовите аллотропные модификации кремния. Какая из них
химически
более активна и почему?
11.29. Назовите и обоснуйте основную область использования кри-
сталлического кремния.
11.30. Перечислите известные вам способы получения кристалличе-
ского и аморфного кремния. Приведите уравнения реакций.
11.31. Во сколько раз в земной коре атомов кислорода больше, чем
атомов кремния? Массовые доли кислорода и кремния в земной коре
соот-
ветственно равны 47,2 и 27,6 %.
11.32. Приведите по два уравнения реакций, в которых углерод и
кремний выступают: а) в качестве восстановителей; б) в качестве окисли-
телей.
11.33. Какие Вы знаете оксиды кремния? Опишите их физические
свойства. В чем заключается причина резкого различия в физических
свойствах оксида углерода (IV) и оксида кремния (IV)? В
виде каких со-
единений встречается оксид кремния (IV) в природе?
11.34. Какую кислоту нельзя хранить ни в обычной стеклянной посу-
де, ни в посуде из кварцевого стекла? Почему? Ваш ответ подтвердите
уравнением реакции.
11.35. Как из кремнезема получить кремниевую кислоту?
11.36. Приведите уравнения реакций, которые лежат в основе получе-
ния
различных стекол.
11.37. Какие соединения называют жидкими стеклами? На каких
свойствах жидких стекол основано их практическое использование?

Глава 11. Главная подгруппа IV группы 26
11.38. Для реакции
2C + SiO
2
+ 2Cl
2
' SiCl
4
+ 2CO – Q
напишите выражение закона действующих масс для химического равнове-
сия. Установите, в каком направлении произойдет смещение равновесия
при: а) увеличении давления; б) нагревании системы; в) добавлении хлора;
г) добавлении монооксида углерода.
11.39. Осуществите следующие превращения:
а) SiCl
4
→ Si → Na
2
SiO
3
→ Na
2
CO
3
→ Na
2
SO
4
→ Na
2
SiO
3
;
б)
Si Mg
2
Si
SiH
4
SiO
2
SiO
2
Si K
2
SiO
3
BaSiO
3
11.40. Как с помощью одного вещества (какого?) определить, в какой
пробирке находятся растворы: сульфата калия, силиката калия, карбоната
натрия? Напишите все уравнения реакций.
11.41. Охарактеризуйте строение и свойства карборунда SiC.
11.42. При сплавлении кремнезема с содой было получено 6,1 г сили-
ката натрия. выделившийся газ был поглощен раствором едкого натра
(
ρ = 1,12 г / мл) объемом 18 мл с массовой долей NaOH 10 %. Определите,
какая соль и в каком количестве образовалась?
11.43. Смесь кремния и угля массой 5 г обработали избытком концен-
трированного раствора щелочи при нагревании. В результате реакции вы-
делилось 2,8 л водорода (н. у.). Вычислите массовую долю углерода в этой
смеси.
11.44. При растворении
в водном растворе щелочи 8 г смеси кремния
с цинком выделилось 6,272 л газа (н. у.). Найдите процентный состав сме-
си.
11.45. Определите объем водорода (н. у.), выделившегося при обра-
ботке раствором гидроксида натрия смеси, полученной при сплавлении 6 г
магния с 45 г оксида кремния (IV).

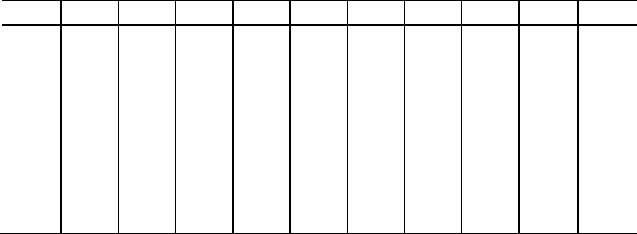
ПРИЛОЖЕНИЕ
МОЛЕКУЛЯРНЫЕ МАССЫ НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
(ОКРУГЛЕННЫЕ)
O
2-
OH
-
Cl
-
Br
-
I
-
NO
3
S
2-
SO
3
2-
SO
4
2-
CO
3
2-
PO
4
3-
SiO
3
2-
H
+
18 36,5 81 128 63 34 82 98 62 98 78
NH
4
+
35 53,5 98 145 80 68 116 132 96 149 112
Na
+
62 40 58,5 103 150 85 78 126 142 106 164 122
K
+
94 56 74,5 119 166 101 110 158 174 138 212 154
Ba
2+
153 171 208 197 391 261 169 217 233 197 101 213
Ca
2+
56 74 111 200 294 164 72 120 136 100 310 116
Mg
2+
40 58 95 184 278 148 56 104 120 84 262 100
Al
3+
102 78 133,5 267 408 213 150 294 342 234 122 282
Cr
3+
152 103 158,5 292 433 238 200 344 392 284 147 332
Fe
2+
72 90 127 216 310 180 88 136 152 116 358 132
Fe
3+
160 107 162,5 296 437 242 208 352 400 292 151 340
Mn
2+
71 89 126 215 309 179 87 135 151 115 355 131
Zn
2+
81 99 136 225 319 189 97 145 161 125 385 141
Cu
2+
80 98 135 224 318 188 96 144 160 124 382 140
Ag
+
232 125 143,5 188 235 170 248 296 312 276 419 292
Pb
2+
223 241 278 367 461 331 239 287 303 267 811 283
Приложение
28
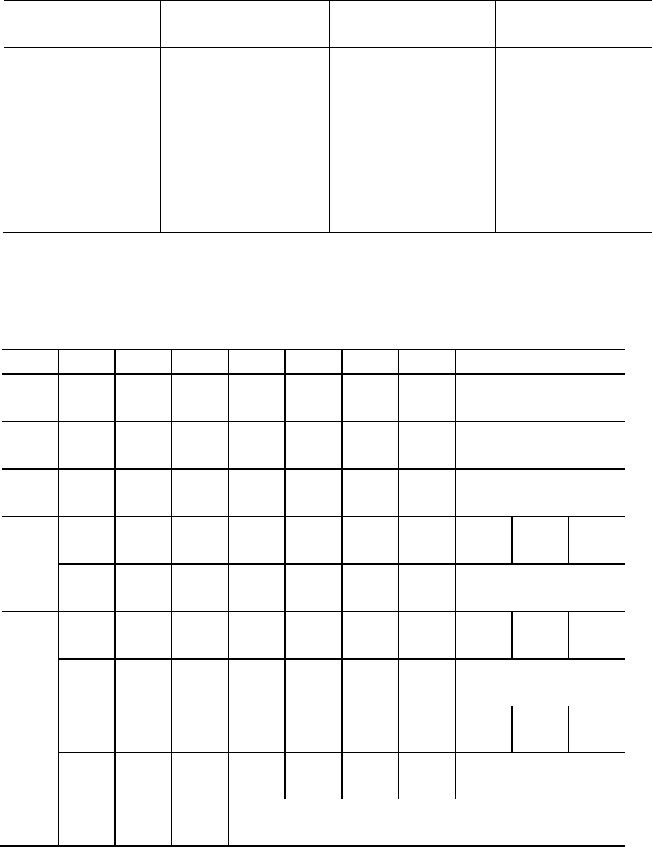
ТРЕХЗНАЧНЫЕ ДЕСЯТИЧНЫЕ ЛОГАРИФМЫ
0 1 2 3 4 5 6 7 8 9
1,
000 041 079 114 146 176 204 230 255 279
2,
301 322 342 362 380 398 415 431 447 462
3,
477 491 505 519 532 544 556 568 580 591
4,
602 613 623 634 644 653 663 672 681 690
5,
699 708 716 724 732 740 748 756 763 771
6,
778 785 792 799 806 813 820 826 833 839
7,
845 851 857 863 869 875 881 887 892 898
8,
903 909 914 919 924 929 935 940 945 949
9,
954 959 964 969 973 978 982 987 991 996
Эта таблица позволяет находить логарифмы от 1 до 10. Прежде всего
необходимо найти в первой слева колонке таблицы первую цифру задан-
ного числа. Затем, следуя по найденной строке вправо, дойти до колонки,
соответствующей второй цифре заданного числа. Так как искомые числа
находятся в пределах от 1 до 10, то, следовательно, его логарифм должен
быть
заключен в пределах от 0 до 1.
Поступая таким образом, найдем, например, что логарифм числа 3,2
будет равен 0,505.
Умножение и деление:
lg ab = lg a + lg b;
lg a / b = lg a − lg b.
Возведение в степень и извлечение корня:
lg a
n
= n lg a;
lg a
1/n
= (1 / n) lg a.
Приложение
29
СТАНДАРТНЫЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ СОЕДИНЕНИЙ
ИЗ ПРОСТЫХ ВЕЩЕСТВ
Вещество
Q,
кДж/моль
Вещество
Q,
кДж/моль
CO (г) 110,5 HI (г) -26,6
CO
2
(г) 393,5 H
2
O (г) 241,8
CaCO
3
(кр) 1207 H
2
O (ж) 285,8
CaO (кр) 635 NH
3
(г) 46,2
CuO (кр) 162 NO (г) -90,3
HF (г) 271 NO
2
(г) -33,5
HCl (г) 92.2 P
2
O
5
(кр) 1492
HBr (г) 36,3
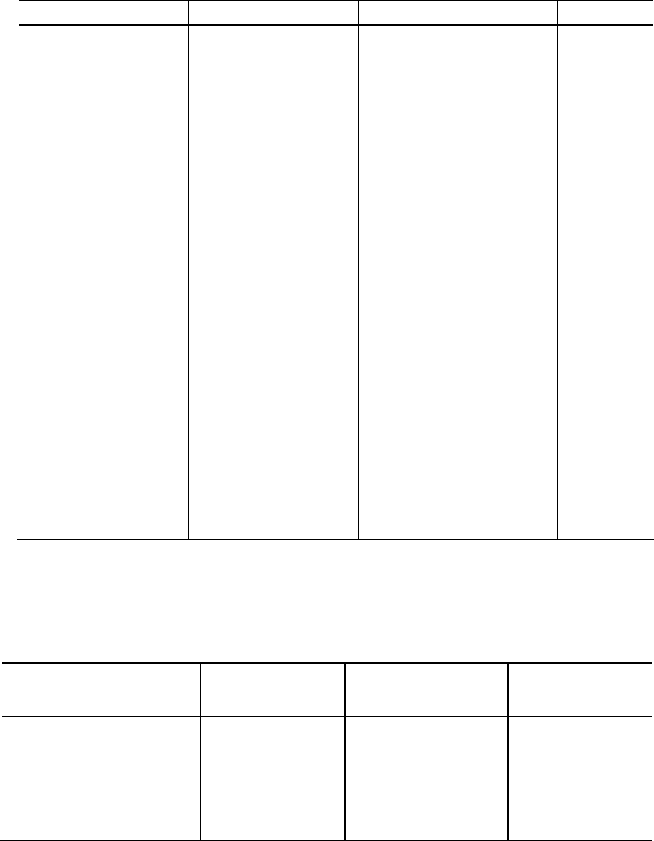
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
ЭЛЕМЕНТОВ
I II III IV V VI VII VIII
1 H He
2,10
-
2 Li Be B C N O F Ne
0,97 1,47 2,01 2,50 3,07 3,50 4,10
-
3 Na Mg Al Si P S Cl Ar
0,93 1,23 1,47 2,25 2,32 2,60 2,83
-
K Ca Sc Ti V Cr Mn Fe Co Ni
4
0,91 1,04 1,20 1,32 1,45 1,56 1,60 1,64 1,70 1,75
Cu Zn Ga Ge As Se Br Kr
1,75 1,66 1,82 2,02 2,11 2,48 2,74
-
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd
5
0,89 0,99 1,11 1,22 1,23 1,30 1,36 1,42 1,45 1,39
Ag Cd In Sn Sb Te I Xe
1,42 1,46 1,49 1,72 1,82 2,02 2,21
-
Cs Ba * Hf Ta W Re Os Ir Pt
6
0,86 0,97 1,23 1,33 1,40 1,46 1,52 1,55 1,44
Au Hg Tl Pb Bi Po At Rn
1,42 1,44 1,44 1,55 1,67 1,76 1,90
-
7 Fr Ra **
0,86 0,97
* — Лантаноиды: 1,01–1,14.
** — Актиноиды: 1,00–1,22.
Приложение
30
КОНСТАНТЫ ДИССОЦИАЦИИ
НЕОРГАНИЧЕСКИХ ОСНОВАНИЙ
Гидроксид Формула Константа дисс., K
в
pK
в
Алюминия Al(OH)
3
1,38⋅10
-9
8,86
Аммония NH
4
OH
1,79⋅10
-5
4,75
Бария Ba(OH)
2
2,30⋅10
-1
0,64
Галлия Ga(OH)
3
1,60⋅10
-11
(2)
10,8
Железа (2) Fe(OH)
2
1,30⋅10
-4
3,89
Железа (3) Fe(OH)
3
1,82⋅10
-11
(2)
10,74
1,35⋅10
-12
(3)
11,87
Кадмия Cd(OH)
2
5,00⋅10
-3
(2)
2,30
Кальция Ca(OH)
2
4,30⋅10
-2
(2)
1,37
Кобальта (2) Co(OH)
2
4,00⋅10
-5
(2)
4,40
Лантана La(OH)
2
5,20⋅10
-4
(3)
3,30
Лития LiOH
6,75⋅10
-1
0,17
Магния Mg(OH)
2
2,50⋅10
-3
(2)
2,60
Марганца (2) Mn(OH)
2
5,00⋅10
-4
(2)
3,30
Меди (2) Cu(OH)
2
3,40⋅10
-7
(2)
6,47
Натрия NaOH 5,90 –0,77
Никеля Ni(OH)
2
2,50⋅10
-5
(2)
4,60
Свинца Pb(OH)
2
9,60⋅10
-4
(1)
3,02
Стронция Sr(OH)
2
1,50⋅10
-1
(2)
0,82
Хрома (3) Cr(OH)
3
1,02⋅10
-10
(3)
9,90
Цинка Zn(OH)
2
4,00⋅10
-5
(2)
4,40
КОНСТАНТЫ ДИССОЦИАЦИИ
НЕОРГАНИЧЕСКИХ КИСЛОТ
Кислоты
Формула
Константа
дисс., К
а
рК
а
Азотистая HNO
2
4,00⋅10
-4
3,4
Азотистоводородная HN
3
2,60⋅10
-5
Азотная HNO
3
4,36⋅10
–1,64
Алюминиевая (мета) HAlO
2
4,00⋅10
-13
12,4
Борная (мета) HBO
2
7,50⋅10
-10
9,12
