Албертс Б., Брей Д. и др. Молекулярная биология клетки. Том 1
Подождите немного. Документ загружается.

471
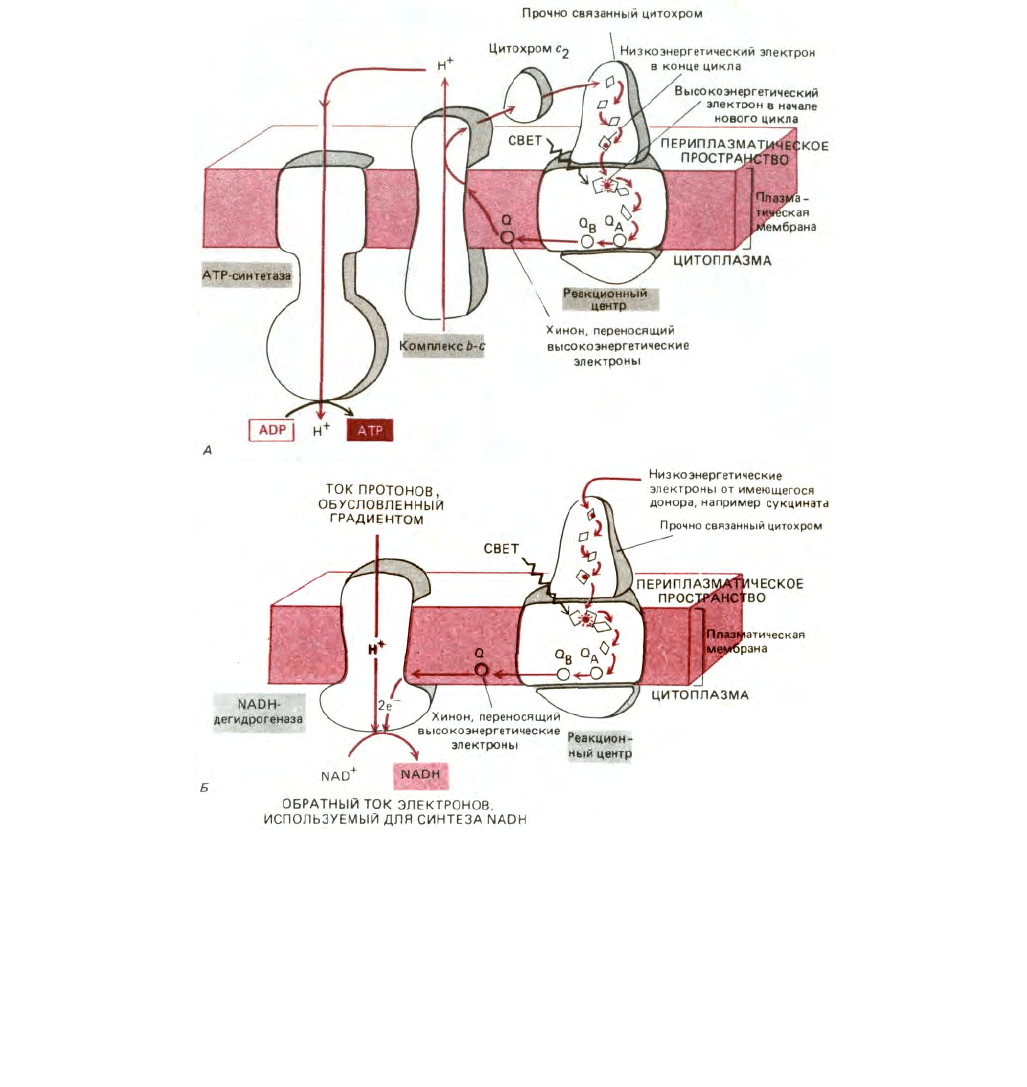
Рис. 7-51. Две реакции переноса электронов в фотосинтетической системе пурпурных бактерий. Эти реакции протекают в плазматической
мембране, а цитохром с
2
находится в растворимой форме в периплазматическом пространстве под наружной мембраной (см. рис. 6-54). А. В
результате циклического потока электронов на плазматической мембране создается электрохимический протонный градиент. Энергия этого
градиента используется АТР-синтетазой для синтеза АТР в бактериальной плазматической мембране. Б. Обратный поток электронов через NADH-
дегидрогеназу, осуществляемый за счет энергии того же протонного градиента, используется для синтеза NADH.
личными способами для двух целей - для синтеза АТР и образования NADPH. АТР синтезируется с помощью механизма, включающего перекачку
протонов и похожего на тот, с которым мы уже познакомились, рассматривая митохондрии (разд. 7.1.8): протоны перемещаются через
плазматическую мембрану бактерии в результате переноса высокоэнергетических электронов хиноном на комплекс b-с
1
, встроенный в эту
мембрану. Комплекс b-c
l
передает затем свои электроны на растворимый цитохром, от которого электроны (теперь уже с низкой энергией), пройдя
через другой, прочно связанный цитохром, вновь попадают в реакционный центр, завершая таким образом циклический процесс (рис. 1-51, А).
NADPH образуется в ходе второго электронтранспортного процесса, в котором высокоэнергетические электроны переходят от хинона не
на комплекс b-с
1
, а на NAD. Образующийся при этом NADH превращается затем с помощью трансгидрогеназы в NADPH. Так как переносимые

472
хиноном высокоэнергетические электроны находятся на более низком энергетическом уровне, чем электроны в NADH (напомним, что в
митохондриях электроны переносятся с NADH на хинон, а не наоборот - см. рис. 7-34), образование NADH из NAD требует затраты энергии. У
пурпурных фотосинтезирующих бактерий электрохимический протонный градиент, создаваемый на плазматической, мембране, заставляет протоны
возвращаться в клетку через NADH-дегидрогеназный комплекс, снабжая этот комплекс энергией, необходимой для обратного переноса электронов
от хинона на NAD (рис. 7-51, Б).
Таким образом, в плазматической мембране пурпурных бактерий реакционные центры используются для создания большого пула
восстановленных молекул. Часть этих молекул обеспечивает создание на плазматической мембране значительного электрохимического протонного
градиента. За счет энергии этого градиента осуществляются два процесса: 1) синтез АТР с помощью АТР-синтетазы и 2) создание обратного потока
электронов от остальной части восстановленного хинона на NAD, в результате чего генерируется восстановительная сила, необходимая для синтеза
органических молекул.
7-24;
7-25;
7-26
7.3.10. У растений и цианобактерий в результате нециклического фотофосфорилирования образуются как NADPH, так и АТР [31,
35]
Наиболее сложен фотосинтез у растений и цианобактерий. Здесь в двухступенчатом процессе, называемом нециклическим
фотофосфорилированием, сразу образуются и АТР, и NADPH. Благодаря тому что две фотосистемы последовательно возбуждают электрон,
последний способен пройти весь путь от воды до NADPH. По мере прохождения высокоэнергетических электронов через сопряженные
фотосистемы часть заключенной в электронах энергии генерирует NADPH, а часть отводится на синтез АТР.
В первой из двух фотосистем, по историческим причинам получившей название фотосистемы II, кислород двух молекул воды
связывается группой атомов магния при участии плохо изученного фермента, расщепляющего воду. Извлекаемые по одному электроны сразу же
заполняют образовавшиеся под действием света «дырки» в хлорофилле реакционного центра. Как только четыре электрона извлечены (для этого
требуются четыре кванта света), фермент освобождает О
2
; таким образом, фотосистема II катализирует реакцию 2Н
2
О → 4Н
+
+ 4е
-
+ О
2
.
«Ядро» реакционного центра в фотосистеме II гомологично только что описанному бактериальному реакционному центру и точно так же
генерирует сильные доноры электронов в форме восстановленных молекул хинона в мембране. Эти молекулы передают электроны на комплекс b
6
-
f, сходный с бактериальным комплексом b-с и комплексом b - с
1
в дыхательной цепи митохондрий. Как и в митохондриях, комплекс b
6
- f
перекачивает протоны через тилакоидную мембрану в тилакоидное пространство (в хлоропластах) или из цитозоля через впячивания
плазматической мембраны (у цианобактерий), и создающийся при этом электрохимический градиент доставляет энергию для синтеза АТР АТР-
синтетазой (рис. 7-52 и 7-53). Конечным акцептором в этой цепи переноса электронов служит вторая фотосистема (фотосистема I), принимающая
электроны в «дырки», образовавшиеся под действием света в хлорофилле ее реакционного центра. В то время как электроны, активированные
фотосистемой II, имеют слишком низкую энергию,
473
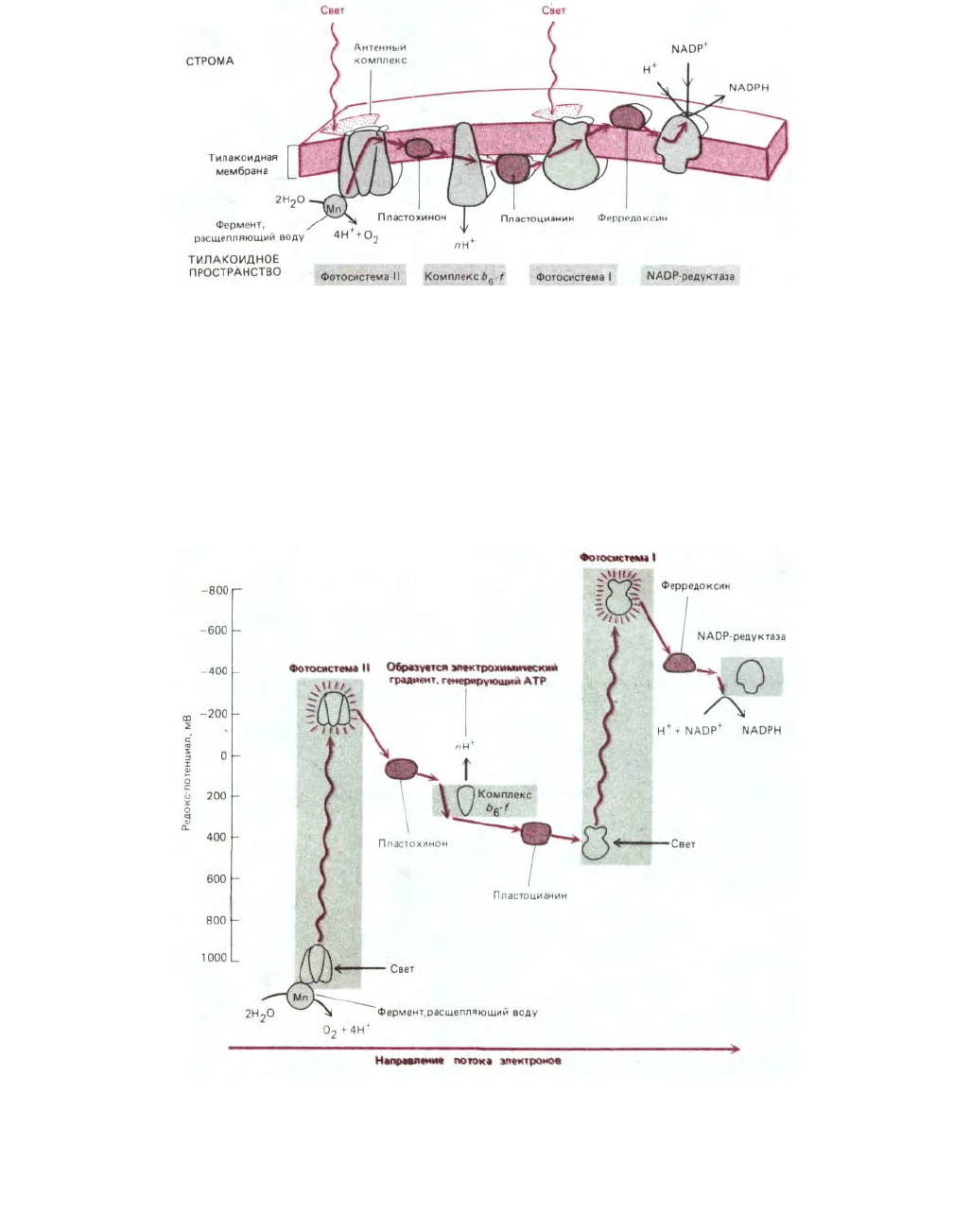
Рис. 7-52. Перенос электронов в процессе фотосинтеза в тилакоидной мембране. Подвижными переносчиками электронов в этой цепи служат
пластохинон (очень сходный с убихиноном митохондрий), пластоцианин (небольшой медьсодержащий белок) и ферредоксин (небольшой белок,
содержащий железо-серный центр). Комплекс b
b
-f очень похож на комплекс b-с
1
митохондрий и комплекс b-с бактерий (см. рис. 7-63): все три
комплекса принимают электроны от хинонов и перекачивают протоны. Обратите внимание, что протоны, высвобождаемые при окислении воды, и
протоны, захватываемые при образовании NADPH, тоже участвуют в создании электрохимического протонного градиента, доставляющего энергию
для синтеза АТР.
чтобы перейти на NADP
+
, каждый электрон, покидающий фотосистему I, находится на очень высоком энергетическом уровне благодаря
последовательной активации двумя квантами света. В результате эти электроны способны перейти на железо-серный центр ферредоксина и
восстановить NADP
+
до NADPH (рис. 7-53); при этом из среды извлекается один протон.
Зигзагообразную схему фотосинтеза, показанную на рис. 7-53, называют Z-схемой. В результате двух отдельных этапов возбуждения,
каждый из которых катализируется своей фотосистемой, электрон передается от воды, обычно прочно удерживающей свои электроны (редокс-
потенциал + 820 мВ), на NADPH, который имеет довольно слабое сродство к электронам (редокс-потенциал — 320 мВ). Один квант видимого света
не способен сообщить электрону достаточно энергии для прохождения всего пути от начала фотосистемы II до конца фотосистемы
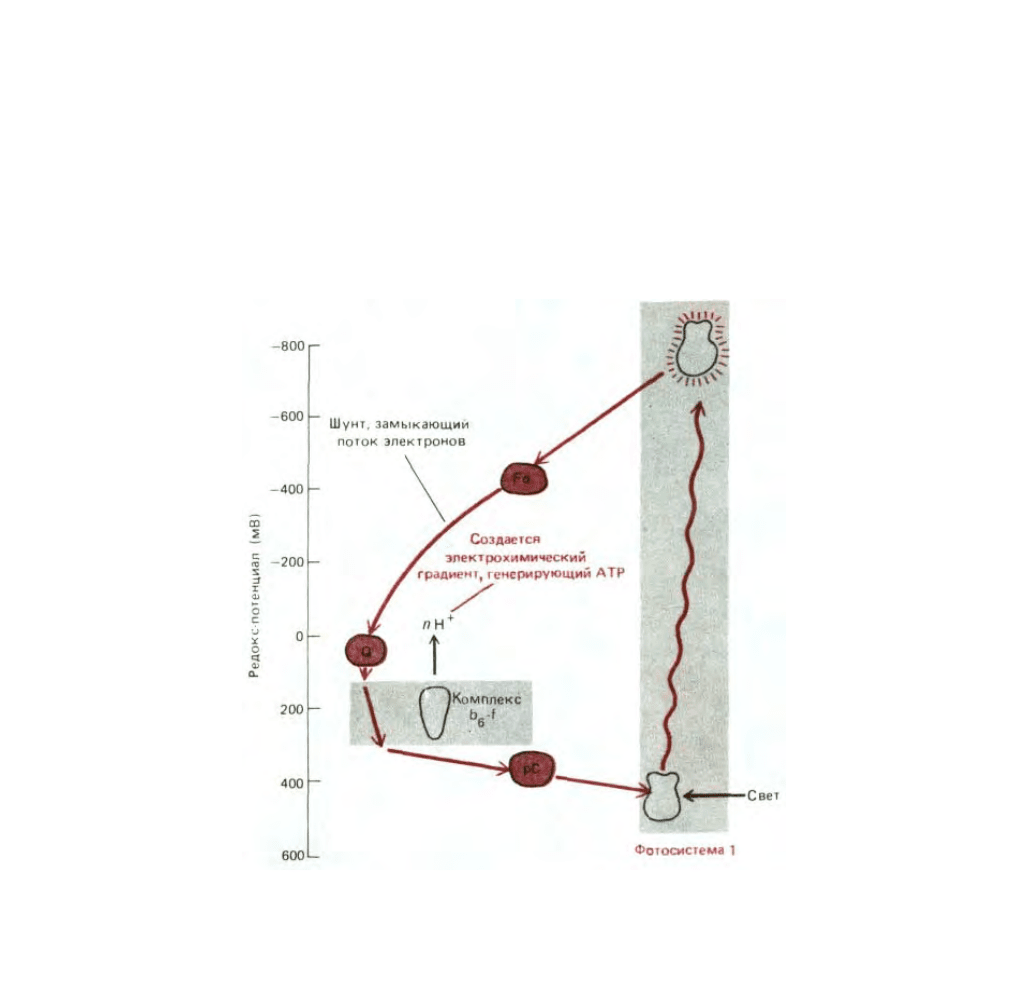
Рис. 7-53. Изменения редокс-потенциала при прохождении электронов в процессе фотосинтеза с образованием NADPH и АТР у растений и
цианобактерий. Фотосистема II очень похожа на реакционный центр пурпурных бактерий (см. рис. 7-50), с которым она эволюционно связана.
Фотосистема I отличается от этих двух систем: как полагают, она эволюционно родственна фотосистемам другой группы прокариот - зеленых
бактерий. В фотосистеме I электроны возбужденного хлорофилла проходят через ряд прочно связанных железо-серных центров. Две
последовательно соединенные фотосистемы обеспечивают суммарный поток электронов от воды к NADP
+
с образованием NADPH. Кроме того,
образуется АТР с помощью АТР-синтетазы (не показана) за счет энергии электрохимического протонного градиента, который создается
электронтранспортной цепью, связывающей фотосистему II с фотосистемой I. Эту Z-схему образования АТР называют нециклическим
фосфорилированием в отличие от циклической схемы, представленной на рис. 7-54 (см. также рис. 7-52).
474
I; видимо, для этого нужно столько энергии, сколько требуется для переноса электрона с воды на NADP
+
. Кроме того, использование двух
отдельных следующих друг за другом фотосистем позволяет связать их электронтранспортной цепью, в которой энергия электронов будет
достаточна для перемещения Н
+
через тилакоидную мембрану (или плазматическую мембрану цианобактерий), и тем самым -направить часть
возбуждаемых светом электронов на синтез АТР.
7.3.11. В процессе циклического фотофосфорилирования хлоропласты могут синтезировать АТР без образования NADPH [31, 36]
При нециклическом фотофосфорилировании, рассмотренном выше, высокоэнергетические электроны, покидающие фотосистему II,
обеспечивают синтез АТР, тогда как энергия электронов, выходящих из фотосистемы I, расходуется на образование NADPH. При этом на одну пару
электронов, переходящих с Н
2
О на NADP
+
с образованием молекулы NADPH, синтезируется немногим больше одной молекулы АТР. Однако для
фиксации углерода АТР нужен в значительно большем количестве, чем NADPH (см. рис. 7-43). Для получения дополнительного АТР хлоропласты
могут переводить фотосистему I на циклический режим работы, при котором энергия системы направляется не на синтез NADPH, а на образование
АТР. В этом процессе, называемом циклическим фотофосфорилированием, участвует поток электронов, во многом сходный с тем, энергию
которого используют фотосинтезирующие бактерии для получения АТР (см. рис. 7-51, А). При этом высокоэнергетические электроны,
активированные фотосистемой I, не переходят к NADP
+
, а возвращаются на комплекс b
6
-f, вызывая тем самым перемещение протонов через
тилакоидную мембрану. Создающийся в результате электрохимический градиент доставляет энергию для синтеза АТР (рис. 7-54).
Рис. 7-54. Путь переноса электронов при циклическом фосфорилировании. Этот путь позволяет синтезировать только АТР, без образования
NADPH и О
2
. Будет ли поток электронов нециклическим или циклическим, зависит от того, куда будет передавать свои реакционно-способные
электроны ферредоксин - на NADP
+
, как показано на рис. 7-53, или на компоненты, ведущие обратно к комплексу b
6
-f. Всякий раз, когда
происходит накопление NADPH и соответственно снижается уровень NADP
+
, создаются благоприятные условия для протекания фотосинтеза по
циклической схеме. Другие, менее прямые регуляторные механизмы тоже обеспечивают образование при фотосинтезе АТР и NADPH в
надлежащей пропорции. Ф —ферредоксин; ПХ - пластохинон; ПЦ - пластоцианин.
475
Итак, процесс нециклического фотофосфорилирования, включающий восстановление NADP
+
с участием воды как донора электронов,
осуществляется при совместном действии фотосистем I и II, и в результате образуются NADPH, АТР и О
2
. В отличие от этого при циклическом
фотофосфорилировании, в котором участвует только фотосистема I, синтезируется один лишь АТР - образования NADPH и О
2
не происходит.
Таким образом, относительная интенсивность циклического и нециклического переноса электронов будет определять, какая доля световой энергии
пойдет на образование восстановительной силы (NADPH) и какая превратится в энергию фосфатных связей (АТР). Этот баланс регулируется в
соответствии с потребностью в NADPH. Будет ли поток электронов циклическим или нет, зависит от того, куда будет передавать свои
реакционноспособные электроны ферредоксин - на NADP
+
или на компоненты, ведущие обратно к комплексу b
6
-f (сравните рис. 7-53 и 7-54). При
низких концентрациях NADP
+
, обусловленных накоплением NADPH, будет преобладать циклический процесс, приводящий к синтезу АТР.
Влияние уровня NADPH на циклическое фотофосфорилирование - это лишь часть обширной регуляторной сети, контролирующей
активность фотосистем I и II. Например, избыточная активность фотосистемы II приводит к повышению соотношения восстановленного и
окисленного хинона в тилакоидной мембране, а чрезмерная активность фотосистемы II - к противоположному эффекту (см. рис. 7-53). Однако
всякий раз, когда соотношение восстановленного хинона к окисленному превысит определенное пороговое значение, активируется протеинкиназа,
фосфорилирующая главный светоулавливающий пигментный белок в антенном комплексе. Это способствует отделению антенного комплекса от
фотосистемы и даже переходу его из области локализации фотосистемы II (граны) в тилакоидную мембрану, где сконцентрированы компоненты
фотосистемы І. В результате фотосистема I получает большую долю лучистой энергии, до тех пор пока уровень хинонов не возвратится к норме.
7-27
7.3.12. Геометрия перемещения протонов в митохондриях и в хлоропластах сходна [37]
Наличие в хлоропластах третьего внутреннего компартмента-тилакоидного пространства - на первый взгляд сильно отличает их от
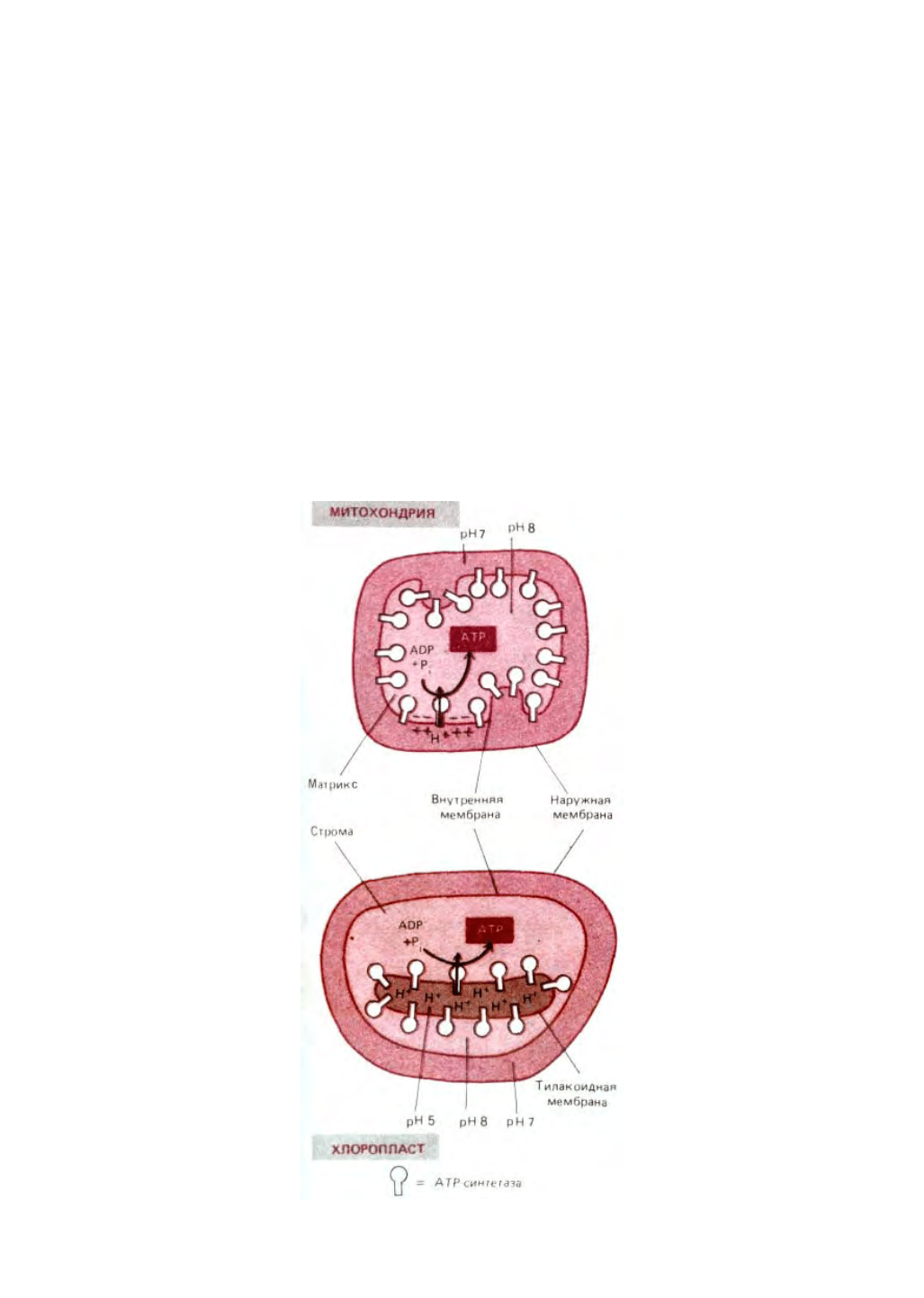
митохондрий. Однако геометрия перемещения протонов в этих двух органеллах очень сходна. Как видно из рис. 7-55, в хлоропластах протоны
откачиваются из стромы (рН 8) в тилакоидное пространство (рН около 5), создавая градиент в 3-3,5 единицы рН. Это создает на тилакоидной
мембране протонодвижущую силу около 200 мВ (почти целиком обусловленную градиентом рН, а не мембранным потенциалом), за счет которой
мембранная АТР-синтетаза осуществляет синтез АТР.
В митохондриальном матриксе, так же как и в строме хлоропласта, величина рН близка к 8, но она создается за счет переноса протонов из
органеллы в цитозоль (рН около 7), а не в какой-то ее внутренний компартмент. Поэтому градиент рН относительно мал и протонодвижущая сила
на внутренней митохондриальной мембране, близкая к такой же силе на тилакоидной мембране хлоропласта, в основном создается за счет
суммарного мембранного потенциала (см. разд. 7.1.7). Однако и в митохондриях, и в хлоропластах каталитический участок АТР-синтетазы
находится в большом компаргменте органеллы (соответственно в матриксе и в строме), который имеет рН около 8,0
Рис. 7-55. Сравнение потока протонов и ориентации АТР-синтетазы в митохондриях и хлоропластах. Компартменты со сходным рН окрашены
одинаково. Протонодвижущая сила на тилакоидной мембране почти полностью обусловлена градиентом рН; высокая проницаемость этой
мембраны для ионов Mg
2+
и Сl
-
позволяет потоку этих ионов рассеивать большую часть мембранного потенциала. Как полагают, митохондрии не
могли бы выдержать такое защелачивание (до рН 10), какое потребовалось бы для создания протонодвижущей силы без участия мембранного
потенциала.

476
и заполнен растворимыми ферментами. Поэтому именно здесь образуется весь АТР органеллы (рис. 7-55).
Несмотря на эти черты сходства между митохондриями и хлоропластами, последние устроены таким образом, что происходящие в них
процессы переноса электронов и протонов более доступны для изучения, чем в митохондриях. Разрушив внутреннюю и наружную мембраны
хлоропластов, можно выделить неповрежденные тилакоидные диски. Они сходны с субмитохондриальными частицами: компоненты
электронтранспортной цепи, использующие NADP
+
, ADP и фосфат, тоже расположены здесь с внешней стороны мембраны. Однако тилакоиды
представляют собой интактные естественные структуры и потому гораздо более активны, чем субмитохондриальные частицы, получаемые из
митохондрий искусственным путем. Поэтому некоторые из экспериментов, впервые доказавших ключевую роль хемиосмотического механизма,
были проведены на хлоропластах, а не на митохондриях.
7.3.13. Внутренняя мембрана хлоропласта, подобно внутренней мембране митохондрии, содержит белки-переносчики,
облегчающие обмен метаболитами с цитозолем [38]
Хотя электрон- и протонтранспортирующие реакции фотосинтеза легче всего изучать на препаратах хлоропластов, у которых внутренняя
и наружная мембраны разрушены и удалены, такие хлоропласты не способны к фотосинтетической фиксации СО
2
из-за отсутствия ряда важных
веществ, в нормальных условиях имеющихся в строме. Но хлоропласты можно выделить и так, что их внутренняя мембрана останется
неповрежденной. На таких препаратах можно показать, что внутренняя мембрана обладает избирательной проницаемостью и, значит, содержит
специальные белки-переносчики. Например, значительная часть глицеральдегид-3-фосфата, образующегося в строме при фиксации углерода,
выводится из хлоропластов с помощью эффективной системы антипорта, обменивающей трехуглеродные фосфосахара на неорганический фосфат.
Глицеральдегид-3-фосфат, в изобилии поступающий в цитозоль, используется клеткой как исходный материал для биосинтеза многих
других веществ, включая сахарозу, предназначенную на «экспорт». Кроме того, попав в цитозоль, глицеральдегид-3-фосфат легко превращается (в
результате некоторых реакций цепи гликолиза) в 3-фосфоглицерат с образованием одной молекулы АТР и одной молекулы NADH (в ходе такой же
двустадийной реакции, но идущей в обратном направлении, в цикле фиксации углерода образуется глицеральдегид-3-фосфат - см. рис. 7-43). Таким
образом, глицеральдегид-3-фосфат, транспортируемый из хлоропластов, служит не только главным источником связанного углерода, но также
доставляет NADPH и АТР для клеточного метаболизма за пределами хлоропласта.
7.3.14. Хлоропласты осуществляют и другие биосинтетические реакции [39]
Помимо фотосинтеза в хлоропластах осуществляется много других биосинтетических процессов. Например, все жирные кислоты клетки
и ряд аминокислот образуются с помощью ферментов, находящихся в строме. Кроме того, в хлоропластах происходит восстановление нитрита
(NO
2
-
) до аммиака (NH
3
) за счет энергии электронов, активированных светом; в растениях этот аммиак служит источником азота для синтеза
аминокислот и нуклеотидов. Таким образом, значение хлоропластов для метаболизма растений и водорослей не ограничивается их ролью в
фотосинтезе.

477
Заключение
Хлоропласты и фотосинтезирующие бактерии получают высокоэнергетические электроны с помощью фотосистем, улавливающих
электроны, возбуждаемые солнечным светом, который поглощается молекулами хлорофилла. В состав фотосистем входит антенный комплекс,
связанный с фотохимическим реакционным центром, где в строго определенном порядке расположены белки и пигменты, участвующие в
фотохимических реакциях фотосинтеза. До сих пор лучше всего изучен реакционный центр пурпурных фотосинтезирующих бактерий - известна
его полная трехмерная структура. У этих бактерий единственная фотосистема создает электрохимический градиент, энергия которого
используется для синтеза как АТР, так и NADPH. В хлоропластах и у цианобактерий имеются две фотосистемы. В зависимости от нужд клетки
в разных соотношениях осуществляются электронные потоки двух типов: I) нециклический поток, создаваемый при участии двух
последовательно соединенных фотосистем, переносит электроны с воды на NADP
+
с образованием NADPH, причем попутно синтезируется и
АТР; 2) циклический поток, поддерживаемый лишь одной фотосистемой, передающей электроны по замкнутой цепи, приводит к образованию
только АТР. В хлоропластах все электронтранспортные процессы происходят в тилакоидной мембране: для синтеза АТР протоны накачиваются
в тилакоидное пространство и затем в результате обратного тока протонов через АТР-синтетазу в строме образуется АТР.
Получаемые при фотосинтезе АТР и NADPH служат источниками энергии для многих биосинтетических реакций, происходящих в
строме, в том числе для жизненно важного цикла фиксации СО
2
, в котором из СО
2
образуются углеводы. Эти углеводы в виде трехуглеродных
фосфосахаров переносятся в цитозоль клетки, где служат источником органического углерода, АТР и восстановительной силы.
7.4. Эволюция электронтранспортных цепей [40]
Структуру, функцию и эволюцию клеток и организмов в значительной мере можно связать с их потребностью в энергии. Мы уже видели,
что механизмы использования таких разных источников энергии, как свет и окисление глюкозы, в основе своей одинаковы. По-видимому,
эффективный способ синтеза АТР появился еще на ранних этапах эволюции и с тех пор подвергся лишь незначительным изменениям. Как же
впервые возникли ключевые компоненты электронтранспортной цепи - АТР-синтетаза, протонные насосы, использующие энергию окислительно-
восстановительных процессов, и фотосистемы? Гипотезы о событиях, происходивших в ходе эволюции, проверить трудно. Однако ключи к
разгадке можно найти как в различных примитивных электронтранспортных цепях, сохранившихся у некоторых современных бактерий, так и в
геологических данных относительно условий, существовавших на Земле миллиарды лет назад.
7.4.1. Древнейшие клетки, вероятно, синтезировали АТР с помощью процессов брожения [41]
Как уже говорилось в гл. 1, полагают, что первые живые клетки возникли примерно 3,5·10
9
лет назад, когда возраст Земли составлял
свыше 10
9
лет. Поскольку в окружающей среде отсутствовал кислород, а органические молекулы, образовавшиеся в ходе геохимических процессов,
имелись в избытке, самые первые метаболические пути синтеза АТР были, по-видимому, сходны с существующими ныне формами брожения.
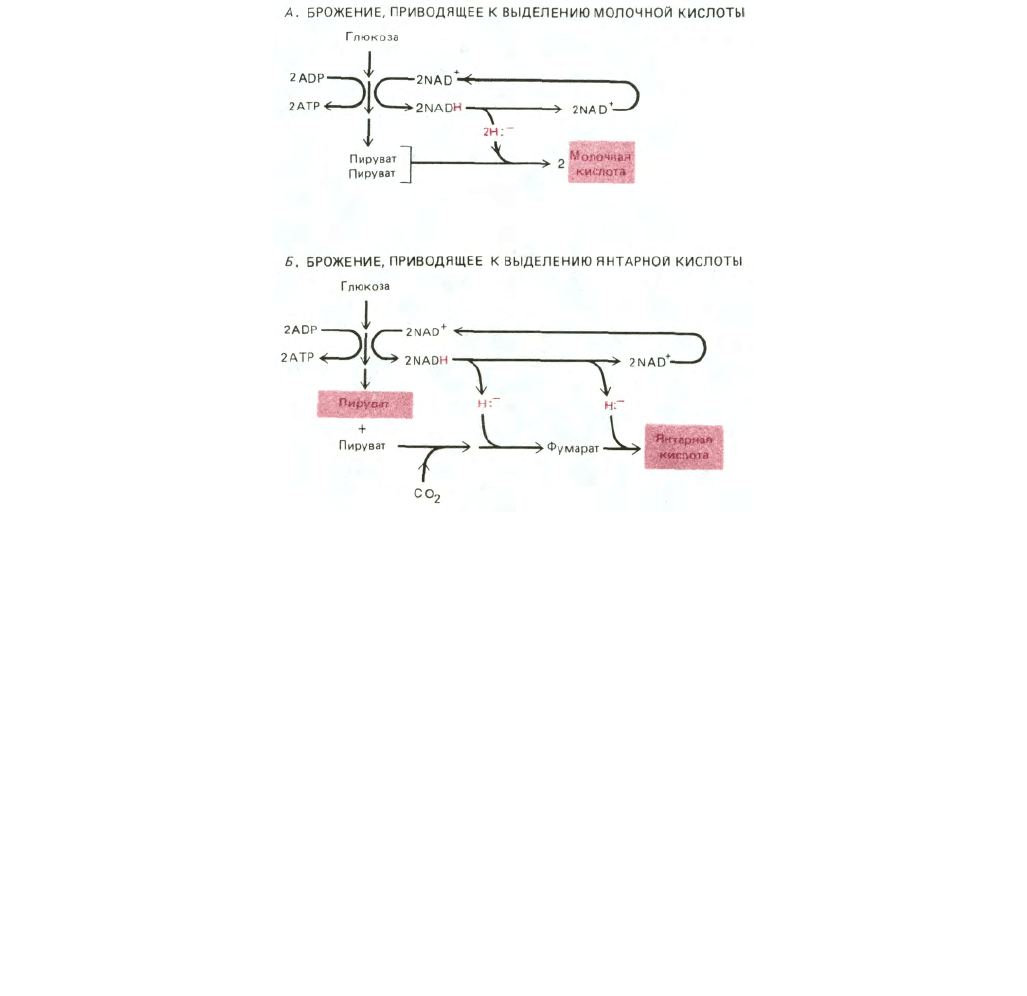
478
Рис. 7-56. Схемы двух типов брожения (конечные продукты выделены цветом). А. Две молекулы NAD
+
, использованные на каждую молекулу
глюкозы, подвергшейся гликолизу, регенерируются путем переноса гидрид-иона с NADH на пируват с образованием двух молекул молочной
кислоты. Молочная кислота выводится из клетки. Б. Две молекулы NAD
+
, израсходованные на каждую молекулу глюкозы при гликолизе,
регенерируются путем последовательного переноса гидрид-ионов от двух молекул NADH на соединения, получаемые из пирувата, в результате
чего образуется янтарная кислота. На каждую молекулу янтарной кислоты, выводимую из клетки, одна молекула пирувата (выделена цветом)
остается в клетке для последующих процессов биосинтеза. В обоих случаях (А и Б) для регенерации NAD
+
и продолжения гликолиза в анаэробных
условиях требуется выведение какой-то органической кислоты.
При брожении АТР образуется путем субстратного фосфорилирования (разд. 2.2.2), при котором используется энергия, высвобождаемая
в реакциях частичного окисления органических молекул, богатых водородом, таких как глюкоза. В отсутствие кислорода, который мог бы служить
акцептором водорода, выделяемый при окислении молекул водород должен переноситься (через NADH или NADPH) на какую-то другую
органическую молекулу (или на другую часть той же молекулы), которая при этом восстанавливается. Из органических конечных продуктов
брожения один (или несколько) выводится из клетки в окружающую среду как отход метаболизма, а другие, такие как пируват, используются
клеткой для биосинтезов.
Разные организмы выделяют разные конечные продукты, но чаще всего это органические кислоты (углеродные соединения с группой
СООН). Из наиболее важных продуктов бактериального брожения следует отметить молочную кислоту (которая накапливается и при анаэробном
гликолизе в клетках млекопитающих; см. разд. 2.3.2), а также муравьиную, уксусную, пропионовую, масляную и янтарную кислоты. На рис. 7-56
представлены два типа брожения, встречающиеся у современных бактерий.
7-28
7.4.2. Появление электронтранспортной цепи, запасающей энергию, позволило анаэробным бактериям использовать в качестве
источника энергии несбраживаемые органические соединения [42]
Ранние процессы брожения должны были обеспечить образование не только АТР, но и восстанавливающих агентов (NADH и NADPH),
необходимых для процессов биосинтеза, и, вероятно, многие из главных метаболических путей сложились в условиях, когда брожение было
единственным способом получения энергии. Однако со временем метаболическая активность прокариот должна была изменить окружающую
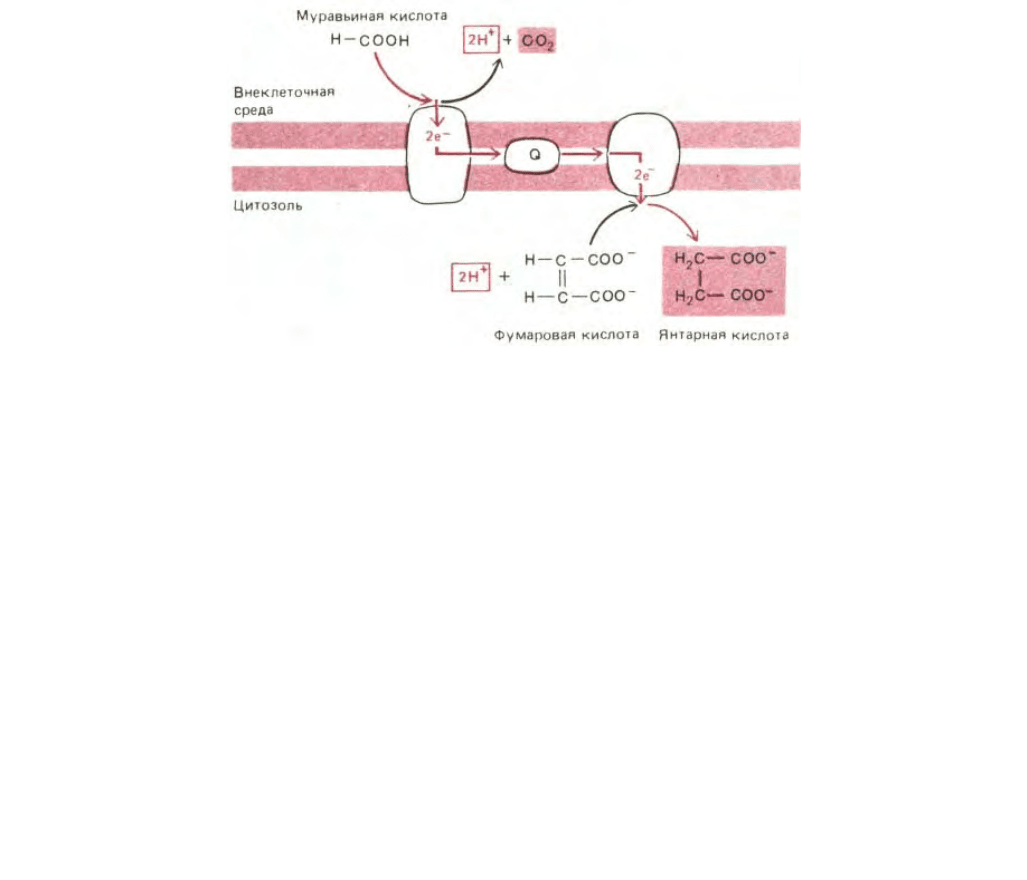
479
Рис. 7-57. У некоторых современных бактерий, растущих в анаэробных условиях, в том числе у Е. со/г, окисление муравьиной кислоты фумаратом
осуществляется при участии электронтранспортной цепи, находящейся в плазматической мембране. Как показано, в результате этого процесса
образуются сукцинат и СО
2
. Обратите внимание, что протоны используются внутри клетки, а образуются снаружи, что равнозначно перекачиванию
протонов из клетки. Таким образом, эта связанная с мембраной электронтранспортная система может генерировать на плазматической мембране
электрохимический протонный градиент. Окислительно-восстановительный потенциал пары муравьиная кислота - СО
2
равен - 420 мВ, а для пары
фумарат - сукцинат он составляет + 30 мВ.
среду, и это привело к возникновению новых биохимических путей. Накопление побочных продуктов брожения могло привести к следующим
изменениям:
Стадия 1. Из-за непрерывного выделения кислот рН окружающей среды понизился; в результате понадобились трансмембранные
насосы, откачивающие ионы Н
+
из клетки, чтобы она не погибла от чрезмерного закисления. Вполне возможно, что один из таких насосов
использовал энергию гидролиза АТР и, таким образом, мог быть предшественником современной АТР-синтетазы.
Стадия 2. Одновременно с накоплением несбраживаемых органических кислот, которое привело к появлению протонного насоса,
использующего энергию АТР, истощались запасы сбраживаемых веществ, за счет окисления которых можно было осуществлять транспорт
метаболитов и другие важные жизненные процессы. В этих условиях отбор благоприятствовал тем бактериям, которые были способны выводить
ионы Н
+
без сопряжения с гидролизом АТР, так что последний сохранялся для других надобностей. Давление отбора, возможно, привело к
появлению первых белков, связанных с мембраной, которые могли использовать перенос электронов между молекулами с различным
окислительно-восстановительным потенциалом в качестве источника энергии для откачивания протонов через плазматическую мембрану. Для
некоторых из этих белков могли найтись подходящие доноры и акцепторы электронов среди накопившихся несбраживаемых органических кислот.
Немало таких электронтранспортных белков встречается и у ныне живущих бактерий; например, некоторые бактерии, растущие на средах с
муравьиной кислотой, перекачивают протоны за счет относительно небольшой окислительно-восстановительной энергии, извлекаемой при
переносе электронов с муравьиной кислоты на фумаровую (рис. 7-57). У других бактерий возникли сходные электронтранспортные механизмы,
«занятые» исключительно окислением и восстановлением неорганических субстратов (см., например, рис. 7-59).
Стадия 3. В конце концов у некоторых бактерий выработалась настолько эффективная цепь переноса электронов, что энергии запасалось
больше, чем было нужно для поддержания внутриклеточного рН. Откачивание протонов создавало большой электрохимический градиент, который
позволял протонам переходить обратно в клетку через АТР-зависимые протонные насосы, что приводило к обращению их действия, т.е. заставляло
их функционировать как АТР-синтетазы. Поскольку таким бактериям нужно было гораздо меньше сбраживаемых питательных веществ, запасы
которых всё уменьшались, эти бактерии стали быстро вытеснять своих соседей.
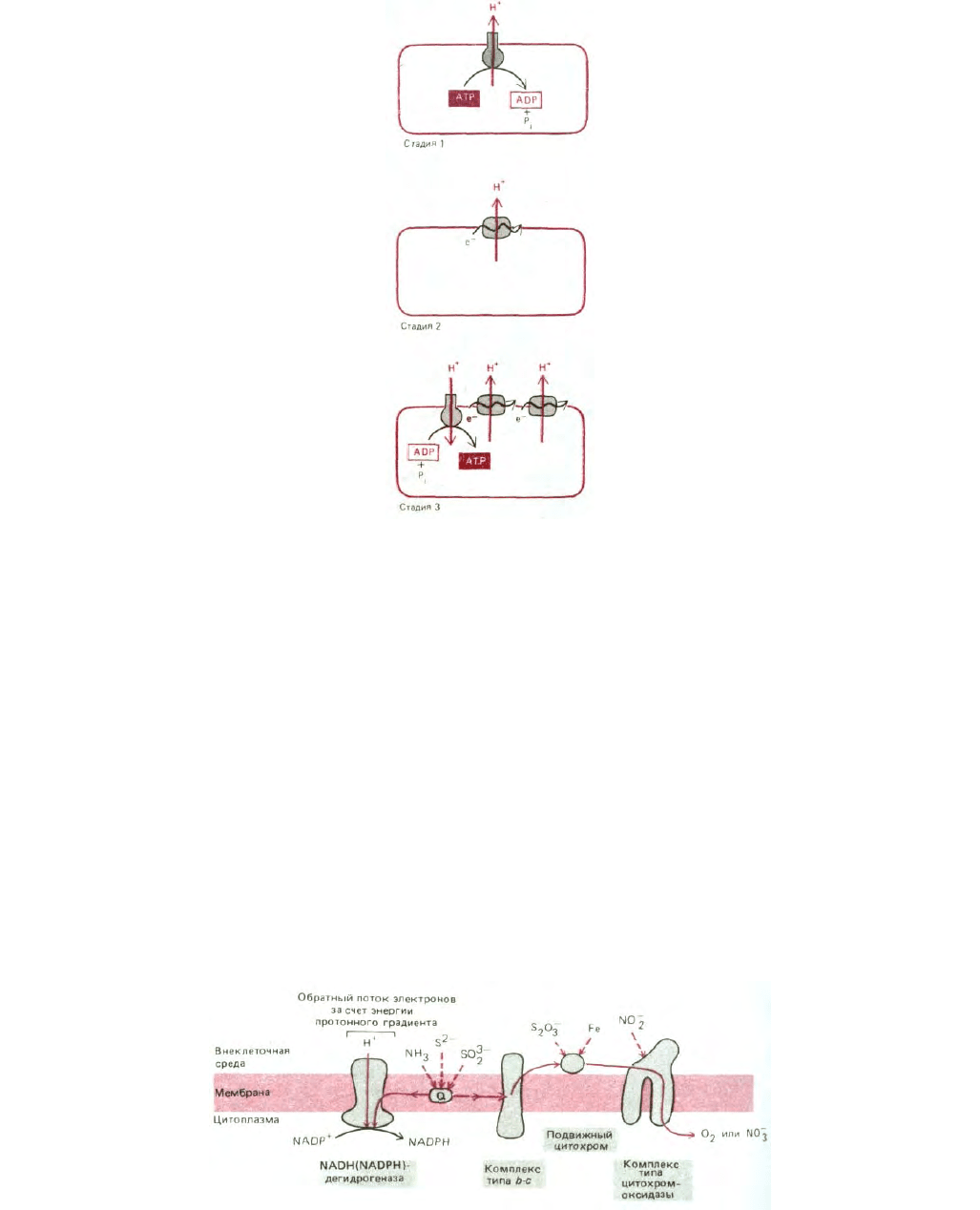
480
Рис. 7-58. Возможная эволюция механизмов окислительного фосфорилирования.
Эти три гипотетические стадии в эволюции механизмов окислительного фосфорилирования схематически представлены на рис. 7-58.
7.4.3. Фотосинтезирующие бактерии, найдя неисчерпаемый источник восстановительной силы, смогли преодолеть серьезный
кризис в эволюции клетки
Хотя только что описанные эволюционные шаги разрешили проблему поддержания как нейтральной внутриклеточной среды, так и
достаточных энергетических запасов, осталось непреодоленным другое, не менее серьезное затруднение. Истощение запасов сбраживаемых
органических веществ означало, что нужно найти иной источник углерода для синтеза Сахаров - предшественников столь многих других молекул,
необходимых клетке. Потенциальным источником углерода могла быть углекислота, которой было достаточно в атмосфере; однако для
превращения СО
2
в органические молекулы, например углеводы, нужно восстановить связанную углекислоту сильным донором водорода (таким,
как NADH или NADPH), способным отдавать богатые энергией электроны, необходимые для образования одной СН
2
О-единицы из СО
2
(см. рис. 7-
43). На ранних стадиях эволюции клетки большие количества таких восстанавливающих агентов образовывались при брожении. Однако по мере
сокращения запасов сбраживаемых субстратов и возрастания роли мембранной АТР-синтетазы в образовании АТР запасы NADH и других
восстановителей должны были тоже иссякнуть. Таким образом, клетки столкнулись с острой необходимостью найти новый источник сильных
восстановителей.
Главными донорами электронов в среде, где уже не было сбраживаемых молекул, стали органические кислоты, получаемые при
анаэробном метаболизме углеводов, неорганические молекулы, такие как сероводород (H
2
S), образующийся в ходе геохимических процессов, и
вода. Но восстанавливающая способность всех этих соединений слишком мала, чтобы ее можно было использовать для фиксации углекислоты.
Впервые появление сильных доноров электронов было связано, вероятно, с использованием электрохимического протонного градиента между
двумя сторонами плазматической мембраны для поддержания обратного тока электронов, что и послужило причиной возникновения
мембраносвязанных ферментных комплексов, напоминающих NADH-дегидрогеназу (рис. 7-59). Однако главный эволюционный «прорыв» в
энергетическом метаболизме произошел, когда возникли фотохимические реакционные центры, способные прямо синтезировать такие молекулы,
как NADH. Полагают, что такие центры впервые появились больше 3 млрд. лет назад у предшественников зеленых серных бактерий. Современные
зеленые серные бактерии используют лучистую энергию для переноса атома водорода (в виде электрона и протона) от молекулы сероводорода
Рис. 7-59. Некоторые пути переноса электронов у современных бактерий, у которых необходимые для роста АТР и восстановительная сила
образуются всецело за счет энергии окисления неорганических молекул -таких, как соединения железа, азота, серы и аммиака. Некоторые виды
способны расти в анаэробных условиях благодаря замене кислорода как конечного акцептора электронов нитратом. Другие виды используют цикл
фиксации углерода и синтезируют органические молекулы исключительно из СО
2
. «Прямой» поток электронов позволяет откачивать из клетки
протоны, и энергия возникающего при этом протонного градиента используется АТР-синтетазой для синтеза АТР (на схеме не показано). NADPH,
необходимый для фиксации углерода, образуется при участии «обратного» тока электронов (см. также рис. 7-51, Б).
